Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 3, стр. 32-36
Исследование рентгеновского излучения в композитных материалах с металлами при облучении нейтронами и фотонами
Ю. М. Бурмистров 1, В. М. Скоркин 1, *
1 Институт ядерных исследований РАН
117312 Москва, Россия
* E-mail: skorkin@inr.ru
Поступила в редакцию 24.05.2018
После доработки 22.06.2018
Принята к публикации 22.06.2018
Аннотация
Исследовано вторичное рентгеновское излучение при облучении композитов нейтронами и фотонами. Изучено воздействие на биологические клетки характеристического рентгеновского излучения и конверсионных электронов от захвата жидкокристаллическими структурами ДНК–Gd замедляющихся нейтронов из DT-реакции. Жидкокристаллическая структура в виде микрочастиц объемом 0.1 мкм3 содержит 10 000 атомов Gd на каждую молекулу ДНК. В процессе облучения нейтронами биологических образцов с концентрацией в 1000 частиц ДНК–Gd на одну биологическую клетку происходит поражение клеток вторичным радиационным излучением при флуенсе тепловых нейтронов ~1011 н/cм2. С помощью спектрометра из особочистого германия исследованы также радиационно-защитные свойства и характеристическое рентгеновское излучение композита c Pb при облучении фотонами от кобальт-57 активностью 100 кБк.
ВВЕДЕНИЕ
Тяжелые металлы используются для создания препаратов ядерной медицины и материалов для защиты от радиационного излучения. Например, гадолиний и иттербий используются в препаратах для нейтрон-захватной терапии и брахитерапии злокачественных новообразований [1–4]. Микрочастицы свинца и вольфрама применяются в композитных радиационно-защитных материалах как поглощающие гамма и бета излучение агенты [5, 6]. Эти элементы интенсивно поглощают фотонное или нейтронное излучение и создают рентгеновское излучение и конверсионные электроны. В первом случае вторичное радиационное излучение от реакции захвата тепловых нейтронов используется для поражения раковых клеток в организме больного. В защитных материалах поглощение гамма и бета излучения применяется для уменьшения энергии и проникающей способности радиации и защиты жизненно важных органов персонала.
Гадолиний, имеющий большое сечение захвата тепловых нейтронов, используется в композитах (как источник характеристического рентгеновского излучения и конверсионных электронов) [7]. Эффективность применения препаратов с гадолинием зависит от локальной концентрации гадолиния в используемых средствах. В работах [8–10] были исследованы свойства жидкокристаллической структуры комплекса ДНК–Gd с концентрацией гадолиния около 300 мг/мл. Исследованные жидкокристаллические структуры объемом 10–13 см3 в виде частиц цилиндрической формы содержали 104 двух цепочечных молекул ДНК и 108 атомов Gd. Определено, что в структуре ДНК–Gd три атома гадолиния соединяют 2 нуклеотида (фосфатные группу) молекул ДНК. Использование этих композитных материалов как основного компонента туморотропного вещества для поглощения нейтронного излучения может значительно повысить эффективность нейтрон-захватной терапии (НЗТ). Высокая концентрация гадолиния, доставляемого в опухоль, позволяет уменьшить необходимый для терапии поток нейтронов и вредное воздействие облучения на здоровые ткани.
Композитные материалы с элементами свинца и вольфрама в несколько раз увеличивают поглощение внешнего радиационного излучения, преобразуя его в локальное рентгеновское излучение.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Модельные расчеты показывают, что двойное повреждение ядра раковой клетки приводит к ее гибели [11]. Реакция захвата тепловых нейтронов в частицах ДНК–Gd сопровождается образованием характеристического рентгеновского излучения (42.4 кэВ), оже-электронов (до 7 кэВ) и конверсионных электронов (от 30 до 200 кэВ). Оже-электроны почти полностью поглощаются в частице ДНК–Gd [12]. Рентгеновское излучение и конверсионные электроны вылетают из частиц и могут поражать ядра раковых клеток (рис. 1). Вероятность рентгеновского излучения и образования конверсионного электрона составляет около 50% на один захваченный частицей ДНК–Gd тепловой нейтрон. В биологическом материале объемом 1 мл содержится ~108 клеток, и при концентрации частиц ДНК–Gd около 1011 см–3 (или гадолиния около 5 мг/мл3) возможно гарантированное проникновение радиационного излучения в ядро клетки и его двойное повреждение. Двойной радиационный захват в частицах ДНК–Gd, приводящий к поражению клеток возможен при флуенсе тепловых нейтронов ~1011 н/cм2
Рис. 1.
Схематическое изображение процесса захвата нейтронов в частице ДНК–Gd с вылетом рентгеновского излучения, оже-электронов и конверсионных электронов на поверхности биологической клетки: 1 – молекула ДНК, 2 – ион гадолиния, 3 – нейтрон, 4 – вторичный фотон, 5 – вторичный электрон, К – клетка, Я – ядро клетки.

В настоящей работе исследование вторичного радиационного излучения от захвата нейтронов проводится по его действию на биологические клетки в образцах. В эксперименте с нейтронами использовались биологические образцы, содержащие около 107 биологических клеток в питательном водном растворе. Одноклеточный слой (объемом 0.1 мл) был равномерно распределен на дне пластмассового контейнера (рис. 2). Слой из частиц ДНК–Gd (с массой гадолиния Gd около 0.5 мг) покрывал слой биологических клеток и тем самым создавал концентрацию около 1000 частиц ДНК–Gd на клетку или концентрацию гадолиния в биологическом материале около 5 мг/мл.
Рис. 2.
Схематическое изображение образца с биологическими клетками и частицами ДНК–Gd: 1 – контейнер, 2 – водный раствор, 3 – слой из частиц ДНК–Gd, 4 – слой биологических клеток.

В исследовании локального рентгеновского излучения в защитных материалах с элементами свинца (79 кэВ) и вольфрама (64.5 кэВ) измерялись спектры фотонов при облучении композитных материалов излучением от источника 57Co. Определялась степень ослабления первичного фотонного излучения и интенсивность характеристического локального рентгеновского излучение.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
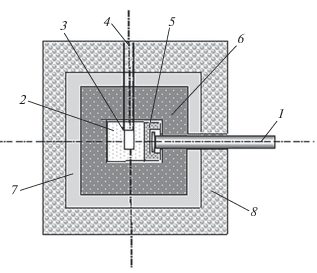
Устройство для облучения биологических образцов нейтронами располагалось вблизи мишени нейтронного генератора (рис. 3). Быстрые (14 МэВ) нейтроны от нейтронного генератора размножались за счет неупругого рассеяния и реакции (n, 2n) в конвертере из вольфрама толщиной 2 см и замедлялись до тепловой энергии в блоке-замедлителе из полиэтилена размером 20 × 20 × 20 см [13]. Внутри куба в полости размером 5 × 5 × 10 см располагались биологические образцы с клетками. Конвертер-отражатель из свинца толщиной 20 см создавал дополнительный поток нейтронов. Слои из висмута и борированного полиэтилена окружали устройство для поглощения внешних нейтронов и гамма излучения.
Рис. 3.
Устройство для облучения биологических образцов: 1 – источник быстрых нейтронов (нейтронный генератор), 2 – блок-замедлитель быстрых нейтронов, 3 – полость внутри куба, 4 – входное отверстие для размещения облучаемых образцов, 5 – конвертер из вольфрама, 6 – конвертер-отражатель из свинца, 7 – слой защиты от гамма-излучения и нейтронного излучений, 8 – слой защиты из борированного полиэтилена.
Для обеспечения жизнедеятельности клеток температура внутри полости устройства поддерживалась около 36°С с помощью термостата. Стабильность температуры обеспечивалась регулировкой нагревательных элементов термостата, помещенных в полость с биологическими образцами и датчиками температуры.
Для исследования характеристического рентгеновского излучения в композитном защитном материале использовался источник 57Co (активностью 105 Бк) с энергией фотонов 122.06 кэВ (85.5%), 136.47 кэВ (10.7%). Спектры рентгеновского излучения от защитного материала и фотонов от источника измерялись низкофоновым гамма-спектрометром на основе детектора из сверхчистого германия [14].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
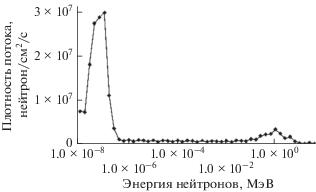
Для оптимизации экспериментальных условий были выполнены измерения и расчеты плотности потоков тепловых и быстрых нейтронов в замедлителе. Расчет проводился по программе NCNP4B с библиотекой MCNPXS. Измерения выполнены методом активационного анализа с использованием образцов Мn, Nb, In. Значения потоков тепловых и быстрых нейтронов в месте расположения биологических образцов приведены на рис. 4.
Рис. 4.
Расчетное энергетическое распределение нейтронов в полости с облучаемыми биологическими образцами внутри устройства.
Облучение образцов с биологическими клетками проводилось в нескольких сеансах. Перед каждым сеансом готовились три образца с клетками: контрольный, образец для облучения с частицами ДНК–Gd и образец без частиц. Длительность облучения для каждого из двух образцов составляли от 15 мин до 1 ч. Флуенс тепловых и быстрых нейтронов измерялся активационным методом и изменялся в интервале (0.5–5) × 1011 н/cм2 в зависимости от величины тока дейтронов на мишени НГ-400. Плотность потока быстрых и тепловых нейтронов в образцах менялась в интервалах (1–3) × 107 и (0.5–1.5) × 108 н/cм2/с соответственно.
После сеансов образцы выдерживались несколько дней, а затем проверялись на наличие в них живых, размножающихся клеток. Отсутствие таких клеток в образце свидетельствует о гибели клеток под облучением.
В результате исследований установлено, что после сеанса с флуенсом тепловых нейтронов свыше 1011 н/cм2, клетки в биологическом образцах с частицами ДНК–Gd погибают и не размножаются (рис. 5). Биологические клетки в контрольных образцах и в облученных без частиц ДНК–Gd образцах остаются живыми и размножаются. Это свидетельствует о том, что дополнительное характеристическое рентгеновское излучение и конверсионные электроны от захвата нейтронов в частицах ДНК–Gd поражают биологические клетки. Исследованный композитный материал для нейтрон-захватной-терапии имеет высокую концентрацию гадолиния и позволяет в несколько раз уменьшить необходимый поток нейтронов и вредное воздействие облучения.
Рис. 5.
Оптическое изображение биологических клеток из образцов после их облучения (получено с помощью микроскопа Leica DMI4000): 1 – контрольный, необлученный образец, 2 – облученный нейтронами образец без частиц ДНК–Gd (светлые точки-клетки), 3 – облученный образец с частицами ДНК–Gd.

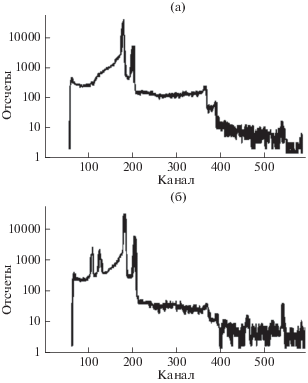
При гамма-облучении радиационно-защитного материала были измерены спектры характеристического рентгеновского излучения и спектры ослабленного гамма излучения источника 57Co, прошедшего через композитный материал с металлом (рис. 6). Спектр от открытого гамма источника 57Co измерялся 50 с. Спектр от источника 57Co, закрытого защитным материалом измерялся 150 с. Пик в спектре характеристического рентгеновского излучения с энергией около 80 кэВ указывает на наличие в защитном материале свинцовой компоненты. Интенсивность характеристического излучения составляет 3% от интенсивности линии 122 кэВ источника. Наличие элементов свинца в защитном композите подтверждается также измерением спектра характеристического излучения от свинцовой пластины, закрывающей источник (рис. 7). Из анализа гамма пиков на спектрах при энергиях 122.06 и 136.47 кэВ определены величина ослабления защитным материалом гамма-излучения при этих энергиях (3.7 и 2.8 соответственно). Оценка концентрации свинцовой компоненты в защитном материале по этим величинам дает значение около 0.3 г/cм2.
ЗАКЛЮЧЕНИЕ
Исследования композитов с компонентами тяжелых металлов важны для создания препаратов ядерной медицины и радиационно-защитных материалов. Гамма-, бета-излучение и нейтроны (как наиболее распространенный и проникающий вид радиации) может эффективно поглощаться компонентами композитных материалах и создавать локальное рентгеновское и электронное излучение. Результаты проведенных исследований важны для создания композитных материалов с высокой способностью поглощения радиации и уменьшения вредного воздействие облучения на человека.
Список литературы
Miller G.A., Hertel N.E., Wehring B.W. et al. // Nuclear Technology. 1993. T. 103. 320.
Piermattei A., Azario L., Montemaggi P. // Phys. Med. Biol. 1995. V. 40. P. 1331.
David C.M., Mark A.T., John J.M. et al. // Med. Phys. Biol. 2007. V. 34. P. 3614.
Mitin V.N., Kulakov V.N., Khokhlov V.F. et al. // Applied Radiation and Isotopes. 67 2009. T. 67. P. 299.
Гелашвили В.Р. Пленочные материалы для защиты от радиации: Автореф. дис. ... канд. техн. наук. Пенза: ПГАСА, 1997. 24 с.
Гришина А.Н. Структура и свойства радиационно-защитных жидкостекольных композиционных материалов повышенной плотности: Дис. ... канд. техн. наук. Воронеж: Воронеж. гос. архитект.-строит. ун-т, 2010. 230 с.
Greenwood R.C., Reich C.W., Baader H.A. et al. // Nucl. Phys. 1978. V. A304. P. 327.
Евдокимов Ю.М., Салянов В.И., Нечипуренко Ю.Д. и др. // Молекулярная биология. 2003. Т. 37. С. 1.
Yevdokimov Yu.M., Salyanov V.I., Kondrashina O.V. et al. // Int. J. Biol. Macromol. 2005. V. 370. P. 165.
Акулиничев С.В., Скоркин B.М. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2008. Т. 12. С. 74.
Goorley T., Zamenhof R., Nikjoo H. // Int. J. Radiat. Biol. 2004. V. 80. P. 933.
Акулиничев С.В., Евдокимов Ю.М., Лазебник Д.Б. и др. // Медицинская физика. 2006. № 4. С. 54.
Andreev A.V., Makarov S.A., Skorkin V.M. // Proc. of XII Int. Conf. on Electrostatic Accelerators. Obninsk. Russia, 2000. P. 94.
Andreev A.V., Burmistrov Yu.M., Konobeevski E.S. et al. // Proc. of 4th Int. Conf. “NPAE-Kyiv 2012”, 2013. Part 2. P. 575. http://www.npae2012.kiev.ua/docs/NPAE-Kyiv2012-Part202.pdf.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования