Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2019, № 7, стр. 27-35
Атомно-силовая микроскопия и оптические характеристики гибридных полимерных наносистем на основе наночастиц серебра и селена
С. В. Валуева 1, *, М. Э. Вылегжанина 1, А. В. Плющенко 1, 2
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
* E-mail: svalu67@mail.ru
Поступила в редакцию 26.09.2018
После доработки 12.11.2018
Принята к публикации 18.11.2018
Аннотация
Методами атомно-силовой микроскопии, динамического светорассеяния и УФ-спектроскопии определены морфологические, размерные и спектральные характеристики гибридных полимерных наносистем на основе наночастиц нуль-валентных селена и серебра, стабилизированных зостерином и метилцеллюлозой. Показана возможность регулирования морфологических параметров, а также размерных и спектральных характеристик гибридных полимерных наносистем путем варьирования природы наночастиц и биоактивного полимерного стабилизатора.
ВВЕДЕНИЕ
Уникальные свойства наноструктурированных систем и материалов (электромагнитные, каталитические, биологические), обнаруженные в последние десятилетия, являются предметом активных исследований. Коллоидные растворы металлов/неметаллов, образующиеся при восстановлении ионов в растворах полимеров, рассматриваются как дисперсии композитов, включающих наночастицы металлов/неметаллов и макромолекулы, которые образуют защитные экраны вокруг наночастиц. Объектами исследования до сих пор остаются, главным образом, золи благородных металлов и металлов платиновой группы из-за их высокой устойчивости к агрегации и окислению. Предполагается, что макромолекулярные экраны, препятствующие дальнейшему росту частиц металла/неметалла и предохраняющие их от агрегации, образуются благодаря нековалентным (адсорбционным) взаимодействиям полимерных цепей с поверхностью растущих наночастиц. К таким взаимодействиям относятся стерические, электростатические и гидрофобные, а также водородные и координационные связи. Один из наиболее перспективных способов получения стабильных наночастиц – восстановление их ионных форм в растворах полимеров. Адсорбция макромолекул на наночастицах сопровождается формированием органической оболочки на неорганическом ядре и приводит к снижению поверхностного натяжения, стабилизации образующихся наночастиц (препятствующей их агрегации), торможению роста, а также повышению их устойчивости [1]. Кроме того, в таких процессах часто образуются наночастицы, характеризующиеся достаточно узким распределением по размерам, что важно с практической точки зрения для получения хорошо организованных трехмерных периодических наноструктур. Следует также заметить, что средний размер наночастиц, образующихся в присутствии органических соединений, существенно меньше, чем в их отсутствие. Эти факты свидетельствуют о влиянии адсорбции органических молекул на поверхности металлов/неметаллов на процесс формирования наночастиц [2].
Металлические наночастицы весьма перспективны в биоаналитической электрохимии [3, 4], биомедицине [5, 6], при синтезе заменителей крови [7]. Так, например, для наночастиц нуль-валентного серебра (Ag0) характерны сильно выраженные антимикробные свойства, причем степень антибактериального эффекта в значительной мере определяется размерами и формой наночастиц [8–10]. Известно, что биогенный элемент – селен, входящий в состав пищевых продуктов, оказывает антибластическое действие, а между содержанием селена во внешней среде и частотой поражения населения злокачественными опухолями существует обратно пропорциональная зависимость [11]. Известно также, что в условиях дефицита селена наблюдается развитие миокардиодистрофии, атеросклероза, ишемической болезни сердца, инфаркта миокарда и хронического гепатита различной этимологии [12]. В клинической медицине показана эффективность использования наночастиц селена в нуль-валентной форме (Se0) в комбинации с известными противоопухолевыми веществами [13].
В формировании гибридных полимерных наносистем ключевую роль играют силы дальнодействия между наночастицами и макромолекулами, а также между образующимися наноструктурами, которые определяются, в первую очередь, природой наночастиц и полимерного стабилизатора. Если в качестве полимерных стабилизаторов используются неионогенные полимеры, то такая стабилизация называется стерической, если же в качестве стабилизаторов выступают полиэлектролиты, то экранирование (в случае металлических частиц) происходит по механизму электростерической стабилизации [14].
Ввиду того, что гибридные полимерные наносистемы обладают синергизмом свойств исходных компонентов, были синтезированы и изучены наносистемы на основе биосовместимых полимерных стабилизаторов, используемых для получения лекарственных препаратов и биологически активных добавок [8, 15–21] и наночастиц Se0 и Ag0.
В настоящей работе в качестве полимерной системы использовали метилцеллюлозу и зостерин. Их структурные формулы, состав и молекулярные массы представлены в табл. 1. Метилцеллюлоза хорошо растворима в воде, что позволяет использовать ее для получения композиций биомедицинского назначения с требуемым комплексом физико-химических и биологических свойств [15]. Зостерин, относящийся к классу пектинов, обладает уникальным комплексом биоактивных свойств: высокой антиоксидантной, иммуномодулирующей, противовирусной, репаративной, противоопухолевой, геропротекторной, гипохолестеринемической, радиозащитной и сорбционной активностью. Поэтому он широко применяется в медицине, ветеринарии, медицинской косметологии и других сферах [16–19]. Целью работы было определение размерных и спектральных характеристик содержащих серебро и селен гибридных полимерных наносистем на основе метилцеллюлозы и зостерина с использованием широкого спектра методов при массовом соотношении ν между Ag0, а также Se0 и биоактивным полимерным стабилизатором, равным 0.1 (ν = 0.1 – точка насыщения адсорбционной емкости наночастиц селена [22]).
Таблица 1.
Структурные формулы, состав и молекулярные массы (Mw) биоактивных полимерных стабилизаторов
| Название | Структурная формула, состав |
|---|---|
| Метилцеллюлоза Mw = 40 000 |
[C6H7O2(OH)3 – x(OCH3)x]n, х = 1, 2 или 3 |
| Зостерин Mw = 60 000 |
Зостерин имеет линейный остов из рамногалактурана и разветвленную область (из ксилогалактуронана). В зостерине мало метильных групп (не более 5% от общего числа гидроксильных остатков) |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение наночастиц нуль-валентного селена и серебра. Синтез наночастиц селена осуществлялся в результате реакции (1) между селенистой (H2SeO3) и аскорбиновой (C6H8O6) кислотами в присутствии биоактивного полимерного стабилизатора (БПС):
(1)
${{{\text{H}}}_{2}}{\text{Se}}{{{\text{O}}}_{3}} + 2{{{\text{C}}}_{6}}{{{\text{H}}}_{8}}{{{\text{O}}}_{6}} \to {\text{S}}{{{\text{e}}}^{0}} + 3{{{\text{H}}}_{2}}{\text{O}} + 2{{{\text{C}}}_{6}}{{{\text{H}}}_{6}}{{{\text{O}}}_{6}}.$В колбу емкостью 20 мл помещали 5 мл водного раствора стабилизатора (сБПС = 0.2 мас. %) и 3 мл воды. Затем добавляли 1.0 мл раствора H2SeO3 концентрацией 0.16 мас. %. Раствор перемешивали в магнитной мешалке в течение 10–20 мин. Далее в полученную смесь добавляли 1.0 мл раствора C6H8O6 концентрацией 0.4 мас. %. После введения всех компонентов раствор выдерживали при комнатной температуре в течение суток. В результате восстановления получался раствор красновато-оранжевого цвета. Количество реагентов рассчитывали из соотношения Se0 : БПС как 1 : 10 (сБПС = 0.1 мас. %, сSe = 0.01 мас. %, ν = cSe/сБПС = 0.1). В результате реакции (1) без стабилизатора образовывался золь нуль-валентного красного аморфного селена (Se0) и дегидроаскорбиновой кислоты. Образование нуль-валентного селена было обнаружено ранее [23]. Без стабилизатора наночастицы Se0 являются лиофобными коллоидами с низкой агрегативной устойчивостью. Введение в реакцию (1) БПС приводит к получению стабильных (по крайней мере, в течение трех месяцев) растворов красновато-оранжевого цвета.
Наночастицы серебра получали в результате реакции (2) между нитратом серебра (AgNO3) и боргидридом натрия (NaBH4):
(2)
$\begin{gathered} {\text{AgN}}{{{\text{О }}}_{3}} + {\text{NaB}}{{{\text{H}}}_{4}} + {{{\text{H}}}_{2}}{\text{O}} \to \\ \to {\text{A}}{{{\text{g}}}^{0}} + {\text{NaN}}{{{\text{O}}}_{3}} + {\text{B(OH}}{{{\text{)}}}_{3}} + {{{\text{H}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} {\text{.}} \\ \end{gathered} $В колбу емкостью 20 мл наливали 5 мл водного раствора БПС (сБПС = 0.2 мас. %) и 3 мл воды. Затем добавляли 1 мл раствора нитрата серебра (AgNO3) концентрацией 0.16 мас. %. Колбу помещали в ледяную баню до охлаждения на 30–40 мин. Далее при механическом перемешивании в полученную смесь добавляли 1 мл раствора NaBH4 концентрацией 0.2 мас. %, приготовленного в ледяной бане. После введения всех компонентов раствор выдерживали при пониженной температуре еще в течение 1 ч. В результате восстановления серебра получался раствор желтовато-коричневатого цвета. Количество реагентов рассчитывали из отношения серебра к полимеру как 1 : 10 (сБПС = 0.1, сAg = 0.01 мас. %, ν = сAg/сБПС = 0.1).
В результате реакций (1) и (2) были получены гидрофобные наночастицы металлоида (Se0) и относительно гидрофильные наночастицы металла (Ag0). Величина рН селенсодержащих растворов составляла 3.3–3.4, содержащих серебро растворов – 10.6–10.8. Для измерения рН среды использовали милливольтметр И-160МИ.
Изучение морфологии гибридных наносистем методом атомно-силовой микроскопии (АСМ). АСМ-исследования морфологии содержащих селен и серебро гибридных полимерных наносистем проводили в атомно-силовом микроскопе Nanotop NT-206 (ОДО “Микротестмашины”, Беларусь). Измерения выполняли в контактном режиме в воздухе с использованием кремниевых кантилеверов NSC11/AlBS с коэффициентом жесткости k = 3.0 Н/м и радиусом кривизны кончика острия 10 нм. Экспериментальные данные обрабатывали с помощью программы Surface Explorer. В качестве подложки использовали слюду.
Регистрация спектров поглощения. Спектры поглощения в УФ- и видимой областях измеряли с помощью спектрофотометра SpecordM-40 (“Карл Цейс Йена”, Германия) в рабочем диапазоне от 220 до 900 нм в кварцевых кюветах с фотометрическим слоем толщиной 1 см. Относительная суммарная погрешность при регистрации спектров не превышала 2%.
Измерения динамического светорассеяния. Гидродинамические радиусы наноструктур ($R_{h}^{*}$) в водных растворах гибридных полимерных наносистем определяли методом динамического светорассеяния на корреляционном спектрометре Photocor Complex (источник света – гелий-неоновый лазер фирмы Coherent мощностью 20 мВт с длиной волны λ = 632.8 нм) с программируемым коррелятором Photo or-FC (число каналов 288, ООО “Фотокор”, Россия). Обработку корреляционной функции осуществляли с помощью программы DynaLS (“Гелиос”, Россия). Величины гидродинамических радиусов $R_{h}^{*}$ (табл. 2) рассчитывали из значений коэффицентов диффузии (D*) по уравнению Эйнштейна–Стокса: $R_{h}^{*}$ = = kT/6πη0D* (η0 – вязкость растворителя, k – константа Больцмана, T – температура) [24].
Таблица 2.
Размерные параметры для содержащих селен и серебро гибридных полимерных наносистем при ν = 0.1
| Наносистема | $R_{{h1}}^{*},$ нм (основной пик) |
$R_{{{\text{sp}}}}^{*},$ нм | $R_{{{\text{ACM}}}}^{*},$ нм | Ra, нм | Rq, нм | $R_{{h2}}^{*},$ нм (малый пик) |
|---|---|---|---|---|---|---|
| Зостерин/Se0 | 67 | 86 | 70–80 | 0.8 | 1.2 | 8 |
| Зостерин/Ag0 | 35 | 45 | 50–65 | 4.9 | 6.0 | 6 |
| Метилцеллюлоза/Se0 | 76 | 98 | 80–100 | 3.0 | 4.5 | 16 |
| Метилцеллюлоза/Ag0 | 68 | 88 | 60–80 | 0.6 | 0.8 | 12 |
Примечание. $R_{{h1}}^{*}$ – гидродинамический радиус наноструктуры, определенный методом динамического светорассеяния, соответствующий основному пику на рис. 2; $R_{{{\text{sp}}}}^{*}$ = 1.29$R_{{h1}}^{*}$ (соотношение, выполняемое для сферической модели наноструктуры); $R_{{{\text{ACM}}}}^{*}$ – радиус наноструктуры, определенный методом атомно-силовой микроскопии; $R_{{h2}}^{*}$ – гидродинамический радиус нанокластера, определенный методом динамического светорассеяния, соответствующий малому пику на рис. 2; Ra – средняя арифметическая шероховатость поверхности пленки; Rq– среднеквадратичная шероховатость поверхности пленки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
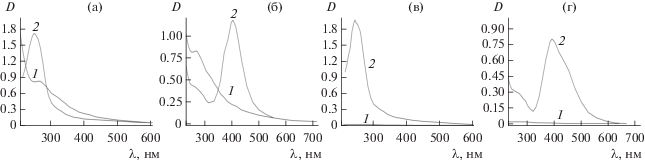
На рис. 1 приведены оптические спектры поглощения в УФ- и видимой областях гибридных полимерных наносистем: зостерин/Se0, МЦ/Se0, зостерин/Ag0 и метилцеллюлоза/Ag0. В случае гибридных полимерных наносистем зостерин/Se0 и метилцеллюлоза/Se0 и (рис. 1а, 1в) в оптических спектрах поглощения наблюдается четко выраженный узкий пик при λ = 250–253 нм, что свидетельствует об образовании в водном растворе наночастиц селена в нуль-валентном состоянии (согласно литературным данным пик поглощения для свободных наночастиц Se0 наблюдается при λ = 256 нм, что мало отличается от ранее исследованных селенсодержащих наносистем [25]). Максимум полосы поверхностного плазмонного резонанса для исследованных содержащих серебро наносистем наблюдается при λ = 400 нм, что свидетельствует об образовании в водном растворе наночастиц серебра в нуль-валентном состоянии [26].
Рис. 1.
УФ-спектры свободных биоактивных полимерных стабилизаторов (БПС) в воде при сБПС = 0.1 мас. % (1) и соответствующих гибридных наносистем на основе зостерина и метилцеллюлозы (2): содержащих селен (а, в) и серебро (б, г).
Важно отметить, что селен представляет собой гидрофобный неорганический полимер, поэтому стабилизация наночастиц Se0 происходит преимущественно за счет их взаимодействий с гидрофобными фрагментами БПС (селенсодержащие гибридные наносистемы формируются по стерическому механизму стабилизации [14]). Напротив, для металлсодержащих систем (в рассматриваемом случае содержащих серебро) на основе зостерина и метилцеллюлозы, которые в щелочной области (рН 10.6–10.8) заряжены, реализуется электростерический механизм стабилизации.
При электростерической стабилизации заряженные функциональные группы БПС вызывают изменение электронной плотности поверхностных электронов наночастиц (схема 1 ), что, в свою очередь, приводит к изменению величины оптической плотности поверхностного плазмонного резонанса.
Схема 1. Изменение электронной плотности поверхностных электронов НЧ при электростерической стабилизации.
Оценка гидродинамического радиуса Rh наночастиц селена методом динамического светорассеяния показала, что в отсутствие полимера образуются крупные частицы селена радиусом ~100 нм (первые сутки), ~180 нм (вторые сутки), характеризующиеся вначале узким унимодальным распределением по размерам. Однако через ~50 ч распределение по размерам становится бимодальным и широким. По истечении двух суток происходит уже видимая агрегация селена. При использовании в качестве стабилизатора наночастиц селена зостерина или метилцеллюлозы в водных растворах при ν = 0.1 формируются наноструктуры с гидродинамическим радиусом $R_{{h1}}^{*}$ < 100 нм (основной пик в табл. 2 и на рис. 2), без тенденции к агрегации в течение нескольких месяцев. Важно отметить, что большие размеры селенсодержащие наносистемы приобретают в случае использования в качестве стабилизатора метилцеллюлозы, характеризующейся большей степенью гидрофобности. Аналогичная ситуация наблюдается для содержащих серебро гибридных полимерных наносистем: при использовании в качестве стабилизатора наночастиц серебра метилцеллюлозы и зостерина формируются наноструктуры с гидродинамическим радиусом $R_{{h1}}^{*}$ < 100 нм (основной пик в табл. 2 и на рис. 2). Максимальные размеры таких систем, как и в случае селенсодержащих систем, наблюдаются при стабилизации наночастиц серебра метилцеллюлозой.
Рис. 2.
Распределение по размерам $R_{{h1}}^{*}$ и $R_{{h2}}^{*}$ гибридных полимерных наносистем зостерин/Se0, зостерин/Ag0, МЦ/Se0 и МЦ/Ag0 (МЦ – метилцеллюлоза) в соответствии с относительной интенсивностью I/I0 динамического светорассеяния.
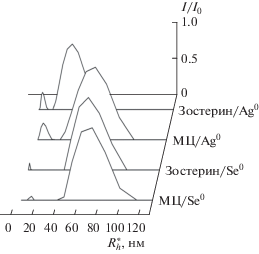
При учете того, что чем сильнее взаимодействие поверхностных атомов с адсорбированными на наночастицах макромолекулами, тем меньше размер частиц, при котором образуется устойчивая в растворе система [27], были сопоставлены величины гидродинамических радиусов $R_{{h1}}^{*}$ для содержащих серебро и селен гибридных полимерных наносистем при использовании одних и тех же биоактивных полимерных стабилизаторов. Анализ размерных параметров (табл. 2) показал, что содержащие серебро наносистемы имеют меньший радиус $R_{{h1}}^{*},$ чем селенсодержащие системы, что, по-видимому, обусловлено большей степенью гидрофобности наночастиц селена по сравнению с наночастицами серебра.
АСМ-изображения поверхности пленок водных растворов зостерина и метилцеллюлозы на слюде хорошо иллюстрируют существенные различия в морфологии использованных в работе БПС. Так, для пленки зостерина (рис. 3а) характерна тенденция укладки молекулярных клубков в цепочечные агрегаты протяженностью ~0.4–2 мкм. Образуется рыхлая неоднородная пленка с областями повышенной локальной плотности. Согласно профилограмме (рис. 3б) высота этих участков над поверхностью пленки составляет 15–30 нм. Оценка средней арифметической (Ra) и среднеквадратичной (Rq) шероховатости поверхности пленки зостерина дает значения Ra = 6.0 и Rq = 7.7 нм. Поверхность пленки, отлитой из водного раствора метилцеллюлозы, более гладкая (значения шероховатости поверхности пленки на порядок меньше, чем для зостерина: Ra = 0.7, Rq = = 0.9 нм). По оценке профилограммы (рис. 4б) высота рельефа поверхности образца составляет 1.0–2.5 нм.
Рис. 3.
АСМ-изображения (а, в, д) (размер вставки 3 × 3 мкм) и профили выделенных участков (б, г, е) поверхности пленок, отлитых из водных растворов: зостерина (а, б); систем зостерин/Se0 (в, г) и зостерин/Ag0 (д, е).
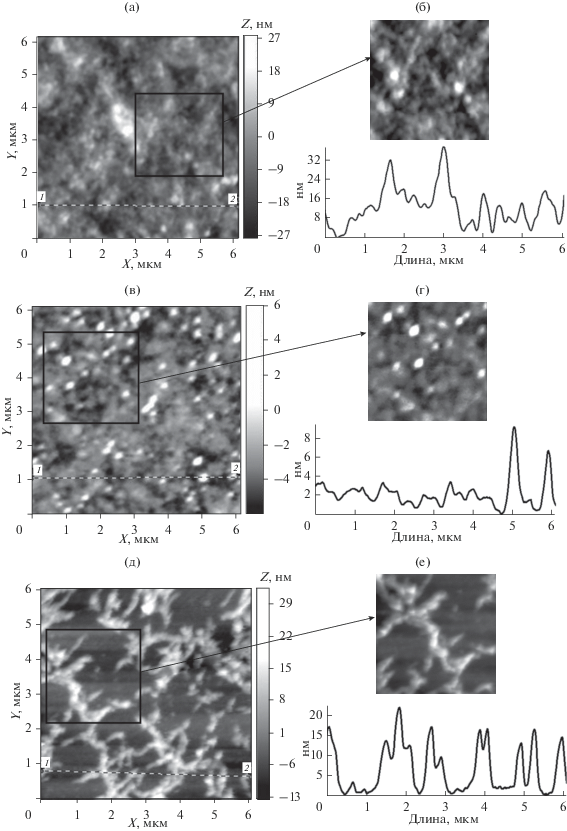
Рис. 4.
АСМ-изображения (а, в, д) (размер вставки 3 × 3 мкм) и профили выделенных участков (б, г, е) поверхности пленок, отлитых из водных растворов: метилцеллюлозы (а, б); систем метилцеллюлоза/Se0 (в, г) и метилцеллюлоза/Ag0 (д, е).
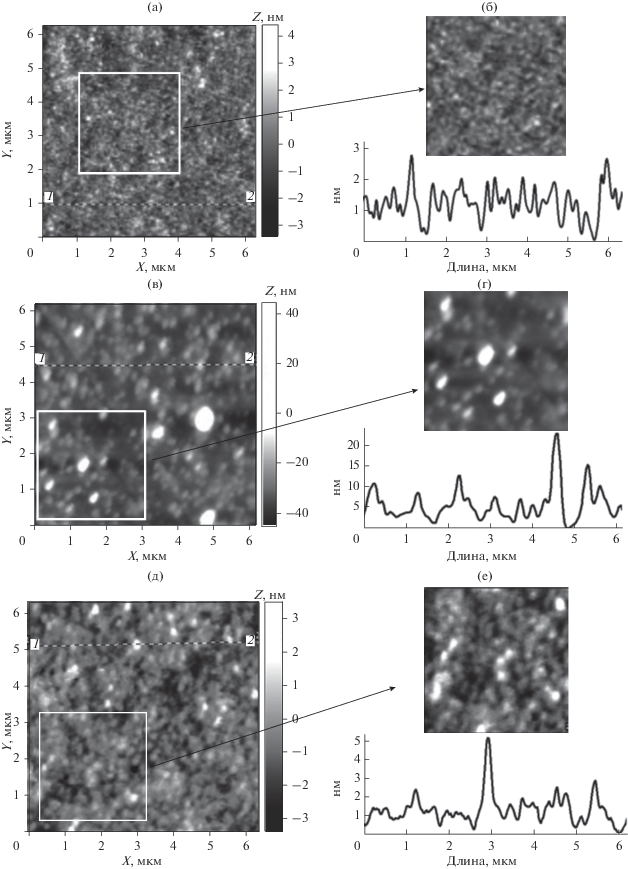
На АСМ-изображениях гибридных полимерных наносистем зостерин/Se0 и метилцеллюлоза/Se0 (рис. 3в, 3г и 4в, 4г) хорошо видно, что основная популяция наноструктур имеет форму, близкую к сферической. Радиусы наноструктур, оцененные методом АСМ ($R_{{{\text{ACM}}}}^{*}$), хорошо коррелируют с размерами наноструктур, полученными методом динамического светорассеяния ($R_{{{\text{sp}}}}^{*}$ = = 1.29$R_{{h1}}^{*}$ (соотношение, выполняемое для сферической модели наноструктуры)): $R_{{{\text{ACM}}}}^{*}$ = 70–80 и $R_{{{\text{sp}}}}^{*}$ = 86 нм для системы зостерин/Se0; $R_{{{\text{ACM}}}}^{*}$ = 80–100 и $R_{{{\text{sp}}}}^{*}$ = 98 нм для системы метилцеллюлоза/Se0 (табл. 2). Для систем зостерин/Ag0 и метилцеллюлоза/Ag0 ситуация не столь однозначна: если содержащие серебро наноструктуры на основе метилцеллюлозы, так же как и в случае с селеном, представляют собой изолированные сферы (рис. 4д, 4е, табл. 2) с близкими размерами в растворе ($R_{{{\text{sp}}}}^{*}$ = 68 нм) и в пленке ($R_{{{\text{ACM}}}}^{*}$ = 60–80 нм), то для системы зостерин/Ag0 характерна морфология “гребнеобразных тяжей”, “наполненных” сферическими наноструктурами с размерами $R_{{{\text{ACM}}}}^{*}$ = 50–65 и $R_{{{\text{sp}}}}^{*}$ = 45 нм (рис. 3д, 3е, табл. 2). Рельефная “тяжеобразная” морфология наноструктур зостерин/Ag0 приводит к увеличению параметров шероховатости пленки Ra = 4.9 и Rq = = 6.0 нм по сравнению со значениями этих параметров, полученными для других изученных гибридных полимерных наносистем (рис. 5, табл. 2). Важно отметить, что независимо от природы наночастиц более крупные наноструктуры наблюдаются в случае использования в качестве стабилизатора метилцеллюлозы, которая, как уже отмечалось выше, имеет большую степень гидрофобности (табл. 2, рис. 2–4).
Рис. 5.
3D-изображения поверхности пленок, отлитых из водных растворов: а – зостерина; б – систем зостерин/Se0; в – зостерин/Ag0; г – метилцеллюлозы; д – систем метилцеллюлоза/Se0; е – метилцеллюлоза/Ag0.

Анализ распределений нанокластеров серебра по размерам, по данным динамического светорассеяния (гидродинамические радиусы $R_{{h2}}^{*},$ соответствующие малым пикам на рис. 2), для систем метилцеллюлоза/Ag0 и зостерин/Ag0 показал, что наиболее вероятные размеры составляют, соответственно, 12 и 6 нм (табл. 2). Наиболее вероятные размеры нанокластеров селена превосходят размеры нанокластеров серебра и составляют по данным динамического светорассеяния для систем метилцеллюлоза/Se0 и зостерин/Se0 (табл. 2), соответственно, 16 и 8 нм.
Полученные результаты составляют физико-химическую основу для модификации полимерных материалов с выраженной физиологической активностью биогенными элементами в нуль-валентной форме.
ВЫВОДЫ
Методом УФ-спектроскопии для содержащих серебро и селен гибридных полимерных наностстем на основе зостерина и метилцеллюлозы установлен факт образования в водном растворе наночастиц в нуль-валентном состоянии. Показано, что селенсодержащие наносистемы на основе изученных биоактивных полимерных стабилизаторов формируются по стерическому механизму стабилизации. Напротив, в случае содержащих серебро систем зостерин/Ag0 и метилцеллюлоза/Ag0 имеет место электростерический механизм стабилизации.
Методом динамического светорассеяния установлено, что при использовании в качестве стабилизатора наночастиц селена и серебра зостерина или метилцеллюлозы в водных растворах при ν = 0.1 формируются наноструктуры с гидродинамическим радиусом в нанометровом диапазоне ($R_{h}^{*}$ < 100 нм).
Методом АСМ показано, что селенсодержащие наноструктуры в случае обоих стабилизаторов характеризуются сферической морфологией. Тип морфологии содержащих серебро наноструктур зависит от природы стабилизатора: в случае системы метилцеллюлоза/Ag0 наблюдается морфология сферы, а для системы зостерин/Ag0 характерна морфология “гребнеобразных тяжей”, “наполненных” сферическими наноструктурами.
Обнаружено, что содержащие серебро наноструктуры имеют меньшие радиусы $R_{{h1}}^{*}$ и $R_{{{\text{ACM}}}}^{*},$ чем селенсодержащие наноструктуры, что, по-видимому, обусловлено большей степенью гидрофобности наночастиц селена по сравнению с наночастицами серебра. Аналогичная тенденция наблюдается и для содержащих селен и серебро нанокластеров ($R_{{h2}}^{*}$).
Список литературы
Тальрозе Р.В., Шандрюк Г.А., Мерекалов А.С. и др. // Высокомолекулярные соединения. А. 2009. Т. 51. № 11. С. 1930.
Литманович О.Е. // Высокомолекулярные соединения. С. 2008. Т. 50. № 7. С. 1370.
Wang J. // Anal. Chim. Acta. 2003.V. 500. № 1–2. P. 247.
Вертелов Г.К., Оленин А.Ю., Лисичкин Г.В. // Журн. аналит. химии. 2007. Т. 62. № 9. С. 903.
Rosi N.L., Mirkin C.A. // Chem. Rev. 2005. V. 105. № 4. P. 1547.
De la Fuente J.M., Renades S. // Biochim. Biophys. Acta. 2006. V. 1760. № 4. P. 636.
Takeoka S. // Organ Microcirculation. V. 13. / Ed. Ishii H. et al. Tokyo: Springer, 2006. P. 35.
Афиногенов Г.Е., Панарин Е.Ф. Антимикробные полимеры. СПб: Гиппократ, 1993. 264 с.
Копейкин В.В., Афиногенов Г.Е., Панарин Е.Ф., Сантурян Ю.Г. // Тез. докл. XX науч. конф. “Химия и физика высокомолекулярных соединений”. Л.: ИВС АН СССР, 1983. С. 86.
Патент 2 128 047 (РФ). 27.03.1999. Водорастворимая серебросодержащая бактерицидная композиция и способ ее получения. / ИВС РАН. Афиногенов Г.Е., Копейкин В.В., Панарин Е.Ф. // Б.И. 27.03.1999. 4 с.
Yoshizawa K., Willett W.C., Morris S.J. // J. Natl. Cancer Inst. 1998. V. 90. № 16. P. 1219.
Yu S.Y., Zhu Y.J., Li W.G. // Biol. Trace Element Res. 1997. V. 51. № 1. P. 117.
Wang Y., Hang H., Yan L. // Colloids Surfaces. B. 2016. V. 140. P. 297. https://doi.org/10.1016/j.colsurfb.2015.12.056
Mayer A.B.R. // Polym. Adv. Technol. 2001. V. 12. P. 96.
Суханова Т.Е., Вылегжанина М.Э., Гофман И.В. и др. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2014. № 9. С. 47. https://doi.org/10.7868/S0207352814090194
Лоенко Ю.Н., Артюхов А.А., Козловская Э.П. и др. Зостерин. Владивосток: Дальнаука, 1997. 88 с.
Вехов В.Н. Зостера морская Белого моря. М.: МГУ, 1992. 144 с.
Лазарева Е.Б., Меньшиков Д.Д. Опыт и перспективы использования пектинов в лечебной практике // Антибиотики и химиотерапия. 1999. № 2. С. 37.
Колесова В.Г., Додали В.А., Лойко В.И., Марченко В.А. // Эфферентная терапия. 1995. Т. 1. № 1. С. 65.
Кирш Ю.Э. Поли-N-винилпирролидон и другие поли-N-виниламиды. М.: Наука, 1998. 252 c.
Валуева С.В., Азизбекян С.Г., Кучинский М.П. и др. // Нанотехника. 2012. № 4(32). С. 53.
Валуева С.В., Титова А.В., Боровикова Л.Н. // Журн. физ. химии. 2015. Т. 89. № 9. С. 1420. doi 10.7868/S0044453715090368
Shaker A.M. // J. Colloid Interface Sci. 1996. V. 180. P. 225.
Brown W. Dynamic Light Scattering: the Method and Some Application. Oxford: Clarendon Press, 1993. 305 p.
Бусев А.И. Колориметрические (фотометрические) методы определения неметаллов. М.: Изд-во иностр. лит-ры, 1963. 467 с.
Низамов Т.Р., Евстафьев И.В., Оленин А.Ю., Лисичкин Г.В. // Коллоидный журн. 2014. Т. 76. № 4. С. 513. https://doi.org/10.1134/S1061933X14040127
Kamat P.V. // J. Phys. Chem. B. 2002. V. 106. P. 7729.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования