Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 10, стр. 55-58
Об адсорбции воды на поверхности (001) NaCl
В. П. Власов a, А. Э. Муслимов a, *, В. М. Каневский a
a Институт кристаллографии им. А.В. Шубникова
ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Россия
* E-mail: amuslimov@mail.ru
Поступила в редакцию 19.03.2020
После доработки 24.04.2020
Принята к публикации 27.04.2020
Аннотация
Проведены исследования адсорбции воды на поверхности (001) скола NaCl в атмосферных условиях при относительной влажности 80% методом контактной силовой спектроскопии. Показано, что на свежем сколе толщина адсорбционного слоя достигает величины ~1.2 нм. При помещении образца в вакуум толщина адсорбционного слоя уменьшается до 0.5 нм. Вторичная ионная масс-спектрометрия показала наличие молекул воды в верхнем слое и соединений воды с подложкой в нижнем слое. При последующем помещении образца в атмосферные условия толщина адсорбционного слоя увеличивался незначительно, до 0.6–0.7 нм. Результаты можно объяснить наличием на свежесколотой поверхности NaCl свободных зарядов (ионов Na+) и электрического поля поверхности.
ВВЕДЕНИЕ
Плоскости скола (001) некоторых щелочно-галоидных кристаллов (обычно NaCl, KCl) часто используют в экспериментах по изучению поверхностных явлений, поскольку они обладают сравнительно простой структурой. Первые эксперименты по изучению структуры поверхности (001) щелочно-галоидных кристаллов методом дифракции атомных и молекулярных пучков [1, 2] показали, что поверхностный слой имеет такую же структуру, как и объем кристалла. Однако из этих экспериментов не было ясно, были эти поверхности кристаллов чистыми или покрытыми, по меньшей мере, монослоем воды, что необходимо знать для теоретических расчетов.
При исследованиях эпитаксиального роста металлов (обычно Au и Ag) на плоскости (001) щелочно-галоидных кристаллов (NaCl, KCl) ожидаемое улучшение эпитаксии на сверхвысоковакуумных сколах не подтвердилось. Эпитаксия Au на поверхностях (001) NaCl и KCl, полученных сколом в сверхвысоком вакууме, была достигнута при температурах подложек выше 750 К, тогда как на поверхностях, полученных сколом в атмосфере, достаточно совершенную структуру Au получали при ~500 К, что можно объяснить адсорбцией воды из атмосферы. Для подробного рассмотрения всех экспериментальных данных следует обратиться к обзору [3].
Методом оже-электронной спектроскопии проведены исследования поверхностей (001) NaCl и KCl, полученных сколом в сверхвысоком вакууме [4]. Установлено значительное превышение сигнала от металлов (Na, K) по сравнению с сигналом от галогена (Cl), и отсутствует картина дифракции медленных электронов [5]. Нагрев подложек или экспозиция в атмосфере полностью восстанавливает их поверхностную структуру. Этот эффект можно объяснить нейтрализацией поверхностного заряда.
Адсорбция воды и границы раздела вода–твердое тело представляют фундаментальный интерес во многих областях химии, биологии, геологии. В [6] приведены данные работ до 2002 г. о взаимодействии воды с поверхностями твердых тел. В последующем интенсивность появления публикаций по данной теме значительно увеличилась. Это связано в большей степени с ростом интереса к адсорбции воды на поверхности металлов, вызывающей коррозию в атмосферных условиях [7–10] и структурные изменения поверхности, например, графена, оксида алюминия и других материалов. Исследования адсорбции воды на поверхности диэлектриков и полупроводников способствуют поиску катализаторов для ее разложения, что представляет интерес для энергетиков [11–13].
Непосредственная заинтересованность в явлении адсорбции привела к значительному количеству работ по проблеме адсорбции воды на щелочных галоидах, для которых легко получить ювенильную (идеально чистую) поверхность [14–16]. Однако остается открытым вопрос, присутствует или нет монослой воды на плоскостях скола (001) в условиях сверхвысокого вакуума. Для измерений в вакууме и на воздухе наиболее информативной представляется сканирующая зондовая микроскопия, а именно, метод контактной силовой спектроскопии, позволяющий отображать адгезионные силы. Кроме того, информативным является метод масс-спектрометрии вторичных ионов. Полагаем, что сочетание этих методов может прояснить проблему адсорбции воды на поверхности щелочных галоидов в атмосферных условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования адсорбционного слоя на поверхности (001) щелочно-галоидных кристаллов (NaCl) проводили с помощью сверхвысоковакуумного зондового микроскопа “Нанофаб-100” (МТ МДТ), откачиваемого турбомолекулярным и ионным насосами до вакуума ~10–7 Па. Образцы кристаллов раскалывали по плоскости спайности на воздухе при относительной влажности ~80% и через 10–20 с помещали на измерительный столик. После процедуры измерения, которая занимала до 40 мин, проводили откачку. По достижении заданного вакуума измерения повторяли. Их проводили методом контактной силовой спектроскопии в зависимости от времени экспозиции. Полученные данные, выраженные в ΔI, были переведены в толщину слоя по методике [16] как теоретически, так и экспериментально – по точкам касания зонда к слою адсорбированной воды и поверхности кристалла. Полученные в отдельных точках толщины слоя экстраполировали на весь спектр.
Состав поверхности анализировали методом вторичной ионной эмиссии с использованием сверхвысоковакуумной установки, оснащенной квадрупольным масс-спектрометром I0-220 Pfeiffer и ионной пушкой с дифференциальной откачкой. Эта пушка позволяла получать пучок ионов Ar+ диаметром 5–10 мм с током до 10 нА при ускоряющем напряжении 1.5 кВ. Измеряли спектры вторичной ионной масс-спектрометрии (ВИМС).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
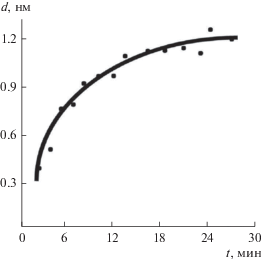
Адсорбцию воды на поверхности (001) скола щелочно-галоидных кристаллов NaCl исследовали при влажности атмосферного воздуха 80%. На рис. 1 показаны результаты спектроскопических измерений адгезионных сил в зависимости от времени экспозиции образца NaCl. Как можно видеть, через 30 мин экспозиции поверхности кристалла в атмосфере при относительной влажности ~80% и комнатной температуре (~293 К) толщина приповерхностного слоя воды достигает ~1.2 нм, что соответствует примерно четырем монослоям. За 2–3 мин экспозиции на поверхности формируется неоднородная структура адсорбированной воды. Она обнаружена в процессе спектроскопических исследований при латеральном смещении зонда. Стабильные измерения по всей поверхности возможны примерно через 3 мин, когда вся поверхность покрывается одним слоем. Увеличение слоя продолжается в течение ~30 мин и прекращается при достижении ~1.2 нм.
Рис. 1.
Нарастание адсорбционного слоя Н2О на свежесколотой поверхности (001) NaCl в зависимости от времени экспозиции при относительной влажности 80%. Получено с использованием контактной силовой спектроскопии по методике [16].
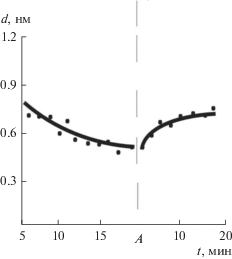
При помещении образца NaCl в вакуум (рис. 2) адсорбированный слой воды в течение 5 мин уменьшается до 0.7 нм и далее за 15 мин приближается к стабильному значению ~0.5 нм, т.е. к 1.5 монослоя, которое сохраняется в вакууме длительное время (в течение четырех суток). При напуске воздуха (относительная влажность 80%) до атмосферного давления (рис. 2, точка А) адсорбированный слой воды увеличивается незначительно, до ~0.6–0.7 нм, т.е. он не достигает начального значения 1.2 нм.
Рис. 2.
Зависимость толщины адгезионного слоя Н2О от времени при помещении в вакуум 10–5 Па (до точки А) и после выноса в атмосферу при относительной влажности 80% (после точки А). Получено с использованием контактной силовой спектроскопии по методике [16].
Спектры ВИМС измеряли в образцах в вакууме ~10–5 Па путем счета положительных ионов. Для этого использовали несколько образцов каждого типа ионов, поскольку было замечено быстрое снижение счета для ряда ионов. Скорость счета ионов (Н2O)+ уменьшалась за 15–20 с в 12 раз, а ионов (Н2О)Na+ в пять раз. Отмечали появление ионов (NaOH)Na+ и значительный рост ионов (NaCl)+. Полученные результаты позволяют предположить, что адсорбция воды в указанных условиях начинается в местах дефектов, в том числе на ступенях, и распространяется по всей поверхности. Процесс адсорбции воды протекает медленно и прекращается примерно через 30 мин при достижении четырех слоев, если считать толщину одного слоя ~0.3 нм. При помещении в вакуум десорбируются верхние слои, тогда как 1.45–1.50 слоя сохраняются на поверхности. Результаты ВИМС показывают, что в верхнем слое находится вода, в приповерхностном слое установлены соединения воды с катионом. Неожиданным является поведение адсорбции воды при помещении образца после вакуума в атмосферные условия, когда слой воды едва достигает 0.6 нм.
При раскалывании щелочно-галоидных кристаллов по плоскости спайности (001) поверхность приобретает заряд [4, 17], который во влажной атмосфере нейтрализуется адсорбированными слоями и, в основном, слоем воды. Электрические свойства молекул воды включают в себя дипольный, квадрупольный и более высокие моменты. Доминирующее электростатическое взаимодействие электрических моментов Н2О и электрического поля поверхности NaCl обусловливает образование поверхностных слоев воды. При оценке простой модели взаимодействия молекулы Н2О с одиночным ионом Na+ на расстоянии а от центра иона по формуле [18]:
где q = 1.6 × 10–19 Кл, т.е. элементарный заряд Na+, ε0 = 8.85 × 10–12 кВ–1 · м–1, a – сумма радиусов Na+ и Н2О (0.095 + 0.14 нм), получаем напряженность электрического поля 2.6 × 1010 В · м–1. Образующийся при раскалывании слой Na+ удерживает четыре–пять слоев воды, из которых два слоя в вакууме десорбируются, а ближние к поверхности полтора–два слоя воды связаны с ионами Na+ и нейтрализуют их. В результате при последующей экспозиции поверхности в атмосферных условиях приповерхностный слой Н2О практически не увеличивается. Такое поведение можно объяснить тем, что первичная адсорбция в основном определяется наличием на поверхности свободных зарядов в виде ионов Na+, которые нейтрализуются первыми слоями Н2О. Электрическое поле, определяющее взаимодействие молекулы Н2О с ионом Na+ в структуре поверхности кристалла NaCl, убывает с расстоянием между Н2О и Na+ по квадратичному закону, что видно из приведенного выражения. Такое электрическое поле обеспечивает адсорбцию четырех слоев Н2О.ЗАКЛЮЧЕНИЕ
Приведенная модель электростатического взаимодействия молекулы Н2О с ионом Na+ может иметь место после скола, когда на поверхности кристалла NaCl осаждаются свободные ионы Na+ [4]. В отсутствие зарядов электрическое поле на поверхности (001) кубического гранецентрированного ионного кристалла задается выражением Леннарда-Джонса [19]:
(2)
$E = \frac{{2q}}{{{{\varepsilon }_{0}}{{b}^{2}}}}{\text{exp}}( - \pi \sqrt {{{2a} \mathord{\left/ {\vphantom {{2a} b}} \right. \kern-0em} b}} ),$Таким образом, адсорбированный слой воды на поверхности кристалла NaCl, несущей свободный заряд (ионы Na+) достигает толщины 4 монослоя. При отсутствии свободного заряда адсорбированный слой воды, образующийся в результате воздействия электрического поля на поверхности (001) NaCl, не превышает 2 монослоя. Только первый слой непосредственно обусловлен электрическим полем подложки.
Список литературы
Estermann I., Stern O. // Z. Physik. 1930. V. 61. P. 95.
Toennies J.P. // Appl. Phys. 1974. V. 3. P. 91.
Green A., Bauer E., Peck R.L., Dancy J. // Kristall und Technik. 1970. V. 5. P. 345.
Власов В.П., Муслимов А.Э., Каневский В.М. // Кристаллография. 2019. Т. 64. № 6. С. 938.
Корсунов В.Е., Князев С.А., Бутенко П.Н. и др. // ФТТ. 2017. Т. 59. № 2. С. 308.
Henderson M.A. // Surf. Sci. Rep. 2002. V. 46. P. 1.
Hadgson A., Hag S. // Surf. Sci. Rep. 2009. V. 64. P. 381.
Brandenburg J.G., Zen A., Fitzner M. et al. // J. Phys. Chem. 2019. V. 10. № 3. P. 358.
Badan C., Heyrich Y., Koper T.M., Juurlink B.F. // J. Phys. Chem. Lett. 2016. V. 7. P. 1682.
Wang R., Stritto M.D., Remsing R.C. et al. // J. Phys. Chem. 2019. V. 123. № 5. P. 15618.
Giovanbattista N., Rossky P., Debenedetti P.G. // J. Phys. Chem. B. 2009. V. 113. P. 13723.
Bjorncholm O., Hansen M.H., Hodgson A. et al. // Chem. Rev. 2016. V. 116. № 13. P. 7698.
Bourret G.R., Diwald O. // J. Matt. Res. 2019. V. 34. № 3. P. 428.
Verdaguer A., Sacha G.M., Luna M. et al. // J. Chem. Phys. 2005. V. 123. P. 12 473.
Bruzewicz D.A., Checco A., Ocko B.M. et al. // J. Chem. Phys. 2011. V. 134. P. 044702.
Shimizu T.K., Maier S., Verdaguer A. et al. // Progress Surf. Sci. 2018. V. 93. № 4. P. 87.
Власов В.П., Муслимов А.Э., Каневский В.М. // Письма в ЖТФ. 2019. Т. 45. Вып. 5. С. 30.
Ewing G.E. // Chem. Rev. 2006. V. 106. P. 1511.
Lennard-Jones J.F., Dent B.M. // Trans. Faraday Soc. 1928. V. 24. P. 92.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


