Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 2, стр. 80-89
Влияние имплантации ионов кислорода на состав поверхности и коррозионно-электрохимические свойства сплава Cu50Ni50
Ф. З. Гильмутдинов a, Т. С. Картапова a, О. Р. Бакиева a, b, *, В. Л. Воробьев a, А. А. Колотов a, Е. М. Борисова b, С. М. Решетников a, b
a Удмуртский федеральный исследовательский центр УрО РАН
426000 Ижевск, Россия
b Удмуртский государственный университет
426034 Ижевск, Россия
* E-mail: ftiran@mail.ru
Поступила в редакцию 19.04.2019
После доработки 15.05.2019
Принята к публикации 20.05.2019
Аннотация
Изучено влияние имплантации ионов кислорода на состав и некоторые свойства слоя, образующегося на поверхности сплава Cu50Ni50. Показано, что облучение ионами кислорода приводит к преимущественному окислению никеля – компонента с большей электроотрицательностью. Оксидные формы никеля сегрегируются в основном на поверхности сплава. Образующиеся слои оксида способствуют улучшению пассивации сплава и уменьшению анодных токов растворения в щелочной среде. В кислой и нейтральных средах влияние имплантации кислорода менее заметно. Имплантация кислорода приводит к повышению электрохимической активности сплава в реакции электровосстановления кислорода.
ВВЕДЕНИЕ
Коррозионно-электрохимические, адсорбционные, каталитические свойства металлических материалов во многом определяются составом и свойствами поверхностных слоев [1]. Среди различных методов модификации поверхности металлов и сплавов можно выделить различные технологии высокоэнергетического воздействия на эти материалы [2, 3]. Повышение коррозионной стойкости исследуемых объектов происходит, в частности, при имплантации ионов кислорода. Такая ионная модификация различных металлов и сплавов приводит к созданию поверхностных оксидных/гидроксидных слоев, способствующих переходу поверхности в пассивное состояние и повышению коррозионной стойкости. Отметим, что наряду с образованием различных по составу неравновесных поверхностных структур в ходе имплантации может происходить разрыхление поверхности, изменение ее энергетического состояния, что дополнительно приводит к изменению свойств материалов.
Для изучения влияния различных видов поверхностной обработки определенный интерес представляют сплавы меди, широко используемые как конструкционные материалы. Наиболее хорошо изучены коррозионно-электрохимические свойства сплавов Cu–Zn, т.е. латуней различного состава [4–6]. Латуни, как и большинство других технически важных сплавов меди, состоят из собственно меди, т.е. электроположительного11 металла, для которого стандартный окислительно-восстановительный потенциал E0 Cu2+/Cu = 0.34 В и который не растворяется в кислотах и самопроизвольно не окисляется в водных средах, не содержащих окислителей. Вторым компонентом, в частности, в составе латуни является электроотрицательный металл цинк, для которого стандартный окислительно-восстановительный потенциал E0 (Zn2+/Zn) = –0.76 В, что свидетельствует о его химической неустойчивости и склонности к самопроизвольному окислению, т.е. коррозии. Тем не менее, в определенных условиях (нейтральная среда, способствующая переходу цинка в пассивное состояние, отсутствие хлорид-ионов как депассиваторов) латуни обладают более высокой коррозионной стойкостью, чем чистая медь [7–10].
Аналогичные выводы могут быть сделаны и относительно сплавов Cu–Ni [7–10]. Никель по сравнению с медью – металл, характеризующийся большей электроотрицательностью (E0 Ni2+/Ni = = –0.25 В), т.е. больше склонен к окислению. В связи с этим атомы никеля на поверхности сплава окисляются в первую очередь с образованием оксидной (гидроксидной) пленки, что и приводит к пассивации и уменьшению анодных (коррозионных) токов. С учетом результатов [6, 11, 12] можно полагать, что пассивации подвергается также и та часть поверхности, которая занята атомами меди. Вполне вероятно, что в области потенциалов полной пассивации сплава образуются смешанные оксиды (гидроксиды) меди и никеля. Следует отметить, то наиболее изучен состав поверхностных соединений и их влияние на коррозионно-электрохимические свойства латуни [4, 6], тогда как в этом отношении сплав Cu–Ni остается малоизученным. Сравнительно простой механизм равномерного перехода в раствор ионов Ni2+ и Cu2+ наблюдается только в нейтральной среде в отсутствие ионов-депассиваторов. В кислых хлоридных растворах никелевый компонент сплава Cu–Ni растворяется с большей скоростью [13–16].
В настоящей работе исследованы состав и структура поверхностных слоев сплава Cu50Ni50 до и после облучения ионами кислорода. Изучена также ионная модификация коррозионно-электрохимических свойств сплава. Согласно данным [9, 10] медно-никелевый сплав эквивалентного состава, т.е. Cu50Ni50, оказался наиболее коррозионно-стойким, что являлось решающим фактором в выборе объекта исследования.
МЕТОДИКА ЭКСПЕРИМЕНТА
В ходе выполнения работы проведено исследование химического состава и атомной структуры сплава Cu–Ni при имплантации ионов кислорода в различных режимах облучения. Образцы представляли собой пластины площадью 1 см2 и толщиной 2 мм, поверхность которых подвергали механической шлифовке, полировке, последующей промывке и обезжириванию этиловым спиртом в ультразвуковой ванне. Сплав Сu–Ni был получен в вакуумной индукционной печи в атмосфере аргона без гомогенизирующего отжига. Состав по данным рентгенофлуоресцентного анализа (спектрометр Inrov-X, α-2000) соответствует формуле Cu50Ni50. Облучение ионами кислорода проводили в ионно-лучевой установке с источником ПИОН-1М в импульсно-периодическом режиме (τ = 1 мс, ν = 200 Гц). При функционировании установки могут образоваться атомарные, молекулярные и многозарядные ионы. Образцы облучали однозарядными ионами О+, их сепарацию в приборе осуществляли с помощью фильтров Вина в скрещенных электрическом и магнитном полях при подобранных параметрах. В этом случае только ионы с определенной массой и зарядом движутся в ионном источнике по прямолинейной траектории, и их извлекают через соосные диафрагмы в электродах ионной оптики, что обеспечивает однородность пучка, в том числе одинаковое зарядовое состояние.
В результате предварительных опытов было установлено, что максимально высокая для данной установки доза ионов облучения при максимальной энергии потока ионов приводит к созданию достаточно плотных поверхностных слоев. При низкой дозе (1015–1016 см–2) и при малой энергии (менее 10 кэВ) образуются сверхтонкие слои, в которых кислород находится преимущественно в адсорбированном (хемосорбированном) состоянии. Как было показано в ходе дальнейших исследований, некоторые средние режимы оказались оптимальными для создания поверхностных слоев оксида. Для ионной модификации образцов далее был выбран следующий режим облучения: доза D = 1017 см–2, энергия ионов E = 10 кэВ, плотность тока облучения J = = 0.1 мА/см2.
МЕТОДИКА ПРОВЕДЕНИЯ РФЭС-ИССЛЕДОВАНИЙ
Химический состав поверхностных слоев медно-никелевого сплава до и после облучения исследовали методом рентгеновской фотоэлектронной спектроскопии (РФЭС) на спектрометре SPECS (MgKα-излучение для возбуждения спектра фотоэлектронов). Снимали РФЭ-спектры Ni, Cu, O1s1/2 и C1s1/2. Обработку спектральных данных проводили с помощью программы Casa XPS.
Относительная погрешность определения концентрации элементов составляла ±3%. Послойный РФЭС-анализ проведен с помощью распыления (травления) поверхности ионами аргона с энергией 4 кэВ и плотностью тока 30 мкА/см2. Скорость травления при используемых параметрах ионной пушки (энергия ионов, плотность тока) определяли экспериментально, измеряя толщину распыленного слоя методом атомно-силовой микроскопии. Измеренная таким образом скорость травления составила ~1 нм/мин. Анализ химического состояния элементов проводили с использованием справочных данных [17], эталонных спектров металлов и их оксидов с применением совместного анализа РФЭ-спектров остовных электронных уровней и оже-спектров LMM металлов [18].
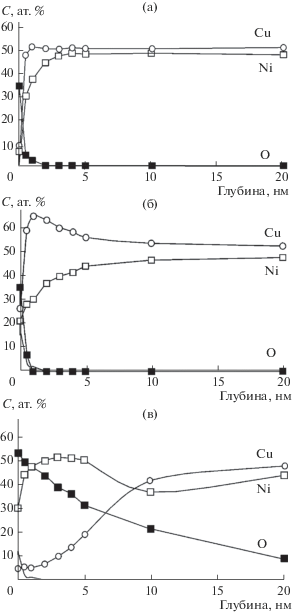
На рис. 1а представлено распределение элементов в поверхностных слоях сплава Cu50Ni50 до облучения ионами кислорода. Можно видеть, что поверхностный сверхтонкий слой толщиной не более 2–3 нм обогащен атомами меди. Далее по глубине поверхностного слоя концентрации меди и никеля выравниваются и соответствуют эквивалентному составу сплава. После облучения ионами кислорода в указанном выше режиме (рис. 1б) наблюдается обогащение никелем поверхностного слоя толщиной до 5 нм. Одновременно с этим растет в поверхностном слое и концентрация кислорода. Известно, что сродство к кислороду можно оценить по убыли свободной энергии (–ΔG) образования соответствующих оксидов. Согласно справочным данным [19, 20] величина ΔG равна для CuO – 127.1, для Cu2O – 146.2, для NiO –216.1 кДж/м. Можно видеть, что при прочих равных условиях при облучении ионами кислорода термодинамически наиболее вероятно образование оксидных форм никеля, что и будет в дальнейшем показано на основании анализа спектров РФЭ. Можно отметить, что при облучении аргоном с теми же параметрами потока, что и при облучении кислородом, в поверхностных слоях происходит увеличение концентрации меди (рис. 1в). Это подтверждает гипотезу о том, что сегрегация атомов меди в данном сплаве может наблюдаться при энергетическом воздействии на поверхность сплава в отсутствие кислорода, т.е. когда исключен процесс окисления никеля. В слоях толщиной более 5 нм концентрации меди и никеля выравниваются.
Рис. 1.
Распределение элементов в поверхностных слоях сплава Cu50Ni50: а – в исходном состоянии; б – после облучения ионами О+; в – после облучения ионами Ar+.
На рис. 2 представлены оже-спектры образцов меди LVV и 2p3/2 на нулевой глубине и 0.5 нм, полученные до ионного облучения. Анализ спектра Cu2p3/2 показал, что атомы меди на исходной поверхности сплава не окислены. Это же подтверждают оже-спектры LVV, которые однозначно соответствуют металлическому (нуль-валентному) состоянию меди.
Рис. 2.
РФЭ-спектры меди Cu2p3/2 (а) и оже-спектры CuLVV (б) на поверхности (1) и глубине 0.5 нм (2).
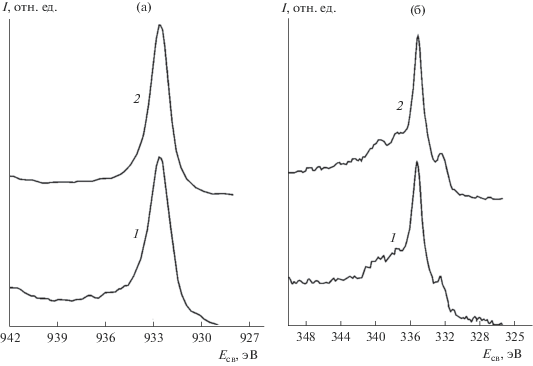
На рис. 3 представлены РФЭ-спектры Ni2p3/2 и O1s сплава Cu–Ni до облучения на поверхности и глубине 0.5 нм. В спектре никеля до ионного травления наблюдается интенсивная компонента 852.8 эВ металлического Ni. Слева в области 855–856 эВ имеется широкий пик, соответствующий слою оксида Ni–O толщиной один–два атомных слоя с хемосорбированным кислородом, который взаимодействует преимущественно с никелем. Не исключено, что здесь может быть тонкий слой гидроксида никеля, так как основной пик кислорода соответствует энергии связи Есв = 531.6 эВ, что более характерно для ОН-группы или хемосорбированного кислорода. Слабое плечо при 529.7 эВ – характерное положение линии кислорода О1s для связи Ni–O. Таким образом, на поверхности сплава имеется сверхтонкая (1–2 нм) оксидная пленка, под которой неокисленный металл. После кратковременного травления в течение 0.5 мин следы окисленного металла исчезают, а интенсивность пика кислорода спадает до уровня шума.
Рис. 3.
РФЭ-спектры Ni2p3/2 (а) и О1s (б) сплава CuNi в исходном состоянии на поверхности (1) и глубине 0.5 нм (2).
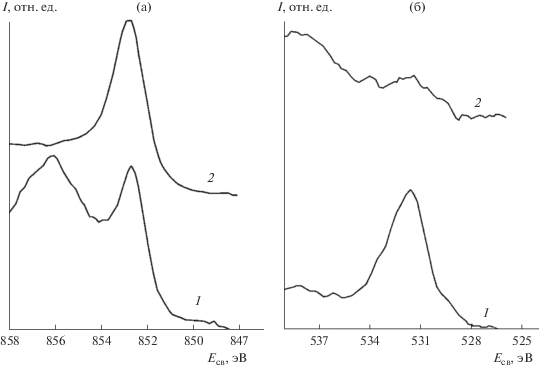
На рис. 4 представлены спектры Ni2p3/2 и O1s сплава Cu–Ni после облучения ионами кислорода. На поверхности ионно-модифицированного образца спектр никеля соответствует Ni2+–O (наличие сателлита при 861 эВ и характерное мультиплетное расщепление основного пика 854.4–856.6 эВ). Спектр близок по своим параметрам к аналогичному спектру монооксида никеля. Отлично значение энергии связи Есв основного пика (854.3 эВ), которое меньше значения эталонного стехиометрического NiO (854.6 эВ). Получен характерный двухкомпонентный спектр кислорода, в котором есть основной пик 529.7 эВ (табличное значение NiO) и второй, слабоинтенсивный, при Есв = 531.4 эВ. Можно предположить, что второй пик связан либо с наличием на поверхности адсорбированного кислорода, либо хемосорбированных и/или химически связанных групп ОН. При ионном травлении интенсивность пика при Есв = 531.4 эВ уменьшается. После травления в спектре наблюдается смещение пика влево к значению 530.2 эВ, нетипичному для объемных оксидов никеля NiO (529.7 эВ). Можно предположить, что при имплантации кислорода формируется модифицированный слой, структура и состав которого отличны от стандартного монооксида никеля.
Рис. 4.
РФЭ-спектры Ni2p3/2 (а) и O1s (б) сплава CuNi после имплантации ионов кислорода на глубине: 0 (1); 0.5 (2), 5 нм (3).

На рис. 5 представлены спектры Cu2p3/2 и CuLVV после модификации поверхности сплава ионами кислорода. Изначально в спектре Cu2p3/2 наблюдаются два состояния меди: Cu2+ (934.3 эВ, которое отличается от стандартного 933.7 эВ для чистого CuO на +0.6 эВ) и Cu+. На глубине 0.5 нм в основном остается только пик при Eсв = 932.8 эВ. Далее на глубинах 3–7 нм медь постепенно переходит в неокисленное состояние. Соответственно, оже-спектры на поверхности и глубине 0.5 нм также соответствуют окисленной меди, а на глубине 5 нм спектр близок к спектру металлической меди.
Рис. 5.
Спектры Cu2p3/2 (а) и CuLVV (б) образца CuNi после имплантации ионов кислорода на глубине: 0 (1); 0.5 (2), 5 нм (3).

Таким образом, из рис. 4, 5 видно, что при имплантации кислорода окисляется преимущественно никель. Имплантация кислорода вызывает обогащение поверхностных слоев никелем – элементом с наибольшим сродством к кислороду. По сравнению с медью никель окисляется до более глубоких слоев. В поверхностных слоях окисленные никель и медь, вероятнее всего, образуют единую структуру Ni–Cu–O, в которую входят катионы обоих металлов. Именно с этим можно связать отличие спектра окисленного никеля от стандартного NiO, а также сдвиг спектра О1s до 530.2 эВ вместо 529.7 эВ. Значение Есв О1s 530.2 эВ не является характерным для объемных стехиометрических оксидов никеля и меди. Таким образом, приведенные данные позволяют утверждать, что облучение ионами кислорода сплава Cu–Ni формирует на его поверхности смешанные слои оксидов меди и никеля. Глубина окисления никеля и концентрация его оксидных форм в поверхностных слоях значительно выше, как и ожидалось, чем в случае меди.
КОРРОЗИОННО-ЭЛЕКТРОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Образцы до и после ионной модификации исследовали путем снятия анодных и катодных потенциодинамических кривых в нейтральной среде боратного буферного раствора при pH 7.4, а также в растворах соляной кислоты и гидроксида калия концентрацией 0.1 M. Использовали потенциостат Eco-Lab 2A-100 производства малого инновационного предприятия при Удмуртском государственном университете. Растворы готовили на основе дистиллированной воды. Аэрация растворов естественная, температура 20 ± 2°C. Использовали стандартную электрохимическую ячейку ЯСЭ-2. Электрод сравнения – насыщенный хлоридсеребряный, относительно которого и приведены далее электродные потенциалы в тексте и на рисунках. Скорость сканирования потенциала при снятии потенциодинамических кривых 2 мВ/с.
Рисунки представляют собой вольт-амперные характеристики сплава Cu–Ni до и после облучения ионами кислорода. Перед снятием анодных потенциодинамических кривых электроды после погружения в растворы соответствующих электролитов подвергали катодной поляризации в течение 15 мин при отрицательных потенциалах на 400 мВ ниже, чем стационарный (коррозионный) потенциал в данной среде. Такая катодная “тренировка” образцов, по-видимому, несколько снижала общую концентрацию оксидных форм на поверхности, ответственных за переход образцов в пассивное состояние. Однако было замечено, что именно после такой катодной предварительной обработки анодные участки кривых лучше воспроизводились. В нейтральной и щелочной среде наблюдались участки так называемого “предпассивного” состояния.
Перед снятием катодных поляризационных кривых на электродах задавали отрицательный потенциал на 800 мВ ниже, чем стационарный (коррозионный) потенциал. Далее включали анодную поляризацию, и катодные кривые, таким образом, снимали при изменении отрицательных электродных потенциалов от более низких значений до более высоких. Для удобства обсуждения кривые на графиках строили в традиционной полулогарифмической системе координат, где логарифмы катодных токов, имеющие по физическому смыслу отрицательные значения, определяли без учета знака, т.е. по модулю величины. На рис. 6 представлены анодные поляризационные кривые исходного и облученного ионами кислорода сплава Cu50Ni50 в боратном буферном растворе с pH 7.4. Как уже отмечалось, анодные поляризационные кривые снимали, начиная со значений отрицательных потенциалов более низких, чем коррозионный (бестоковый) потенциал в данных условиях. В связи с этим на рис. 6 приведены также фрагменты катодных участков поляризационных кривых. Экстраполяция линейных участков катодных и анодных кривых до пересечения дает возможность оценить ток и потенциал коррозии [7, 8]. Как показано на рис. 6, коррозионный (бестоковый) потенциал облученного образца смещен приблизительно на 120 мВ в область бóльших положительных значений, чем потенциал необлученного образца. Одновременно с этим из рисунка следует, что ток коррозии облученного образца уменьшился почти в пять раз. Таким образом, смещение потенциала коррозии облученного образца в положительном направлении свидетельствует о замедлении процесса растворения. Необлученный образец после небольшого участка “предпассивного” растворения сразу же переходит в область пассивации. После облучения область “предпассивного” состояния более протяженная, однако следующий за ним переход в область пассивации демонстрирует несколько меньшие анодные токи. Потенциалы перепассивации поверхности сплава Cu50Ni50 до и после ионной модификации практически одинаковы.
Рис. 6.
Анодные поляризационные кривые образцов сплава Cu50Ni50 в боратном буферном растворе с pH 7.46: 1 – исходная поверхность; 2 – после облучения ионами кислорода.
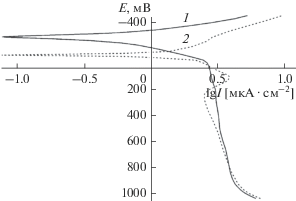
Таким образом, несмотря на то, что в ходе имплантации ионов кислорода изменился состав слоя на поверхности сплава (увеличилась доля оксидно-никелевого компонента), заметного улучшения антикоррозионных свойств сплава достигнуто не было. Тем не менее, можно утверждать, что в условиях самопроизвольной коррозии, благодаря тому, что его исходный бестоковый потенциал находится в области пассивации, ионно-модифицированная поверхность сплава будет проявлять более высокую коррозионную стойкость, чем исходная поверхность.
На рис. 7 представлены катодные поляризационные кривые, полученные с использованием боратного буферного раствора. Учитывая, что этот раствор имел естественную аэрацию, катодный процесс на электродах можно связать с реакцией электровосстановления кислорода:
Из представленных данных следует, что на облученной поверхности сплава Cu–Ni скорость этого процесса значительного выше, чем на исходной поверхности. Так, например, при потенциале E = –400 мВ скорость процесса электровосстановления кислорода составляет около 7.5 мкА/см2, тогда как на необлученной поверхности – около 4.5 мкА/см2. Можно полагать, что оксидные составляющие на поверхности сплава, формирующиеся в ходе имплантации ионов кислорода, усиливают активность поверхности, создают дополнительные активные центры, ускоряющие процесс электровосстановления кислорода. Отметим, что согласно [7, 8], электровосстановление молекулярного кислорода протекает через адсорбционные стадии с участием кислорода на поверхности. Представленные на рис. 7 катодные поляризационные кривые находятся в области потенциалов, далекой от предельного диффузионного тока кислорода. Это дает основание считать, что полученные результаты соответствуют протеканию процесса в кинетической области. При переходе к щелочной среде для облученного образца также наблюдается смещение коррозионного потенциала в положительном направлении (рис. 8). Это свидетельствует о суммарном торможении коррозионного процесса в отсутствие поляризации электрода. Как видно из рис. 8, в этом случае более заметно влияние облучения на поведение анода в сплаве. Как и ожидалось, медно-никелевый сплав в исходном состоянии в щелочной среде находится в пассивном состоянии. Оно может быть связано с наличием поверхностных оксидных или гидроксидных слоев. После облучения ионами кислорода медно-никелевый сплав приобретает еще большую способность к переходу в пассивное состояние. Так, при потенциале 200 мВ анодный ток на поверхности облученного образца почти на порядок меньше, чем на поверхности необлученного. Более того, в случае облученного образца переход в состояние перепассивации также характеризуется более высокими потенциалами на аноде. Все это говорит о том, что в ходе облучения ионами кислорода на поверхности медно-никелевого сплава создаются адсорбционные или химически связанные слои оксида, способствующие резкому замедлению процесса на аноде и повышению коррозионной стойкости этого сплава. В данном случае рост концентрации гидроксид-ионов при переходе в щелочной раствор и наличие сформированных оксидных (гидроксидных) слоев действуют в направлении повышения коррозионной стойкости сплава.Рис. 7.
Катодные поляризационные кривые образцов сплава Cu50Ni50 в боратном буферном растворе с pH 7.46: 1 – исходная поверхность; 2 – после облучения ионами кислорода.
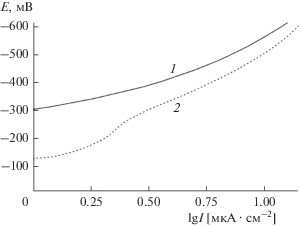
Рис. 8.
Анодные поляризационные кривые образцов сплава Cu50Ni50 в растворе KOH концентрацией 0.1 M: 1 – исходная поверхность; 2 – после облучения ионами кислорода.

На рис. 9 представлены катодные поляризационные кривые в щелочной среде. В данных условиях реакция на катоде может преимущественно проходить по механизму восстановления молекул воды [7, 8]:
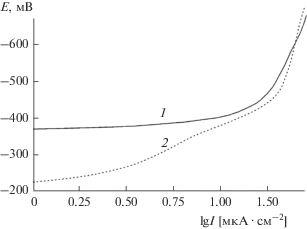
Из рис. 9 видно, что перенапряжение данной реакции на поверхности сплава после ионной модификации значительно ниже. Так, например, катодный ток плотностью 4.6 мкА/см2 на необлученном образце наблюдается при Е = –380 мВ, тогда как на облученном при заметно меньшем потенциале на катоде Е = –295 мВ. Учитывая благоприятное действие имплантации ионов кислорода на скорость данного процесса, можно считать, что это связано с улучшением адсорбции и активации молекул воды, участвующих в разряде, на оксидных (гидроксидных) активных центрах.Рис. 9.
Катодные поляризационные кривые образцов сплава Cu50Ni50 в растворе KOH концентрацией 0.1 M: 1 – исходная поверхность; 2 – после облучения ионами кислорода.
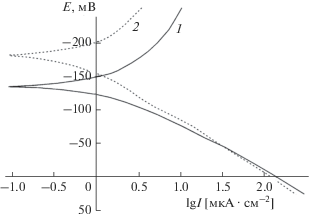
На рис. 10 показаны кривые поляризации анода в растворе HCl концентрацией 0.1 M для сплава Cu50Ni50 до и после облучения. Кислая среда при наличии депассивирующих ионов хлорида препятствует переходу сплава Cu–Ni как в исходном состоянии, так и после имплантации ионов кислорода в пассивное состояние. При изучении анодного растворения сплава Cu30Ni70 [11, 12] в кислых хлоридных растворах было показано, что никелевая и медная составляющие этого сплава растворяются с одинаковой скоростью. Иначе говоря, под влиянием анионов хлорида скорость окисления электроположительного компонента (Cu) выше, чем в отсутствие хлоридов. Что касается электроотрицательного компонента (Ni), наличие хлорид-ионов хотя и ухудшает пассивность поверхности этого металла, тем не менее, скорость его переноса в раствор все же сохраняется на уровне электроположительного компонента. Если учесть, что концентрация никеля в этом сплаве в два раза выше, чем меди, можно говорить о некотором селективном ускорении перехода меди в раствор. Из рис. 10 можно видеть, что, хотя ионная модификация способствовала образованию оксидных форм и меди, и никеля, однако присутствие хорошо адсорбирующихся анионов хлорида как депассиваторов в кислой хлоридной среде свидетельствует о неэффективности облучения сплава ионами кислорода. Хорошо видно, что облученный и необлученный сплавы растворяются практически с одинаковой скоростью. Что касается коррозионного потенциала, то можно видеть, что после облучения ионами кислорода этот потенциал смещается в отрицательном направлении (к катоду). Это явный признак снижения коррозионной стойкости данного образца в рассматриваемых условиях.
Рис. 10.
Анодные поляризационные кривые образцов сплава Cu50Ni50 в растворе HCl концентрацией 0.1 M: 1 – исходная поверхность; 2 – после облучения ионами кислорода.
На рис. 11 представлены кривые поляризации катодов растворе HCl концентрацией 0.1 M сплава до и после облучения ионами кислорода. Можно видеть, что ионная имплантация кислорода приводит к росту перенапряжения выделения водорода на катоде, которое в кислых средах можно представить реакцией электрохимического разряда ионов гидроксония [7]:
Рис. 11.
Катодные поляризационные кривые образцов сплава Cu50Ni50 в растворе HCl концентрацией 0.1 M: 1 – исходная поверхность; 2 – после облучения ионами кислорода.

Таким образом, электрохимические исследования показали, что влияние облучения сплава Cu50Ni50 ионами кислорода неоднозначно влияет на коррозионно-электрохимические свойства поверхности. Конечный результат влияния зависит от природы частиц, находящихся на поверхности, анионного состава и pH среды, и, как следствие, механизма электрохимического процесса.
ВЫВОДЫ
Методом РФЭС и оже-спектроскопии показано, что в исходном состоянии состав поверхностных слоев сплава Cu50Ni50 совпадает с объемным содержанием элементов. Облучение ионами кислорода приводит к преимущественному окислению никелевой составляющей сплава. Оксидные формы никеля, а также хемосорбированный кислород концентрируются в основном на поверхности сплава. Образующиеся оксидные (гидроксидные) слои способствуют улучшению пассивационных свойств сплава в щелочной среде, что приводит к существенному уменьшению токов анодного растворения. В нейтральной среде влияние имплантации кислорода на анодное растворение и самопроизвольную коррозию сплава Cu50Ni50 менее заметно.
Показано, что имплантация кислорода и связанное с этим образование оксидных (гидроксидных) слоев преимущественно никеля приводит к повышению электрохимической активности поверхности сплава в реакции электровосстановления кислорода. Данное явление может быть связано с тем, что имплантация кислорода приводит к созданию на поверхности сплава дополнительных адсорбционных и электрохимически активных центров. Не исключено, что с этим связано также заметное снижение перенапряжения при выделении водорода на катоде в щелочных средах, где в разряде участвуют молекулы воды.
Список литературы
Ролдугин В.И. Физикохимия поверхности. Долгопрудный: Интеллект, 2011. 564 с.
Kolotyrkin V.I., Knyazheva V.M. // Protection of Metals. 1991. V. 27. № 2. P. 141.
Решетников С.М., Гильмутдинов Ф.З., Борисова Е.М. и др. // Коррозия: материалы, защита. 2017. № 9. С. 21.
Маршаков И.К. Анодное растворение и селективная коррозия сплавов. Воронеж: Изд-во Воронеж. ун-та, 1988. 208 с.
Шухардин С.В. Двойные и многокомпонентные системы на основе меди. Москва: Наука, 1979. 248 с.
Акимов А.Г., Астафьев М.Г. // Итоги науки и техники. Коррозия и защита от коррозии. Т. 7. М.: ВИНИТИ, 1978. С. 62.
Скорчеллетти В.В. Теоретические основы коррозии металлов. Л: Химия, 1973. 264 с.
Kaesche H. Die Korrosion der Metalle. Physikalisch-chemische Prinzipien und Aktuelle Probleme. Berlin, Heidelberg: Springer–Verlag, 2011. 563 p.
Corrosion. / Ed. Shrier L.L. London, Boston: Butterworths, 1981. 632 p.
Todt F. Korrosion und Korrosionsschutz. Berlin: Walter de Gruyter, 1961.
Золотарев В.И., Пчельников А.П., Лосев В.В. // Защита металлов. 1988. Т. 24. № 5. С. 723.
Лосев В.В., Пчельников А.П. Анодное растворение сплавов в активном состоянии / Итоги науки и техники. Электрохимия. Т. 15. М.: ВИНИТИ, 1979. С. 62.
Bockris J. O’M., Rubin B.T., Despic A., Lovrecek B. // Electrochim. Acta. 1972. V. 17. P. 973.
Takasu Y., Maru S., Matsuda Y. // Corrosion Engin. 1974. V. 23. P. 621.
Kear G., Barker B.D., Stokes K., Walsh F.C. // J. Appl. Electrochem. 2004. V. 34. № 7. P. 659.
Shih H., Pickering H.W. // J. Electrochem. Soc. 1987. V. 134. № 8. P. 1949.
Нефедов В.И. Рентгеноэлектронная спектроскопия химических соединений. Справ. М.: Химия, 1984. 256 с.
Бриггс Д., Сих М.П. Анализ поверхности методами оже- и рентгеновской фотоэлектронной спектроскопии. М.: Мир, 1987. 600 с.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. Справ. термодинамических величин. Ленинград: Энергоатомиздат, 1989. 239 с.
Wagman D.D., Evans W.H., Parker V.B. et al. // J. Phys. Chem. Ref. Data. 1982. V. 11. S. 2. P. 2.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


