Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 5, стр. 45-50
Перспектива применения различных форм гидроксиапатита для создания биологически активного скаффолда
Е. А. Богданова a, А. Г. Широкова a, *, В. М. Скачков a, Н. А. Сабирзянов a
a Институт химии твердого тела Уральского отделения РАН
620990 Екатеринбург, Россия
* E-mail: alla6685@mail.ru
Поступила в редакцию 26.07.2019
После доработки 17.09.2019
Принята к публикации 20.09.2019
Аннотация
Проведены работы по созданию композиционных материалов с биологически активным покрытием. Изучена морфология вновь образованной поверхности методом растровой электронной микроскопии, а также методом Брунауэра–Эммета–Тейлора. Определена адгезионная прочность покрытия из гидроксиапатита методом центробежного отрыва. В результате проведенных исследований установлены наиболее перспективный метод нанесения, наилучшая форма материала покрытия и оптимальная пористость титанового скаффолда.
ВВЕДЕНИЕ
Неудовлетворенность известными способами, применяющимися в настоящее время в ортопедии и стоматологии для устранения дефектов костной ткани, побуждает специалистов, работающих в области материаловедения, к поиску новых материалов, соответствующих современным критериям [1–4]. В медицинской практике хорошо зарекомендовали себя имплантаты из титана и его сплавов [5–8]. Они обладают механической прочностью, коррозионной стойкостью и биологически совместимы с организмом. Однако при условии монолитности имплантата возникает достаточно сложная проблема их фиксации. Решить эту проблему за счет остеоинтеграции позволяет использование пористых материалов с биологически активным покрытием. При условии сквозной пористости такой имплантат активно взаимодействует с окружающими тканями, что сокращает время его вживления в организм [4]. Кроме того, имплантаты из пористого титана отличаются легкостью, быстротой изготовления и более низкой стоимостью по сравнению с другими. В качестве биологически активного слоя может служить гидроксиапатит – основная неорганическая составляющая костной ткани. При выборе метода нанесения биоактивного покрытия большое внимание необходимо уделять температурной характеристике процесса, поскольку известно, что любая высокотемпературная обработка переводит гидроксиапатит в кристаллическую составляющую, растворимую в меньшей степени по сравнению с минеральной составляющей кости [4, 9].
МАТЕРИАЛЫ И МЕТОДЫ
В качестве трехмерной металлической матрицы, или скаффолда, использовали титан различной пористости (28, 40, 45%). Для биоактивного покрытия методом осаждения из растворов получали ~5–10% коллоидную суспензию гидроксиапатита [10] или 40% водную суспензию ультрадисперсного порошка гидроксиапатита [11]. Для нанесения биоактивного слоя применяли следующие методы: вакуумное импрегнирование коллоидной суспензией гидроксиапатита (способ 1), вакуумное импрегнирование коллоидной суспензией с последующим центрифугированием (способ 2), ультразвуковую обработку коллоидной суспензией (способ 3) и ультразвуковую обработку 40% водной суспензией порошка гидроксиапатита (способ 4).
Вакуумное импрегнирование осуществляли путем пропускания через образец, расположенный на границе среда–вакуум (10–10–8 × 10–1 мм рт. ст.), дозированного количества коллоидной суспензии гидроксиапатита. Способом 2 образец после вакуумной обработки помещали на 1 мин в центрифугу СМ–6М, ELMI при скорости 3500 об./мин. Третьим и четвертым способами покрытие получали путем обработки образца в коллоидной суспензии гидроксиапатита либо в 40% водной суспензии ультрадисперсного порошка гидроксиапатита в ультразвуковой ванне “САПФИР 1.3ТТЦ” при мощности 35 кГц с нагревом до температуры 40°С при перемешивании в течение 1 ч. Во всех случаях сушка образца проходила на воздухе. Количество сорбированного гидроксиапатита определяли по разнице масс образца до и после обработки. Морфологию поверхности покрытых гидроксиапатитом образцов изучали в растровом электронном микроскопе (РЭМ) JSM–6390 LA, JEOL (коэффициент увеличения от ×5 до 300 000, разрешающая способность 3.0 нм при 30 кВ). Поверхностные характеристики получали методом Брунауэра–Эммета–Тейлора (низкотемпературной адсорбции азота с помощью автоматического анализатора площади поверхности и пористости Gemini VII 2390 V1.03 (V1.03t, Micromeritics)). Прочность сцепления покрытия из гидроксиапатита с титановой матрицей оценивали по убыли массы покрытия методом центробежного отрыва (центростремительное ускорение 500 м/с2) [12].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты обработки титановых образцов различной прочности коллоидной суспензией гидроксиапатита и 40% водной суспензией порошка гидроксиапатита приведены в табл. 1. Данные указывают на зависимость прироста массы биоактивного слоя от пористости матрицы, вида суспензии и способа обработки. Так, максимальное увеличение массы образца на 22.07% наблюдается у титана с пористостью 45% при пятиступенчатой обработке водной суспензией ультрадисперсного порошка в ультразвуковой ванне. Однако прирост массы биоактивного слоя не является единственным критерием, свидетельствующим о практической пригодности полученного образца. Для длительного функционирования имплантата в организме необходима оценка прочности покрытия металлического скаффолда. Она рассчитывается на основании данных, полученных методом центробежного отрыва, по формуле:
Таблица 1.
Результаты обработки пористого Ti коллоидным гидроксиапатитом и водной суспензией порошка гидроксиапатита
| Пористость Ti, % | № опыта | mисх, г | mкон, г | ∆m, г | ∆m, % | Σ∆m, г | Σ∆m, % |
|---|---|---|---|---|---|---|---|
| Способ 1 − вакуумная пропитка коллоидной суспензией гидроксиапатита | |||||||
| 28 | 1 | 0.89100 | 0.89800 | 0.00700 | 0.79 | 0.00700 | 0.79 |
| 2 | 0.89800 | 0.90300 | 0.00500 | 0.56 | 0.01200 | 1.35 | |
| 3 | 0.90300 | 0.91000 | 0.00700 | 0.78 | 0.01900 | 2.13 | |
| 4 | 0.91000 | 0.91500 | 0.00500 | 0.55 | 0.02400 | 2.69 | |
| 5 | 0.91500 | 0.92000 | 0.00500 | 0.55 | 0.02900 | 3.25 | |
| 40 | 1 | 0.83000 | 0.85700 | 0.02700 | 3.25 | 0.02700 | 3.25 |
| 2 | 0.85700 | 0.86800 | 0.01100 | 1.28 | 0.03800 | 4.58 | |
| 3 | 0.86800 | 0.88000 | 0.01200 | 1.38 | 0.05000 | 6.02 | |
| 4 | 0.88000 | 0.88600 | 0.00600 | 0.68 | 0.05600 | 6.75 | |
| 5 | 0.88600 | 0.89700 | 0.01100 | 1.24 | 0.06700 | 8.07 | |
| 45 | 1 | 0.37700 | 0.40400 | 0.02700 | 7.16 | 0.02700 | 7.16 |
| 2 | 0.40400 | 0.41500 | 0.01100 | 2.72 | 0.03800 | 10.07 | |
| 3 | 0.41500 | 0.42000 | 0.00500 | 1.20 | 0.04300 | 11.41 | |
| 4 | 0.42000 | 0.42100 | 0.00100 | 0.24 | 0.04400 | 11.67 | |
| 5 | 0.42100 | 0.42800 | 0.00700 | 1.66 | 0.05100 | 13.53 | |
| Способ 2 − вакуумная пропитка коллоидной суспензией гидроксиапатита, центрифугирование (1 мин, 3500 об./мин) | |||||||
| 28 | 1 | 1.05400 | 1.06600 | 0.01200 | 1.14 | 0.01200 | 1.14 |
| 2 | 1.06600 | 1.07300 | 0.00700 | 0.66 | 0.01900 | 1.80 | |
| 3 | 1.07300 | 1.07600 | 0.00300 | 0.28 | 0.02200 | 2.09 | |
| 4 | 1.07600 | 1.08200 | 0.00600 | 0.56 | 0.02800 | 2.66 | |
| 5 | 1.08200 | 1.08400 | 0.00200 | 0.18 | 0.0300 | 2.85 | |
| 40 | 1 | 0.76600 | 0.78900 | 0.02300 | 3.00 | 0.02300 | 3.00 |
| 2 | 0.78900 | 0.79400 | 0.00500 | 0.63 | 0.02800 | 3.66 | |
| 3 | 0.79400 | 0.81100 | 0.01700 | 2.14 | 0.04500 | 5.87 | |
| 4 | 0.81100 | 0.81100 | − | − | 0.04500 | 5.87 | |
| 5 | 0.81100 | 0.81700 | 0.00600 | 0.74 | 0.05100 | 6.66 | |
| 45 | 1 | 0.51000 | 0.54000 | 0.03000 | 5.88 | 0.03000 | 5.88 |
| 2 | 0.54000 | 0.54800 | 0.00800 | 1.48 | 0.03800 | 7.45 | |
| 3 | 0.54800 | 0.55700 | 0.00900 | 1.64 | 0.04700 | 9.22 | |
| 4 | 0.55700 | 0.55700 | − | − | 0.04700 | 9.22 | |
| 5 | 0.55700 | 0.55900 | 0.00200 | 0.36 | 0.04900 | 9.61 | |
| Способ 3 − ультразвуковая обработка в коллоидной суспензии гидроксиапатита (40°С, 1 ч) | |||||||
| 28 | 1 | 1.31285 | 1.31900 | 0.00615 | 0.47 | 0.00615 | 0.47 |
| 2 | 1.31900 | 1.32700 | 0.00800 | 0.61 | 0.01415 | 1.08 | |
| 3 | 1.32700 | 1.33400 | 0.00700 | 0.52 | 0.02115 | 1.61 | |
| 4 | 1.33400 | 1.33400 | − | − | 0.02115 | 1.61 | |
| 5 | 1.33400 | 1.34100 | 0.00700 | 0.52 | 0.02815 | 2.12 | |
| 40 | 1 | 0.79755 | 0.81700 | 0.01945 | 2.43 | 0.01945 | 2.43 |
| 2 | 0.81700 | 0.82400 | 0.00700 | 0.86 | 0.02645 | 3.32 | |
| 3 | 0.82400 | 0.83400 | 0.01000 | 1.21 | 0.03645 | 4.57 | |
| 4 | 0.83400 | 0.83700 | 0.00300 | 0.36 | 0.03945 | 4.95 | |
| 5 | 0.83700 | 0.84400 | 0.00700 | 0.84 | 0.04645 | 5.82 | |
| 45 | 1 | 0.71600 | 0.73400 | 0.01800 | 2.51 | 0.01800 | 2.51 |
| 2 | 0.73400 | 0.75300 | 0.01900 | 2.59 | 0.03700 | 5.17 | |
| 3 | 0.75300 | 0.77200 | 0.01900 | 2.52 | 0.05600 | 7.82 | |
| 4 | 0.77200 | 0.77900 | 0.00700 | 0.91 | 0.06300 | 8.80 | |
| 5 | 0.77900 | 0.79000 | 0.01100 | 1.41 | 0.07400 | 10.34 | |
| Способ 4 − ультразвуковая обработка (40°С, 1 ч) 40% водной суспензией кристаллического гидроксиапатита | |||||||
| 28 | 1 | 0.27410 | 0.28100 | 0.00690 | 2.52 | 0.00690 | 2.52 |
| 2 | 0.28100 | 0.28400 | 0.00300 | 1.07 | 0.00990 | 3.61 | |
| 3 | 0.28400 | 0.28000 | –0.00400 | –1.41 | 0.00590 | 2.15 | |
| 4 | 0.28000 | 0.28100 | 0.00100 | 0.36 | 0.00690 | 2.52 | |
| 5 | 0.28100 | 0.28300 | 0.00200 | 0.71 | 0.00890 | 3.25 | |
| 40 | 1 | 0.31730 | 0.34840 | 0.03110 | 9.80 | 0.03110 | 9.80 |
| 2 | 0.34840 | 0.35330 | 0.00490 | 1.41 | 0.03600 | 11.35 | |
| 3 | 0.35330 | 0.35360 | 0.00030 | 0.08 | 0.03630 | 11.44 | |
| 4 | 0.35360 | 0.35700 | 0.00340 | 0.95 | 0.03970 | 12.51 | |
| 5 | 0.35700 | 0.36100 | 0.00400 | 1.12 | 0.04370 | 13.77 | |
| 45 | 1 | 0.14500 | 0.16760 | 0.02260 | 15.57 | 0.02260 | 15.57 |
| 2 | 0.16760 | 0.17255 | 0.00495 | 2.95 | 0.02755 | 19.00 | |
| 3 | 0.17255 | − | − | − | − | − | |
| 4 | 0.17255 | 0.17500 | 0.00245 | 1.42 | 0.03000 | 20.67 | |
| 5 | 0.17500 | 0.17700 | 0.00200 | 1.14 | 0.03200 | 22.07 | |
Результаты исследования адгезионной прочности представлены на рис. 1. Оптимальная адгезионная прочность была получена для образца 45% пористого титана, обработанного 40% водной суспензией порошка гидроксиапатита (способ 4). Поскольку практическая ценность новых имплантологических материалов в значительной степени определяется их поверхностными характеристиками, способствующими или препятствующими остеокондуктивности имплантата, методом Брунауэра–Эммета–Тейлора было проведено исследование поверхностного слоя гидроксиапатита в полученных образцах (табл. 2).
Рис. 1.
Адгезионная прочность покрытия из гидроксиапатита, нанесенного на пористый титан, способами 1 и 4: вакуумное импрегнирование, коллоидная суспензия гидроксиапатита (1); ультразвуковая обработка в 40% водной суспензии порошка гидроксиапатита (4).
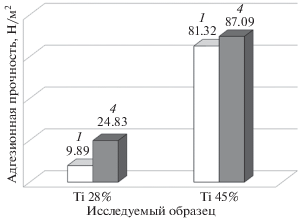
Таблица 2.
Характеристики поверхности пористогоTi, пропитанного коллоидной суспензией гидроксиапатита и водной суспензией кристаллического гидроксиапатита
| Пористость, % | Способ нанесения | Sуд, м2/г | Sпор, м2/г | Vпор, см3/г |
|---|---|---|---|---|
| 28 | Исходный образец | 0.3402 ± 0.0072 | − | − |
| Способ 1 | 4.1893 ± 0.0372 | − | − | |
| Способ 2 | 3.9499 ± 0.0216 | − | − | |
| Способ 3 | 2.3079 ± 0.0062 | − | − | |
| Способ 4 | 2.9443 ± 0.0064 | − | − | |
| 40 | Исходный образец | 0.3943 ± 0.0120 | − | 0.000005 |
| Способ 1 | 8.7330 ± 0.0585 | 0.4632 | 0.000220 | |
| Способ 2 | 7.6470 ± 0.0298 | 0.1630 | 0.000041 | |
| Способ 3 | 6.3632 ± 0.0308 | 0.0655 | 0.000000 | |
| Способ 4 | 14.0917 ± 0.0359 | 1.8232 | 0.003335 | |
| 45 | Исходный образец | 0.3256 ± 0.0453 | 1.3652 | 0.000783 |
| Способ 1 | 11.4029 ± 0.0831 | − | − | |
| Способ 2 | 9.1531 ± 0.0420 | 0.3702 | 0.000152 | |
| Способ 3 | 9.8925 ± 0.0660 | 0.7310 | 0.000384 | |
| Способ 4 | 22.6126 ± 0.0252 | − | − |
Установлено, что ультразвуковая обработка титановых образцов коллоидной суспензией гидроксиапатита или его 40% водной суспензией способствует увеличению площади удельной поверхности у титана (28%) от 0.34 до 2.3 м2/г (в случае коллоидного гидроксиапатита) и 2.94 м2/г (в случае порошка гидроксиапатита), у титана (45%) – от 0.33 до 9.89 м2/г (коллоидный гидроксиапатит) и 22.61 м2/г (порошок). Использование водной суспензии кристаллического гидроксиапатита в качестве материала покрытия позволяет существенно повысить площадь удельной поверхности композиционного материала, возрастающую с увеличением пористости металлической матрицы. Изменения, свидетельствующие о формировании новой развитой поверхности, подтверждаются также РЭМ-изображениями образцов пористого титана до и после нанесения покрытия из гидроксиапатита (рис. 2).
ЗАКЛЮЧЕНИЕ
Получены композиционные материалы путем нанесения биоактивного покрытия на металлическую матрицу. С использованием современных физико-химических методов анализа изучена зависимость формирования поверхностного слоя гидроксиапатита от пористости титанового каркаса, способа обработки и формы гидроксиапатита (коллоидная суспензия, водная суспензия ультрадисперсного порошка). Проведена сравнительная оценка полученных материалов. Рассчитана прочность сцепления образующегося биоактивного слоя с металлической матрицей. Полученные данные позволяют рекомендовать технологически простой способ ультразвуковой обработки 45% пористого титана 40% водной суспензией ультрадисперсного порошка гидроксиапатита для получения равномерного и прочного биоактивного покрытия образцов медицинского назначения.
Список литературы
Arabnejad S., Johnston R.B., Pura J.A. et al. // Acta Biomater. 2016. V. 30. P. 345.
Строганова Е.Е. // Стекло и керамика. 2008. № 1. С. 36.
Акопян Г.В., Хачатрян А.Г. // Вестн. стоматологии и челюстно-лицевой хирургии. 2012. Т. 7. № 11. С. 10.
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2006. 204 с.
Гарафутдинова М.А., Астахов М.В., Колобов Ю.Р. и др. // Материаловедение. 2013. № 12. С. 44.
Hanawa T. // Jpn. Dent. Sci. Rev. 2010. V. 46. P. 93.
Harun W.S.W., Asri R.I.M., Alias J. et al. // Ceram. Int. 2018. V. 44. Iss. 2. P. 1250.
Chen M., Zhang E., Zhang L. // Mater. Sci. Eng. C. 2016. V. 62. P. 350.
Богданова Е.А., Сабирзянов Н.А. // Материаловедение. 2015. № 1. С. 52.
Патент 2 406 693 (РФ). Способ получения суспензии гидроксиапатита / Институт химии твердого тела УрО РАН. Сабирзянов Н.А., Богданова Е.А., Хонина Т.Г. // Б.И. 2010. № 35. С. 5.
Патент 2104924 (РФ). Способ получения гидроксиапатита / Институт химии твердого тела УрО РАН. Яценко С.П., Сабирзянов Н.А. // Б.И. 1998. № 17. С. 5.
Лунев В.М., Немашкало О.В. // ФIП ФИП PSE. 2010. Т. 8. № 1. С. 64.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования



