Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 5, стр. 73-81
Особенности самоорганизации пленок на основе триглицина под действием паров органических соединений
А. С. Морозова a, *, С. А. Зиганшина a, **, А. А. Бухараев a, М. А. Зиганшин b, А. В. Герасимов b
a Казанский физико-технический институт им. Е.К. Завойского,
ФИЦ “Казанский научный центр” РАН
420029 Казань, Россия
b Химический институт им А.М. Бутлерова,
Казанского (Приволжский) федерального университета
420008 Казань, Россия
* E-mail: morozova_anna_s@mail.ru
** E-mail: sufia@mail.ru
Поступила в редакцию 03.08.2019
После доработки 12.09.2019
Принята к публикации 14.09.2019
Аннотация
Методом атомно-силовой микроскопии исследована самосборка триглицина на поверхности высокоориентированного пиролитического графита и слюды. Продемонстрирована возможность формирования кристаллических структур на основе триглицина в результате воздействия на его аморфную пленку паров органических соединений или воды. Показано, что органические соединения, способные к образованию водородных связей, оказывают влияние на поверхность пленок, нанесенных на данные подложки. Органические соединения, неспособные к водородному связыванию, изменяют морфологию пленок, нанесенных только на поверхность пирографита.
ВВЕДЕНИЕ
Органические кристаллы представляют большой интерес для современных нанотехнологий [1]. Они применяются при создании оптических запоминающих устройств, цветных дисплеев, систем оптической связи [2], органических полевых транзисторов [3], их используют при разработке новых лекарственных форм для фармацевтических препаратов [4]. При этом активно развиваются методы получения микро- и нанокристаллов, физико-химические свойства которых в значительной степени определяются морфологией их поверхности [5]. Наиболее распространенным способом получения органических кристаллов остается метод выращивания их из растворов [6], который, тем не менее, имеет ряд недостатков, связанных с чувствительностью этого метода к малейшим изменениям во внешних условиях [7]. Среди них можно выделить длительность процесса и отсутствие гарантий получения кристаллов с заданной морфологией, формой и размером. Кроме того, следует учитывать способность органических соединений к образованию различных полиморфных модификаций [8]. Другой метод заключается в формировании кристаллов и наноструктур на поверхности аморфных пленок, нанесенных на различные подложки, под действием паров органических соединений. Аморфное состояние вещества, являясь метастабильным с точки зрения термодинамики, обладает избыточной энергией и может быть переведено в упорядоченное состояние (наноструктуры, кристаллы) под воздействием внешних факторов [9]. Этот переход может быть инициирован при взаимодействии пленки с парообразным соединением. Варьирование органических паров или типа подложки позволяет получать различные органические структуры [10–14]. Вместе с тем к настоящему времени управление самосборкой молекул в тонких пленках и предсказание возможной морфологии поверхности пленок с выращенными на них кристаллами, все еще остается сложной задачей [15].
Довольно распространенными объектами для таких исследований являются короткоцепные пептиды (олигопептиды), поскольку микро- и наноструктуры на их основе в настоящее время нашли свое применение в различных областях [16], таких как оптика и энергетика [3, 17], медицина [18], материаловедение [19]. Особенностью олигопептидов, обусловившей интерес к ним, является их способность к самосборке с образованием разнообразных структур: наночастиц, нановолокон, наностержней, нанопроводов, нанотрубок, наносфер [20, 21]. Наиболее простым олигопептидом из всего разнообразия является дипептид глицил-глицин, образованный из остатков простейшей аминокислоты (глицина). Глицин, входящий в состав многих белков и биологически активных соединений, обладает высокой биологической активностью [22], поэтому структура и свойства его кристаллов довольно хорошо исследованы [23, 24]. В то же время, ди- и триглицин представляют также большой интерес в связи с возможностью их использования при производстве биологически активных и лекарственных препаратов [25]. Для диглицина известно, что при кристаллизации его из раствора при нормальных условиях могут образоваться три полиморфа α, β и γ [26, 27]. Для триглицина количество известных полиморфных модификаций меньше: две формы (α и β [28]). При этом морфология поверхности кристаллов этих полиморфов остается практически не изученной.
В настоящей работе с помощью метода атомно-силовой микроскопии (АСМ) было изучено влияние паров органических соединений на морфологию пленок трипептида глицил-глицил-глицин, нанесенных на поверхность двух отличающихся по свойствам подложек: высокоориентированного пиролитического графита (ВОПГ) и слюды. Особенностью выбранных подложек является наличие избыточной электронной плотности на поверхности в случае ВОПГ [29] и заряда в случае слюды [30]. Эти подложки активно используются для получения микро- и наноструктур на основе пептидов и олигопептидов, а также для исследования их свойств методами зондовой микроскопии [31], но при этом возможное влияние подложек на вид образующихся структур практически не изучено.
МЕТОДИКА ПОЛУЧЕНИЯ И ИССЛЕДОВАНИЯ ОБРАЗЦОВ
АСМ-исследования
В качестве объекта был использован трипептид глицил-глицил-глицин (GGG) (Chem-ImpexInternational № 0562579) (рис. 1). Раствор олигопептида с концентрацией 1 мг/мл готовился растворением точной навески в смеси метанол–вода (в соотношении 1 : 1). В качестве подложек были использованы две атомарно-гладкие, отличающиеся по своим свойствам поверхности: гидрофобный высокоориентированный пиролитический графит (ВОПГ) и гидрофильная слюда. Пленки трипептида получали путем нанесения 40 мкл свежеприготовленного раствора трипептида на поверхность подложки с последующим испарением растворителя. Для получения наноструктур подожку с нанесенной пленкой помещали в чашку Петри с 200 мкл растворителя. Не допускалось прямого контакта жидкого растворителя и образца. Далее чашку Петри с пленкой на подложке герметизировали и выдерживали при комнатной температуре и влажности воздуха 60–83% в течение 24 ч. После насыщения проводилась осушка образца в потоке воздуха при температуре 45°С. Для насыщения пленок GGG парами использовались растворители, отличающиеся по физико-химическим свойствам, относящиеся к разным классам органических соединений:
1) хлорпроизводные (слабые протонодоноры): хлороформ, дихлорметан;
2) азотсодержашие (протоноакцепторы): ацетонитрил, пиридин;
3) спирты (протонодоноры): метанол, этанол;
4) ароматические (слабый протоноакцептор): бензол.
Морфология поверхности пленок трипептида до и после насыщения парами органических соединений исследовалась методом атомно-силовой микроскопии на приборе Solver P47Pro (НТ-МДТ, Россия) с использованием стандартных кремниевых кантилеверов NSG-11 (НТ-МДТ, Россия) с резонансной частотой колебания от 114 до 259 кГц.
Рентгеновская порошковая дифрактометрия
Пленки трипептида глицил-глицил-глицин, полученные на поверхности пирографита и слюды, до и после взаимодействия с парами воды и этанола были охарактеризованы методом рентгеновской порошковой дифрактометрии с использованием дифрактометра MiniFlex 600 (Rigaku, Япония), оснащенного высокоскоростным D/teX-детектором. Измерения проводили с использованием CuKα-излучения (40 кВ, 15 мА), результаты были получены при комнатной температуре в диапазоне углов 2θ от 5° до 50° шагом 0.02° и временем экспозиции в каждой точке 0.24 с без вращения.
Пленки трипептида были получены на поверхности подложек по методике, описанной выше. Затем пленки механически снимались с поверхности подложки с помощью тефлонового скребка. Процедуру повторяли несколько раз для накопления необходимого количества вещества для анализа методом рентгеновской порошковой дифрактометрии. Далее образцы пленок в виде порошка (после получения дифрактограмм) выдерживались в контакте с насыщенным паром воды (первый образец) и этанола (второй образец) в течение 12 ч при комнатной температуре. Продукты насыщения были охарактеризованы методом рентгеновской порошковой дифрактометрии.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
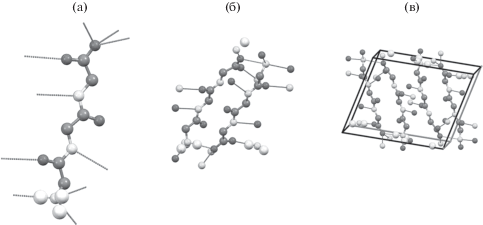
Морфология поверхности пленок трипептида глицил-глицил-глицин, нанесенных на различные подложки, была исследована методом АСМ. На рис. 2 представлены АСМ-изображения пленки GGG на ВОПГ и слюде. При нанесении 40 мкл раствора на поверхности подложек образуются пленки с толщиной ~100 нм.
Установлено, что подложка оказывает значительное влияние на морфологию пленки трипептида. В случае гидрофобного ВОПГ на поверхности формируется ровная аморфная пленка (рис. 2а). Среднеквадратичная шероховатость на скане 10 × 10 мкм составляет ~5.8 ± 0.1 нм. На поверхности гидрофильной слюды формируется аморфная пленка (рис. 2б). Среднеквадратичная шероховатость на скане составила ~1.35 ± 0.4 нм.
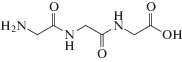
Согласно данным рентгеноструктурного анализа [32], каждая молекула трипептида может образовывать до 10 водородных связей (рис. 3а), поэтому молекулы GGG легко формируют димеры (рис. 3б) и тетрамеры (рис. 3в), поскольку в элементарной кристаллографической ячейке присутствует четыре молекулы GGG. Первичные аминогруппы (–NH2) ди- и тетрамеров находятся в заряженной (аммонийной) форме, поэтому способны к сильным взаимодействиям с отрицательно заряженными группами на поверхности слюды [33], в результате чего возможна ориентация молекул трипептида с образованием упорядоченных слоев (рис. 2б). Следует отметить, что предложенная методика получения аморфных пленок трипептида является полезной, поскольку именно аморфное состояние является предпочтительным для последующего формирования различных органических наноструктур или кристаллов, при обработке пленок парами органических растворителей или воды [34].
Рис. 3.
Схематичное изображение молекулы GGG с водородными связями (а), димера (б) и элементарной кристаллической ячейки кристалла, образованной четырьмя молекулами GGG (в) [32].
Далее аморфные пленки GGG насыщали парами воды или органических соединений. Было установлено, что сильные протонодоноры (спирты) и протоноакцептор (пиридин), а также вода оказывают значительное влияние на морфологию пленок, нанесенных на разные подложки.
После взаимодействия пленки, нанесенной на поверхность ВОПГ, с парами метанола формируются неориентированные слоистые кристаллические структуры, имеющие различную форму и размеры. Насыщение пленки трипептида парами этанола приводит к формированию узких кристаллов длиной до 450 нм и шириной 118–370 нм в случае ВОПГ (рис. 4а) и слоистых кристаллических структур и прямоугольных кристаллов длиной от 500 нм до 1.3 мкм, шириной от 300 нм до 1.2 мкм на поверхности слюды (рис. 4б). После насыщения парами воды на поверхности пленки трипептида на ВОПГ были обнаружены протяженные кристаллы длиной до 40 мкм высотой от 10 до 70 нм (рис. 4в). Значительное изменение морфологии поверхности аморфной пленки GGG под действием паров воды хорошо согласуется с данными по сорбции, полученными методом кварцевых микровесов [35], согласно которым трипептид, нанесенный на поверхность золота, способен эффективно связывать воду, но обладает относительно низкой емкостью по отношению к спиртам. Следует также отметить, что влияние паров на морфологию пленок олигопептидов, нанесенных на ВОПГ и поверхность кварцевого резонатора, покрытую золотом, одинаково [12]. На поверхности аморфной пленки GGG, нанесенной на слюду, после воздействия паров воды были обнаружены слоистые кристаллы (рис. 4г). Ширина чешуек составляет от 50 до 150 нм, высота от 30 до 100 нм.
Рис. 4.
АСМ-изображения пленок GGG, нанесенных на ВОПГ (а, в) и слюду (б, г), после насыщения парами этанола (а, б) и воды (в, г).

Результаты взаимодействия паров органических соединений с тонкими пленками олигопептидов, нанесенных на различные подложки, согласуются с величинами краевого угла смачивания θ используемых подложек (табл. 1). Для сравнения в табл. 1 приведены значения краевых углов смачивания поверхности окисленного кремния, который также является широко используемой подложкой при изучении органических наноструктур методами зондовой микроскопии [36]. Как видно из табл. 1, краевые углы смачивания поверхностей ВОПГ и золота имеют близкие значения, но существенно отличаются от величины краевого угла для слюды. По-видимому, более гидрофобный характер поверхности этих подложек и отсутствие сильных взаимодействий с молекулами олигопептидов обеспечивает возможность их самосборки под действием паров. В случае слюды для процесса переупаковки молекул олигопептидов в твердой фазе требуется затратить больше энергии для преодоления адгезии.
Для изучения состояния тонких пленок трипептида до и после взаимодействия с парами были получены дифрактограммы пленок, полученных на поверхности подложек, и пленок, насыщенных парами воды и этанола (рис. 5).
Рис. 5.
Дифрактограммы пленки GGG, полученной на поверхности ВОПГ при быстром испарении растворителя (кривая 1), пленки GGG после насыщения парами этанола (кривая 2) и парами воды (кривая 3).
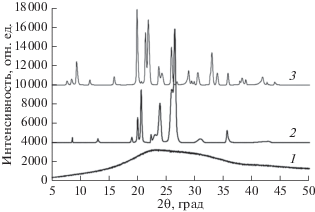
Согласно полученным данным, на поверхности изученных подложек в условиях быстрого испарения растворителя формируются аморфные пленки (рис. 5, кривая 1). На дифрактограмме присутствует широкое “гало”, характерное для аморфных веществ. В результате взаимодействия аморфной пленки GGG с насыщенным паром этанола и воды происходит ее кристаллизация (рис. 5, кривые 2 и 3). Следует отметить, что кристаллическая упаковка трипептида в полученных продуктах насыщения различается. Дифрактограмма образца GGG, насыщенного этанолом, содержит интенсивные пики при значениях 2θ, равных 20°, 20.6°, 23.9°, 25.9°, 26.5° и 35.6° (рис. 5, кривая 2). В то время как на дифрактограмме образца GGG, насыщенного парами воды, присутствуют интенсивные пики при углах 19.9°, 21.4°, 21.9°, 23.7°, 25.9°, 28.9°, 30.4°, 32.4°, 33.8° и 35.7° (рис. 5, кривая 3). Результаты порошковой дифрактометрии согласуются с данными, полученными методом АСМ, которые показывают, что на поверхности пленок GGG под влиянием воды и этанола образуются различные структуры: небольшие узкие кристаллы в случае этанола и длинные кристаллы в случае воды (рис. 4).
Насыщение пленки GGG парами пиридина приводит к значительному изменению ее морфологии (рис. 6). В случае ВОПГ (рис. 6а) пленка частично набухает, на ней формируются округлые объекты диаметром ~1 мкм, выступающие над поверхностью пленки на 10–30 нм, и плоские кристаллические структуры, похожие на листы дерева, диаметром от 10 до 20 мкм, а также скопления мелких кристалликов, длина и толщина которых составляет от 500 нм до 1 мкм от 500 до 700 нм соответственно. В случае слюды (рис. 6б) на пленке формируются округлые объекты, напоминающие по форме кратеры диаметром от 500 нм до 2 мкм, высотой жерла от 250 до 500 нм. В последнем случае можно предположить обычное набухание пленки без ее кристаллизации.
Рис. 6.
АСМ-изображение пленки GGG, нанесенной на ВОПГ (а), слюду (б), после насыщения парами пиридина.

Насыщение пленки, нанесенной на ВОПГ, парами бензола приводит к образованию на ее поверхности кристаллических наноструктур шестигранной дендритной формы (рис. 7а). Обнаруженные наноструктуры состоят из нановолокон длиной от 10 до 60 нм, толщиной от 60 до 250 нм. Влияние бензола, неспособного к сильным межмолекулярным взаимодействиям с трипептидом, на морфологию его пленки может быть результатом хорошего смачивания поверхности гидрофобного пирографита (краевой угол составляет 0°) [45] и образования тонкой прослойки между слоем трипептида и подложкой. В результате этого подвижность молекул трипептида увеличивается и происходит кристаллизация. Насыщение пленки, нанесенной на слюду, парами бензола приводит к ее выравниванию и формированию пор глубиной более 70 нм (рис. 7б). По-видимому, в данном случае большую роль играют взаимодействия GGG с подложкой. На слюде, способной за счет электростатического взаимодействия или водородных связей прочно удерживать молекулы трипептида, воздействие паров бензола не приводит к формированию наноструктур.
Рис. 7.
АСМ-изображение пленки GGG, нанесенной на ВОПГ (а, в) и слюду (б, г), после насыщения парами бензола (а, б) и дихлорометана (в, г).
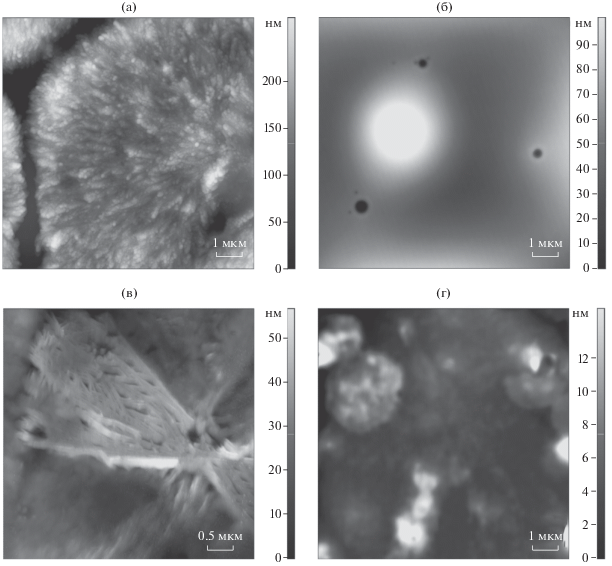
Аналогичное воздействие на пленку трипептида было зафиксировано для паров слабого протонодонора-дихлорометана. При насыщении аморфной пленки трипептида парами дихлорометана, неспособного к сильным специфическим взаимодействиям с GGG, используемая подложка оказывает существенное влияние на конечный результат (рис. 7в, 7г). При использовании в качестве подложки слюды (рис. 7г) пленка GGG после взаимодействия с дихлорометаном набухает, а в некоторых случаях на ее поверхности образуются разрывы глубиной до 150 нм. Насыщение парами дихлорометана пленки GGG, нанесенной на поверхность ВОПГ (рис. 7в), приводит к формированию кристаллических структур, исходящих в виде расширяющихся лучей из единого центра длиной от 3 мкм. Можно предположить, что механизм этого влияния тот же, что и в случае бензола.
ЗАКЛЮЧЕНИЕ
В работе предложен способ получения аморфных пленок трипептида глицил-глицил-глицин на поверхности высокоориентированного пиролитического графита и слюды. Продемонстрирована самоорганизация пленок с образованием различных наноструктур и кристаллов.
Показано, что структурирование аморфной пленки трипептида, нанесенной на ВОПГ и слюду, происходит под действием паров сильных протонодоноров (спирты, вода) и протоноакцептора (пиридин). После насыщения пленки парами спиртов и пиридина на поверхности формируются слоистые кристаллические структуры различной формы. В случае паров воды на поверхности пленки трипептида, нанесенной на ВОПГ, образуются протяженные кристаллы.
Влияние паров растворителей, неспособных к формированию водородных связей (дихлорометан и бензол), на морфологию пленок, нанесенных на ВОПГ и слюду, различно. На поверхности ВОПГ происходит кристаллизация трипептида с образованием развитой поверхности, а на слюде морфология пленок практически не изменяется.
Таким образом, комбинируя тип подложки и парообразного компонента, можно направлено воздействовать на поверхность тонкой пленки трипептида глицил-глицил-глицин и формировать кристаллические структуры на его основе с различной геометрией. Полученные результаты могут быть полезными для разработки методики управляемой самоорганизации короткоцепных олигопептидов под действием паров органических соединений и воды.
Список литературы
Yang X., Myerson A.S. // CrystEngComm. 2015. V. 17. P. 723.
Nandhini S., Murugakoothan P. // Materials Letters. 2019. V. 241. P. 152.
Forrest S.R. // Quantum Electron. 2000. V. 6. P. 1072.
Yang X., Ong T.-Ch., Michaelis V.K. et al. // CrystEngComm. 2015. V. 17. P. 6044.
Li J., Tilbury C.J., Kim S.H., Doherty M.F. // Prog. Mater. Sci. 2016. V. 82. P. 1.
Seevakan K., Bharanidharan S. // International J. Pure and Appl. Mathematics. 2018. V. 119. P. 5743.
Huang J., Stringfellow T.C., Yu L. // J. Am. Chem. Soc. 2008. V. 130. P. 13973.
Bernstein J. Polymorphism in Molecular Crystals. N.Y.: Oxford University Press, 2002. 428 p.
Debenedetti P.G., Supercooled F.H. // Nature. 2001. V. 410. P. 259.
Ziganshin M.A., Gubina N.S., Gerasimov A.V. et al. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 20168.
Ziganshin M.A., Efimova I.G., Gorbatchuk V.V. et al. // J. Pept. Sci. 2012. V. 18. P. 209.
Ziganshin M.A., Efimova I.G., Bikmukhametova A.A. et al. // Protection of Metals and Phys. Chem. of Surf. 2013. V. 49. P. 274.
Ziganshin M.A., Bikmukhametova A.A., Gerasimov A.V. et al. // Protection of Metals and Phys. Chem. of Surf. 2014. V. 50. P. 49.
Lee J.S., Ryu J., Park C.B. // Soft Matter. 2009. V. 5. P. 2717.
Punzo F. // J. Mol. Struct. 2013. V. 1032. P. 147.
Kim S., Kim J.H., Lee J.S. et al. // Small. 2015. V. 11. P. 3623.
Ryu J. // ACS Nano. 2010. V. 4. P. 2695.
Mata A. // Biomaterials. 2010. V. 31. P. 6004.
Lee J.S. // Soft Matter. 2009. V. 5. P. 2343.
Zelzer M. // Chem. Soc. Rev. 2010. V. 39. P. 3351.
Guo C., Luo Y., Zhou R., Wei G. // Nanoscale. 2014. V. 6. P. 2800.
Lu Y., Zhu X., Li J. et al. // Biochem. Pharmacol. 2017. V. 123. P. 40.
Vijayalakshmi V., Dhanasekaran P. // J. Crystal Growth. 2018. V. 506. P. 117.
Mailoud O.M., Elsayed A.H., El Fetouh H.A. et al. // Results in Physics. 2019. V. 12. P. 925.
Liakopoulou-Kyriakides M. // Studies in Natural Products Chemistry. 2002. V. 27. P. 793.
Bernal J.D. // Z. Kristallogr. Cryst. Mater.1931. V. 78. P. 363.
Hughes E., Moor W.J. // J. Am. Chem. Soc. 1949. V. 71. P. 2618.
Smith A.J., Farukh I.A., Soldatov D.V. // CrystEngComm. 2014. V. 16. P. 7196.
Banerjee S., Sardar M., Gayathri N. et al. // Phys. Rev. B. 2005. V. 72. P. 075418.
Maslova M.V., Gerasimova L.G., Forsling W. // Colloid J. 2004. V. 66. P. 322.
Korolkov V.V., Allen S., Roberts C.J. et al. // Faraday Discuss. 2013. V. 166. P. 257.
Pichon-Pesme V., Lecomte C. // Acta Cryst. 1998. V. 54. P. 485.
Sit P.S., Marchant R.E. // Surf. Sci. 2001. V. 491. P. 421.
Ryu J. // Adv. Mater. 2008. V. 20. P. 3754.
Ziganshin M.A, Ziganshina S.A, Gubina N.S. et al. // Orient. J. Chem. 2015. V. 31. P. 1977.
Chatterjee A., Zhang L., Leung K.T. // Langmuir. 2012. V. 28. P. 12502.
Amadei C.A., Lai C.-Y., Heskes D. et al. // J. Chem. Phys. 2014. V. 141. P. 084709-1.
Parobek D., Liu H. // 2D Mater. 2015. V. 2. P. 032001.
Cognard J. // Gold Bull. 1984. V. 17. P. 131.
Rafiee J., Rafiee M.A., Yu Z.-Z. et al. // Adv. Mater. 2010. V. 22. P. 2151.
Debacher N.A., Ottewill R.H. // Colloids Surf. 1991. V. 52. P. 149.
Liu L., Buckley J.S. // J. Petroleum Science and Engineering. 1999. V. 24. P. 75.
Silverio V., Canane P.A.G., Cardoso S. // Colloids Surf. A. 2019. V. 570. P. 210.
Aronov D., Rosenman G. // J. Appl. Phys. 2007. V. 101. P. 084901-1.
Callaghan I.C., Everett D.H., Fletcher A.J.P. // J. Chem. SOC., Faraday Trans. 1. 1983. V. 79. P. 2723.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования