Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 6, стр. 3-9
Строение и фотохромные свойства новых спиропиранов индолинового ряда, содержащих свободные карбоксильные группы
И. В. Ожогин a, *, А. В. Чернышев a, В. В. Бутова b, Б. С. Лукьянов a, c, Е. А. Радченко a, Е. Л. Муханов a, А. В. Солдатов b
a Научно-исследовательский институт физической и органической химии, Южный федеральный университет
344090 Ростов-на-Дону, Россия
b Международный исследовательский институт интеллектуальных материалов, Южный федеральный университет
344090 Ростов-на-Дону, Россия
c Донской государственный технический университет
344007 Ростов-на-Дону, Россия
* E-mail: iozhogin@sfedu.ru
Поступила в редакцию 22.08.2019
После доработки 03.09.2019
Принята к публикации 03.09.2019
Аннотация
По реакции циклоконденсации йодида 5-карбокси-1,2,3,3-тетраметил-3H-индолия с соответствующими 2,4-дифомилфенолами были получены два новых фотохромных спиропирана, содержащих карбоксильные группы в гетареновой части молекулы и представляющих интерес в качестве модификаторов металлоорганических каркасов для придания им фотоуправляемых функций. Структура полученных соединений была подтверждена данными ИК-, ЯМР-спектроскопии на ядрах 1H и 13C (с использованием двумерных методик COSY 1Н–1Н, HSQC 1Н–13C, HMBC 1Н–13C и HMBC 1Н–15N), химический состав определен методом элементного анализа. Были измерены дифрактограммы порошкообразных образцов соединений, с помощью которых были установлены группы симметрии и параметры элементарных ячеек. Фотохимические исследования выявили фотохромные свойства соединений при комнатной температуре, а измерение констант скоростей термического обесцвечивания kBA мероцианиновых форм при разных температурах позволило рассчитать энергию активации данных процессов.
ВВЕДЕНИЕ
Спиропираны представляют собой один из наиболее перспективных классов органических фотохромных соединений. Благодаря высокой светочувствительности, отклику на целый ряд внешних воздействий и широким возможностям структурной модификации спиропираны привлекают постоянное внимание исследователей как легко настраиваемые молекулярные переключатели для использования в таких областях, как молекулярная электроника, хемосенсорика, биовизуализация, фотофармакология и так далее [1–6].
Модификация молекул спиропиранов реакционноспособными заместителями позволяет включать их в структуру различных материалов, что приводит к изменению свойств материалов под действием света, рН, ионов металлов и даже механической силы. Благодаря своей высокой реакционной способности спиропираны, содержащие карбокси- и/или формильные группы, могут быть легко модифицированы [7–9]. Они часто придают соединениям дополнительные полезные свойства, такие как фотохромизм в твердой фазе [10], рН-зависимая флуоресценция для биовизуализации [11], способность к хромогенному детектированию ионов металлов и других химических объектов [12–14]. На основе карбоксизамещенных спиропиранов была создана система доставки лекарств, чувствительная к свету и ионам металлов [15].
Одно из крайне интересных и быстро развивающихся направлений в области создания интеллектуальных материалов основано на включении фотохромных соединений в структуру металлоорганических каркасов, что дает возможность управлять их свойствами под действием света. Известны примеры инкорпорации молекул спиропиранов в поры металлоорганических каркасов [16, 17], однако более продуктивным методом представляется постсинтетическая модификация металлоорганических каркасов, основанная на замене части молекул линкера в структурах типа UiO-66 молекулами спиропиранов или его прекурсора, содержащего карбоксильные группы [18]. С помощью такой модификации становится возможным управлять сорбционными, люминесцентными и другими свойствами гибридного материала под действием света.
Целями настоящей работы были синтез и исследование структуры и фотохромных свойств новых спиропиранов индолиновой серии, содержащих карбоксильные группы в гетареновом фрагменте и электроноакцепторный формильный заместитель в положении 6' 2H-хроменовой части молекулы. Наличие такого набора заместителей позволят ожидать выраженной фотохромной активности спиропиранов, а также возможности дальнейшего связывания молекул с циркониевыми кластерами металлоорганических каркасов типа UiO-66.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Целевые спиропираны 5-карбокси-1,3,3,8'-тетраметил-6'-формилспиро[индолин-2,2'-2H-хромен] (1a) и 5-карбокси-8'-метокси-1,3,3-триметил-6'-формилспиро[индолин-2,2'-2H-хромен] (1b) (схема 1 ) были получены по реакции циклоконденсации йодида 5-карбокси-1,2,3,3-тетраметил-3H-индолия (2) с соответствующими 2,4-дифомилфенолами (3) при кипячении в этиловом спирте в присутствии органического основания – триэтиламина. Необходимая чистота продуктов была достигнута методами перекристаллизации и колоночной хроматографии.
Схема 1 . Синтез целевых спиропиранов.
При синтезе спиропиранов 1a и 1b 690 мг (2 ммоль) соединения 2 добавляли к кипящему раствору в 10 мл этанола альдегида 3 массой 328 мг (2 ммоль) (в случае соединения 1а) и 360 мг (2 ммоль) (в случае соединения 1b). Затем добавляли по каплям 0.6 мл триэтиламина. Смесь кипятили в течение 2 ч. После охлаждали до комнатной температуры и вливали в раствор HCl концентрацией 1 М. Образовавшийся осадок отфильтровывали и высушивали. Продукт перекристаллизовали из MeOH, после чего хроматографировали на силикагеле (элюент – хлороформ/MeOH в соотношении 95 : 5). В случае соединения 1а выход составил 35.8%, Тпл = 252°С, в случае соединения 1b выход 73.8%, Тпл = 240°С.
Структура полученных соединений была подтверждена данными ИК-, ЯМР-спектроскопии на ядрах 1H и 13C (с использованием двумерных методик COSY 1Н–1Н, HSQC 1Н–13C, HMBC 1Н–13C и HMBC 1Н–15N), состав – методом элементного анализа. Спектры ЯМР регистрировали на приборе Bruker AVANCE-600 (600 МГц) в импульсном фурье-режиме. Положение линий спектра определяли по δ-шкале. Отнесение сигналов проведено относительно остаточных сигналов протонов дейтерорастворителя DMSO-d6 (химический сдвиг δ = 2.50 м.д.).
ИК-спектры измеряли на спектрометре Bruker Vertex 70 в геометрии ATR (Attenuated Total Reflectance) с использованием MCT-детектора и приставки Bruker Platinum ATR в диапазоне от 5000 до 30 см–1 с разрешением 1 см–1, проводили 64 сканирования. Образец сравнения – воздух.
Электронные спектры поглощения растворов соединений до и после облучения зарегистрированы на спектрофотометре Agilent 8453. В качестве источника фотоактивного УФ-излучения использована ртутная лампа ДРШ-250 со светофильтром, выделяющим линию ртутного спектра 365 нм.
Дифрактограммы были измерены на порошковом дифрактометре Bruker D2 PHASER (CuKα, λ = 1.5417 Å) с шагом 0.02°. Анализ профилей отражений выполняли с использованием программного обеспечения Jana2006 [19]. Элементный состав определен методом органического элементного микроанализа [20]. Температуры плавления измерены с помощью прибора Фишера–Джонса, Fisher Scientific.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Cтруктура соединений
ИК-спектр соединения 1а включал полосы при: 1688, 1667 см–1 (колебания связей C=O), 1609, 1592 см–1 (связи C=C), 1250 см–1 (связи C–N), 928 см–1 (связи Cспиро–O). ИК-спектр соединения 1b состоял из полос: 1667 см–1 (колебания связей C=O), 1603, 1595 см–1 (связи C=C), 1251 см–1 (связи C–N), 973, 927 см–1 (связи Cспиро–O).
Для соединения 1а спектр ЯМР 1H: химический сдвиг δ = 1.13 м.д. (синглет, интегральная интенсивность 3H, протоны 3-СН3-группы11), 1.23 м.д. (синглет, 3H, 3-СН3), 1.94 м.д. (синглет, 3H, 8-СН3), 2.72 м.д. (синглет, 3H, N–СН3), 5.90 м.д. (дублет, константа спин-спинового взаимодействия J = = 10.3 Гц, 1H, 3'-H), 6.68 м.д. (дублет, 8.2 Гц, 1H, 7-H), 7.17° м.д. (дублет, 10.3 Гц, 1H, 4'-H), 7.59 м.д. (синглет, 1H, 7'-Н), 7.65 м.д. (дублет, 1.7 Гц, 1H, 5'-Н), 7.67 м.д. (дублет, 1.4 Гц, 1H, 4-H), 7.80 м.д. (дублет дублетов, 8.2, 1.5 Гц, 1H, 6-Н), 9.78 м.д. (синглет, 1H, 6'-CHO), 12.36 м.д. (синглет, 1H, COOH). Спектр ЯМР 13С: химический сдвиг δ = = 14.61 м.д. (8'-СН3), 19.61 м.д. (3-СН3), 25.36 м.д. (3-СН3), 28.27 м.д. (N–СН3), 51.01 м.д. (C-3), 105.12 м.д. (Cспиро), 106.10 м.д. (C-7), 118.13 м.д. (C-10′), 119.37 м.д. (C-3'), 121.35 м.д. (C-5), 122.78 м.д. (С-4), 124.25 м.д. (С-8'), 126.78 м.д. (C-5′), 128.97 м.д. (С-6'), 129.08 м.д. (C-4′), 130.72 м.д. (C-6), 132.36 м.д. (C-7'), 136.07 м.д. (C-9), 151.26 м.д. (C-8), 156.18 м.д. (C-9′), 167.37 м.д. (5-COOH), 191.05 м.д. (6'-CHO). Концентрация химических элементов: C – 72.7, H – 5.8, N – 3.9 мас. %. Химическая формула C22H21NO4. Вычисленные значения составили 72.3, 6.0 и 3.6 мас. % соответственно.
Для соединения 1b спектр ЯМР 1H: химический сдвиг δ = 1.14 м.д. (синглет, 3H, 3-СН3), 1.25 м.д. (синглет, 3H, 3-СН3), 2.77 м.д. (синглет, 3H, N-СН3), 3.73 м.д. (синглет, 3H, 8'-ОСН3), 5.89 м.д. (дублет, константа спин-спинового взаимодействия J = 10.3 Гц, 1H, 3'-H), 6.65 м.д. (дублет, 8.2 Гц, 1H, 7-H), 7.13 м.д. (дублет, 10.3 Гц, 1H, 4'-H), 7.36 м.д. (дублет, 1.8 Гц, 1H, 7'-Н), 7.44 м.д. (дублет, 1.8 Гц, 1H, 5'-Н), 7.65 м.д. (дублет, 1.7 Гц, 1H, 4-Н), 7.81 м.д. (дублет дублетов, 8.2 Гц, 1.7, 1H, 6-Н), 9.81 м.д. (синглет, 1H, 6'-CHO), 12.03 м.д. (синглет, 1H, COOH). Спектр ЯМР 13С: химический сдвиг δ = 19.35 м.д. (3-СН3), 25.46 м.д. (3-СН3), 28.25 м.д. (N–СН3), 51.35 м.д. (C-3), 55.62 м.д. (8'-ОСН3), 105.28 м.д. (Cспиро), 105.98 м.д. (C-7), 111.79 м.д. (C-7'), 118.93 м.д. (C-10'), 119.86 м.д. (C-3'), 121.23 м.д. (C-5), 122.64 м.д. (C-5'), 122.89 м.д. (C-4), 128.90 м.д. (C-4'), 129.04, 130.71 м.д. (C-6), 135.93 м.д. (C-9), 147.14 м.д. (C-8'), 147.85 м.д., (C-9'), 151.23 м.д. (C-8), 167.33 м.д. (5-COOH), 190.98 м.д. (6'-CHO). Концентрация химических элементов: C – 69.6, H – 5.6, N – 3.7 мас. %. Химическая формула C22H21NO4. Вычисленные значения составили 69.3, 5.7 и 3.5 мас. % соответственно.
В спектрах ЯМР на ядрах 1Н полученных соединений положение сигналов, их интегральные интенсивности и константы спин-спинового взаимодействия полностью соответствуют представленным структурам. Так, в области алифатических протонов неэквивалентные синглетные сигналы метильных групп в положении 3 проявлялись в диапазонах 1.13–1.14 и 1.22–1.26 м.д., что говорит о магнитной неэквивалентности данных групп и подтверждает спироциклическое строение молекулы. Сигналы групп N–CH3 в соединениях 1a и 1b наблюдались при 2.72 и 2.77 м.д. соответственно. В случае соединения 1b сигнал метоксильной группы, находящейся в положении 8' бензопирановой части молекулы, наблюдался при 3.73 м.д., а соответствующий синглетный сигнал метильного заместителя соединения 1а проявлялся при 1.94 м.д. В ароматической области сигналы протонов 3' и 4' соединений детектировались в виде дублетов в области 5.90 и 7.15 м.д. соответственно с характеристической константой спин-спинового взаимодействия 10.3 Гц, что говорит об их цис-расположении и подтверждает спироциклическую структуру спиропирана. Сигналы протонов формильных групп соединений наблюдались в районе 9.80 м.д. Сигналы карбоксильных групп проявлялись в виде уширенных синглетов при 12.36 и 12.03 м.д. соответственно.
В спектрах ЯМР на ядрах 13С обоих соединений количество сигналов равно 22, что соответствует количеству атомов углерода в молекулах. Характерные сигналы спироциклических атомов углерода были зарегистрированы в районе 105.1–105.3 м.д. и коррелировали в спектре HMBC 1Н–13C с сигналами протонов гемм-метильных групп, а также протонов 3' и 4'. Сигналы атомов углерода формильных и карбоксильных групп проявлялись около 191 и 167 м.д. соответственно.
С целью корректного отнесения всех сигналов одномерных спектров к атомам водорода и углерода молекулы спиропиранов 1a, 1b были исследованы с помощью набора двумерных методик ЯМР, а именно COSY 1Н–1Н, HSQC 1Н–13C, HMBC 1Н–13C и HMBC 1Н–15N. Стоит отметить, что в спектрах HMBC 1Н–15N сигналы атомов азота соединений 1а и 1b проявляются при 98.8 и 97.8 м.д., соответственно, и коррелируют с сигналами протонов групп N–CH3, а также протонов, находящихся в положениях 3' и 7, что также подтверждает представленные структуры.
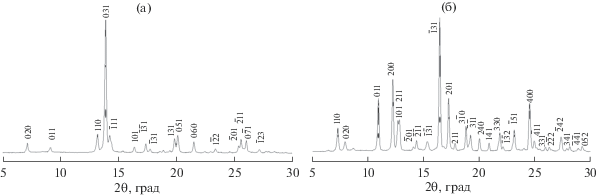
Несмотря на то, что многочисленные попытки выращивания монокристаллов спиропиранов для проведения рентгеноструктурного анализа не увенчались успехом, были измерены дифрактограммы порошковых образцов соединений (рис. 1), с помощью которых были установлены некоторые структурные параметры. Данные проиндицированы в триклинной ячейке, проведен профильный анализ, определены параметры элементарной ячейки (табл. 1). Следует отметить, что низкая симметрия типична для подобных соединений [21–25].
Таблица 1.
Результаты профильного анализа образцов спиропиранов 1а и 1b
| Соединение | 1a | 1b | |
|---|---|---|---|
| Группа симметрии | P | P1 | |
| Параметры элементарной ячейки | a, Å | 7.093(1) | 14.7899(5) |
| b, Å | 24.794(3) | 22.289(1) | |
| c, Å | 10.917(2) | 9.1468(5) | |
| α, град | 93.074(8) | 94.215(2) | |
| β, град | 100.259(9) | 101.984(3) | |
| γ, град | 89.960(10) | 88.700(3) | |
| Факторы расходимости | Rp | 0.1437 | 0.1067 |
| Rwp | 0.1907 | 0.1514 | |
| χ2 | 1.96 | 1.47 | |
Исследование фотохромных свойств
Спектральные и кинетические свойства новых спиропиранов 1a, 1b были исследованы в ацетонитриле. В данном растворителе соединения находятся полностью в спироциклической форме (схема 2 , SP). Она характеризуется интенсивной длинноволновой полосой поглощения с максимумом при 301–303 нм (коэффициент молярной экстинкции ε = 29 400–36 500 л · моль–1 · cм–1) и слабовыраженным плечом при 330–338 нм (табл. 2). Заместители в бензопирановой части молекулы (–CH3, –OCH3) практически не влияют на положение и интенсивность длинноволновой полосы.
Таблица 2.
Спектральные и кинетические свойства спиропиранов 1a и 1b в ацетонитриле
| Спироциклическая форма (SP) | Мероцианиновая форма (MC) | ||||
|---|---|---|---|---|---|
| $\lambda _{{\max }}^{{{\text{abs}}}},$ нм (ε, 103 л · моль–1 · см–1) | $\lambda _{{\max }}^{{{\text{abs}}}},$ нм | τMC, с (293 К) | kBA, 10–2 с–1 (293 К) | Ea, кДж · моль–1 | |
| 1a | 255 (27.5) 303 (29.4) 330 (6.45), плечо |
582 | 21.4 | 4.67 | 80.5 |
| 1b | 230 (35.6) 273 (32.7) 301 (36.5) 338 (8.26), плечо |
581 | 19.0 | 5.05 | 78.0 |
Схема 2 . Схема фотоизомеризации целевых спиропиранов.
Облучение растворов спиропиранов 1a, 1b УФ-светом с λ = 313 нм при Т = 293 К вызывает их окрашивание, связанное с протеканием фотохромной реакции раскрытия пиранового цикла и образованием мероцианиновой формы (схема 2 , МС). В спектрах поглощения появляется полоса, соответствующая MC-форме, с максимумом при 581–582 нм (рис. 2). В отсутствие облучения происходит спонтанное обесцвечивание растворов, обусловленное протеканием термической реакции рециклизации мероцианиновой формы в исходную спироциклическую (рис. 3). Наблюдаемый релаксационный процесс, называемый темновой реакцией, является реакцией первого порядка и может быть описан экспоненциальной функцией:
где D – текущее значение оптической плотности, D∞ – равновесное значение оптической плотности в отсутствие облучения, D0 – максимальное значение оптической плотности, t – время [с], kBA – константа скорости обратной термической реакции замыкания бензопиранового цикла. Спектральные свойства мероцианиновых форм, значения констант скорости kBA, а также времени жизни мероцианиновой формы τMC = 1/kBA для исследуемых соединений приведены в табл. 2. Как и в случае спироциклических форм, заместители в положении 8' 2Н-хроменового фрагмента практически не влияют на положение максимума в спектре мероцианиновой формы.Рис. 2.
Спектры поглощения спиропирана 1a в ацетонитриле в процессе облучения УФ-светом с λ = 313 нм.
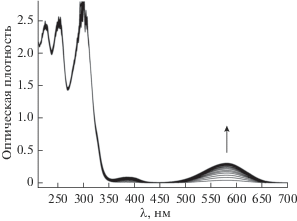
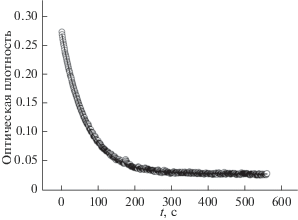
Рис. 3.
Зависимость оптической плотности при максимуме поглощения (λ = 582 нм) мероцианиновой формы спиропирана 1a от времени термической релаксации: точки – эксперимент; сплошная линия – аппроксимация экспоненциальной функцией.
Понижение температуры приводит к замедлению темнового процесса, при этом сохраняется экспоненциальный характер релаксационной кинетики. Наблюдаемая зависимость констант скоростей термического обесцвечивания kBA от температуры подчиняется закону Аррениуса (рис. 4):
Рис. 4.
Зависимость lnkBA от обратной температуры для термической реакции рециклизации мероцианина 1a: точки – экспериментальные данные; линия – результат аппроксимации линейной функцией.

Это позволяет вычислить энергию активации термической реакции рециклизации (табл. 2). Как видно из полученных данных, снижение электронодонорных свойств заместителя в положении 8' 2Н-хроменовой части молекулы при переходе от 1b к 1a приводит к повышению энергии активации и росту кинетической стабильности мероцианиновой формы.
ВЫВОДЫ
Таким образом, в работе были синтезированы новые фотохромные спиропираны индолинового ряда, содержащие карбоксильную группу в гетареновой части и формильную – в 2Н-хроменовом фрагменте. Наличие такого набора заместителей делает их перспективными кандидатами для введения в структуру металлоорганического каркаса и наделения их фотоуправляемыми свойствами. Строение полученных спиропиранов было установлено методами ИК- и ЯМР-спектроскопии на ядрах 1H и 13C (с использованием различных двумерных методик), химический состав определен методом элементного анализа. Измерение дифрактограмм порошкообразных образцов соединений помогло выяснить, что кристаллические решетки спиропиранов 1a и 1b имеют триклинную симметрию, а также установить параметры их элементарных ячеек. Спектрально-кинетические исследования выявили фотохромную активность соединений при комнатной температуре. Времена жизни мероцианиновых форм спиропиранов были найдены в диапазоне 19.0–21.4 с, а рассчитанные значения энергии активации реакции термической рециклизации составили 78.0–80.5 кДж/моль, что подтверждает их перспективность для использования в качестве фотомодуляторов свойств различных интеллектуальных материалов.
Список литературы
Минкин В.И. // Успехи химии. 2013. Т. 82. С. 1.
Klajn R. // Chem. Soc. Rev. 2014. V. 43. P. 148.
Wang L., Li Q. // Chem. Soc. Rev. 2018. V. 47. P. 1044. https://doi.org/10.1039/c7cs00630f
Pianowski Z.L. // Chem. Eur. J. 2019. V. 25. P. 5128. https://doi.org/10.1002/chem.201805814
Paramonov S.V., Lokshin V., Fedorova O.A. // J. Photochem. Photobiol. C. 2011. V. 12. P. 209. https://doi.org/10.1016/j.jphotochemrev.2011.09.001
Lerch M.M., Hansen M.J., van Dam G.M. et al. // Angew. Chem. Int. Ed. 2016. V. 55. P. 10 978. https://doi.org/10.1002/anie.201601931
Лаптев А.В., Лукин А.Ю., Беликов Н.Е. и др. // Изв. Акад. наук. Сер. хим. 2014. Т. 9. С. 2026.
Tomasulo M., Kaanumal S.L., Sortino S., Raymo F.M. // J. Org. Chem. 2007. V. 72. P. 595. https://doi.org/10.1021/jo062004d
Pugachev A.D., Lukyanova M.B., Lukyanov B.S. et al. // J. Mol. Struct. 2019. V. 1178. P. 590. https://doi.org/10.1016/j.molstruc.2018.10.062
Сафоклов Б.Б., Лукьянов Б.С., Буланов А.О. и др. // Изв. Акад. наук. Сер. хим. 2002. Т. 3. С. 431.
Wan S., Zheng Y., Shen J. et al. // ACS Appl. Mater. Interfaces. 2014. V. 6. P. 19 515. https://doi.org/10.1021/am506641t
Yu G., Cao Y., Liu H. et al. // Sensors and Actuators. B. 2017. V. 245. P. 803. https://doi.org/10.1016/j.snb.2017.02.020
Stubing D.B., Heng S., Abell A.D. // Org. Biomol. Chem. 2016. V. 14. P. 3752. https://doi.org/10.1039/C6OB00468G
Heng S., Zhang X., Pei J. et al. // Biosensors. 2017. V. 7. P. 36. https://doi.org/10.3390/bios7030036
Heng S., Zhang X., Pei J. et al. // Chem. Eur. J. 2019. V. 25. P. 854. https://doi.org/10.1002/chem.201804816
Zhang F., Zou X., Feng W. et al. // J. Mater. Chem. 2012. V. 22. P. 25 019. https://doi.org/10.1039/C2JM34618D
Schwartz H.A., Olthof S., Schaniel D. et al. // Inorg. Chem. 2017. V. 56. P. 13 100. https://doi.org/10.1021/acs.inorgchem.7b01908
Healey K., Liang W., Southon P.D. et al. // J. Mater. Chem. A. 2016. V. 4. P. 10 816. https://doi.org/10.1039/C6TA04160D
Petříček V., Dušek M., Palatinus L. // Z. Kristallog. 2014. V. 229. № 5. P. 345. https://doi.org/10.1515/zkri-2014-1737
Гельман Н.Э., Терентьева Е.А., Шанина Т.М., Кипаренко Л.М. Методы количественного органического элементного анализа. М.: Химия, 1987. 296 с.
Lin C.H., Chen J.R., Yang D.Y. // J. Comb. Chem. 2010. V. 12. P. 119. https://doi.org/10.1021/cc900127g
Eilmes A. // J. Phys. Chem. A. 2013. V. 117. P. 2629. https://doi.org/10.1021/jp3117209
Kundu P.K., Lerner A., Kučanda K. et al. // J. Am. Chem. Soc. 2014. V. 136. P. 11 276. https://doi.org/10.1021/ja505948q
Seiler V.K., Callebaut K., Robeyns K. et al. // CrystEngComm. 2018. V. 20. P. 3318. https://doi.org/10.1039/C8CE00291F
Ozhogin I.V., Tkachev V.V., Lukyanov B.S. et al. // J. Mol. Struct. 2018. V. 1161. P. 18. https://doi.org/10.1016/j.molstruc.2018.02.027
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования