Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2020, № 7, стр. 52-61
Исследование морфологии поверхности микрофильтрационных мембран МФФК, МПС методами атомно-силовой и растровой электронной микроскопии
С. В. Ковалев a, *, С. И. Лазарев a, О. А. Ковалева a
a Тамбовский государственный технический университет
392000 Тамбов, Россия
* E-mail: sseedd@mail.ru
Поступила в редакцию 12.12.2019
После доработки 25.01.2020
Принята к публикации 27.01.2020
Аннотация
Методами атомно-силовой и растровой электронной микроскопии исследована морфология поверхности полимерных микрофильтрационных мембран. В качестве объектов исследования использованы промышленно выпускаемые мембраны МФФК (на основе гидрофобной фторопластовой композиционной мембраны, размер пор 0.45 мкм) и МПС (на основе полиэфирсульфона, размер пор 0.45 мкм) ООО НПП “Технофильтр”, г. Владимир. В качестве технологической жидкости, применяемой для рабочих образцов мембран МФФК, МПС при проведении процесса микрофильтрации, выступала зрелая мелассная бражка ОАО “Биохим”, г. Рассказово. Анализ морфологии поверхности микрофильтрационных мембран позволил идентифицировать участки расположения пор, дрожжей, полисахаридов, межпоровые связующие области. В результате анализа микроскопических изображений выявлены линии потока разделяемого раствора во “впадинах” профиля на поверхности рабочих микрофильтрационных мембран. Установлено, что исходные мембраны МФФК, МПС имеют щелевые поры (длиной и шириной 0.4–0.6 мкм), а рабочие мембраны загрязняются (засоряются) дрожжами, полисахаридами и их частицами, что связано с остаточным динамическим мембранообразованием. Выявлено, что параметры шероховатости поверхности рабочих мембран МФФК и МПС различаются: Ra, Rz – в 1.69 и 1.87 раза, Rmax – в 1.67 и 1.05 раза (в случае наклонных и фронтальных сечений) соответственно. Это связано со специфическими особенностями, сопровождающими процесс микрофильтрационного разделения растворов, содержащих дрожжи, полисахариды и их обрывки (наличие адсорбционного слоя на поверхности мембраны, растрескивание остаточного слоя динамической мембраны (засоренного слоя)).
ВВЕДЕНИЕ
Методы атомно-силовой (АСМ) и растровой электронной микроскопии (РЭМ) активно применяются для исследования морфологии поверхности органических и неорганических мембран [1–3]. В [4] изучена морфология поверхности мембран МФ-4СК исходной и модифицированной полианилином. Показано, что АСМ позволяет характеризовать качественные и количественные изменения рельефа поверхности мембран. В [5] отмечается, что сорбция пектина на мембранах МА-40 и МА-41, соответственно, повышает и понижает однородность поверхности при использовании метода АСМ. В [6] рассмотрено применение АСМ для изучения пористой структуры катионообменных мембран. На основании экспериментальных данных рассчитана пористость и получено распределение пор по радиусам. В работе [7] методом АСМ исследована морфология поверхности исходных и отработанных (засоренных) обратноосмотических полиамидных мембран, используемых для процессов очистки и опреснения морской воды. Отмечается, что на величину отложений бактерий на мембранах влияет шероховатость поверхности.
Недостаточно внимания в научном международном сообществе уделено исследованию морфологии поверхности микрофильтрационных мембран с порами заданного диаметра, например, при обработке растворов биохимических производств для селективного задерживания дрожжей, полисахаридов и пропускании воды и спирта. Это сказывается на процессе внедрения пористых мембран на отечественных предприятиях. Встречаются лишь фрагментированные данные об использовании, например, мембран МФФК в процессах разделения различных растворов и изготовления на их основе мембран других типов [8–11]. Особенным обстоятельством при обработке биохимических растворов подобных типов является то, что они содержат наряду с ионами, переносящими электрический заряд, еще и полисахариды, их обрывки (частицы), а также живые биологические объекты (дрожжи).
При исследовании традиционным методом АСМ и использовании высокочувствительной схемы измерения, состоящей из зонда, расположенного на кантилевере, лазерного луча, отражающегося от кантилевера и попадающего на четырехквадрантный фотоприемник, существует крупная проблема использования лазера видимого диапазона, на котором основано большинство применяемых в настоящее время атомно-силовых микроскопов. Лазерное излучение видимого диапазона, попадая на сложные биологические объекты, инициирует фотохимические реакции, при которых может происходить перестройка этих объектов [12].
Массовое внедрение и широкое применение самых современных микроскопов, например, компании AIST-NT, в которых регистрирующая система с ИК-лазером работает в невидимом диапазоне, ограничено тем, что подобная технология (приборное оснащение) очень слабо востребована на рынке России. А если и востребована, то только в рамках крупных НИУ (Национальный исследовательский университет), НИИ технического направления, например, в РГУ нефти и газа имени И.М. Губкина, Московском институте электронной техники и других [12, 13].
Анализ литературных данных лишь подтверждает, что подобное приборное оснащение, например, SmartSPM-1000, массово не используется для исследования именно морфологии полимерных микрофильтрационных мембран, засоренной (загрязненной) поверхности. В [14, 15] подтверждается использование приборов АСМ со специальными кремниевыми кантилеверами. В [16] приведены результаты тестовых испытаний кремниевых зондов (кантилеверов) с острием на эталонной кремниевой тестовой решетке (TGT-решетке). Отмечается, что деградация острия кремниевых зондов наблюдается даже при однократном применении в АСМ, т.е. применение покупных кремниевых зондов, остроту которых гарантирует производитель, не обеспечивает 100% правильную интерпретацию полученных данных, например, при первом, втором, третьем сканировании. В [17] отмечается, что в настоящее время зонды АСМ производятся на коммерческой основе, однако перед коммерческой реализацией в лаборатории и на производстве могут быть получены датчики низкого качества, в том числе двойные зонды, зонды с двумя наконечниками или с несколькими наконечниками и так далее.
Поэтому использование атомно-силового микроскопа, работающего по классической схеме (кантилевер освещается лазером видимого диапазона, и по положению отраженного луча (“зайчику”) на детекторе определяется его изгиб), не совсем корректно, так как при изучении морфологии поверхности микрофильтрационных мембран при обработке биологической жидкости предполагается, что поверхности мембран могут содержать дрожжи. То есть при “классической схеме” могут возникать необратимые последствия деградации одного из компонентов разделяемого раствора – клеток дрожжей, что также может вносить погрешность в исследование морфологии поверхности отработанных полупроницаемых мембран. На общую погрешность исследования наряду с биологическими объектами (дрожжами) влияют и сопутствующие явления, которые сопровождают баромембранное разделение подобных растворов, например, динамическое мембранообразование на поверхности полупроницаемой пленки [18, 19].
В результате оценки преимуществ и недостатков классического метода АСМ с применением кантилевера и лазера видимого и невидимого диапазона для анализа морфологии поверхности полупроницаемых мембран был выбран вариант базового прибора, который доступен широкому кругу научно-исследовательских лабораторий, – NanoEducator корпорации NT-MDT (Россия, Зеленоград). Он включает пьезоэлектрическую трубку, играющую одновременно роль актуатора перемещения зонда и датчика создаваемого перемещения, а также вольфрамовый зонд. Выбор этого приборного оснащения предотвращает нежелательные последствия протекания сложных фотохимических реакций при наличии на поверхности мембран биологических объектов (дрожжевых клеток и их частей), которые, так же, как и глобулы полимера, полисахариды, влияют на общую морфологию поверхности отработанных мембран. Применение прибора NanoEducator удовлетворительно, в сравнении с классическим вариантом, описывает результаты экспериментов по исследованию морфологии эритроцитов и эталонной TGT-решетки [20]. Трехмерные изображения остроконечных пиков TGT-решетки, полученные с помощью кремниевого зонда (сканирующий зондовый микроскоп (СЗМ) NTEGRA Aura), несколько выигрышней в отличие от вольфрамового зонда (СЗМ NanoEducator). При анализе морфологии поверхности отработанных полупроницаемых микрофильтрационных мембран после разделения биологических растворов не предполагали, что на поверхности могут быть остроконечные выступы. Это можно оценить по АСМ-изображениям мембраны МФФК [11], а исследование подобных биологических объектов – клеток эритроцитов – показало довольно хороший результат [20].
Стоит критически относиться к тому, что одним из недостатков пьезокерамики является неоднозначность зависимости удлинения от направления изменения электрического поля (гистерезис). Это приводит к тому, что при одних и тех же управляющих напряжениях пьезокерамика оказывается в различных точках траектории в зависимости от направления движения. Для исключения искажений СЗМ-изображений, обусловленных гистерезисом пьезокерамики, информацию регистрируют в точках при прямом проходе, что отмечается в [21].
Проведенный обзор и критическое сравнение современного оборудования АСМ для исследования структуры поверхности органических и неорганических мембран позволил сформулировать утверждение, что адекватное применение процесса мембранного разделения растворов биохимических производств связано не только со структурой мембран, но и морфологией поверхности и засорением. Поэтому выбранный подход предполагает, что экспериментальная обработка данных, полученных методом АСМ, при изучении морфологии поверхности полупроницаемых мембран должна быть обязательно проведена с применением дополнительных методов исследования, например, РЭМ. Подобное необходимо учитывать для расширения модельных представлений о механизме переноса растворителя и веществ через поровое пространство микрофильтрационных мембран. Поэтому целью настоящей работы было исследование морфологии поверхности микрофильтрационных мембран МФФК, МПС методами АСМ и РЭМ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Применение для биохимических производств высокопроизводительных пористых полимерных материалов, эксплуатируемых при температурах до 100°С, обладающих хорошей механической прочностью и задерживающей способностью относительно дрожжей и полисахаридов, является перспективной задачей, которая может быть решена при использовании микрофильтрационных мембран МФФК, МПС [18]. Объектами исследования были промышленно выпускаемые отработанные микрофильтрационные мембраны: МФФК (гидрофобная пленка, изготовленная на основе фторопласта Ф42Л (сополимер тетрафторэтилена и винилиденфторида), армированная нетканым полипропиленом); МПС (гидрофильная полиэфирсульфоновая мембрана с асимметричной структурой пор). Их характеристики представлены в табл. 1 [22, 23]. В качестве технологической жидкости, используемой для образцов МФФК, МПС при проведении процесса микрофильтрации (при избыточном трансмембранном давлении 0.5 МПа), выступала зрелая мелассная бражка ОАО “Биохим”, г. Рассказово, основные характеристики которой представлены в табл. 2.
Таблица 1.
Качественные показатели исследуемых мембран
| № | Показатель | Микрофильтрационная мембрана | |
|---|---|---|---|
| МФФК [22, 23] | МПС [23] | ||
| 1 | Внешний вид | Мелкопористая пленка белого цвета на нетканой подложке без видимых дефектов, механических включений и повреждений | Пленка белого цвета без видимых дефектов, механических включений и повреждений |
| 2 | Диаметр диска, м | 0.293 | 0.24 |
| 3 | Толщина диска, мкм | 110 | 110 |
| 4 | Производительность, дм3/м2 · ч | Этиловый спирт при давлении 0.05 МПа – не менее 7500 | Вода при давлении 0.1 МПа (1 атм) – не менее 60 |
| 5 | рН раствора | 1–13 | 1–14 |
| 6 | Максимальная температура, К | 353 | 373 |
| 7 | Диаметр пор, мкм | 0.45 | |
| 8 | Цена 2018 г. (без НДС), руб/м2 | 308 | 635 |
Таблица 2.
Основные характеристики зрелой мелассной бражки производства ОАО “Биохим”, г. Рассказово
| Характеристика | Показатель |
|---|---|
| Цвет раствора | Темно-коричневый (черный) мутный раствор |
| рН среды | 5.25–5.34 |
| Содержание спирта, об. % | 9.20–9.60 |
| Содержание биомассы дрожжей, кг/м3 | 11.50–14.00 |
| Несброженные сахара, г/см3 | 0.525–0.550 |
Так как заранее предполагали, что микрофильтрационные мембраны задерживали такие биологические объекты, как дрожжи и полисахариды, поверхности отработанных образцов мембран МФФК, МПС сканировали при помощи зондового микроскопа NanoEducator корпорации NT-MDT (Россия, Зеленоград) в автоматическом режиме на воздухе при температуре 22 ± 1°C на основе рекомендаций [24]. Размеры областей сканирования составляли 20 × 20 и 10 × 10 мкм. Такие области выбраны в целях сопоставления с данными [11] исследования морфологии поверхности мембран этого же типа. Для визуализации поверхности микрофильтрационных мембран, выравнивания и исключения искажений изображений исследуемых пористых пленок были использованы стандартные средства компьютерной обработки программой Scan Viewer, позволяющей подчеркивать и усиливать неоднородности изображений посредством выделения границ объектов и заключающейся в очистке изображения от проявления различных шумов.
Для дальнейшего исследования было использовано оборудование более высокого уровня, с хорошей разрешающей способностью – РЭМ JSM-6390 (JEOL Ltd., Япония) в лаборатории “Биоорганической химии” ФГБОУ ВО “ТГУ им. Г.Р. Державина”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ходе исследования были получены 2D (рис. 1а, 2а) и 3D (рис. 1б, 2б) АСМ-изображения рабочих поверхностей пористых пленок МФФК, МПС (с наклонными и фронтальными сечениями) после микрофильтрационного разделения технологического раствора зрелой мелассной бражки биохимического производства. При многократном исследовании рабочих образцов мембран МФФК, при обработке сложной рельефной поверхности пористых пленок присутствовали артефакты, характерные для сбоев сканирования (вероятно, из-за попадания дрожжей, полисахаридов или их частиц под острие зонда), в отличие от мембран МПС, при изучении которых подобные сбои отсутствовали. В целях достоверной интерпретации полученных АСМ-изображений поверхности отработанных мембран МФФК, МПС их анализировали, проводя сечения в местах, где артефакты отсутствовали – на перегородках (сбои сканирования). Подобный анализ необходим для выявления остаточной пористости и шероховатости поверхности тонких пористых перегородок, а также для всестороннего изучения ее морфологии [25].
Рис. 1.
2D (а) и 3D (б) АСМ-изображения рабочей поверхности микрофильтрационной мембраны МФФК. Прямыми линиями обозначены наклонное и фронтальное сечения.

Анализ АСМ-, РЭМ-изображений мембран МФФК, МПС выявил различную морфологию их поверхностей: межпоровые участки, поры (оцениваемая поверхностная пористость полупроницаемых пленок при проведении наклонных и фронтальных сечений), дрожжи (эллиптической формы), полисахариды (при среднем диаметре сферической частицы крахмального зерна 5–10 мкм [26]). АСМ-изображения мембран МФФК, МПС (рис. 1, 2), полученные после микрофильтрационного разделения раствора биохимического производства, подчеркивают их сложный рельеф, что является предсказуемым состоянием в результате действия на тонкую пористую пленку трансмембранного давления (обжатое состояние).
Рис. 2.
2D (а) и 3D (б) АСМ-изображения рабочей поверхности микрофильтрационной мембраны МПС. Прямыми линиями обозначены наклонное и фронтальное сечения.
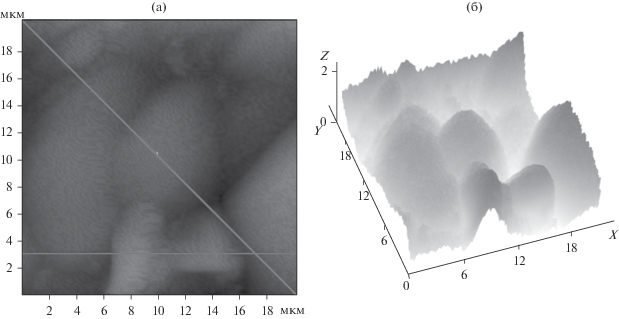
Для дальнейшей идентификации структуры поверхности мембран применяли инвертирование 2D (рис. 1а, 2а) и 3D (рис. 1б, 2б) АСМ-изображений отработанных мембран МФФК, МПС после микрофильтрационного разделения технологического раствора. Установлено, что окраска поровых (пор) и межпоровых участков мембран МФФК, МПС более светлая, что говорит о хорошей поверхностной пористости отработанных мембран (рис. 1, 2). Менее светлые участки поверхности мембран относятся к остаткам динамической мембраны (дрожжи, полисахариды и их частицы). В то же время на 2D (рис. 1а) и 3D (рис. 1б) АСМ-изображениях поверхности мембраны МФФК видны перпендикулярно и горизонтально расположенные дрожжи, которые на одном изображении одного размера. Подобное можно наблюдать и на поверхности мембраны МПС. На 2D (рис. 2а) и 3D (рис. 2б) АСМ-изображениях поверхности этих пористых перегородок можно идентифицировать горизонтально расположенные дрожжи.
Для подтверждения изменения морфологии поверхности мембран МФФК, МПС в результате микрофильтрации зрелой мелассной бражки получены РЭМ-изображения исходных и рабочих образцов мембран (рис. 3, 4). Наблюдаются “выступы” и “впадины”, различная поверхностная пористость и так далее. На отработанных образцах мембран МФФК, МПС идентифицируются дрожжи, полисахариды и их частицы. Можно отметить как горизонтальное, так и вертикальное расположение дрожжевых клеток. Сравнивая данные АСМ-исследований мембран МФФК [10], полученные в настоящей работе РЭМ-изображения (рис. 3а) и результаты [11], можно отметить их схожесть. Различаются лишь диаметры пор. В работе использованы исходные микрофильтрационные мембраны марки МФФК с порами большего размера – 0.45 мкм, в отличие от [10, 11]. Анализ АСМ-изображений мембраны МФФК [11] показал, что на поверхности подобных перегородок можно наблюдать глобулы полимера, так же, как и в случае исходных мембран этого типа. Таким образом, можно констатировать, что применение совокупности методов АСМ и РЭМ позволяет адекватно анализировать морфологию поверхности микрофильтрационных мембран при обработке зрелой мелассной бражки биохимического производства, особенно при наличии в ней таких биологических объектов, как дрожжи.
В процессе исследования морфологии поверхности отработанных мембран отмечено, что тангенциальная подача разделяемого раствора в межмембранный канал аппарата приводит к тому, что на АСМ-изображениях наблюдается рельеф загрязненной поверхности, характерный для тангенциального потока. Это явление идентифицируется при большем увеличении 10 × 10 мкм, инвертированных АСМ-изображений микрофильтрационных перегородок подобных типов (рис. 5). Анализ 3D АСМ-изображений поверхности отработанных мембран МФФК (рис. 5а) и МПС (рис. 5б) после контрастирования при увеличении 10 × 10 мкм выявил линии потока разделяемого раствора в “долинах”. То есть можно интерпретировать появление этих линий в результате действия избыточного давления и тангенциальной подачи (прокачивания) раствора по поверхности мембран в направлении выраженных “долин” с учетом оттока растворителя через поры.
Рис. 5.
3D АСМ-изображения рабочей поверхности микрофильтрационных мембран МФФК (а), МПС (б) после инвертирования.

Различная морфология рабочих микрофильтрационных мембран (“выступы” и “впадины” профиля) также подтверждается сечениями АСМ-изображений поверхности (рис. 1а, 2а) при сравнении с РЭМ-изображениями исходных образцов, по которым можно идентифицировать также и размеры пор. Сравнивая полученные АСМ- и РЭМ-изображения поверхностей мембран, можно отметить, что исходные мембраны МФФК и МПС имеют более широкие поры смешанной формы (длина и ширина 0.4–0.6 мкм), а отработанные мембраны загрязняются (засоряются). Загрязнение мембран дрожжами, полисахаридами и их частицами (фрагменты дрожжевых клеток и полисахаридов) связано с присутствием в растворе обрабатываемой бражки подобных компонентов, которые вызывают остаточное динамическое мембранообразование (рис. 6). Это подтверждают данные РЭМ (рис. 3б, 4б), а также падение удельного выходного потока с течением времени эксперимента при действии трансмембранного давления величиной P = 0.5 МПа [18].
Рис. 6.
Отработанные образцы микрофильтрационных мембран МПС (а) и МФФК (б) после разделения зрелой мелассной бражки при трансмембранном давлении Р = 0.5 МПа.

Не менее важным этапом представленной работы является характеризация объектов исследования по шероховатости поверхности при анализе АСМ-изображений отработанных мембран (рис. 7, 8) при случайном выборе участка отработанной мембраны (рис. 6). Контролируемые параметры АСМ-изображений полимерных мембран МФФК, МПС представлены в табл. 3 на основе анализа рис. 1, 2 и формул, приведенных в [27].
Рис. 7.
Сечения поверхности микрофильтрационной мембраны МФФК, представленные на рис. 1: а – наклонное; б – фронтальное.
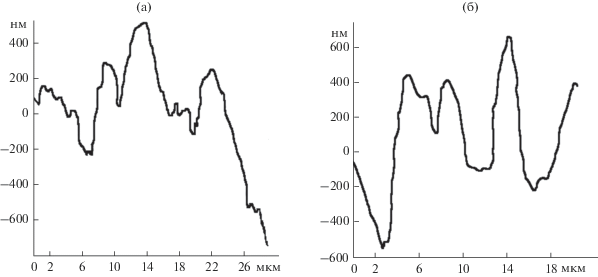
Рис. 8.
Сечения поверхности микрофильтрационной мембраны МПС, представленные на рис. 2: а – наклонное; б – фронтальное.
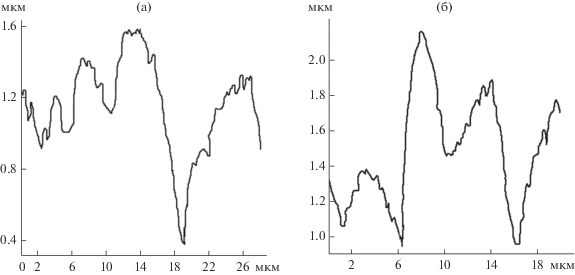
Таблица 3.
Параметры сечений поверхности микрофильтрационных мембран МФФК, МПС (рис. 1, 2)
| Параметры | Мембрана | ||
|---|---|---|---|
| МФФК рабочая (рис. 1) | МПС рабочая (рис. 2) | ||
| Наклонное сечение | Длина базовой линии l, мкм | 26.0 ± 1.0 | 26.0 ± 1.0 |
| Высота наибольшего выступа профиля Rp, нм | 380 ± 51.0 | 580 ± 47.0 | |
| Глубина наибольшей впадины профиля Rv, нм | 370 ± 38.0 | 610 ± 48.0 | |
| Наибольшая высота неровностей профиля Rmax, нм | 750 ± 45.0 | 1190 ± 37.0 | |
| Высота неровностей профиля Rz, нм | 476.7 ± 63.0 | 448.3 ± 55.0 | |
| Среднее арифметическое отклонение профиля Ra, нм | 238.3 ± 24.0 | 224.2 ± 27.0 | |
| Фронтальное сечение | Длина базовой линии l, мкм | 20.0 ± 1.0 | 20.0 ± 1.0 |
| Высота наибольшего выступа профиля Rp, нм | 630 ± 42.0 | 620 ± 45.0 | |
| Глубина наибольшей впадины профиля Rv, нм | 620 ± 35.0 | 630 ± 39.0 | |
| Наибольшая высота неровностей профиля Rmax, нм | 1250 ± 53.0 | 1250 ± 49.0 | |
| Высота неровностей профиля Rz, нм | 805.5 ± 34.0 | 840.2 ± 36.0 | |
| Среднее арифметическое отклонение профиля Ra, нм | 403.8 ± 31.0 | 420.2 ± 35.0 | |
В результате экспериментального исследования поверхностей пористых пленок установлено, что специфические особенности их морфологии связаны также с тем, что разделение используемого промышленного раствора биохимического производства сопровождается явлениями, возникающими непосредственно при обработке растворов, содержащих активные (дрожжи) и пассивные (полисахариды, обрывки дрожжей и полисахаридов) биологические объекты. Например, формируется адсорбционный слой на поверхности мембраны, состоящий из остатков динамической мембраны, который влияет на взаимодействие с СЗМ-зондом. Растрескивается остаточный слой динамической мембраны (засоренный слой), что подтверждают данные РЭМ поверхности микрофильтрационных мембран МФФК и МПС (рис. 3б, 4б).
Расчет (табл. 3) показал, что шероховатость поверхности отработанных мембран МФФК, МПС различна. Параметры Ra, Rz различаются в 1.69 и 1.87 раза, Rmax – в 1.67 и 1.05 раза (в случае наклонных и фронтальных сечений) соответственно. Поэтому следует проводить обязательный анализ поверхности мембран – наряду с фронтальными и наклонными сечениями АСМ-изображений, что во многих работах отсутствует (например, [11, 25, 27] и других), так как это влияет на общую шероховатость поверхности и на ее морфологию. Как отмечается в [28], среднеарифметическая шероховатость поверхности определяет центр распределения, а среднеквадратичная шероховатость – дисперсию случайной величины и характеризует отклонение отдельных ее значений от центра распределения.
Анализ данных РЭМ (табл. 3) и АСМ-изображений рабочих микрофильтрационных мембран МФФК, МПС показывает, что они более шероховатые по сравнению с исходными мембранами. Это связано с тем, что, во-первых, поверхности отработанных мембран прошли обработку под давлением при тангенциальной подаче раствора (появление характерных линий потока разделяемого раствора и соответствующие колебания высот по “выступам” и “впадинам”), а во-вторых, растворитель переносится через поровые участки мембраны, и формируется динамическая мембрана на ее поверхности. После прекращения перекачивания раствора с мембранообразующими добавками она смывается, что отмечается в [18]. Остаются менее значительные динамические отложения мембранообразующих веществ (дрожжи, полисахариды). Также негативным фактором роста шероховатости поверхности подобных мембран является адсорбирование полисахаридов [29]. Участки “впадин” нанофильтрационных и обратноосмотических тонкопленочных мембран обладают способностью захватывать частицы, ограничивая их диффузию через поры [30]. В [31] отмечается, что трансмембранное давление увеличивает поток через мембрану, а также влияет на биологическое обрастание мембран, которое, в свою очередь, зависит от гидрофобности мембран [32].
Данные анализа морфологии и шероховатости поверхности микрофильтрационных мембран МФФК, МПС используются для описания механизма переноса веществ через пористые области полимерных материалов под действием на мембрану трансмембранного давления и тангенциального потока в микрофильтрационном аппарате. Экспериментальные и расчетные данные о морфологии поверхности микрофильтрационных исходных и отработанных мембран МФФК, МПС, полученные методами АСМ и РЭМ, позволяют адекватно моделировать работу полупромышленных установок, так как исследование структуры поверхностного слоя мембраны необходимо для выяснения механизма засорения мембран при разделении биохимических, биологических растворов.
ЗАКЛЮЧЕНИЕ
Применение методов АСМ и РЭМ для анализа поверхности микрофильтрационных мембран МФФК, МПС (исходных и рабочих) позволило исследовать морфологические особенности пористых перегородок. На основе полученных АСМ-изображений и их инвертирования были идентифицированы участки расположения пор, дрожжей, полисахаридов, и межпоровые связующие области.
Методом АСМ выявлены характерные направления движения раствора (линии потока разделяемого раствора), которые наблюдаются во “впадинах” профиля на поверхности микрофильтрационных мембран МФФК, МПС. Они образуются в результате действия трансмембранного давления и тангенциальной подачи (прокачивания) раствора по поверхности мембран.
Сравнительный анализ полученных АСМ-, РЭМ-изображений выявил на поверхности исходных мембран МФФК, МПС щелевые поры (длиной и шириной 0.4–0.6 мкм). Отработанные мембраны загрязняются (засоряются) дрожжами, полисахаридами и их частицами (фрагментами дрожжевых клеток и полисахаридов). Это связано с присутствием в растворе обрабатываемой бражки компонентов, которые вызывают остаточное динамическое мембранообразование.
Анализ АСМ-изображений рабочих поверхностей микрофильтрационных мембран показал, что необходимым этапом работы является характеризация пористых пленок по шероховатости поверхности при проведении сечений (наклонных, фронтальных) и контроль параметров (Rmax, Rz, Ra). Шероховатость поверхностей рабочих мембран МФФК и МПС различна. Параметры Ra и Rz различаются в 1.69 и 1.87 раза соответственно, а Rmax – в 1.67 и 1.05 раза (в случае наклонных и фронтальных сечений соответственно).
Полученные данные о морфологии и шероховатости поверхности мембран МФФК, МПС связаны со специфическими особенностями, сопровождающими процесс микрофильтрационного разделения растворов, содержащих дрожжи, полисахариды и их обрывки (наличие адсорбционного слоя на поверхности мембраны, растрескивание остаточного слоя динамической мембраны (засоренного слоя)).
Список литературы
Шишкина С.В., Желонкина Е.А., Ананченко Б.А. // Adv. Sci. Хим. науки. 2017. № 2. С. 1.
Васильева В.И., Кранина Н.А., Малыхин М.Д., Акберова Э.М., Жильцова А.В. // Поверхность, рентген., синхротр. и нейтрон. исслед. 2013. № 2. С. 51.
Ситникова В.Е. Спектроскопическое изучение структуры полимерных дисперсных систем: Дис. … канд. хим. наук: 02.00.04. Тверь: ТГУ, 2015. 139 с.
Калинин В.В., Филиппов А.Н., Ханукаева Д.Ю. // Тр. РГУ Нефти и газа (НИУ) им. И.М. Губкина. Автоматизация, моделирование и энергообеспечение. 2012. № 1(266). С. 129.
Котов В.В., Гречкина М.В., Перегончая О.В., Зяблов А.Н. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 1. С. 118.
Зайченко Н.А., Васильева В.И., Григорчук О.В., Зяблов А.Н., Гречкина М.В. // Сорбционные и хроматографические процессы. 2010. Т. 10. № 5. С. 745.
Powell L.C., Hilal N., Wright C.J. // Desalination. 2017. V. 404. P. 313.
Рудобашта С.П., Махмуд С.Ю. // Химия и химическая технология. 2010. Т. 53. № 1. С. 108.
Красиков А.В., Нараев В.Н., Красиков В.Л. // Изв. С.-Петерб. гос. технол. ин-та (техн. ун-та). 2012. № 13. С. 33.
Гриценко В.О., Орлов Н.С. // Мембраны. 2002. № 16. С. 10.
Bazhenov S.D., Borisov I.L., Bakhtin D.S., Rybakova A.N., Khotimskiy V.S., Molchanov S.P., Volkov V.V. // Green En. Environment. 2016. V. 1. № 3. P. 235.
Трусов М.А. // Наноиндустрия. 2011. № 4. С. 8.
Гудилин Д. // Наноиндустрия. 2014. № 4. С. 28.
Ханукаева Д.Ю., Филиппов А.Н. // Мембраны и мембранные технологии. 2013. Т. 3. № 3. С. 210.
Лоза Н.В., Фалина И.В., Попова Д.С., Кононенко Н.А. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 5. С. 663.
Циркунова Н.Г., Борисенко В.Е., Кухаренко Л.В., Гольцев М.В., Чижик С.А. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2009. № 9. С. 82.
Chen Y., Cai J., Liu M., Zeng G., Feng Q., Chen Z. // Scanning. 2004. V. 26. № 4. P. 155.
Kovaleva O.A., Lazarev S.I., Kovalev S.V. // Petroleum Chem. 2017. V. 57. № 11. P. 974.
Kovaleva O.A., Kovalev S.V. // Petroleum Chem. 2017. V. 57. № 6. P. 542.
Стовпяга А.В., Лобова И.Н. // Науч.-тех. вестн. С.-Петерб. гос. ун-та информ. технологий, механики и оптики. 2010. № 6(70). С. 94.
Миронов В.Л. Основы сканирующей зондовой микроскопии. Учеб. пособие. Нижний Новгород: Ин-т физики микроструктур РАН, 2004. 110 с.
http://www.vladipor.ru/catalog/show/&cid=015&id=1 (дата обращения: 21.09.2018).
http://www.technofilter.ru/prod/filtry_i_oborudovanie_dlya_laboratornoj_filtracii/filtr_disc/membrana_poliefirsulfonovaya_marki_mps/ (дата обращения: 21.09.2018).
Сканирующий зондовый микроскоп NanoEducator. Руководство пользователя. Зеленоград: НТ-МДТ, 2008. 137 с.
Крисилова Е.В., Елисеева Т.В., Гречкина М.В. // Сорбционные и хроматографические процессы. 2010. Т. 10. № 1. С. 103.
Литвяк В.В., Бутрим С.М., Канарский А.В., Канарская З.А. // Вестн. технол. ун-та. 2018. Т. 21. № 3. С. 64.
Marzban R., Saberi F., Shirazi M.M.A. // Brazilian J. Chem. Engin. 2016. V. 33. № 4. P. 783.
Коновалова О.А., Сибгатуллин М.Э., Монтач А.Н., Колачева Н.В., Галимуллин Д.З., Салахов М.Х. // Уч. зап. Казан. ун-та. Сер. физ.-мат. науки. 2010. № 3. С. 99.
Ulbricht M., Ansorge W., Danielzik I., König M., Schuster O. // Separation and Purification Technol. 2009. V. 68. Iss. 3. P. 335.
Fang Y., Duranceau S.J. // Membranes. 2013. V. 3. Iss. 3. P. 196.
Saeki D., Karkhanechi H., Matsuura H., Matsuyama H. // Desalination. 2016. V. 378. P. 74.
Akin O., Temelli F. // Desalination. 2011. V. 278. Iss. 1–3. P. 387.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования




