Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 10, стр. 18-22
Определение локальной структуры и персистентной длины червеобразных мицелл олеата калия методом малоуглового рассеяния нейтронов
В. С. Молчанов a, *, А. В. Рогачев b, О. Е. Филиппова a
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Объединенный институт ядерных исследований
141980 Дубна, Россия
* E-mail: molchan@polly.phys.msu.ru
Поступила в редакцию 25.01.2021
После доработки 22.02.2021
Принята к публикации 25.02.2021
Аннотация
Изучены экспериментальные данные малоуглового рассеяния нейтронов водных растворов червеобразных мицелл анионного ПАВ олеата калия в присутствии низкомолекулярной соли KCl для широкого диапазона концентраций поверхностно-активных веществ. Показано, что с увеличением концентрации мицелл в сетке интенсивность рассеяния при малых значениях векторов рассеяния уменьшается за счет структурного фактора. В области средних значений векторов рассеяния определены параметры локальной структуры мицелл, которые не зависят от концентрации поверхностно-активных веществ. При малых концентрациях олеата калия получены значения персистентной длины червеобразных мицелл. Определена истинная персистентная длина мицелл при экстраполяции полученных значений к нулевой концентрации поверхностно-активных веществ, где взаимодействие между мицеллами отсутствует.
ВВЕДЕНИЕ
Червеобразные мицеллы поверхностно-активных веществ (ПАВ) образуются в водной среде за счет гидрофобных взаимодействий углеводородных групп и могут достигать в длину десятки микрометров [1–5]. Они привлекают внимание благодаря полимероподобным свойствам: длинные, гибкие и могут переплетаться с образованием сетки топологических зацеплений, которая придает растворам высокую вязкость (на 4–7 порядков выше вязкости воды) и упругость, подобно полимерным гелям [6, 7]. Такие мицеллы также называют мицеллярными цепями. Но в отличие от полимерных цепей, где звенья связаны ковалентно, молекулы ПАВ самоорганизуются в длинные агрегаты за счет гидрофобных взаимодействий, и поэтому их длина и гибкость восприимчивы к составу раствора. На основе таких мицелл создают адаптивные вязкоупругие растворы, которые широко применяются в косметике, бытовой химии и нефтедобывающей отрасли [3].
Одной из основных характеристик червеобразных мицелл является персистентная длина, характеризующая гибкость червеобразных мицелл по аналогии с полимерными цепями. Персистентной длиной полимера называют расстояние вдоль цепи, на котором средняя величина косинуса угла между направлением начала и конца фрагмента цепи убывает в e раз [8]. Тогда участки цепи, расположенные на расстоянии порядка двух персистентных длин, оказываются независимыми в отношении их взаимной ориентации, и полимерную цепь можно представить в виде свободно-сочлененной цепи, состоящей из прямолинейных участков. Минимальный жесткий участок цепи, который можно аппроксимировать прямолинейным участком, называют сегментом Куна, который определяют экспериментально, например, при помощи малоуглового рассеяния нейтронов (МУРН) [9], что позволяет определить и персистентную длину, которая в два раза короче длины сегмента Куна [8]. В случае сетки переплетенных червеобразных мицелл персистентная длина оказывает влияние на упругость системы и корреляционную длину в сетке [10]. Также отмечается, что высокая гибкость мицелл является одним из факторов образования разветвленных мицелл, что приводит к падению вязкости растворов на порядки [11]. В литературе отмечается [10], что в случае катионных и анионных ПАВ персистентная длина может достигать сотен нанометров, так как заряженные гидрофильные группы ПАВ выпрямляют мицеллу, подобно случаю сильно заряженных полиэлектролитов [3, 10]. Для анализа кривых МУРН заряженных червеобразных мицелл используются подходы, применяемые для полиэлектролитов [12]. При увеличении количества соли в растворе электростатическое отталкивание гидрофильных групп экранируется ионами, и персистентная длина мицелл уменьшается до 15–30 нм [13]. При этом на кривых рассеяния исчезает структурный фактор от электростатического отталкивания заряженных мицелл в сетке [14].
В данной работе исследуется локальная структура и персистентная длина червеобразных мицелл олеата калия методом МУРН в зависимости от концентрации ПАВ. В литературе отмечается, что гибкость червеобразных мицелл не зависит от концентрации ПАВ [10, 13]. При этом широко исследованы вязкоупругие свойства растворов переплетенных червеобразных мицелл данного анионного ПАВ в присутствии низкомолекулярной соли KCl [6, 14–16], но вопрос персистентной длины остается малоизученным.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Анионное ПАВ олеат калия (40 мас. % в воде) фирмы Aldrich использовали без предварительной очистки. Его критическая концентрация мицеллообразования в воде составляет (7–14) × × 10–4 моль/л [17, 18]. Хлорид калия фирмы Helicon (степень очистки >99.8%) использовали без предварительной очистки. Эксперименты МУРН проводили на установке ЮМО реактора ИБР-2 лаборатории нейтронной физики им. И.М. Франка в Объединенном Институте Ядерных Исследований (г. Дубна). Данные были обработаны согласно стандартной процедуре [19]. Для увеличения контраста для приготовления растворов использовали D2O. Все эксперименты проводили при температуре 20°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
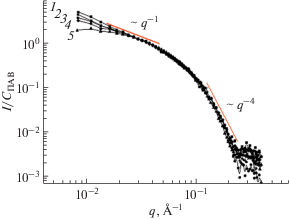
Исследование структуры мицелл олеата калия методом МУРН проводили для растворов, содержащих 6 вес. % соли KCl для экранировки электростатического отталкивания в системе [14, 15]. Значение вектора рассеяния q обратно пропорционально размеру рассеивающих объектов, поэтому разные участки кривой свидетельствуют о рассеянии на участках разного масштаба. На рис. 1 представлены кривые рассеяния растворов олеата калия различных концентраций, причем на оси ординат отложена интенсивность рассеяния, отнесенная к концентрации ПАВ. Рассмотрим сначала область высоких значений q. В этой области интенсивность рассеяния убывает как ~q–4. Это означает, что граница раздела фаз резкая [19]. В нашем случае поверхность раздела фаз, имеющих разную плотность рассеяния, – поверхность мицеллы. Наличие резкой границы раздела фаз означает, что молекулы в мицелле плотно упакованы, что не позволяет воде проникать в мицеллу.
Рис. 1.
Приведенные кривые рассеяния растворов олеата калия разных концентраций: 1 – 0.5, 2 – 0.6, 3 – 0.7, 4 – 2, 5 – 3 вес. % при температуре 20°С. Растворитель: раствор KCl концентрации 6 вес. % в дейтерированной воде.
Далее рассмотрим область более низких q, соответствующих крупным рассеивающим объектам. В нашем случае эта область будет характеризовать локальную форму мицелл. Если предполагают наличие объектов с одним ярко выраженным масштабом, например, стержнеподобных объектов, длина которых намного превышает поперечные размеры, то для данной области q строят кривую в координатах ln(Iq) от q 2 [19]. Сначала, исходя из предварительных оценок радиуса инерции мицеллы относительно оси вращения Rин и длины прямолинейного участка $\left( l \right),$ определяют границы области так, что 1/l < q < 1/Rин. Выделяют область линейной зависимости и затем на основании этого уточняют границы области данной системы (рис. 2). Из наклона зависимости можно определить радиус инерции объектов относительно оси вращения, направленной вдоль максимального размера l. Если объекты в растворе представляют собой однородные цилиндры, из величины радиуса инерции можно определить радиус поперечного сечения по формуле: R = = Rин$\sqrt 2 .$ Таким образом, были оценены поперечные размеры цилиндрических мицелл в растворах разных концентраций, представленные в табл. 1.
Рис. 2.
Данные МУРН в координатах ln(Iq)(q2) для растворов олеата калия концентраций 0.6 (1), 2 (2) и 3 (3) вес. % при температуре 20°С. Растворитель: раствор KCl концентрации 6 вес. % в дейтерированной воде. Прямые построены с помощью метода наименьших квадратов.
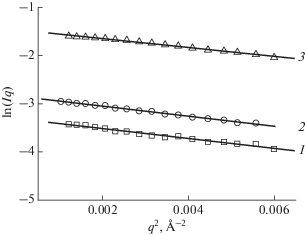
Таблица 1.
Поперечный размер мицелл в растворах олеата калия разной концентрации при 20°C. Растворитель: раствор KCl концентрации 6 вес. % в дейтерированной воде
| Концентрация ПАВ, вес. % | Радиус инерции Rин, Å | Поперечный радиус R, Å |
|---|---|---|
| 0.5 | 14.9 ± 0.6 | 21.1 ± 0.9 |
| 0.6 | 14.4 ± 0.7 | 20.3 ± 1.0 |
| 0.7 | 14.5 ± 0.7 | 20.6 ± 1.0 |
| 2 | 14.5 ± 0.8 | 20.5 ± 1.1 |
| 3 | 13.6 ± 0.1 | 19.2 ± 1.6 |
Видно, что радиус поперечного сечения мицелл олеата калия в широком диапазоне концентраций близок к 20 Å. Этот результат хорошо согласуется с геометрией цилиндрической мицеллы, поперечное сечение которой представляет собой окружность, образованную молекулами олеата калия, длина которых равна 19.5 Å [14]. Некоторое уменьшение значения радиуса при высокой концентрации ПАВ может быть следствием уменьшения интенсивности рассеяния в данной области векторов рассеяния q за счет вклада структурного фактора [20], так как по мере увеличения количества ПАВ в растворе растет их количество и длина, как было показано ранее в литературе [14], и поэтому растет и вклад межмицеллярных взаимодействий в структурный фактор. Таким образом, несмотря на то, что существует вклад структурного фактора в кривую рассеяния от сетки переплетенных мицелл, полученный “кажущийся” радиус инерции и соответствующий поперечный радиус мицелл хорошо совпадают с геометрией мицеллы и длиной молекулы ПАВ. Поэтому можно заключить, что для данной области значений векторов рассеяния вклад структурного фактора незначительный.
Из рис. 1 видно, что при q > 2 × 10–2 Å–1 кривые хорошо совпадают друг с другом. Это свидетельствует о том, что локальная цилиндрическая структура мицелл не изменяется с концентрацией ПАВ. Некоторые расхождения кривых наблюдаются лишь в области низких q. Это расхождение невелико в случае растворов низкой концентрации. В этом случае кривые согласуются с асимптотикой q–1, которая указывает на присутствие в растворах цилиндрических мицелл ПАВ [3, 14–16]. При повышении концентрации ПАВ расхождение становится более существенным, и интенсивность при малых q уменьшается. Этот факт также можно объяснить тем, что при высоких концентрациях возрастают межмицеллярные взаимодействия, понижающие интенсивность при малых векторах рассеяния [20]. Таким образом, методом МУРН показано, что в широком диапазоне концентраций олеата калия мицеллы имеют локальную цилиндрическую форму с фиксированным радиусом. Радиус поперечного сечения мицелл близок к длине гидрофобного хвоста молекулы олеата калия, что согласуется с геометрией цилиндрической мицеллы ПАВ.
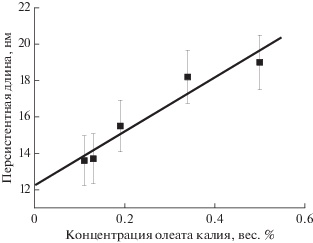
Другим важным параметром, который можно оценить из кривых МУРН, является персистентная длина, которая, как и в случае полимеров, характеризует гибкость цепи. Мицелла приобретает гибкость благодаря тепловым колебаниям молекул в протяженной цепи. Персистентную длину мицелл можно вычислить при помощи метода МУРН по формуле lpq* = 1.91 [3, 9, 10, 19, 21, 22], зная величину вектора рассеяния q*, при котором наблюдается переход от рассеяния прямолинейного участка червеобразной мицеллы, характеризующегося зависимостью q–1, к рассеянию от более крупного объекта (клубка гибкой мицеллярной цепи). На рис. 3 приведены кривые рассеяния растворов олеата калия при невысоких концентрациях, где структурный фактор от взаимодействия мицелл невысокий или отсутствует. В области низких векторов рассеяния наблюдаем возрастание интенсивности по сравнению со степенной зависимостью q–1. Данные зависимости были перестроены в координатах Холтцерса Iq(q) (рис. 4), из которых можно оценить значение q*. Вычисленные значения персистентной длины зависят от концентрации ПАВ (рис. 5) и при этом согласуются с литературными данными, согласно которым, персистентная длина червеобразных мицелл анионных и катионных ПАВ в условиях экранирования отталкивания гидрофильных головок на поверхности мицелл имеет протяженность порядка 15–30 нм [2, 3, 10]. В соответствии с полученными выше данными о влиянии структурного фактора на интенсивность рассеяния в области низких частот, можно предполагать, что с уменьшением концентрации ПАВ мы оцениваем персистентную длину с большей точностью. Отсюда, при экстраполяции полученных значений к нулевой концентрации (рис. 5) мы получаем наиболее корректное значение персистентной длины червеобразных мицелл олеата калия, равное 12.2 ± 0.7 нм. Таким образом, из анализа кривых МУРН оценена величина персистентной длины мицелл олеата калия, на основе которой можно корректно описывать структуру вязкоупругих растворов червеобразных мицелл данного ПАВ. По отношению персистентной длины к толщине мицеллы (lp/D = 3.1) можно также сделать вывод о том, что червеобразные мицеллы олеата калия являются полугибкими цепями.
Рис. 3.
Зависимости интенсивности рассеяния от вектора рассеяния для растворов олеата калия концентрации 0.11 (1), 0.13 (2), 0.19 (3), 0.34 (4) вес. % при температуре 20°С. Растворитель: раствор KCl концентрации 6 вес. % в дейтерированной воде.
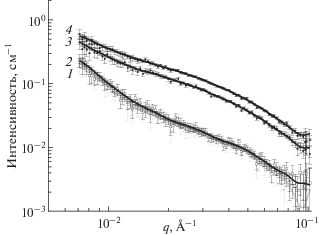
Рис. 4.
Кривые рассеяния в координатах Холтцерса Iq(q) для растворов олеата калия концентрации 0.11 (1), 0.13 (2), 0.19 (3), 0.34 (4) вес. % при температуре 20°С. Растворитель: раствор KCl концентрации 6 вес. % в дейтерированной воде. Значения q*, при которых происходит отклонение от горизонтального участка, указаны стрелками.
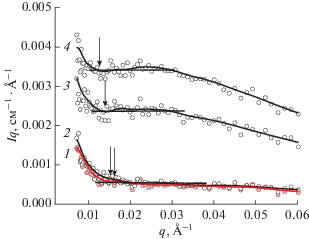
Рис. 5.
Зависимость персистентной длины червеобразных мицелл олеата калия от концентрации ПАВ при 20°С. Погрешности указаны с учетом точности определения значения q* на рис. 4. Растворитель: раствор KCl концентрации 6 вес. % в дейтерированной воде.
ЗАКЛЮЧЕНИЕ
В работе методом МУРН исследована локальная структура и персистентная длина червеобразных мицелл анионного ПАВ олеата калия в широком диапазоне концентраций ПАВ в присутствии большого количества низкомолекулярной соли KCl, которая экранирует электростатическое отталкивание между мицеллами. Подтверждена локальная цилиндрическая форма плотноупакованных червеобразных мицелл, поперечный радиус которых равен длине хвоста ПАВ. Определена персистентная длина червеобразных мицелл при невысоких концентрациях ПАВ, когда вклад структурного фактора взаимодействия переплетенных мицелл отсутствует или относительно слабый. Путем экстраполяции значений к нулевой концентрации ПАВ определена истинная персистентная длина червеобразных мицелл олеата калия.
Список литературы
Kern F., Lequeux F., Zana R., Candau S.J. // Langmuir. 1994. V.10. P. 1714. https://doi.org/10.1021/la00018a018
Fischer P., Rehage H. // Langmuir. 1997. V. 13. P. 7012. https://doi.org/10.1021/la970571d
Dreiss C.A. Wormlike Micelles: an Introduction, Wormlike Micelles. London: The Royal Society of Chemistry, 2017. 356 p. https://doi.org/10.1039/9781782629788-00001
Arleth L., Bergstrom M., Pedersen J.S. // Langmuir. 2002. V. 18. P. 5343. https://doi.org/10.1021/la015693r
Raghavan S.R., Edlund H., Kaler E.W. // Langmuir. 2002. V. 18. P. 1056. https://doi.org/10.1021/la011148e
Молчанов В.С., Шашкина Ю.А., Филиппова О.Е., Хохлов А.Р. // Коллоидный журнал. 2005. Т. 67. № 5. С. 668. https://doi.org/10.1007/s10595-005-0139-8
Квятковский А.Л., Молчанов В.С., Филиппова О.Е. // Высокомолекулярные соединения. Серия А. 2019. Т. 61. № 2. С. 180. https://doi.org/10.1134/S2308112019020081
Гросберг А.Ю., Хохлов А.Р. Статистическая физика макромолекул. М.: Наука, 1989. С. 344.
Свергун Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986. С. 279.
Magid L.J. // J. Phys. Chem. B. 1998. V. 102. № 21. P. 4064. https://doi.org/10.1021/jp9730961
Molchanov V.S., Efremova M.A., Orekhov A.S., Arkharova N.A., Rogachev A.V., Philippova O.E. // J. Molecular Liquids. 2020. V. 315. P. 113684 https://doi.org/10.1016/j.molliq.2020.113684
Sommer C., Pedersen J.S., Egelhaaf S.U., Cannavacciuolo L., Kohlbrecher J., Schurtenberger P. // Langmuir. 2002. V. 18. P. 2495. https://doi.org/10.1021/lA010214
Oelschlaeger C., Suwita P., Willenbacher N. // Langmuir. 2010. V. 26. № 10. P. 7045. https://doi.org/10.1021/la9043705
Molchanov V.S., Philippova O.E., Khokhlov A.R., Kovalev Y.A., Kuklin A.I. // Langmuir. 2007. V. 32. P. 105. https://doi.org/10.1021/la061612l
Lin Z., Eads C.D. // Langmuir. 1997. V. 7463. P. 2647. https://doi.org/10.1021/la961004d
Flood C., Dreiss C.A., Croce V., Cosgrove T. // Langmuir. 2005. V. 21. P. 7646. https://doi.org/10.1021/la050326r
Fukuda H., Goto A., Yoshioka H., Goto R., Morigaki K., Walde P. // Langmuir. 2001. V. 17. P. 4223. https://doi.org/10.1021/la0100338
Cistola D.P., Atkinson D., Hamilton J.A., Small D.M. // Biochemistry. 1986. V. 25. P. 2804. https://doi.org/10.1021/bi00358a011
Kuklin A.I., Rogachev A.V., Soloviov D.V., Ivankov O.I., Kovalev Yu.S., Utrobin P.K., Kutuzov S.A., Soloviev A.G., Rulev M.I., Gordeliy V.I. // J. Phys.: Conf. Ser. 2017. V. 848. P. 012010. https://doi.org/10.1088/1742-6596/848/1/012010
Garamus V.M., Pedersen J.S., Kawasaki H., Maeda H. // Langmuir. 2000. V. 16. P. 6431. https://doi.org/10.1021/la000085h
Chen W.-R., Butler P.D., Magid L.J. // Langmuir. 2006. V. 22. P. 6539. https://doi.org/10.1021/la0530440
Jerke G., Pedersen J.S., Egelhaaf S.U., Schultenberger P. // Langmuir. 1998. V. 14. P. 6013. https://doi.org/10.1021/la980390r
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


