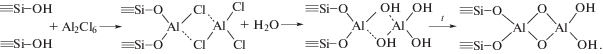Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 3, стр. 66-72
Нанослои оксидов тантала и алюминия и диэлектрические композиции на их основе
Ю. К. Ежовский *
Санкт-Петербургский Государственный технологический институт (технический университет)
190013 Санкт-Петербург, Россия
* E-mail: ezhovski1@mail.ru
Поступила в редакцию 04.04.2020
После доработки 09.06.2020
Принята к публикации 11.06.2020
Аннотация
Представлены обобщенные результаты изучения процессов формирования нанослоев оксидов тантала и алюминия, а также их многослойных композиций, полученных методом молекулярного наслаивания на поверхности кремния (100). Установлено, что формирование оксидных слоев попеременной хемосорбцией паров галогенида металла и воды может осуществляться по трем механизмам: реакцией между компонентами в полимолекулярном адсорбированном слое с образованием гидратированных оксидов; последовательном наращиванием мономолекулярных слоев (слоевой механизм роста); образованием и последующим развитием двумерных островковых структур. Определены условия реализации этих механизмов роста и многослойных композиций с чередующимися зонами указанных оксидов. Для стабилизации процесса формирования оксидного слоя и расширения температурного интервала слоевого роста использовался активатор обмена – триэтиламин. Проведена оценка диэлектрических характеристик, синтезированных наноструктур, а также влияния термообработки на эти характеристики.
ВВЕДЕНИЕ
Получение оксидных диэлектрических структур с использованием поверхностных химических реакций, лежащих в основе атомно-слоевого осаждения (ALD-технология), также известного как метод молекулярного наслаивания [1–3], предусматривает выявление технологических условий слоевого роста, исключающих стадию образования трехмерных зародышей. Это позволяет осуществить матричный синтез наноструктур с контролем состава и толщины на уровне монослоя. Использующие газо-фазную подачу реагента и имеющие самоорганизующийся характер такие процессы позволяют осуществлять групповую обработку изделий, что обеспечивает их рентабельность. Успешное использование ALD-технологии в решении ряда проблем электроники отмечается в ряде публикаций, например [4–6]. Субмикронные слои оксидов алюминия и тантала представляют практический интерес как материалы с высокими диэлектрическими характеристиками. Особыми свойствами должны обладать многослойные наноструктуры на основе этих материалов – диэлектрические сверхрешетки, характеристики которых будут определяться составом и последовательностью расположения слоев.
В настоящей работе представлены обобщенные результаты исследований процессов синтеза и основных диэлектрических характеристик нанослоев оксидов тантала и алюминия и их многослойных композиций, полученных методом молекулярного наслаивания на поверхности кремния и пленок алюминия на кремнии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение оксидных слоев методом молекулярного наслаивания базируется на самоограничивающихся процессах хемосорбции галогенида, например, хлорида металла (МCln), и паров воды в условиях предельного заполнения поверхности. На гидроксилированной поверхности кремния синтез слоев может быть представлен в виде следующих поверхностных реакций:
(I)
$\begin{gathered} {{( \equiv {\kern 1pt} {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{OH}})}_{m}} + {\text{MC}}{{{\text{l}}}_{n}} \to \\ \to {{( \equiv {\kern 1pt} {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{O}} - )}_{m}}{\text{MC}}{{{\text{l}}}_{{n\, - \,m}}} + m{\text{HCl}}, \\ \end{gathered} $(II)
$\begin{gathered} {{( \equiv {\kern 1pt} {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{O}} - )}_{m}}{\text{MC}}{{{\text{l}}}_{{n\, - \,m}}} + (n - m){{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to \\ \to {{( \equiv {\kern 1pt} {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{O}} - )}_{m}}{\text{M}}{{({\text{ОН}})}_{{n\, - \,m}}} + (n - m){\text{HCl}}. \\ \end{gathered} $Значение m зависит от распределения и концентрации гидроксильных групп на поверхности, например, для кремниевой матрицы m = 2 [7, 8]. Многократное повторение реакций (I) и (II) (с промежуточным удалением избытка реагентов и продуктов реакции) приводит к формированию оксидного слоя заданной толщины. При этом необходимо, чтобы температурные условия (Тп) роста пленок бинарных соединений АВ отвечали соотношению:
Синтез нанослоев осуществлялся на свежепротравленном кремнии (КЭФ-7.5, ориентация (100)). По эллипсометрическим оценкам толщина остаточного оксидного слоя не превышала 2 нм. Процесс синтеза проводился в вакуумно-проточной установке (давление остаточных газов было не выше 10–1 Па) при давлении паров реагентов 10–100 Па и в диапазоне температур подложки 423–623 К. Давление паров галогенидов алюминия и тантала определялось температурой их источников.
Толщина синтезируемых нанослоев определялась из эллипсометрических измерений поляризационных параметров Δ и Ψ и рассчитывалась согласно однослойной модели Друде–Тронстона [9]. Параметры Δ и Ψ измерялись на эллипсометре, собранном по схеме PQSA [9] с фиксированным компенсатором. В качестве источника линейно поляризованного света использовался лазер ЛГ-75 с длиной волны излучения 632.8 нм. Для повышения точности измерений осуществлялась магнитная модуляция светового луча, при этом погрешность в определении параметров Δ и Ψ не превышала ±0.1.
Состав ультратонких слоев контролировался по данным рентгеновской фотоэлектронной спектроскопии (РФЭС) с использованием спектрометров НР-5950А (излучение AlКα, ЕKα= = 1486 эВ). Отсчет энергии осуществлялся по углеродному стандарту С1s1/2 c Ест = 285.0 эВ. Максимальная глубина проникновения зонда в поверхностный слой при указанных энергиях не превышала 8 нм [10]. Идентификация энергетических линий исследуемых элементов Еs проводилась по данным работ [11, 12], а состав слоев определялся с использованием соотношения [10]:
(2)
$\frac{{{{I}_{1}}}}{{{{I}_{2}}}} \approx \frac{{{{n}_{1}}{{\sigma }_{1}}\sqrt {{{E}_{{K2}}}} }}{{{{n}_{2}}{{\sigma }_{2}}\sqrt {{{E}_{{K1}}}} }},$Погрешность в определении состава не превышала 5%. Состав cлоев также идентифицировался по эллипсометрическому контролю показателя преломления, который определяли по методу Холмса [9].
Определение диэлектрических характеристик слоев проводилось в системе металл–диэлектрик–металл на вакуумно-напыленных пленках алюминия на кремнии толщиной около 0.2 мкм. Для измерений электрофизических параметров использовались оксидные наноструктуры толщиной 40–60 нм. Их синтез и формирование проходило по аналогичным закономерностям (как и на кремнии). В качестве второго электрода использовались пленки никеля, полученные вакуумным испарением.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
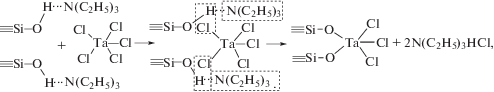
Поверхностные реакции (I) и (II) должны проходить в неравновесных условиях, обеспечивающих полноту их протекания, для чего необходима достаточно высокая активность гидроксильных групп поверхности. Однако гидроксильные группы свежепротравленного монокристаллического кремния с толщиной оксида менее 3 нм в поверхностных реакциях проявляют слабые протонодонорные свойства [7, 8]. Поэтому для активации поверхностных реакций (I) было предложено использовать триэтиламин. Этот реагент, обладая достаточно сильными протоноакцепторными свойствами, одновременно может выполнять ряд функций: стабилизировать гидроксильный покров дополнительными водородными связями, активировать реакцию за счет образования промежуточного комплекса и связывать выделяющийся хлористый водород, что обеспечивает полноту протекания реакций. При синтезе триэтиламин, не склонный к реакциям нуклеофильного замещения, можно подавать совместно с парами воды (H2O + N(C2H5)3), и образующийся на поверхности комплекс типа ≡Si–OH—N(C2H5)3 способствует протонизации гидроксильных групп.
Поскольку топология гидроксильного покрова поверхности кремния, содержащем тонкий оксидный слой, при Тп > 450 К может обеспечить химическую связь галогенида не более чем с двумя гидроксильными группами [7], хемосорбцию галогенида металла, например TaCl5, с участием триэтиламина можно представить в следующем виде:
Реакция (III) отражает только стехиометрию поверхностной реакции, а не координацию металла в образующемся оксиде. Многократное повторение реакций (I) и (II) с промежуточным удалением избытка реагентов и продуктов реакции приводит к формированию оксидного слоя необходимой толщины d, которая, как было установлено (рис. 1), пропорциональна количеству циклов обработки N:
Рис. 1.
Динамика роста пленок Al2O3 (1) и Та2О5 (2) на кремниевой матрице при Тп = 523 К с использованием ТЭА.
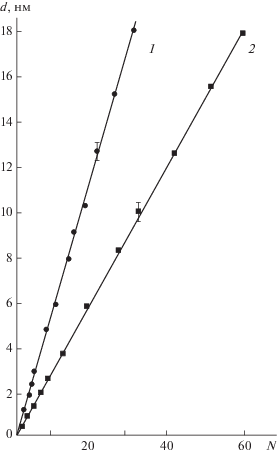
где d0 – коэффициент пропорциональности, характеризующий строение синтезированного слоя и показывающий усредненную толщину пленки за один цикл обработки одним и другим компонентами. Линейность зависимости d = f(N) указывала на сохраняющуюся активность гидроксильных групп и равномерное количество синтезированного поверхностного соединения в каждом цикле. Во всех случаях толщина пленки d была пропорциональна количеству циклов обработки N поверхности матрицы по реакциям (I) и (II).
Сопоставление величины d0, получившей название “параметр роста слоя”, с межслоевым расстоянием металл–кислород в структуре оксида позволяет оценить степень заполнения поверхности и служит критерием для определения механизма формирования слоев. Наибольший интерес представляет слоевой механизм, который можно реализовать в неравновесных условиях реакций (I, II) при предельном гидроксилировании поверхности и достаточной активности ОН-групп.
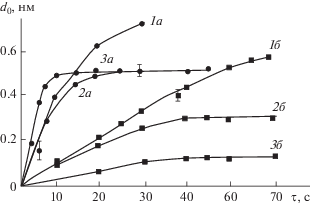
Для определения условий предельного заполнения поверхности синтезируемыми группировками по реакциям (I) и (II) при данной температуре синтеза и давлении паров проводилось эллипсометрическое изучение кинетических характеристик хемосорбции галогенида металла и воды с использованием триэтиламина. Критерием оценки служила зависимость параметра роста d0, который рассчитывался из 20–30 циклов обработки, от времени контакта реагента с подложкой. Анализ этой зависимости при различных температурах подложки и давлениях паров галогенида показал (рис. 2), что кинетика заполнения поверхности для изучаемых диапазонов давлений паров реагентов существенно зависит только от температуры подложки. Для обоих оксидов хемосорбция галогенидов имела однотипный характер (рис. 2). При Тп < 423 К в диапазоне давления паров галогенидов (Р = 10–100 Па) наблюдалось непрерывное возрастание параметра d0, что указывало на полимолекулярную адсорбцию галогенида (рис. 2, кривые 1а, 1б). Более высокие температуры подложки приводили к насыщению поверхности оксидными группировками (рис. 2, кривые 2а, 2б, 3а, 3б), что указывало на самоограничивающийся характер процесса. Из этих данных было выбрано время контакта паров галогенида и воды при давлениях Р ≈ 10 Па, которое составляло 30 с для AlCl3 и 60 с для TаCl5, и использовалось во всех последующих экспериментах.
Рис. 2.
Кинетика заполнения поверхности компонентами при формировании слоев Al2O3 (1а–3а) и Та2О5 (1б–3б) при различных температурах подложки: Тп = = 403 К (1а, 1б); Тп = 523 К (2а, 2б); Тп = 603 К (3а, 3б); Р = 10 Па.
Анализ серии зависимостей d = f(N) для слоев Al2O3 и Та2О5, полученных при различных температурах подложки, позволил установить влияние этого фактора на параметр роста слоев (рис. 3). По зависимости d0= f(Тп) можно судить о механизме их формирования и определить условия слоевого роста. Высокие значения d0 в области низких температур и уменьшение этого параметра с ростом Тп указывали на полимолекулярную сорбцию реагентов при Тп < 450 К и их взаимодействие в адсорбированном слое с образованием гидратированного оксида. При Т > 450 К значение d0 для Al2O3 было близко к удвоенному межслоевому расстоянию металл–кислород, что позволило характеризовать эти условия как условия слоевого роста, если считать, что поверхностные реакции проходят с участием димера Al2Cl6, преобладающего в составе паров галогенида и приводящего к образованию двух алюмокислородных слоев по схеме:
Рис. 3.
Влияние температуры синтеза на параметр роста слоев Al2O3 (1, 1а) и Та2О5 (2, 2а) на кремнии с активатором обмена (триэтиламин) (1, 2) и без активатора (1а, 2а).
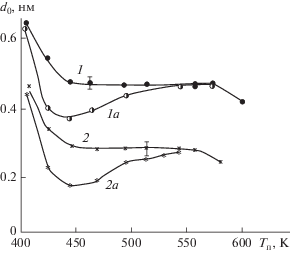
Реакции (IV) не приводит к образованию промежуточного комплекса с триэтиламином, который аналогичен реакции (III), и не отражает реальной координации алюминия в формирующемся оксидном слое. Для сравнения на рис. 3 приведены зависимости d0 = f(Тп) для слоев Та2О5 и Al2O3, синтезированных без использования триэтиламина (рис. 3 кривые 1а, 2а). В этом случае при Тп > 453 К хемосорбция галогенидов имела выраженный активационный характер и реализовать слоевой рост было возможно только при Tп > 550 K. Использование в синтезе триэтиламина позволило ликвидировать активационный барьер, что привело к расширению температурного диапазона слоевого роста почти на 100°С в низкотемпературную область (рис. 3). При более высоких температурах синтеза снижение d0 вызвано частичным дегидроксилированием поверхности и формированием двумерных островковых структур. Исследования состава синтезированных продуктов проводилось методами ИК- и РФЭ-спектроскопии для пленок толщиной более 10 нм. По данным РФЭС было установлено, что в области энергий 75–120 эВ отсутствовали линии, характерные для галогенидов (2s-, 2p-уровней), а также вблизи характерных для 1s-уровней азота энергий 401–402 эВ – группы ${\text{NR}}_{4}^{ + }$ [12]. Следовательно, в процессе синтеза триэтиламина полностью десорбируется. Для слоев Та2О5 и Al2O3 с d > 5 нм также не обнаружены пики с энергиями 100–150 эВ, характерные для 2s-, 2p-уровней кремния, что указывало на сплошность слоев при этих толщинах.
По площадям пиков кислорода (Есв = 530–534 эВ) и соответствующих металлов (Есв = = 74.6 эВ – Al2р, Есв = 118.8 эВ – Al2s и Есв = 26.8 эВ – Та4f) было определено соотношение кислорода и металла в оксидном слое при различных температурах синтеза (табл. 1). Также в табл. 1 представлены результаты, полученные после термообработки слоев в вакууме (2–10 Па) при Т = 773 К в течение 1 ч, которые показали, что полученные при Тп > 523 К оксидные наноструктуры практически не гидратированы и отвечают составу Та2О5 и Al2O3 соответственно. Повышенное содержание кислорода при низких температурах синтеза, по всей вероятности, вызвано гидратацией оксидов, а при повышенных (в основном для Al2O3) – небольшим вкладом кислорода оксидного слоя матрицы.
Таблица 1.
Соотношение кислорода и металла в слоях оксидов алюминия и тантала при различных температурах синтеза
| Тп, K | 423 | 473 | 523 | 553 | 573 | 773 |
| O/Al | 4.0 | 2.3 | 1.8 | 1.5 | 1.6 | 1.5 |
| O/Ta | 4.6 | 3.0 | 2.6 | 2.5 | 2.5 | 2.5 |
Проведенные ИК-спектроскопические исследования методом многократного нарушенного полного внутреннего отражения (МНПВО) слоев оксидов алюминия и тантала, синтезированных на кремниевых элементах при Тп = 553 К, подтвердили результаты, полученные по данным РФЭС.
Электронографические исследования структуры синтезированных оксидных пленок толщиной более 10 нм показали, что слои Та2О5 во всем диапазоне температур аморфны. Пленки Al2O3, полученные при Тп < 450 K, также были аморфны, а при больших температурах синтеза в них наблюдалась ά-Al2O3. Близость упругости паров галогенидов тантала и алюминия, а также температурных условий слоевого механизма роста их оксидных систем (рис. 3), значительно упрощали синтез многослойных наноструктур на их основе, при котором требовался прогрев всей системы подачи паров галогенидов в реактор до температуры их источника.
Эллипсометрическое исследование динамики роста многослойных наноструктур показало, что в пределах слоя каждого оксида сохранялась линейность зависимости d = f(N) c параметром d0, характерным для данного оксида (3 нм для Та2О5 и 0.45 нм для Al2O3) (рис. 3). Это указывало на сохранение слоевого механизма их формирования. Изучение состава и профиля распределения элементов по толщине синтезированных структур проводилось методами РФЭС и оже-электронной спектроскопии для двухслойных систем Si–Al2O3–Та2О5 и Si–Та2О5–Al2O3, при этом каждый слой имел толщину до 20 нм. В РФЭС-спектрах не обнаружено энергетических максимумов, характерных для хлора и кремния, что свидетельствовало о полноте протекания поверхностных реакций и сплошности получаемых слоев при данной толщине. В РФЭС-спектрах синтезированных многослойных наноструктур хорошо идентифицировались линии с Есв = 118.9 эВ и 74.8 эВ, соответствующие 2s- и 2р-уровням Al, а также 26.8 эВ, характерные для 4f-уровней Та.
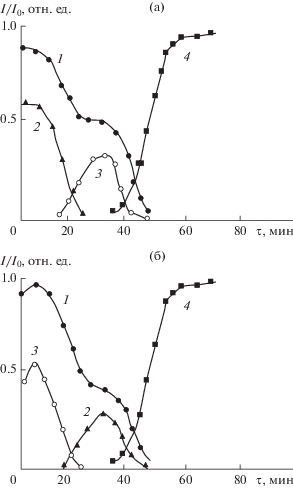
Анализ оже-спектров с послойным травлением ионами аргона (скорость травления составляла около 0.5 нм/мин) показал (рис. 4), что для наноструктурных композиций с d > 10 нм распределение Та и Al соответствовало чередованию их оксидных слоев при синтезе. Появление сигнала от кремниевой матрицы фиксировалось только после 40-минутного травления, что при данной скорости травления хорошо согласовывалось с общей толщиной оксидной наноструктуры.
Рис. 4.
Изменение интенсивностей оже-пиков кислорода (1), алюминия (2), тантала (3) и кремния (4) при послойном стравливании наноструктуры Si –Та2О5–Al2O3 (a) и Si–Аl2O3–Та2О5 (б).
Зональное распределение соответствующего металла в оксидной наноструктуре (рис. 4) должно приводить к отличию ее свойств от свойств смеси оксидов. Наиболее характерным параметром является диэлектрическая проницаемость ε, которую определяли по измерению емкости системы на образцах с общей толщиной 40–60 нм. При этом в исследуемых образцах варьировалась как толщина каждого слоя di (Al2O3) и dj (Та2О5), так и их чередование. Сравнение экспериментальных данных диэлектрической проницаемости многослойных композиций с расчетными значениями по модели Ландау–Лифшица для статистической смеси диэлектриков [13] во всех случаях показало существенное отличие (табл. 2). Только после двухчасовой термообработки образцов (Т = 873 К) значения приближались к расчетным для смеси диэлектриков, причем наилучшее совпадение наблюдалось для образцов с малой толщиной слоя (di, dj > 5 нм) хотя бы одного из компонентов системы (табл. 2, № 1, 3, 7). Это указывало на зональное распределение оксидов в диэлектрическом слое и заметный вклад диффузионных процессов только при термообработке при Т > 873 К и толщине оксидного слоя d < 5 нм.
Таблица 2.
Диэлектрическая проницаемость ε многослойных наноструктур Al2O3–Та2О5 различной композиции
| № | Толщина слоя Аl2O3, di, нм | Толщина слоя Та2О5, dj, нм | Чередование слоев оксидов | ε | ||
|---|---|---|---|---|---|---|
| Эксперимент | Расчет | Эксперимент после термообработки | ||||
| 1 | 5 | 5 | Атататататат | 13.6 | 14.8 | 14.8 |
| 2 | 25 | 25 | Ат | 13.7 | 14.8 | 14.1 |
| 3 | 10 | 5 | Тататат | 12.2 | 13.0 | 12.8 |
| 4 | 20 | 10 | Тата | 12.2 | 13.0 | 12.7 |
| 5 | 10 | 20 | Атат | 15.8 | 16.9 | 16.2 |
| 6 | 10 | 50 | Ат | 18.1 | 19.35 | 18.5 |
| 7 | 5 | 20 | Атата | 17.7 | 18.7 | 18.7 |
ЗАКЛЮЧЕНИЕ
Установленные закономерности формирования наноструктур оксидов Та2О5 и Al2O3 и их многослойных композиций в целом отражают общую тенденцию влияния температурного фактора на механизм роста слоев, полученных методом молекулярного наслаивания. Показано, что формирование слоев Al2O3 и Та2О5 попеременной хемосорбцией паров галогенида металла и воды может осуществляться по трем механизмам: реакцией между компонентами в полимолекулярном адсорбированном слое с образованием гидратированных оксидов, последовательном наращивании мономолекулярных слоев (слоевой механизм роста), образованием и последующим развитием двумерных островковых структур. Использование в процессе синтеза активатора обмена триэтиламина интенсифицирует хемосорбцию галогенида, стабилизирует процесс формирования оксидного слоя и расширяет температурный интервал слоевого роста. Результаты оценки основных диэлектрических характеристик синтезированных наноструктур показали, что их параметры позволяют использовать метод молекулярного наслаивания для создания диэлектрических структур (в том числе и многослойных композиций) в субмикронной элементной базе микро- и наноэлектронных систем.
Список литературы
Алесковский В.Б. // Вестн. АН СССР. 1975. № 6. С. 48.
Ежовский Ю. К. // Журн. физ. химии. 2017. Т. 91. № 4. С. 691.
Букин С.В., Шулаков А.С. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2007. № 2 С. 13.
Gelatos J., Chen L., Chung H., Thakur R. // Solid State Technol. 2003. V. 2. P. 44.
Gaskins J.T., Hopkins P.E., Merrill D.R. // ECS J. Solid State Sci. Technol. 2017. V. 6. I. 10. P. 189.
Gougousi T. // Progress in Crystal Growth and Characterization of Materials. 2016. V. 62. I. 4. P. 1.
Ежовский Ю.К. // Неорг. матер. 2019. Т. 55. № 2. С. 117.
Ежовский Ю.К. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2015. № 5. С. 43.
Громов В.К. Введение в эллипсометрию. Л.: Изд. ЛГУ, 1986. 192 с.
Нефедов В.И., Черепин В.Т. Физические методы исследования поверхности твердых тел. М.: Наука, 1983. 296 с.
Нефедов В.И. Рентгено-электронная спектроскопия химических соединений. М.: Химия, 1984. 256 с.
Handbook of X-ray photoelectron spectroscopy. Perkin-Elmer Corporation Physical Electronics Division 6509 Flying Cloud Drive. Edom Prairie, Minnesota 55 344, 1978. 456 p.
Лазарев В.Б., Красов В.Г., Шаплыгин И.С. Электропроводность окисных систем и пленочных структур. М.: Наука, 1979. 68 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования