Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 3, стр. 94-100
Химический дизайн микропинцета на основе сплава DyPrFeCoB
О. В. Коплак a, *, Е. В. Дворецкая a, **, В. Л. Сидоров b, Н. Н. Дремова a, И. В. Шашков c, Д. В. Королев d, Р. А. Валеев d, В. П. Пискорский d, Р. Б. Моргунов a, d
a Институт проблем химической физики РАН
142432 Московская область, Черноголовка, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
c Институт физики твердого тела РАН
142432 Московская область, Черноголовка, Россия
d Всероссийский научно-исследовательский институт авиационных материалов
105005 Москва, Россия
* E-mail: o.koplak@gmail.com
** E-mail: dvoretskaya95@yandex.ru
Поступила в редакцию 14.06.2020
После доработки 06.08.2020
Принята к публикации 17.08.2020
Аннотация
Микропровода α-Fe/DyPrFeCoB с параболическим острием для концентрации магнитного потока и усиления силы притяжения частиц созданы методом селективного растворения. Оптимизированы условия заострения конца микропровода посредством травления кислотой HNO3, а также смесями кислот HNO3 + HCl и H2SO4 + HNO3. Магнитная сила одиночного микропровода с заостренным концом (до 880 пН) дает возможность захватывать и удерживать микрочастицу DyPrFeCoB размером 1 мкм в области ~5 мкм. Значительный градиент магнитного поля (до ~3.5 × 105 Тл/м), создаваемый на конце микропровода, достаточен для воздействия на биологические процессы внутри клеток даже без магнитных маркеров. Условия прикрепления/отсоединения магнитной микрочастицы контролируются обменным смещением, возникающим на границе ферромагнитного ядра α-Fe и ферримагнитной оболочки PrDyFeCoB, и четырьмя магнитными состояниями микропровода, которые переключаются слабым внешним однородным магнитным полем ~0.1–2 кА/м.
ВВЕДЕНИЕ
Магнитный пинцет – устройство, которое создает сильно неоднородное магнитное поле, способное к захвату ферромагнитных частиц и магнитомеченных клеток. Магнитное управление положением магнитомеченных частиц позволяет избежать интенсивного облучения и механического воздействия, которое неизбежно приводило бы к деградации биологических объектов [1]. Поэтому разработка магнитных пинцетов необходима в медицинской спинтронике для контроля, отслеживания и перемещения магнитомеченных клеток [1–3], выпрямления молекул ДНК и РНК [4, 5], торсионной деформации длинных биологических молекул [6]. Стратегия создания магнитного пинцета включает в себя: подбор магнитного материала, который бы создавал необходимое магнитное поле и характеризовался биосовместимостью; дизайн формы микропровода для максимизации магнитной силы [7, 8]; разработку процесса прикрепления/отсоединения ферромагнитных объектов [9, 10].
Проблему регулируемого открепления частиц обычно решают с помощью электромагнитных микрокатушек [9–11], которые управляют величиной намагниченности микропровода [12, 13]. С использованием микроэлектромагнитной матрицы возможна манипуляция не только наночастицами, но и биологическими клетками [14, 15]. Однако катушки имеют ограничения по току и создаваемому им магнитному полю. Это заметно усложняет конструкцию и увеличивает стоимость магнитного пинцета. Недостатком использования магнитных пинцетов на основе однофазных микропроводов Fe, покрытых стеклянной оболочкой, является плохо контролируемая намагниченность. Изготовление микропроводов из сплавов на основе переходных (TM) и редкоземельных (RE) элементов методом экстракции висящей капли расплава открывает возможность контроля намагниченности вследствие расслоения фазы RE–TM–B на аморфную редкоземельную часть с низкой коэрцитивной силой и микрокристаллическую часть, состоящую из переходных металлов [16]. Наиболее серьезной проблемой является дизайн формы магнитных полюсов микропроводов, которые должны быть расположены в непосредственной близости к образцу [1] и способны к перемещению микрообъектов. В [17] был разработан двухзондовый манипулятор на базе атомно-силового микроскопа (АСМ), где в качестве зонда выступают заостренные вольфрамовые микропровода с диаметром острого конца ~250 нм. С помощью такого манипулятора удалось реализовать механическое позиционирование пучка нанопроволок InAs, лежащего на подложке SiO2, в плоскости XY с субмикронной точностью. В качестве зондов манипулятора, способного перемещать субмикронные объекты без механических воздействий, исключительно с помощью магнитного поля, могут выступать разработанные в [16, 18] двухфазные микропровода с ферромагнитным ядром α-Fe и ферримагнитной оболочкой DyPrFeCoB. Микропровода α-Fe/DyPrFeCoB обладают высокой намагниченностью насыщения Ms, что увеличивает силу, действующую на микрочастицу. Дизайн формы таких микропроводов для максимизации магнитной силы возможен путем адресного химического травления оболочки и ядра, состоящих из разных материалов.
Поэтому целью настоящей работы был химический дизайн конца α-Fe/DyPrFeCoB микропровода для концентрации магнитного потока и усиления силы притяжения частиц и/или магнитомеченных биологических микрообъектов, а также применение двухкомпонентной структуры микропровода для переключения его намагниченности с помощью однородного магнитного поля.
МЕТОДИКА И ОБРАЗЦЫ
Микропровода были получены методом экстракции висящей капли расплава PrDyFeCoB, нагретой электронным пучком [18]. Капля сплава PrDyFeCoB охлаждалась с высокой скоростью ~106 К/с, достаточной для формирования аморфной фазы PrDyFeCoB на поверхности микрокристаллического ядра α-Fe. Структурный и химический состав полученных микропроводов, включая ядро α-Fe и оболочку PrDyFeCoB, определяли методами энергодисперсионного и рентгенофазового анализа. В энергодисперсионном спектре присутствуют пики основных элементов микропровода: Pr, Dy, Fe, Co, B (рис. 1а). Методом рентгенофазового анализа было установлено примерно одинаковое (50 : 50) процентное содержание доли кристаллических включений Fe и доли аморфной оболочки PrDyFeCoB [18]. Для получения изображений микропроводов использовали оптический микроскоп AxioImager.A1 (Zeiss) и растровый автоэмиссионный электронный микроскоп (РЭМ) SUPRA25 (Zeiss). Микропровода, используемые во всех экспериментах, имели длину ~15 мм и радиус 10–25 мкм.
Рис. 1.
Энергодисперсионный микроанализ поверхности микропровода α-Fe/DyPrFeCoB (а), область микроанализа представлена на вставке. РЭМ-изображение: б – микропровода α-Fe/DyPrFeCoB после травления смесью кислот HNO3 + HCl (1 : 3); в – микрочастица DyPrFeCoB (показана белой стрелкой), захваченная микропроводом α-Fe/DyPrFeCoB, предварительно намагниченным во внешнем продольном магнитном поле ~7.96 кА/м.

Для химического дизайна микроигл использовали кислоты HNO3, HCl, H2SO4, H3PO4, а также смеси кислот HNO3 + HCl (1 : 3), H2SO4 + HNO3 (1 : 1). В ходе эксперимента одиночный микропровод одним концом погружали в химический растворитель с температурой 60°С на 5 с. Далее микропровод подвергался промывке в дистиллированной воде и сушке при комнатной температуре.
Распределение намагниченности вблизи конца микропровода получено методом магнитооптических индикаторных пленок (МОИП), основанном на магнитооптическом эффекте Фарадея в оптически прозрачной гранатовой пленке, которая была помещена на микропровод. Особенности и преимущества исследования локальной намагниченности в тонких пленках и микрообъектах метода МОИП описаны в [19]. Конец микропровода был покрыт магнитоиндикаторной пленкой железоиттриевого граната, легированного висмутом, на одну сторону которой был нанесен тонкий слой оксида алюминия. Эти слои позволяли визуализировать отраженный линейно поляризованный свет, сфокусированный в поляризационном микроскопе. В отсутствие внешнего магнитного поля намагниченность индикаторной пленки лежит в ее плоскости. Поскольку микропровод обладает собственным полем, в гранатовой пленке возникает отклонение намагниченности от ее ориентации в плоскости. Таким образом, результирующий МОИП-сигнал был прямо пропорционален перпендикулярной составляющей намагниченности микропровода.
Локальный гистерезис намагниченности поверхности микропровода был получен при помощи микроскопа Durham Nano-MOKE3, в основе работы которого лежит магнитооптический эффект Керра. Поперечную составляющую намагниченности сканировали вдоль оси микропровода в меридиональной геометрии. Магнитное поле было направлено вдоль оси микропровода, лазерный луч и ось микропровода лежали в одной плоскости. Диаметр сфокусированного лазерного пятна (длина волны 660 нм) составлял 6 мкм.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для концентрации магнитного потока и усиления локального магнитного поля из цилиндрического микропровода α-Fe/DyPrFeCoB был получен микропровод с острым концом (рис. 1б, 1в). При использовании смеси кислот HNO3 + HCl (1 : 3) (рис. 1), H2SO4 + HNO3 (1 : 1) (рис. 2а), а также кислоты HNO3 (рис. 2б) были получены микропровода с вершиной, близкой к параболической форме. Растворение в кислотах HCl (рис. 2в), H2SO4 (рис. 2г), H3PO4 (рис. 2д) не позволило достичь конусообразной геометрии. Поскольку растворимость аморфной оболочки PrDyFeCoB была выше, чем растворимость кристаллического ядра α-Fe в кислотных смесях HNO3 + HCl (1 : 3), H2SO4 + HNO3 (1 : 1), HNO3, селективное травление привело к истончению конца микропровода до радиуса ~1, 1.8 и 0.75 мкм соответственно. Микронное значение радиуса является оптимальным для использования микропроводов α-Fe/DyPrFeCoB в качестве магнитных пинцетов, работающих с биологическими объектами [20]. Вероятнее всего, железное ядро микропровода пассивируют группы ОН в концентрированных кислотах HNO3 и H2SO4, что способствует образованию параболической вершины. Можно предположить, что ядро микропровода растворяется быстрее оболочки в результате следующих химических реакций:
(1)
${\text{2Fe}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} = {\text{F}}{{{\text{e}}}_{2}}{{({\text{S}}{{{\text{O}}}_{{\text{4}}}})}_{3}} + 3{\text{S}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow + {\text{ 6}}{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(2)
${\text{Fe}} + 4{\text{HN}}{{{\text{O}}}_{3}} = {\text{Fe(N}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{3}} + {\text{NO}}\, \uparrow + \,2{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Рис. 2.
Оптическое изображение микропроводов α-Fe/DyPrFeCoB, полученных химическим травлением: а – в смеси кислот H2SO4 + HNO3 (1 : 1); б – HNO3; в – HCl; г – H2SO4; д – H3PO4.

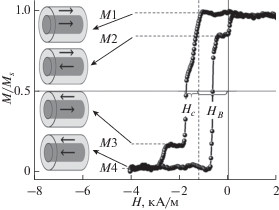
Петля гистерезиса, записанная в центре микропровода с помощью магнитооптического эффекта Керра (рис. 3), характеризуется четырьмя уровнями магнитного момента (М1–М4 на рис. 3), соответствующими разным взаимным ориентациям намагниченности ядра и оболочки. Уровень М1 отвечает состоянию, когда векторы намагниченности в ядре и оболочке направлены в одну сторону вдоль магнитного поля. Уровни М2 и М3 соответствуют состоянию, в котором векторы намагниченности ядра и оболочки ориентированы антипараллельно, при этом на уровне М2 внешнее магнитное поле сонаправлено с намагниченностью в оболочке, а на уровне М3 оно сонаправлено с намагниченностью в ядре. На уровне М4 намагниченность и ядра, и оболочки направлена против внешнего поля. Таким образом, каждый уровень соответствует одной из четырех взаимных ориентаций магнитных моментов PrDyFeCoB оболочки и α-Fe ядра. Поскольку глубина проникновения света не превышала ~20–30 нм, метод, основанный на магнитооптическом эффекте Керра, позволяет определить намагниченность тонкого поверхностного слоя микропровода, которая зависит от магнитного поля рассеяния ядра α-Fe и внешнего магнитного поля. Наличие обменной связи между ферромагнитным ядром α-Fe и ферримагнитной оболочкой PrDyFeCoB приводит к смещению петли гистерезиса на величину НВ ~ 1.2 кА/м. Ориентация спинов ферромагнитного α-Fe ядра вблизи границы раздела зафиксирована по распределению спинов в антиферромагнитной (ферримагнитной) оболочке, благодаря чему в них формируется однонаправленная (обменная) анизотропия. Величина поля обменного смещения НВ обусловлена переориентацией спинов в антиферромагнитной оболочке вблизи границы раздела [21]. Наличие обменного смещения необходимо для стабилизации начального состояния намагничивания магнитного пинцета или датчика на основе микропровода.
Рис. 3.
Гистерезис угла поляризации света, пропорционального поверхностной намагниченности, полученный методом магнитооптического эффекта Керра в центре микропровода. Четыре уровня соответствуют различным магнитным моментам микропровода α-Fe/DyPrFeCoB (показаны пунктирными линиями). На вставке – соответствующие эскизы с взаимными ориентациями магнитного момента ядра α-Fe и оболочки DyPrFeCoB.
На рис. 4а представлена ферромагнитная микрочастица DyPrFeCoB диаметром ~1 мкм и весом ~200 пН, захваченная концом микропровода, заранее намагниченным в поле 7.96 кА/м. На рис. 4б визуализировано распределение поперечной составляющей намагниченности параболического конца микропровода α-Fe/DyPrFeCoB, полученное методом МОИП. Из рисунка видно, что намагниченность микропровода сконцентрирована в остром конце микропровода в соответствии с расчетом магнитного потока в магните параболической формы [20], наиболее близкой к форме конца в наших экспериментах. Таким образом, эффективный концентратор магнитного поля может быть создан путем химического заострения микропровода. Большой градиент магнитного поля вблизи кончика микропровода является необходимым условием захвата магнитных микрочастиц и магнитомеченных биологических объектов.
Рис. 4.
РЭМ-изображение конусообразного конца микропровода, предварительно намагниченного в поле ~7.96 кА/м с захваченной микрочастицей PrDyFeCoB размером ~1 мкм (а). Визуализация распределения намагниченности на конце размагниченного микропровода без микрочастицы, полученного методом МОИП (б).

Максимальная сила, удерживающая магнитные частицы, зависит от максимально достижимого градиента поля вблизи конца микропровода. В [20] для параболической формы магнита предложен способ вычисления оптимального расстояния от наконечника до частицы, при котором существует достаточно сильный градиент. В экспериментах получена близкая к параболической форма наконечника микропровода, что позволило оценить градиент поля магнитного потока ∇B и его зависимость от расстояния на параболической оси r по формуле [20]:
где Ms = 6.3 × 105 A/м – намагниченность насыщения, определенная в [20], β ~ 106 м–1 – постоянный коэффициент в уравнении параболы y(R) = βR 2, μ0 = 4π × 10–7 Тл · м · А–1 – магнитная проницаемость вакуума. Выражение (3) действительно для однородно намагниченного материала. Будем пренебрегать неоднородной намагниченностью, соответствующей намагниченностям ядра и оболочки. Согласно [20] максимальный градиент для параболического магнита может быть достигнут при R = 1/4β = 0.25 мкм. Выражение (3) приводит к ∇B = μ0Ms/(4βR2) = (0.61 × 105)– (3.52 × 105) Тл/м (табл. 1). Градиент магнитного потока на конце микропровода заметно выше градиента в [20] из-за повышенной намагниченности насыщения в редкоземельных микропроводах. Градиент магнитного поля до ~3.25 × 105 Тл/м, обнаруженный возле конца одиночного микропровода, очень близок к максимальным градиентам ~106 Тл/м, достигнутым в массивах микропроводов [15, 16, 20]. Этого градиента достаточно даже для воздействия на биологические процессы внутри клеток, а также на группы клеток без магнитных маркеров. Поскольку клетка диамагнитна, ее можно рассматривать как каплю диамагнитной жидкости, которая, будучи помещенная в неоднородное поле, разделяется на несколько меньших капель для удовлетворения минимума полной энергии системы. Таким образом, после достижения достаточного магнитного градиента могут быть возможны значительные изменения функций, формы и пространственной организации клетки [22]. Пороговое значение градиента магнитного потока $\nabla B$ составляет: для позиционирования и магнитно-ассистированной миграции мезенхимальных стволовых клеток – 105–106 Тл/м, для включения/выключения канала в клетках с механочувствительными ионными каналами – 103 Тл/м, для фиксации опухоли из обогащенных железом раковых клеток – 104–105 Тл/м, для магнитно-вспомогательного деления раковых клеток с низким натяжением мембран – 103–105 Тл/м, для изменения пути дифференцировки и экспрессии генов мезенхимальных стволовых клеток – 102 Тл/м, для эндоцитоза с магнитной поддержкой клеток РС-3 и фибропластов – 102–103 Тл/м, для набухания клеток моноцитарной лейкемии ТНЗ-1 – 103 Тл/м [22]. Химическое заострение конца микропровода приводит к возрастанию магнитного потока на три порядка (таблица). Сравнительные характеристики микропроводов α-Fe/DyPrFeCoB и их магнитная сила F после травления кислотами HNO3 + HCl (1 : 3), H2SO4 + HNO3 (1 : 1), HNO3 приведены в табл. 1. Соответствующая магнитная сила микропровода 3F = m∇B = 152.5–880 пН (здесь m – намагниченность частицы), действующая на микрочастицу из того же материала радиусом ~1 мкм (рис. 4), очень близка к ультравысокому градиенту ~106 Тл/м, экспериментально обнаруженному вблизи наконечников редкоземельных микропинцетов, изготовленных дорогим литографическим методом [20, 23]. Максимальное расстояние r1 = 3.99, r2 = 12.98, r3 = 2.25 мкм для микропроводов 1–3 (табл. 1), ограничивающее способность пинцета удерживать частицу весом 200 пН, было получено при учете обратно пропорциональной зависимости магнитной силы от расстояния между частицей и пинцетом F = mμ0Ms/r. Эта оценка была проверена экспериментально следующим образом. Одиночная микрочастица, удаленная на 5 мкм от наконечника микропровода, представлена на рис. 5. Таким образом, верхняя граница активной зоны пинцета составляет ~5 мкм. Когда поле насыщения 7.96 кА/м предварительно приложено вдоль ядра микропровода, намагниченный микропровод захватывает частицу (рис. 1в, 4), в то время как в отсутствие магнитного поля наблюдается открепление частицы.Таблица 1.
Характеристики микропроводов α-Fe/DyPrFeCoB с параболической вершиной
| Параметр | Микропровод 1 | Микропровод 2 | Микропровод 3 |
|---|---|---|---|
| Радиус RН микропровода до травления кислотой, мкм | 43 | 18.7 | 22.5 |
| Градиент поля магнитного потока $\nabla B$ микропровода до травления кислотой, 102 Тл/м | 1.1 | 5.7 | 3.9 |
| Кислота, используемая для травления | HNO3 + HCl (1 : 3) | H2SO4 + HNO3 (1 : 1) | HNO3 |
| Радиус R конца микропровода после травления кислотой, мкм | 1 | 1.8 | 0.75 |
| Градиент поля магнитного потока $\nabla B$ конца микропровода после травления кислотой, 105 Тл/м | 1.98 | 0.61 | 3.52 |
| Магнитная сила F, действующая на микрочастицу из того же материала радиусом ~1 мкм, пН | 495 | 153 | 880 |
| Расстояние взаимодействия, мкм | 3.99 | 12.98 | 2.25 |
ЗАКЛЮЧЕНИЕ
Химическое растворение конца микропровода α-Fe/DyPrFeCoB кислотой HNO3, а также смесями кислот HNO3 + HCl (1 : 3) и H2SO4 + HNO3 (1 : 1) позволяет получить практически идеальную параболическую форму конца микропровода с радиусом магнитного полюса до ~1.5 мкм, что позволяет использовать такой микропровод в качестве магнитного пинцета.
Градиент поля магнитного потока на конце одиночного микропровода имеет довольно высокое значение – до ~3.52 × 105 Тл/м, достаточное для воздействия на биологические процессы внутри клеток в отсутствие ферромагнитных маркеров. Сила магнитного притяжения до ~880 пН, контролирующая микрочастицу DyPrFeCoB размером 1 мкм в широкой области длиной ~5 мкм, является достаточной для биологических и медицинских применений.
Наличие ферромагнитного ядра α-Fe и ферромагнитной аморфной оболочки DyPrFeCoB позволяет использовать четыре магнитных состояния, переключаемых внешним однородным магнитным полем, для контролируемого прикрепления–открепления микрочастиц.
Список литературы
Sarkar R., Rybenkov V.V. // Frontiers in Physics. 2016. V. 4. № 48. P. 20. https://doi.org/10.3389/fphy.2016.00048
Henighan T., Chen A., Vieira G., Hauser A.J., Yang F.Y., Chalmers J.J., Sooryakumar R. // Biophys. J. 2010. V. 98. № 3. P. 412. https://dx.doi.org/10.1016%25252Fj. bpj.2009.10.036
Kollmannsberger P., Fabry B. // Rev. Sci. Instrum. 2007. V. 78. P. 114301. https://doi.org/10.1063/1.2804771
Vlaminck I., Dekker C. // Ann. Rev. Biophys. 2012. V. 41. P. 453. https://doi.org/10.1146/annurev-biophys-122311-100544
Lipfert J., Wiggin M., Kerssemakers J., Pedaci F., Dekker N.H. // Nature Commun. 2011. V. 2. № 439. P. 1. https://doi.org/10.1038/ncomms1450
De Vlaminck I., Dekker C. // Annu. Rev. Biophys. 2012. V. 41. P. 453. https://doi.org/10.1146/annurev-biophys-122311-100544
Thiaville A., Tomaš D., Miltat J. // Phys. Stat. Sol. A. 1998. V. 170. № 439. P. 125. https://doi.org/10.1002/(SICI)1521-396X(199811)170:1 <125::AID-PSSA125>3.0.CO;2-8
Chen L., Offenhausser A., Krause H.J. // J. Appl. Phys. 2015. V. 118. № 12. P. 124 701. https://doi.org/10.1063/1.4931981
Bijamov A., Shubitidze F., Oliver P.M., Vezenov D.V. // J. Appl. Phys. 2010. V. 108. № 10. P. 104 701. https://doi.org/10.1063/1.3510481
Barbic M., Mock J.J., Gray A.P., Schultz S. // Appl. Phys. Lett. 2001. V. 79. P. 1897. https://doi.org/10.1063/1.1402963
Rinklin P., Krause H., Wolfrum B. // Phys. Stat. Sol. A. 2012. V. 209. P. 871. https://doi.org/10.1002/pssa.201100529
Vazquez M. Magnetic Nano- and Microwires. Cambridge: Woodhead Publ., 2015. 870 p.
Peng H., Qin F., Phan M. Ferromagnetic Microwire Composites From Sensors to Microwave Applications. Switzerland: Springer, 2016.
Lee C.S., Lee H., Westervelt R.M. // Appl. Phys. Lett. 2001. V. 79. P. 3308. https://doi.org/10.1063/1.1419049
Lee H., Purdon A.M., Westervelt R.M. // Appl. Phys. Lett. 2004. V. 85. P. 1063. https://doi.org/10.1063/1.1776339
Коплак O.В., Дворецкая Е.В., Таланцев А.Д., Королев Д.В., Валеев Р.А., Пискорский В.П., Денисова А.С., Моргунов Р.Б. // Физика твердого тела. 2020. V. 62. № 4. С. 562.
Zhukov A.A., Stolyarov V.S., Kononenko O.V. // Rev. Sci. Instrum. 2017. V. 88. P. 063701. https://doi.org/10.1063/1.4985006
Morgunov R.B., Koplak O.V., Piskorskii V.P., Korolev D.V., Valeev R.A., Talantsev A.D. // J. Magn. Magn. Mater. 2020. V. 497. P. 166004. https://doi.org/10.1016/j.jmmm.2019.166004
Nikitenko V.I., Gornakov V.S., Dedukh L.M., Khapikov A.F., Bennett L.H., McMichael R.D., Swartzendruber L.J., Shapiro A.J., Donahue M.J. // J. Appl. Phys. 1996. V. 79. P. 6073. https://doi.org/10.1063/1.362096
De Vries A.H.B., Krenn B.E., van Driel R., Kanger J.S. // Biophys. J. 2005. V. 88. P. 2137. https://doi.org/10.1529/biophysj.104.052035
Escrig J., Allende S., Altbir D., Bahiana M., Torrejon J., Badini G., Vazquez M. // J. Appl. Phys. 2009. V. 105. P. 023907. https://doi.org/10.1063/1.3068177
Zablotskii V., Polyakova T., Lunov O., Dejneka A. // Sci. Rep. 2016. V. 6. P. 37407. https://doi.org/10.1038/srep37407
Zablotskii V., Pastora J.M., Larumbea S., Pérez-Landazábala J.I., Recartea V., Gómez-Polo C. // AIP Conf. Proc. 2010. V. 1311. P. 152. https://doi.org/10.1063/1.3530005
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования



