Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 6, стр. 52-57
Поверхностные свойства бинарных и многокомпонентных полупроводников системы GaSb–ZnTe. Закономерности их изменения
И. А. Кировская a, *, Л. В. Новгородцева a, О. В. Кропотин a, Ю. И. Матяш b
a Омский государственный технический университет
644050 Омск, Россия
b Омский государственный университет путей сообщения
644046 Омск, Россия
* E-mail: kirovskaya@omgtu.ru
Поступила в редакцию 24.07.2020
После доработки 21.10.2020
Принята к публикации 25.10.2020
Аннотация
На основе анализа и обобщения результатов исследований поверхностных свойств (кислотно-основных и адсорбционных) компонентов системы GaSb–ZnTe установлены закономерности их изменений с составом, которые как подчиняются правилу Вегарда (носят плавный характер), так и отклоняются от него (носят экстремальный характер). Объяснены причины появления экстремумов на диаграммах свойства–состав. Обнаружены корреляции между поверхностными и объемными свойствами, полезные не только в научном, но и в практическом аспекте. Выявлены наиболее активные адсорбенты по отношению к NH3, CO, O2, которые предложены для изготовления соответствующих датчиков. Показана возможность и целесообразность использования полученных результатов в полупроводниковом газовом анализе.
ВВЕДЕНИЕ
В работе анализируются результаты исследований поверхностных свойств многокомпонентных алмазоподобных полупроводников – твердых растворов системы GaSb–ZnTe – в сравнении с исходными бинарными полупроводниками типа АIIIВV (GaSb) и АIIВVI (ZnTe). Такие исследования актуальны. С одной стороны, они дополняют сведения о поверхностных свойствах, играющих зачастую определяющую роль в работе полупроводниковых приборов, в полупроводниковом катализе, во многих технологических процессах. С другой стороны, если бинарные полупроводники уже нашли применение в ряде областей современной техники (прежде всего, в микро- и оптоэлектронике), то многокомпонентные полупроводники (твердые растворы) еще таят в себе много неизвестного. В силу сложности внутренних процессов, сопровождающих образование твердых растворов, с изменением состава возможно не только плавное, но и, что особенно привлекательно, экстремальное изменение свойств. Так, в исследуемой системе GaSb–ZnTe катионо- и анионообразующими являются элементы различных групп периодической системы. Поэтому при образовании твердых растворов (GaSb)х(ZnTe)1 –х атомы-заместители в решетке основного вещества выступают как электрически активные примеси. При легировании основного вещества с накоплением второго компонента изменяются кристаллическая решетка, физические и физико-химические свойства твердых растворов.
Задачами работы были исследования кислотно-основных и адсорбционных свойств обозначенных объектов, закономерности их изменений, избирательной чувствительности поверхностей к газам различной электронной природы, а также возможности использования изучаемых твердых растворов в полупроводниковом газовом анализе, создании для него определенного фундамента.
МЕТОДИКА ЭКСПЕРИМЕНТА
Объектами исследований были тонкодисперсные порошки (Sуд = 0.3–0.81 м2/г) и тонкие пленки (d = 20–100 нм) твердых растворов (GaSb)х(ZnTe)1 –х (х = 5, 10, 15, 90, 95 моль %) и исходных бинарных соединений (GaSb, ZnTe). Порошки твердых растворов получали методом изотермической диффузии, модернизированным с учетом физико-химических свойств исходных бинарных соединений, по отработанным режиму и программе температурного нагрева [1]. Для получения пленок применяли дискретное термическое напыление в вакууме (Тконд = 298 К, Р = 1.33 × 10–4 Па) на электродные площадки пьезокварцевых резонаторов АТ-среза [2, 3] с последующим отжигом в парах исследуемых объектов. Толщину пленок оценивали по изменению частоты пьезокварцевого резонатора, с помощью интерферометрии и исходя из условий напыления [1, 4].
О завершении синтеза, получении и структуре твердых растворов судили по результатам рентгенографических исследований в сочетании с результатами электрофизических исследований. Критериями были относительное положение и распределение по интенсивностям основных линий на дифрактограммах, зависимости от состава системы параметра решетки а, межплоскостных расстояний dhkl, рентгеновской плотности ρr, удельной электропроводности σ.
Рентгенографические исследования выполняли при комнатной температуре на приборах ДРОН-3 (CuKα,β-излучение, λ = 0.154178 и 0.139217 нм) и D8 Advance POWDER X-ray Diffractometer фирмы Bruker AXS (CuKα-излучение, λ = = 0.154178 нм) в области больших углов [5, 6] с использованием позиционно-чувствительного детектора Lynxeye, а также базы данных порошковой дифракции ICDDIPDF-2 и программы TOPAS 3.0 (Bruker) для расшифровки дифрактограмм и уточнения параметров решетки соответственно.
Удельную электропроводность определяли методом Ван дер Пау, представляющим собой видоизмененный четырехзондовый метод [7], кислотно-основные свойства поверхностей изучали методами гидролитической адсорбции (оценка рН изоэлектрического состояния – рНизо) [8], неводного кондуктометрического титрования [9], механохимии в сочетании со спектроскопией многократно нарушенного полного внутреннего отражения (МНПВО) [10, 11].
При использовании метода гидролитической адсорбции находили рН среды, в которой адсорбенты-амфолиты отщепляют равные (незначительные) количества ионов Н+ и ОН– [8]. В роли таких адсорбентов выступали GaSb, ZnTe и твердые растворы с характерными изоэлектрическими точками, отвечающими минимуму растворимости. По значениям рНизо судили о средней силе и соотношении кислотных и основных центров.
Методом неводного кондуктометрического титрования [9] определяли электропроводность равновесной смеси (диспергированный компонент системы GaSb–ZnTe + растворитель + метилэтилкетон) при добавлении титранта (этилата калия), строили дифференциальные кривые зависимости удельной электропроводности от объема титранта, на основе которых рассчитывали концентрацию кислотных центров (для отдельных пиков и общую, в расчете на массу навески [г-экв/г]).
Особенность используемого механохимического метода в сочетании с ИК-спектроскопией МНПВО заключается в возможности работать со свежеобразованными поверхностями, следить за их поведением в выбранной реакционной среде (Н2О) по продуктам ее взаимодействия с поверхностными атомами полупроводников – компонентов изучаемой системы – и, таким образом, более четко выявлять природу активных центров, промежуточных соединений, а также возможность активации поверхностей [11].
Адсорбцию газов (NH3, CO, O2) изучали методом пьезокварцевого микровзвешивания (чувствительность 1.23 × 10–11 г/(см2 · Гц) [4] в интервалах температур 252–393 К и давлений 1.1–10.7 Па) [4]. Газы-адсорбаты получали по известным методикам [12].
Воспроизводимость и точность экспериментальных данных проверяли по результатам параллельных измерений с использованием методов математической статистики и обработки результатов количественного анализа. Статистическую обработку полученных численных значений, расчет погрешностей измерений, построение и обработку графических зависимостей проводили с использованием компьютерных программ Stat-2, Microsoft Exel и Origin.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По результатам рентгеновских исследований [13] в системе GaSb–ZnTe (при указанных составах) образуются твердые растворы замещения с кубической структурой сфалерита. В пользу этого свидетельствуют указанные выше критерии: относительное положение и распределение по интенсивностям основных линий на дифрактограммах бинарных соединений и твердых растворов, плавные кривые зависимостей от состава параметра кристаллической решетки а, межплоскостных расстояний dhkl, рентгеновской плотности ρr и удельной электропроводности σ (табл. 1, рис. 1).
Таблица 1.
Параметр решетки (а), межплоскостные расстояния (dhkl) и рентгеновская плотность (ρr) компонентов системы GaSb–ZnTe
| ХZnTe, (мольная доля ZnTe) | а, Å | dhkl, Å | ρr, г/см3 |
|---|---|---|---|
| 0 | 6.1301 | 1.841 | 5.619 |
| 0.05 | 6.1153 | 1.842 | 5.563 |
| 0.10 | 6.1145 | 1.847 | 5.566 |
| 0.85 | 6.1146 | 1.846 | 5.599 |
| 0.90 | 6.1118 | 1.845 | 5.609 |
| 0.95 | 6.1090 | 1.843 | 5.619 |
| 1.00 | 6.0850 | 1.825 | 5.721 |
Рис. 1.
Зависимости от состава компонентов системы GaSb–ZnTe: рН изоэлектрического состояния поверхностей (1); рентгеновской плотности ρr (2); удельной электропроводности σ (3).
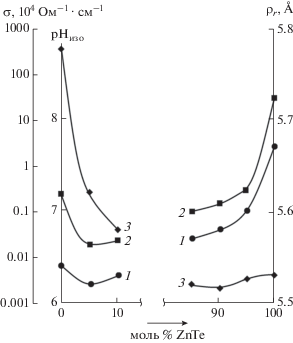
Основные результаты исследований кислотно-основных свойств поверхностей компонентов системы GaSb–ZnTe представлены на рис. 1–3. Значения рН изоэлектрического состояния поверхностей в основном укладываются в слабокислую область с переходом (применительно к ZnTe) в слабощелочную: в ряду GaSb → → (GaSb)х(ZnTe)1 –х → ZnTe они изменяются от 6.2 до 7.7. Плавный характер изменения рНизо с составом дополнительно подтверждает образование в системе GaSb–ZnTe твердых растворов замещения.
Рис. 2.
Дифференциальные кривые неводного кондуктометрического титрования экспонированных на воздухе компонентов системы GaSb–ZnTe: GaSb (1); твердого раствора (GaSb)0.90(ZnTe)0.10 (2).
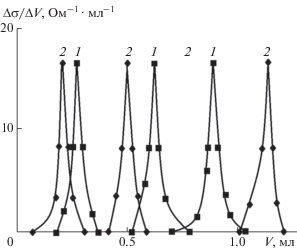
Рис. 3.
Кинетические изотермы диспергирования в воде экспонированных на воздухе крупнодисперсных порошков GaSb (1), (GaSb)0.15(ZnTe)0.85 (2), (GaSb)0.10(ZnTe)0.90 (3) и ZnTe (4).
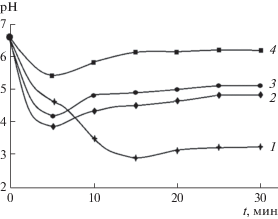
В соответствии с приведенными данными логично считать ответственными за кислотно-основное состояние поверхностей, наряду с центрами Льюиса, играющими основную роль, и центры Бренстеда, на что указывают также результаты неводного кондуктометрического титрования и механохимических исследований (рис. 2, 3). Действительно, дифференциальные кривые неводного кондуктометрического титрования компонентов системы содержат по три пика, что подтверждает существование на поверхностях кислотных центров различных типов. Исходя из накопленного опыта исследования поверхностных свойств алмазоподобных полупроводников [1, 14], можно предположить, что что за первые пики (рис. 2) ответственны льюисовские кислотные центры (координационно-ненасыщенные атомы), за вторые и третьи – бренстедовские (адсорбированные молекулы Н2О, группы ОН– и другие функциональные группы). Подтверждением является рост рНизо с увеличением содержания в системе ZnTe (рис. 1), а также рост со временем рН среды при механохимическом диспергировании, особенно теллурида цинка и твердых растворов с его избытком (рис. 3). При диспергировании в воде бинарных компонентов и твердых растворов системы GaSb–ZnTe, согласно [7, 11], возможно образование с участием координационно-ненасыщенных атомов (Sb, Te) кислот Н3SbO4 и Н2TeO4 на вновь созданных поверхностях. Они под влиянием механохимического воздействия переходят в объем с отщеплением своих остатков ${\text{SbO}}_{{\text{4}}}^{{{\text{3}} - }},$ ${\text{TeO}}_{{\text{4}}}^{{{\text{2}} - }}$ и их возможным последующим гидролизом [1, 11]. Поэтому при диспергировании среда вначале подкисляется, а по истечении определенного отрезка времени (10–20 мин) подщелачивается (рис. 3).
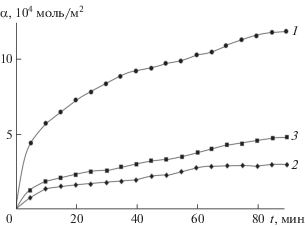
Экспериментальные зависимости адсорбции αp = f(T), αT = f(p), αT = f(t) при внешнем сходстве указывают на протекание химической активированной адсорбции начиная с 313, 323–343, 363 К для NH3, CO, O2 соответственно (рис. 4, 5). Химическую активированную природу адсорбции в обозначенных температурных условиях подтверждают рассчитанные величины энергии активации Еα, теплоты qα и изменения энтропии газов ‒∆Sα адсорбции (с поправкой для алмазоподобных полупроводников). Для различных газов и при различных заполнениях поверхностей они укладываются в интервалы: Еα = 34.9–109.4 кДж/моль, qα = = 2.1–17.6 кДж/моль, –∆Sα = 38.9–74.7 Дж/(моль ⋅ К). Рост энергии активации и уменьшение теплоты адсорбции с ростом степени заполнения поверхностей дополнительно подтверждает присутствие на них различных по силе и энергетическому состоянию активных центров, выявленное в результате исследований кислотно-основных свойств. Наиболее активным адсорбатом оказался аммиак: ${{\alpha }_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$ на порядок выше αCO и ${{\alpha }_{{{{{\text{O}}}_{{\text{2}}}}}}}$ (рис. 4).
Рис. 4.
Изобары адсорбции NH3 (1), CO (2) и O2 (3) на поверхности твердого раствора (GaSb)0.90(ZnTe)0.10 при Рн = 8 Па.
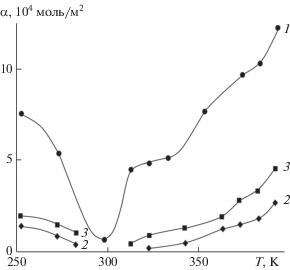
Рис. 5.
Кинетические изотермы адсорбции NH3 (1), CO (2) и O2 (3) на поверхности твердого раствора (GaSb)0.90(ZnTe)0.10 при Рн = 8 Па, Т = 393 К.
На основе совокупного рассмотрения результатов исследований адсорбционных и кислотно-основных свойств поверхностей компонентов системы GaSb–ZnTe, с учетом электронного строения молекул адсорбатов (NH3, CO, O2) можно высказать следующие соображения о механизмах их адсорбционных взаимодействий. А именно, адсорбция NH3, CO протекает по донорно-акцепторному механизму с участием в качестве акцепторов преимущественно поверхностных атомов Ga, Zn, а в качестве доноров – молекул адсорбатов. Адсорбция кислорода – типичного акцептора электронов – протекает по ионно-радикальному механизму [1, 11, 14, 15].
В итоге при детальном анализе полученных результатов были выявлены интересные, научно и практически значимые закономерности, и корреляции. В ряду GaSb → (GaSb)х(ZnTe)1 –х → ZnTe с увеличением содержания в системе ZnTe плавно нарастают значения рН изоэлектрического состояния поверхностей (рНизо), что свидетельствует об уменьшении силы кислотных центров и переходе их из слабокислой области в слабощелочную. С этим согласуется (что дополнительно свидетельствует об уменьшении силы кислотных центров) аналогичное “поведение” характеристик акцепторных свойств катионов – потенциалов ионизации (IGa, IZn), отношений заряда к радиусу (е/r = 4/8 для Ga и 2/4 для Zn), а также рентгеновской плотности ρr (рис. 1) при переходе в системе GaSb–ZnTe от полупроводника типа АIIIВV (GaSb) к полупроводнику типа АIIВVI (ZnTe).
Отмеченные тенденции уменьшения силы кислотных центров (кислотности) поверхностей компонентов системы GaSb–ZnTe с увеличением содержания в ней ZnTe (с переходом в слабощелочную область) коррелируют с результатами механохимических исследований и неводного кондуктометрического титрования. Кинетические изотермы диспергирования указали на повышение рН среды по истечении определенного промежутка времени (10–20 мин), особенно заметное при диспергировании ZnTe и твердых растворов с его избытком (рис. 3). Дифференциальные кривые неводного кондуктометрического титрования, содержащие по три пика, свидетельствуют о том, что кислотно-основное состояние поверхностей формируют не только центры Льюиса, но и центры Бренстеда, возрастание вклада которых и явилось причиной возрастания основности поверхностей и перехода из слабокислой области в слабощелочную. Это нашло отражение в зависимостях рНизо= f(хZnTe), рНсреды = f(t), ∆σ/∆V = f(V) (рис. 2, 3) (t – время [мин], σ – электропроводность среды [Ом–1 ⋅ см–1], V – объем титранта (этилата калия)).
Адсорбционные характеристики (величина адсорбции α, энергия активации Еα и теплота адсорбции qα) с изменением состава системы GaSb–ZnTe изменяются экстремально (например, рис. 6). При четкой корреляции между адсорбционными характеристиками (росту α отвечает рост Еα и уменьшение qα) наблюдается их корреляция с кислотно-основными характеристиками: максимуму Собщ отвечает αmax, уменьшению рНизо – увеличение α (рис. 6). На корреляцию между адсорбционными и кислотно-основными характеристиками указывают рост Еα и падение qα с ростом степени заполнения поверхностей, что дополнительно подтверждает наличие на поверхностях компонентов системы различных по силе и энергетическому состоянию активных центров.
Рис. 6.
Зависимости от состава компонентов системы GaSb–ZnTe: общей концентрации кислотных центров Собщ (1); величины адсорбции аммиака ${{\alpha }_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$ (2); рН изоэлектрического состояния поверхностей – рНизо (3).
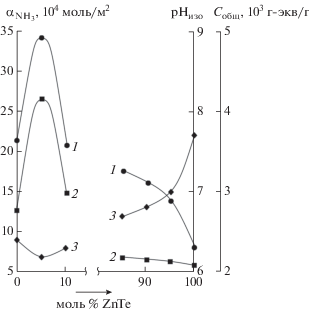
Из корреляций между рНизо= f(хZnTe) и ρr= = f(хZnTe), α = f(хZnTe) и рНизо= f(хZnTe) вытекает зависимость α = f(ρr), которая может быть использована при предварительной оценке чувствительности поверхностей новых материалов и, соответственно, при предварительной оценке возможностей их использования в полупроводниковом газовом анализе. Действительно, чем меньше ρr, тем меньше координационная насыщенность атомов, преимущественно выступающих в роли кислотных центров Льюиса и адсорбционных центров по отношению к молекулам типа NH3, CO, тем больше α и тем больше адсорбционная чувствительность поверхностей по отношению к соответствующему газу.
ЗАКЛЮЧЕНИЕ
Комплексно изучены кислотно-основные и адсорбционные (по отношению к NH3, CO, O2) свойства полученных твердых растворов (GaSb)х(ZnTe)1 –х и бинарных компонентов системы GaSb–ZnTe. Показаны преимущественно слабокислый характер их поверхностей с переходом в слабощелочной (применительно к ZnTe) и повышенная адсорбируемость аммиака, позволяющая ожидать аналогичное поведение и других основных газов. Высказаны соображения о происхождении и относительном вкладе активных центров.
Адсорбция газов (NH3, CO, O2) в соответствии с опытными зависимостями, результатами определения значений энергии активации, теплоты и изменения энтропии адсорбции, с электронной структурой молекул адсорбатов начиная с температур 313, 323–343, 363 К (отвечающих указанным газам) имеет химическую активированную природу. Адсорбция NH3, CO протекает по донорно-акцепторному механизму, адсорбция кислорода – по ионно-радикальному.
Установлены закономерности изменений кислотно-основных и адсорбционных свойств с изменением состава компонентов системы GaSb–ZnTe. Они носят как плавный характер, так и экстремальный, обусловленный сложностью внутренних процессов, сопровождающих формирование твердых растворов.
Выявлены следующие серии корреляций между зависимостями: рНизо= f(хZnTe), рНсреды = f(t), ∆σ/∆V = f(V) (между кислотно-основными свойствами); α = f(хZnTe), Еα= f(хZnTe), qα= f(хZnTe) (между адсорбционными свойствами); α = f(хZnTe), Собщ= f(хZnTe) и рНизо = f(хZnTe) (между адсорбционными и кислотно-основными свойствами); рНизо= f(хZnTe), ρr= f(хZnTe) (между поверхностными и объемными свойствами). На основе корреляций между зависимостями рНизо= f(хZnTe) и ρr= = f(хZnTe), α = f(хZnTe) и рНизо = f(хZnTe) выявлена зависимость α = f(ρr), облегчающая поиск новых материалов для сенсоров.
Список литературы
Кировская И.А. Физико-химические свойства бинарных и многокомпонентных алмазоподобных полупроводников. Новосибирск: СО РАН, 2015. 367 с.
Тонкие пленки антимонида индия. Получение, свойства применение / Ред. Касьян В.А. и др. Кишинев: Штиинца, 1989. 162 с.
Гладких Н.П. Структура тонких пленок. Харьков: ХНУ, 2006. 185 с.
Кировская И.А. Адсорбционные процессы. Иркутск: Изд-во ИГУ, 1995. 300 с.
Горелик С.С., Расторгуев П.Н., Скаков Ю.А. Рентгенографические и электронно-микроскопический анализ. М.: Металлургия, 1970. 107 с.
Смыслов Е.Ф. // Заводская лаборатория. Диагностика материалов. 2006. Т. 72. № 5. С. 33.
Павлов Л.П. Методы измерения параметров полупроводниковых материалов. М.: Высшая школа, 1975. 203 с.
Майдановская Л.Г. // Каталитические реакции в жидкой фазе. Алма-Ата: Изд-во КазССР, 1963. С. 212.
Крешков А.П., Быкова Л.Н., Казарян Н.А. Кислотно-основное титрование в неводных растворах. М.: Химия, 1967. 192 с.
Литтл Л. Инфракрасные спектры адсорбированных молекул. М.: Мир, 1969. 514 с.
Кировская И.А. Поверхностные явления. Омск: Изд-во ОмГТУ, 2001. 175 с.
Рапопорт Ф.М., Ильинская А.А. Лабораторные методы получения чистых газов. М.: Госхимиздат, 1963. 300 с.
Новгородцева Л.В., Глушакова Ю.Д. Получение и идентификация твердых растворов системы GaSb–ZnTe. Матер. XI Междунар. конф. “Студент и научно-технический прогресс”. Новосибирск, 2002. С. 174.
Кировская И.А. Адсорбенты на основе систем типа АIIBVI–АIIBVI – материалы для полупроводникового газового анализа. Новосибирск: Изд-во СО РАН, 2018. 267 с.
Кировская И.А. Твердые растворы бинарных и многокомпонентных полупроводниковых систем. Омск: Изд-во ОмГТУ, 2010. 400 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


