Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 9, стр. 32-39
Синтез металл-органического координационного полимера UiO-66 в виде наночастиц с модифицированной поверхностью
В. В. Бутова a, *, О. А. Бурачевская a, П. В. Медведев a, И. Е. Горбань a, А. А. Кужаров a, Д. Б. Трушина b, c, М. А. Солдатов a
a Международный исследовательский институт интеллектуальных материалов,
Южный федеральный университет
344090 Ростов-на-Дону, Россия
b Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Россия
c Первый Московский государственный медицинский университет им. И.М. Сеченова
119991 Москва, Россия
* E-mail: vbutova@sfedu.ru
Поступила в редакцию 27.01.2021
После доработки 14.02.2021
Принята к публикации 20.02.2021
Аннотация
Приводится методика синтеза, позволяющая получить металл-органический координационный полимер UiO-66 в виде наночастиц с модифицированной поверхностью. Отличительной особенностью разработанной методики является то, что модификация происходит непосредственно в ходе синтеза. В качестве органического полимера, покрывающего поверхность наночастиц UiO-66, выбран биосовместимый полиэтиленгликоль (ПЭГ). Исследовано влияние степени полимеризации ПЭГ на размер, морфологию и заряд поверхности наночастиц UiO-66. Наличие молекул ПЭГ подтверждено методом ИК-спектроскопии. Полученные материалы однофазны, характеризуются высокой степенью кристалличности. Размер частиц варьируется от 80 до 120 нм в зависимости от вида, использованного ПЭГ. Высокий заряд поверхности в водной среде (ζ-потенциал более 20 мВ) показывает возможность создания стабильной суспензии. Таким образом, полученные материалы перспективны как наноконтейнеры для доставки биологически активных веществ.
ВВЕДЕНИЕ
Металл-органические координационные полимеры (МОКП) представляют собой класс пористых материалов с модульной структурой [1, 2]. Их строение можно представить, как сочетание органических и неорганических составных частей, связанных ковалентными связями. Неорганические части представляют собой кластеры металлов, координированных кислородом или азотом (реже – другими неметаллами). Органические молекулы, связывающие эти кластеры в единый каркас, называют линкерами [3]. Таким образом, размер, форма и функциональность пор МОКП определяются сочетанием органической и неорганической составных частей, что открывает широкие возможности для создания материалов с заданными свойствами. Такая гибкость структуры позволяет применять МОКП в самых разных областях: для хранения и разделения газов, селективного катализа, очистки воды и воздуха, как части химических источников тока [4, 5]. Свойства материалов необходимо подбирать под каждую задачу. Последнее время большие успехи достигнуты в применении МОКП для биомедицинских задач, в частности для адресной доставки лекарственных средств. Критически важными свойствами для данного применения являются наноразмерность, устойчивость и низкая токсичность МОКП.
Одним из видов МОКП, удовлетворяющим данным требованиям, является UiO-66. Он состоит из цирконий-кислородных кластеров, соединенных молекулами терефталевой кислоты в трехмерный кубический каркас (рис. 1). Каждый кластер сформирован шестью ионами циркония, соединенными мостиковыми OH-группами (µ3-OH), которые могут отщеплять водород, переходя в мостиковые кислороды (µ3-O). Состав кластера меняется согласно следующей схеме: ${\text{Z}}{{{\text{r}}}_{{\text{6}}}}{{{\text{O}}}_{{\text{4}}}}\left( {{\text{OH}}} \right)_{4}^{{12 + }}$ → ${\text{Z}}{{{\text{r}}}_{{\text{6}}}}{\text{O}}_{6}^{{12 + }}.$ Каждый цирконий-кислородный кластер координирован 12 молекулами линкеров. Такая высокая связанность вместе с прочными ковалентными связями Zr–O приводит к химически и термически стойкому материалу. Каркас UiO-66 содержит поры двух видов – тетраэдрические и октаэдрические – и имеет высокую удельную площадь поверхности (1125 м2/г) [6].
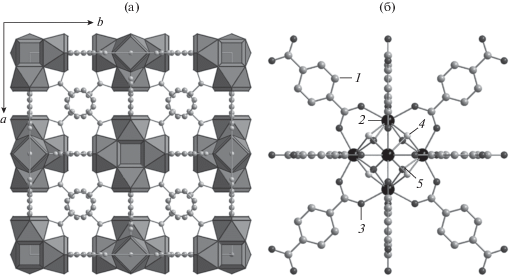
Рис. 1.
Модель структуры UiO-66: а – кубическая элементарная ячейка (показаны циркониево-кислородные полиэдры, шариками обозначены атомы углерода); б – модель цирконий-кислородного кластера, координированного молекулами терефталевой кислоты (показаны атомы углерода (1), циркония (2), кислорода (3), оба варианта мостиковых групп µ3-OH (4) и µ3-O (5)).
Для получения UiO-66 в виде наночастиц обычно применяют метод координационных модуляторов. Согласно данному методу, в реакционную смесь вводят дополнительную монокарбоновую или неорганическую кислоту [7–9]. В качестве модуляторов чаще всего используют бензойную, соляную или уксусную кислоты. Уксусную кислоту применяли для получения наночастиц UiO-66 в [10], которые затем модифицировали поливинилпирролидином, чтобы они могли объединяться в двумерные слои. Производная UiO-66 с азидным фрагментом была получена с использованием того же модулятора [11]. Поверхность частиц далее была покрыта молекулами ДНК, что увеличило стабильность коллоида в физрастворе и повысило клеточное поглощение по сравнению с немодифицированными частицами. В [12] получали наночастицы UiO-66, в качестве модуляторов одновременно выступали бензойная и соляная кислоты. Далее наночастицы использовали для постсинтетического обмена – линкеры заменяли молекулами фотосенсибилизаторов и применяли полученный материал в фотодинамической терапии.
Покрытие поверхности кристаллов МОКП биополимерами может значительно улучшить их свойства. Так, покрытие поверхности UiO-66 полиэтиленгликолем (ПЭГ) позволило добиться контролируемого высвобождения модельного флуоресцентного красителя. При pH 7.4 цепочки ПЭГ блокируют взаимодействие среды с поверхностью наночастиц, тогда как при pH 5.5 загруженные молекулы высвобождаются. Кроме того, покрытие ПЭГ привело к повышенному поглощению материала клетками [13]. В [14] сообщается о радиоактивном аналоге – UiO-66 с изотопом 89Zr, излучающем позитроны. Поверхность наночастиц была дополнительно функционализирована ПЭГ с группой пирена и конъюгирована с пептидным лигандом для накапливания в опухолях молочной железы. Пористый каркас UiO-66 насыщали доксорубицином, служившим как терапевтическим средством, так и визуализатором флуоресценции в этом исследовании.
В настоящей работе представлена методика, позволяющая получить UiO-66 в виде наночастиц, поверхность которых модифицирована ПЭГ, причем синтез и модификация происходят одновременно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез
Исходные реактивы ZrCl4, терефталевая кислота (BDC), диметилформамид (ДМФА), изопропиловый спирт (CH3CH(OH)CH3) производства Alfa Aesar применяли без дополнительной очистки. Также использовали полиэтиленгликоли (ПЭГ) со средней молекулярной массой 200 (PEG200), 600 (PEG600) и 1500 (PEG1500) производства Sigma-Aldrich. Деионизированную воду получали из дистиллированной воды в системе очистки Simplicity UV.
Для получения немодифицированного образца UiO-66 был выбран разработанный ранее авторами метод, позволяющий получить МОКП в виде наночастиц [15]. Для этого использована добавка бензойной кислоты, выполняющей роль модулятора. Модифицированные образцы получали таким же методом, но с добавкой ПЭГ. Тетрахлорид циркония (0.1507 г) растворяли в ДМФА (15 мл), добавляли 35 мкл воды, затем вносили бензойную кислоту (0.7890 г) и перемешивали с помощью магнитной мешалки до полного растворения. Далее в полученный прозрачный раствор вносили соответствующей ПЭГ (табл. 1). Последней в реакционную смесь добавляли терефталевую кислоту (0.1073 г), перемешивали до полного растворения и помещали в предварительно нагретую до 120°C печь на 24 ч. Полученные порошки отделяли центрифугированием, тщательно промывали ДМФА, изопропанолом, а затем сушили при 60°С на воздухе в течение 16 ч.
МЕТОДИКИ АНАЛИЗА
Дифрактограммы были получены на порошковом рентгеновском дифрактометре Bruker D2 PHASER с медным анодом (CuKα, λ = 1.5417 Å) в диапазоне 2θ от 5° до 50° с шагом 2θ = 0.01°. ИК-спектры измеряли на спектрометре Bruker Vertex 70 в геометрии ATR (Attenuated Total Reflectance) с использованием MCT-детектора и приставки Bruker Platinum ATR. Спектры измеряли в диапазоне от 5000 до 300 см–1 с разрешением 1 см–1 в ходе 64 сканирований. Образец сравнения – воздух. Изображения просвечивающей электронной микроскопии (ПЭМ) были получены в микроскопе FEI Tecnai G2 Spirit TWIN с ускоряющим напряжением 80 кВ. Z-потенциал и значения pH суспензий были измерены на анализаторе ζ-потенциала частиц Stabino (титратор заряда частиц) для анализа устойчивости коллоидных частиц и суспензий. Для приготовления суспензии соответствующий порошкообразный образец (0.02 г) помещали в 10 мл деионизированной воды или физраствора, а затем гомогенизировали в течение 30 мин в ультразвуковой ванне. Размер частиц в суспензии определяли с использованием анализатора NANO-flex на основе теории динамического рассеяния света. Измерения адсорбции азота выполнены с помощью системы определения площади поверхности и измерения пористости твердых материалов ASAP 2020 (Micrometrics, США). Для расчета удельной площади поверхности использована модель Брунауэра–Эммета–Теллера.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
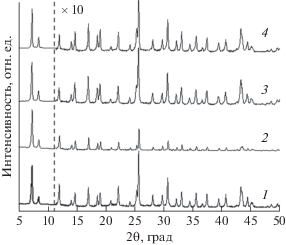
Рентгеновские дифрактограммы приведены на рис. 2. Как видно из приведенных данных, добавка ПЭГ в ходе синтеза не оказывает заметного влияния на фазовый состав и степень кристалличности образцов. Все профили могут быть описаны в рамках кубической симметрии, пространственная группа $Fm\bar {3}m$ (№ 225). Параметры элементарной ячейки образцов UiO-66, 200, 600 и 1500 близки и составили 20.7589(4), 20.7140(16), 20.7700(6) и 20.7659(7) Å соответственно.
Рис. 2.
Дифрактограммы образцов UiO-66 (1), 200 (2), 600 (3) и 1500 (4). Профили смещены по оси y и после пунктирной линии интенсивности умножены на 10 для лучшего представления данных.
Согласно ПЭМ-изображениям (рис. 3) форма частиц сохраняется независимо от введенного ПЭГ. Так, образец UiO-66 представляет собой кристаллы октаэдрической формы, что соответствует литературным данным. Образцы 200 и 600 также представлены октаэдрическим частицами, однако можно заметить, что грани кристаллов сглажены, что может свидетельствовать о формировании аморфного слоя ПЭГ на поверхности частиц. Все три образца UiO-66, 200 и 600 демонстрируют низкую степень агрегации. В отличие от них образец 1500 представлен крупными агрегатами, состоящими из октаэдрических кристаллов.
Также можно наблюдать, что введение ПЭГ в ходе синтеза приводит к изменению среднего размера частиц. Средний размер частиц в образце UiO-66, полученном без введения ПЭГ, составил 66 нм. Введение в ходе синтеза PEG200 и PEG600 несколько увеличивает средний размер частиц, однако они остаются монодисперсными (рис. 4). Средний размер частиц в образцах 200 и 600 по данным ПЭМ составил 78 и 91 нм. Увеличение размера частиц хорошо согласуется с модификацией поверхности полимерными молекулами. Молекулы с большей длиной углеродной цепи приводят к большему увеличению среднего размера частиц. В отличие от образцов UiO-66, 200 и 600 образец 1500, полученный с полимером PEG1500, демонстрирует не только больший размер частиц, но и более широкое распределение их по размерам. Средний размер частиц образца 1500 составил 117 нм. Размер частиц, определенный методом динамического рассеяния света, больше размеров, полученных ПЭМ (рис. 4в). Это связано с методикой измерения, чувствительной к образованию агрегатов и сольватных оболочек. Однако тенденция сохраняется – при увеличении молекулярной массы ПЭГ увеличивается размер частиц. Средний размер частиц в водной суспензии по данным динамического рассеяния света составил 180, 210 и 355 нм для образцов 200, 600 и 1500 соответственно. Средний размер частиц в исходном образце UiO-66 200 нм. Можно предположить, что покрытие полиэтиленгликолем уменьшает степень агрегации и толщину сольватной оболочки частиц.
Рис. 4.
Распределение частиц по размерам, полученное по данным ПЭМ для 200 частиц в каждом образце (а, б) и методом динамического рассеяния света в водной суспензии (в) для образцов: а – UiO-66 (1), 200 (2); б – 600 (3), 1500 (4); в – UiO-66 (1), 200 (2), 600 (3), 1500 (4).

Для измерения кислотности и ζ-потенциала образцов суспензию готовили в воде и в физрастворе. Кислотность суспензий для каждого образца значительно не изменялась и в воде, и в физрастворе, а на значения ζ-потенциала среда оказала заметное влияние. Суспензия UiO-66 достаточно кислая. Это объясняется строением цирконий-кислородных кластеров, образующих кристаллическую решетку МОКП. Ионы циркония в ней связаны мостиковыми µ3-OH группами, определяющими кислотные свойства всего материала (pKa = 3.52) [16, 17]. При модификации МОКП молекулами ПЭГ pH среды увеличивается от 3 у немодифицированного UiO-66 до 4.5–5.5 у образцов 200, 600 и 1500. Так как ПЭГ сам по себе является слабой кислотой и не может значительно влиять на значение кислотности, подобные изменения pH можно объяснить модификацией поверхности кристаллов. Молекулы полимера частично блокируют доступ к кислотным группировкам µ3-OH исходного МОКП, что уменьшает его кислотные свойства.
Покрытие кристаллов МОКП молекулами ПЭГ подтверждает также и изменение ζ-потенциала (рис. 5). Как можно наблюдать из диаграммы, модификация поверхности приводит к снижению значения ζ-потенциала от 41 мВ у UiO-66 до 21, 26 и 27 мВ у образцов 200, 600 и 1500 в водной среде соответственно. В физрастворе тенденция та же – ζ-потенциал уменьшается от 3 мВ у UiO-66 до 2 мВ у модифицированных образцов. Высокий ζ-потенциал UiO-66 в воде связан в первую очередь с депротонированием циркониевых кластеров [16]. Ионы водорода, образующиеся при диссоциации µ3-OH групп и обуславливающие низкие значения pH суспензии UiO-66, образуют двойной слой на поверхности отрицательно заряженного каркаса. Соответственно, снижение заряда поверхности хорошо согласуется с уменьшением доступности групп µ3-OH после модификации поверхности ПЭГ. Однако в целом высокие значения ζ-потенциала в водной среде являются показателем стабильности коллоидного раствора. При переходе к суспензиям в физрастворе наблюдается снижение ζ-потенциала при сохранении значений pH. Это связано, по-видимому, с влиянием дополнительных ионов Na+ и Cl– в растворе, что влияет на двойной слой [18].
Рис. 5.
Диаграмма, показывающая изменение pH и ζ-потенциала суспензии синтезированных образцов UiO-66 (1), 1500 (2), 600 (3) и 200 (4) в водной среде (а) и в физрастворе (б).

Были измерены ИК-спектры всех синтезированных образцов (рис. 6). В области “отпечатка пальца” спектры идентичны, так как данный диапазон обусловлен колебаниями каркаса UiO-66. Пики при 505 и 550 см–1 относят к колебаниям связей циркония с карбоксильными группами линкера [6]. Небольшой пик при 613 см–1 можно отнести к деформационным колебаниям бензольных колец линкеров. Пик при 740 см–1 обусловлен колебаниями групп С–Н и О–Н [15]. Симметричные и асимметричные колебания карбоксильных групп дают пики при 1390 и 1585–1660 см–1 соответственно [19]. Бензойная кислота, использованная в ходе синтеза МОКП, остается в структуре и дает пики при 720 и 1020 см–1 [15]. Переходя к области 2500–3900 см–1, можно заметить отличия в спектрах модифицированных и исходного образцов. Широкий пик при 3000–3600 см–1 относят к адсорбированной в порах воде. Общий для всех спектров пик при 3675 см–1 приписывают колебаниям свободных μ3-мостиковых гидроксилов, принадлежащих кластерам циркония [19, 20]. Пики при 3065 и 2935 см–1 относятся к колебаниям связей С–Н и являются общими для всех образцов [20]. Спектры образцов 200, 600 и 1500 содержат новые пики, не наблюдавшиеся для образца UiO-66 и обусловленные наличием слоя ПЭГ, покрывающего частицы. Так, пики при 3650 и 2955 см–1 относятся к гидроксильным группам, связанным водородными связями, пики при 2930 и 2850 см–1 обусловлены колебаниями СН2-групп ПЭГ [21].
Рис. 6.
ИК-спектры образцов UiO-66 (1), 200 (2), 600 (3) и 1500 (4) в области: а – 400–2000; б – 2500–3900 см–1.

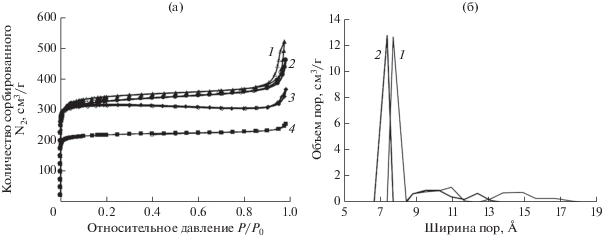
Для успешного применения материалов в биомедицинской области необходимо также сохранение доступности пор для гостевых молекул. Для подтверждения высокой пористости модифицированных МОКП были измерены изотермы адсорбции–десорбции азота (рис. 7а). Изотермы образцов 200, 600 и 1500 имеют сходную форму с UiO-66. Ее можно отнести к типу I согласно классификации ИЮПАК. Такая форма типична для микропористых материалов. Удельные площади поверхности образцов UiO-66, 200, 600 и 1500 составили 1355, 1295, 1285 и 880 м2/г. Таким образом, наблюдается незначительное снижение пористости образцов 200 и 600 по сравнению с немодифицированным UiO-66, в то время как для образца 1500 наблюдается снижение пористости на 35%. Кроме того, на распределении пор по размерам можно заметить небольшое уменьшение диаметра пор образца 200 по сравнению с UiO-66. Это свидетельствует о декорировании поверхности пор молекулами ПЭГ (рис. 7б).
Рис. 7.
Изотермы адсорбции–десорбции азота (а) образцов UiO-66 (1), 200 (2), 600 (3) и 1500 (4); заполненные символы обозначают ветви адсорбции, пустые – десорбции. Распределение пор по размерам (б) образцов UiO-66 (1) и 200 (2), рассчитанное с помощью теории функционала плотности согласно модели цилиндрических пор.
ЗАКЛЮЧЕНИЕ
В ходе настоящего исследования был разработан метод синтеза UiO-66, позволяющий получить наночастицы МОКП с модифицированной поверхностью. В качестве модифицирующих полимеров были использованы ПЭГ со средней молекулярной массой 200, 600 и 1500. Было показано, что введение данных полимеров не приводит к изменению фазового состава или степени кристалличности продукта. Однако в зависимости от степени полимеризации ПЭГ изменяется средний размер частиц, а именно увеличение молекулярной массы ПЭГ ведет к увеличению размера частиц от 80 до 120 нм. С помощью ИК-спектроскопии было подтверждено наличие молекул ПЭГ в образцах 200, 600 и 1500. Было показано, что модификация поверхности молекулами ПЭГ уменьшает доступность µ3-OH-групп циркониевых кластеров каркаса UiO-66. Это приводит к уменьшению концентрации ионов водорода в водных суспензиях и уменьшению ζ-потенциала. Однако его значение все еще остается высоким, что позволяет ожидать формирование стабильного коллоидного раствора.
Таким образом, разработанная методика может быть использована для получения биокомпозитов или контейнеров для лекарственных средств на основе модифицированных пористых наночастиц UiO-66.
Список литературы
Butova V.V., Soldatov M.A., Guda A.A., Lomachenko K.A., Lamberti C. // Russ. Chem. Rev. 2016. V. 85. № 3. P. 280.https://doi.org/10.1070/RCR4554
Yaghi O.M., O’Keeffe M., Ockwig N.W., Chae H.K., Eddaoudi M., Kim J. // Nature. 2003. V. 423. № 6941. P. 705.https://doi.org/10.1038/nature01650
Tranchemontagne D.J., Mendoza-Cortes J.L., O’Keeffe M., Yaghi O.M. // Chem. Soc. Rev. 2009. V. 38. № 5. P. 1257. https://doi.org/10.1039/B817735J
Bai S., Liu X., Zhu K., Wu S., Zhou H. // Nature Energy. 2016. V. 1. № 7. P. 16094. https://doi.org/10.1038/nenergy.2016.94
Li W., Hu S., Luo X., Li Z., Sun X., Li M., Liu F., Yu Y. // Adv. Mater. 2017. V. 29. № 16. P. 1605820.https://doi.org/10.1002/adma.201605820
Butova V.V., Vetlitsyna-Novikova K.S., Pankin I.A., Charykov K.M., Trigub A.L., Soldatov A.V. // Microporous Mesoporous Mater. 2020. V. 296. P. 109998.https://doi.org/10.1016/j.micromeso.2020.109998
Atzori C., Shearer G.C., Maschio L., Civalleri B., Bonino F., Lamberti C., Svelle S., Lillerud K.P., Bordiga S. // J. Phys. Chem. C. 2017. V. 121. № 17. P. 9312.https://doi.org/10.1021/acs.jpcc.7b00483
Butova V.V., Budnyk A.P., Guda A.A., Lomachenko K.A., Bugaev A.L., Soldatov A.V., Chavan S.M., Øien-ØDegaard S., Olsbye U., Lillerud K.P., Atzori C., Bordiga S., Lamberti C. // Crystal Growth Design. 2017. V. 17. № 10. P. 5422.https://doi.org/10.1021/acs.cgd.7b00892
Schaate A., Roy P., Godt A., Lippke J., Waltz F., Wiebcke M., Behrens P. // Chem. Eur. J. 2011. V. 17. № 24. P. 6643.https://doi.org/10.1002/chem.201003211
Lu, G., Cui C., Zhang W., Liu Y., Huo F. // Chem. Asian J. 2013. V. 8. № 1. P. 69.https://doi.org/10.1002/asia.201200754
Morris W., Briley W.E., Auyeung E., Cabezas M.D., Mirkin C.A. // J. Am. Chemi. Soc. 2014. V. 136. № 20. P. 7261.https://doi.org/10.1021/ja503215w
Wang W., Wang L., Li Z., Xie Z. // Chem. Commun. 2016. V. 52. № 31. P. 5402.https://doi.org/10.1039/c6cc01048b
Abánades Lázaro I., Haddad S., Sacca S., Orellana-Tavra C., Fairen-Jimenez D., Forgan R.S. // Chem. 2017. V. 2. № 4. P. 561.https://doi.org/10.1016/j.chempr.2017.02.005
Chen D., Yang D., Dougherty C.A., Lu W., Wu H., He X., Cai T., Van Dort M.E., Ross B.D., Hong H. // ACS Nano. 2017. V. 11. № 4. P. 4315.https://doi.org/10.1021/acsnano.7b01530
Butova V.V., Burachevskaya O.A., Ozhogin I.V., Borodkin G.S., Starikov A.G., Bordiga S., Damin A., Lillerud K.P., Soldatov A.V. // Microporous Mesoporous Mater. 2020. V. 305. P. 110324.https://doi.org/10.1016/j.micromeso.2020.110324
Ibrahim A.H., El-Mehalmey W.A., Haikal R.R., Safy M.E.A., Amin M., Shatla H.R., Karakalos S.G., Alkordi M.H. // Inorg. Chem. 2019. V. 58. № 22. P. 15078.https://doi.org/10.1021/acs.inorgchem.9b01611
Klet R.C., Liu Y., Wang T.C., Hupp J.T., Farha O.K. // J. Mater. Chem. A. 2016. V. 4. № 4. P. 1479.https://doi.org/10.1039/c5ta07687k
Lowry G.V., Hill R.J., Harper S., Rawle A.F., Hendren C.O., Klaessig F., Nobbmann U., Sayre P., Rumble J. // Environ. Sci.: Nano. 2016. V. 3. № 5. P. 935.https://doi.org/10.1039/c6en00136j
Butova V.V., Budnyk A.P., Charykov K.M., Vetlitsyna-Novikova K.S., Bugaev A.L., Guda A.A., Damin A., Chavan S.M., Sigurd Oien-Odegaard, Lillerud K.P., Soldatov A.V., Lamberti C. // Inorg. Chem. 2019. V. 58. № 2. P. 1607.https://doi.org/10.1021/acs.inorgchem.8b03087
Chakarova K., Strauss I., Mihaylov M., Drenchev N., Hadjiivanov K. // Microporous Mesoporous Mater. 2019. V. 281. P. 110.https://doi.org/10.1016/j.micromeso.2019.03.006
Xu R., Wang Z., Wang M., Qiao Z., Wang J. // J. Membrane Sci. 2019. V. 573. P. 455.https://doi.org/10.1016/j.memsci.2018.12.027
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования



