Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2021, № 9, стр. 25-31
Влияние заряда малой добавки со-ПАВ на вязкоупругие свойства растворов цвиттерионных мицеллярных цепей
Е. И. Шаталина a, В. С. Молчанов a, *, А. И. Куклин b, О. Е. Филиппова a
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b Объединенный институт ядерных исследований
141980 Дубна, Россия
* E-mail: molchan@polly.phys.msu.ru
Поступила в редакцию 25.01.2021
После доработки 22.02.2021
Принята к публикации 25.02.2021
Аннотация
Проведено исследование реологических свойств и структуры водных растворов червеобразных мицелл цвиттерионного поверхностно-активного вещества (ПАВ) в присутствии сверхмалой добавки со-ПАВ с близкой структурой, заряд которой зависит от pH. Показано, что при переходе со-ПАВ из катионной формы в незаряженную происходит увеличение вязкости, времени релаксации и упругого отклика растворов на порядок. Методом малоуглового рассеяния нейтронов подтверждено образование цилиндрических мицелл в случае заряженной и незаряженной формы со-ПАВ. Показано, что даже малое количество заряженного со-ПАВ приводит к уменьшению средней контурной длины червеобразных мицелл по сравнению со случаем нейтрального со-ПАВ. Таким образом, исследованы pH-чувствительные вязкоупругие растворы на основе цвиттерионного ПАВ в присутствии сверхмалой добавки со-ПАВ, чей заряд зависит от pH.
ВВЕДЕНИЕ
В водной среде молекулы ПАВ могут образовать агрегаты разной формы для того, чтобы уменьшить контакт гидрофобных групп с растворителем. В данной работе изучаются длинные гибкие цилиндрические мицеллы ПАВ, которые вследствие энтропийных причин находятся в растворе в конформации клубка, поэтому по свойствам они похожи на линейные полимерные цепи, и их выделяют в отдельных класс мицелл – червеобразные мицеллы (или мицеллярные цепи) [1]. Такие мицеллы часто называют живыми полимерами [1–7] в связи с тем, что они непрерывно разрываются и рекомбинируют. С увеличением концентрации ПАВ растворы червеобразных мицелл становятся вязкоупругими, так как образуется сетка переплетенных цепей. Такие мицеллярные цепи широко применяются как загустители в косметике, красках, бытовой химии и технологиях интенсификации добычи нефти [3, 4]. Их важным преимуществом является высокая восприимчивость к концентрации ПАВ, соли, со-ПАВ, pH. Благодаря этому на основе червеобразных мицелл создают “умные” вязкоупругие растворы [4, 7].
Одним из способов получения мицеллярных цепей является использование ионогенного ПАВ с длинным гидрофобным хвостом (С16 и длиннее) совместно с ионогенным со-ПАВ [8–11], молекулы которого образуют совместные мицеллы с основным ПАВ. Смешивание ПАВ позволяет изменять соотношение между длиной, объемом гидрофобной части и площадью поверхности, занятой одной гидрофильной группой на поверхности мицеллы, что приводит к изменению параметра молекулярной упаковки и длины червеобразных мицелл [12]. Таким образом, длина цепей определяется двумя факторами: гидрофобными взаимодействиями и электростатическим взаимодействием на поверхности мицелл.
Червеобразные мицеллы цвиттерионных ПАВ в целом нейтральны, так как гидрофильная часть таких ПАВ содержит заряженные группы обоих знаков заряда, поэтому их свойства менее восприимчивы ко внешним воздействиям по сравнению с мицеллами катионных [4, 7] и анионных ПАВ [3, 13, 14]. Добавление со-ПАВ делает мицеллярные цепи более чувствительными к изменению состава раствора [8]. При добавлении катионного со-ПАВ к цвиттерионному ПАВ, образующему мицеллярные цепи, наблюдалось следующее: сначала вязкость увеличивалась, а потом резко уменьшалась при дальнейшем добавлении со-ПАВ [8]. Авторы предположили, что увеличение вязкости связано с ростом длины мицелл, а резкое падение вязкости авторы объяснили уменьшением длины мицеллярных цепей вследствие увеличения их заряда. Показано, что сетка разрушается при доле катионного ПАВ более 10% по отношению к цвиттерионному ПАВ [8].
В работе [11] показано, что смешанные мицеллы цвиттерионного и анионного ПАВ претерпевают переход от сферы к цилиндру при неожиданно низких концентрациях по сравнению с цвиттерионным ПАВ в отсутствие со-ПАВ. Если головка анионного со-ПАВ крупная, то переход происходит при больших концентрациях. В случае крупной головки средняя площадь, приходящаяся на молекулу ПАВ в мицелле, больше, а, следовательно, самопроизвольный радиус кривизны мицелл меньше. Это уменьшает выгодность перехода от сферических к цилиндрическим мицеллам [11]. Стоит отметить, что эффекты влияния со-ПАВ на свойства растворов наблюдались при количестве со-ПАВ на порядок меньше, чем основного ПАВ, или при соизмеримом с ПАВ количестве со-ПАВ.
В данной работе мы исследуем влияние заряда сверхмалой добавки со-ПАВ на свойства растворов червеобразных мицелл цвиттеронного ПАВ. Основное ПАВ – олеиламидопропилдиметилкарбоксибетаин (ОБ), имеющий длинную гидрофобную группу, способен образовать червеобразные мицеллы. Используемое со-ПАВ–олеиламидопропилдиметиламин (ОА) имеет такую же гидрофобную группу, что и ПАВ, но другой заряд гидрофильной головки. Более того, этот заряд зависит от pH раствора. Таким образом, гидрофобное ядро мицеллы ОБ не изменяется в присутствии ОА, но изменяется взаимодействие гидрофильных групп на поверхности мицеллы. Исследованы вязкоупругие свойства растворов методом реометрии и структура мицелл методом малоуглового рассеяния нейтронов в зависимости от pH раствора. В работе показано, что заряд даже небольшого количества со-ПАВ (количество со-ПАВ в 70 раз меньше, чем основного ПАВ) заметно изменяет реологические свойства сетки червеобразных мицелл, так как влияет на равновесную среднюю длину мицелл.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали цвиттерионное ПАВ олеиламидопропилдиметилкарбоксибетаин (ОБ). Его структурную форму можно увидеть на рис. 1. ОБ был предоставлен НПО “НИИПАВ” (Россия) в виде 29.5 вес. %-ого водного раствора ПАВ ОБ, содержащего 17 вес. % изопропанола, 4 вес. % NaCl и 0.5% олеиламидопропилдиметиламина (ОА). Очистку ОБ от изопропанола проводили методом лиофильной сушки. Степень очистки определяли по спектрам 1H ЯМР. Полученная в результате сухая смесь помимо самого ОБ содержит 11.8 вес. % NaCl (противоионы ОБ) и 1.5 вес. % ОА. Таким образом, в порошке, используемом для приготовления растворов, помимо основного ПАВ присутствует небольшое количество примеси со-ПАВ ОА (1 молекула ОА на 70 молекул ОБ), оставшегося после синтеза и очистки основного цвиттер-ионного ПАВ (рис. 1). Далее в качестве концентрации ПАВ будем указывать суммарную концентрацию ОБ и ОА. В слабокислой среде (pK_Б ≈ 5–6) ОА переходит из не ионной в катионную форму за счет протонирования аминогруппы (при увеличении количества протонов в растворе часть из них присоединяется к атому азота с образованием катиона) и выступает в качестве катионного со-ПАВ. Таким образом, изменяя pH среды можно управлять его зарядом.
Реологические исследования проводили на ротационном реометре Physica MCR301 фирмы Anton Paar (Австрия) с использованием измерительной ячейки конус–плоскость (радиус конуса 25 мм, угол конуса 1°).
Эксперименты по малоугловому рассеянию нейтронов (МУРН) проводили на установке ЮМО реактора ИБР-2 лаборатории нейтронной физики им. И.М. Франка в Объединенном Институте Ядерных Исследований (г. Дубна). Данные были обработаны согласно стандартной процедуре [14]. Для увеличения контраста для приготовления растворов использовали D2O. Все эксперименты проводили при температуре 25°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Было исследовано влияние pH на вязкоупругие свойства растворов смешанных мицелл ПАВ. На рис. 2 представлены частотные зависимости модуля накоплений и модуля потерь при различных кислых pH (4.1, 4.9 и 5.8) 2 вес. %-растворов ОБ и ОА. При всех pH в области высоких частот модуль накопления (G ') больше модуля потерь (G "), что соответствует упругому отклику раствора. В области низких частот модуль потерь превосходит модуль накоплений, что соответствует переходу к вязкому отклику системы. Можно заметить, что значения G ' и G " практически не зависят от pH в данной области значений. Далее частотные зависимости были получены при щелочных pH (7.4, 8.3, 10.2, 11.1) (рис. 3). При высоких частотах система также проявляет упругие свойства, при низких – вязкие, но значения модулей существенно отличаются от значений для кислых pH. При увеличении pH растут значения модуля накоплений G ' и увеличивается область упругого отклика G ' > G ". Полученные зависимости характерны для растворов переплетенных червеобразных мицелл ПАВ [3, 5, 13, 15].
Рис. 2.
Частотные зависимости модулей накопления G ' (закрашенные символы) и потерь G " (пустые символы) для 2 вес. %-ого водного раствора ОБ + OA, pH 4.1 (круги), pH 4.9 (треугольники), pH 5.8 (квадраты).
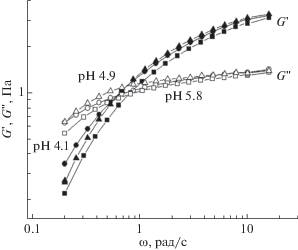
Рис. 3.
Частотные зависимости модулей накопления G ' (закрашенные символы) и потерь G " (пустые символы) для 2 вес. %-ого водного раствора ОБ + OA, pH 7.4 (круги), pH 8.3 (квадраты), pH 10.2 (треугольники), pH 11.1 (ромбы).

Образование мицеллярных цепей ПАВ в исследуемых растворах ПАВ при разных pH было подтверждено методом МУРН. На рис. 4а представлены кривые рассеяния для растворов при pH 5 и pH 11. Для подтверждения структуры (форм-фактора) мицелл была использована меньшая концентрация ПАВ, чтобы уменьшить вклад взаимодействия цепей (фактора взаимодействия) в интенсивность рассеяния [3, 7, 16, 17]. Видно, что в области низких значений векторов рассеяния наблюдается степенная зависимость q–1, указывающая на рассеяние от цилиндрических мицелл ПАВ [3, 7, 16, 17]. Стоит отметить, что кривые рассеяния практически совпадают при всех значениях векторов рассеяния, а значит локальная цилиндрическая форма мицелл и толщина мицелл не изменяется при варьировании pH. Из угла наклона графика зависимости ln(Iq) от q2 для значений q, соответствующих рассеянию от локальной цилиндрической структуры мицелл (рис. 4б), были получены значения радиуса поперечного сечения мицелл [7, 16, 17]: Rп = 26.5 ± 0.8 при pH 5 и Rп = 26.3 ± 0.3 при pH 11, что близко к значению длины молекулы ОБ [18]. Следовательно, можно предположить, что изменение реологических свойств растворов вызвано изменением контурной длины цепей, которая может достигать нескольких микрон [3, 8], поэтому в данном диапазоне векторов рассеяния она не влияет на интенсивность рассеяния [7, 16, 17].
Рис. 4.
Кривые МУРН растворов 0.4 вес. %-растворов ОБ + ОА в D2O при pH 5 (пустые символы) и при pH 11 (закрашенные символы) (а). Данные МУРН в координатах ln(Iq)(q2) для растворов 0.4 вес. %-растворов ОБ + ОА в D2O при pH 5 (пустые символы) и при pH 11 (закрашенные символы) (б).

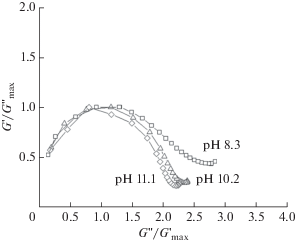
Проанализируем изменение реологических свойств растворов. Значение модуля накоплений при высоких частотах пропорционально количеству зацеплений в сетке [1, 5, 13, 17]. Для сравнения этого параметра мы использовали значение модуля накоплений при 10 рад/с. На рис. 5 видно, что при увеличении pH от 7.4 до 8.3 резко увеличивается количество зацеплений в сетке и увеличивается область упругого отклика (G ' > G '). Более того, при pH > 8 наблюдается плато для модуля накоплений, характерное для длинных червеобразных мицелл ПАВ, реологические свойства которых описываются моделью Максвелла с одним временем релаксации [1, 2, 17]:
 где
где  = $\frac{{{{G}_{0}}}}{2}$ в случае модели Максвелла. Для идеального максвелловского тела диаграмма имеет вид
полуокружности с единичным радиусом [1–3, 17, 19, 20]. На рис. 5 представлены данные зависимости для растворов при высоких pH. Видно, что с увеличением
pH кривые стремятся к максвелловской полуокружности. В сетке зацеплений червеобразных
мицелл существуют два характерных времени, определяющих релаксацию напряжений: время
рептации (τrep) и время жизни (τbr) [1, 17, 19], т.е. время между двумя последовательными обратимыми разрывами мицеллы [1, 2]. При ${{\tau }_{{{\text{rep}}}}} \ll {{\tau }_{{{\text{br}}}}}$ за время рептации цепи не успевают разорваться. Данный режим наблюдается в случае
относительно коротких цепей [17]. При ${{\tau }_{{{\text{rep}}}}} \gg {{\tau }_{{{\text{br}}}}}$ за время рептации цепи успевают разорваться много раз. Тогда релаксационные процессы
усредняются, и система характеризуется одним временем релаксации. Такой режим наблюдается
в случае длинных цепей, так как они разрываются чаще, а их время рептации больше.
Поэтому в случае длинных цепей система описывается моделью Максвелла вязкоупругой
жидкости с одним временем релаксации. Таким образом, при увеличении pH растет средняя
контурная длина мицеллярных цепей. Для больших pH можно оценить размер элементарной
ячейки сетки (корреляционную длину), используя соотношение ε = $\sqrt[3]{{\frac{{kT}}{{{{G}_{0}}}}}}$ [1, 2, 7], ε ≈ 98 нм. А также можно рассчитать контурную длину цепей [1, 2, 7]: L = le
= $\frac{{{{G}_{0}}}}{2}$ в случае модели Максвелла. Для идеального максвелловского тела диаграмма имеет вид
полуокружности с единичным радиусом [1–3, 17, 19, 20]. На рис. 5 представлены данные зависимости для растворов при высоких pH. Видно, что с увеличением
pH кривые стремятся к максвелловской полуокружности. В сетке зацеплений червеобразных
мицелл существуют два характерных времени, определяющих релаксацию напряжений: время
рептации (τrep) и время жизни (τbr) [1, 17, 19], т.е. время между двумя последовательными обратимыми разрывами мицеллы [1, 2]. При ${{\tau }_{{{\text{rep}}}}} \ll {{\tau }_{{{\text{br}}}}}$ за время рептации цепи не успевают разорваться. Данный режим наблюдается в случае
относительно коротких цепей [17]. При ${{\tau }_{{{\text{rep}}}}} \gg {{\tau }_{{{\text{br}}}}}$ за время рептации цепи успевают разорваться много раз. Тогда релаксационные процессы
усредняются, и система характеризуется одним временем релаксации. Такой режим наблюдается
в случае длинных цепей, так как они разрываются чаще, а их время рептации больше.
Поэтому в случае длинных цепей система описывается моделью Максвелла вязкоупругой
жидкости с одним временем релаксации. Таким образом, при увеличении pH растет средняя
контурная длина мицеллярных цепей. Для больших pH можно оценить размер элементарной
ячейки сетки (корреляционную длину), используя соотношение ε = $\sqrt[3]{{\frac{{kT}}{{{{G}_{0}}}}}}$ [1, 2, 7], ε ≈ 98 нм. А также можно рассчитать контурную длину цепей [1, 2, 7]: L = le где le – длина между зацеплениями. Длину между зацеплениями можно найти из формулы: ${{G}_{0}} \approx {{kT} \mathord{\left/ {\vphantom {{kT} {\left( {l_{e}^{{9{\text{/}}5}}l_{p}^{{6{\text{/}}5}}} \right)}}} \right. \kern-0em} {\left( {l_{e}^{{9{\text{/}}5}}l_{p}^{{6{\text{/}}5}}} \right)}}$ [1, 2, 18–20], где lp = 40 нм – персистентная длина мицеллярных цепей ОБ [21]. При pH = 8.3 контурная длина цепи примерно равна 1.1 мкм, при pH = 10.2 и 11 она
больше и составляет 1.8 мкм. Таким образом показано, что увеличение pH приводит к
росту мицеллярных цепей.
где le – длина между зацеплениями. Длину между зацеплениями можно найти из формулы: ${{G}_{0}} \approx {{kT} \mathord{\left/ {\vphantom {{kT} {\left( {l_{e}^{{9{\text{/}}5}}l_{p}^{{6{\text{/}}5}}} \right)}}} \right. \kern-0em} {\left( {l_{e}^{{9{\text{/}}5}}l_{p}^{{6{\text{/}}5}}} \right)}}$ [1, 2, 18–20], где lp = 40 нм – персистентная длина мицеллярных цепей ОБ [21]. При pH = 8.3 контурная длина цепи примерно равна 1.1 мкм, при pH = 10.2 и 11 она
больше и составляет 1.8 мкм. Таким образом показано, что увеличение pH приводит к
росту мицеллярных цепей.
Рис. 5.
Зависимости модуля потерь G " от модуля накоплений G ', нормированные на  для 2 вес. %-растворов ОБ + ОА при pH 8.3 (квадраты), pH 10.2 (треугольники), pH
11.1 (ромбы).
для 2 вес. %-растворов ОБ + ОА при pH 8.3 (квадраты), pH 10.2 (треугольники), pH
11.1 (ромбы).
В нашем исследовании вязкость растворов измеряется через модуль комплексной вязкости |η*|. В области низких частот, согласно правилу Кокса–Мерца [22], его значение равно вязкости при нулевой скорости сдвига, называемой вязкостью η0 раствора. При низких pH модуль комплексной вязкости практически не изменяется (рис. 6). Однако при увеличении pH значение вязкости увеличивается на порядок. Время релаксации в сетке определяли по обратной величине частоты перехода к вязкому отклику: tрел = $\frac{1}{\omega }.$ В случае кислых pH при не максвелловском поведении в сетке существует набор времен релаксации [2, 7, 17], а данная величина равна максимальному времени релаксации в сетке [2, 7, 17]. На рис. 7 видим, что время релаксации также растет с pH. Полученные изменения вязкости и времени релаксации хорошо согласуются с увеличением длины мицелл.
Рис. 6.
Зависимость модуля накопления G ′ (при высоких частотах) от pH системы 2 вес. %-ого водного раствора ОБ + OA (а). Зависимость времени релаксации от pH системы 2 вес. %-ого водного раствора ОБ + OA (б).

Рис. 7.
Частотная зависимость модуля комплексной вязкости для 2 вес. %-ого водного раствора ОБ + OA, pH 4.1 (круги), pH 4.9 (треугольники), pH 5.8 (квадраты) (а). Частотная зависимость модуля комплексной вязкости для 2 вес. %-ого водного раствора ОБ + OA, pH = 7.4 (круги), pH 8.3 (квадраты), pH = 10.2 (треугольники), pH 11.1 (ромбы) (б).

Увеличение длины мицелл при увеличении pH можно объяснить депротонированием аминогруппы со-ПАВ и уменьшением электростатического отталкивания на поверхности мицелл, что делает более плотную цилиндрическую упаковку молекул в мицеллах более выгодной, поэтому мицеллы объединяются в более длинные. Рост длины мицелл при уменьшении электростатического отталкивания гидрофильных групп червеобразных мицелл ранее был показан в литературе на примере смешанных мицелл цвиттерионного и анионного ПАВ при добавлении соли [8–12], но в нашем случае это происходит за счет нейтрализации заряда сверхмалой добавки со-ПАВ (1 : 70). Дополнительным фактором сильного влияния малой добавки может быть притяжение между нейтральной молекулой ОА и цвиттерионной ОБ за счет образования водородных связей между аминогруппами ПАВ и со-ПАВ.
ЗАКЛЮЧЕНИЕ
Показано, что присутствие сверхмалой добавки pH-чувствительного со-ПАВ ОА в мицеллярных цепях цветтерионного ПАВ близкого строения ОБ приводит к созданию pH-чувствительной сетки, чьи реологические свойства существенно зависят от заряда со-ПАВ. С учетом постоянного количества ПАВ и широкого распределения цепей по длине [1, 2, 7] можно полагать, что при низком pH самые короткие мицеллы, чья длина меньше, чем размер элементарной ячейки в сетке, не участвуют в ее образовании. При увеличении pH увеличивается количество цепей, участвующих в образовании сетки, что влечет за собой увеличение количество зацеплений, поэтому G ' растет. Также при объединении цепей в более длинные время релаксации системы растет, за счет чего растет и вязкость системы. Изменение свойств в мицеллярной сетке полностью обратимо при варьировании pH, поэтому можно заключить, что в данной работе разработана pH-восприимчивая вязкоупругая система мицеллярных цепей на основе цвиттерионного ПАВ за счет присутствия сверхмалой pH-чувствительной добавки со-ПАВ, переходящей из нейтральной формы в катионную.
Список литературы
Cates M.E., Fielding S.M. // Adv. Phys. 2006. V. 55. № 7–8. P. 799.https://doi.org/10.1080/00018730601082029
Cates M.E. // Macromolecules. 1987. V. 20. № 9. P. 2289.https://doi.org/10.1021/ma00175a038
Shibaev A.V., Tamm M. V., Molchanov V.S., Rogachev A.V., Kuklin A.I., Dormidontova E.E., Philippova O.E. // Langmuir. 2014. V. 30. № 13. P. 3705.https://doi.org/10.1021/la500484e
Chu Z., Dreiss C.A., Feng Y. // Chem. Soc. Rev. 2013. V. 42. № 17. P. 7174.https://doi.org/10.1039/C3CS35490C
Квятковский А.Л., Молчанов В.С., Филиппова О.Е. // Высокомолекулярные соединения. Серия А. 2019. Т. 61. № 2. С. 180.https://doi.org/10.1134/S2308112019020081
Berret J.F., Appell J., Porte G. // Langmuir. 1993. V. 9. № 11. P. 2851.https://doi.org/10.1021/la00035a021
Dreiss C.A. Wormlike Micelles: An Introduction, Wormlike Micelles. London: The Royal society of chemistry, 2017. 356 P. https://doi.org/10.1039/9781782629788-00001
Hoffmann H., Rauscher A., Gradzielski M., Schulz S.F. // Langmuir. 1992. V. 8 № 9. P. 2140.https://doi.org/10.1021/la00045a013
Ghosh S., Khatua D., Dey J. // Langmuir. 2011. V. 27 № 9. P. 5184.https://doi.org/10.1021/la1040147
Różańska S. // Colloids and Surfaces A: Physicochemical Engineering Aspects. 2015. V. 482. P. 394.https://doi.org/10.1016/j.colsurfa.2015.06.045
Christov N.C., Denkov N.D., Kralchevsky P.A., Ananthapadmanabhan K.P., Lips A. // Langmuir. 2004. V. 20. P. 565.https://doi.org/10.1021/la035717p
Danov K.D., Kralchevsky P.A., Stoyanov S.D., Cook J.L., Stott I.P. // J. Colloid Interface Sci. 2019. V. 547. P. 245.https://doi.org/10.1016/j.jcis.2019.03.105
Молчанов В.С., Филиппова О.Е. // Кол. Журн. 2009. Т. 71. № 2. С. 249.https://doi.org/10.1134/s1061933x09020136
Kuklin A.I., Rogachev A.V., Soloviov D.V., Ivankov O.I., Kovalev Yu.S., Utrobin P.K., Kutuzov S.A., Soloviev A.G., Rulev M.I., Gordeliy V.I. // J. Phys.: Conf. Ser. 2017. V. 848. P. 012010.https://doi.org/10.1088/1742-6596/848/1/012010
Lin Z., Eads C.D. // Langmuir. 1997. V. 7463. P. 2647.https://doi.org/10.1021/la961004d
Flood C., Dreiss C.A., Croce V., Cosgrove T. // Langmuir. 2005. V. 21. P. 7646.https://doi.org/10.1021/la050326r
Molchanov V.S., Philippova O.E., Khokhlov A.R., Kovalev A.S., Kuklin A.I. // Langmuir. 2007. V. 32. P. 105.https://doi.org/10.1021/la061612l
Molchanov V.S., Efremova M.A., Orekhov A.S., Arkharova N.A., Rogachev A.V., Philippova O.E. // J. Molecular Liquids. 2020. V. 315. P. 113684.https://doi.org/10.1016/j.molliq.2020.113684
Плетнева В.А., Молчанов В.С., Филиппова О.Е. // Кол. Журн. 2010. Т. 72. № 5. С. 707.https://doi.org/10.1134/s1061933x10050200
Куряшов Д.А., Филиппова О.Е., Молчанов В.С., Башкирцева Н.Ю., Дияров И.Н. // Кол. Журн. 2010. Т. 72. № 2. С. 225.https://doi.org/10.1134/S1061933X10020134
McCoy T.M., King J.P., Moore J.E., Kelleppan V.T., Sokolova A.V., Campo de L., Manohar M., Darwish T.A., Tabor R.F. // J. Colloid Interface Sci. 2019. V. 534. P. 518.https://doi.org/10.1016/j.jcis.2018.09.046
Cox W.P., Merz E.H. // J. Polym. Sci. 1958. V. 28. P. 619.https://doi.org/10.1002/pol.1958.1202811812
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования



