Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 1, стр. 10-17
Высвобождение ТРИТЦ-декстрана из композитных микрокапсул под воздействием низкочастотного переменного магнитного поля
А. В. Михеев a, b, *, И. А. Бурмистров b, В. Б. Зайцев a, В. В. Артемов b, Д. Н. Хмеленин b, С. С. Старчиков b, М. М. Веселов a, Н. Л. Клячко a, Т. В. Букреева b, c, Д. Б. Трушина b, d
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
b ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Россия
c НИЦ “Курчатовский институт”
123182 Москва, Россия
d Первый Московский государственный медицинский университет
им. И.М. Сеченова Министерства здравоохранения РФ (Сеченовский университет)
119991 Москва, Россия
* E-mail: mikheev.av16@physics.msu.ru
Поступила в редакцию 25.05.2021
После доработки 20.06.2021
Принята к публикации 25.06.2021
- EDN: WWPAYA
- DOI: 10.31857/S1028096021120116
Аннотация
Синтезированы композитные микрокапсулы на основе полиэлектролитов и наночастиц оксидов железа, и исследован процесс высвобождения инкапсулированного высокомолекулярного декстрана под воздействием низкочастотного переменного магнитного поля за счет магнитомеханической активации наночастиц в полимерной оболочке. В результате химической конденсации двух- и трехвалентного железа синтезированы и методами просвечивающей электронной микроскопии, динамического светорассеяния, порошковой рентгеновской дифракции и мессбауэровской спектроскопии охарактеризованы однодоменные магнитные наночастицы Fe3O4 сферической формы. Полиэлектролитные микрокапсулы из полиаллиламин гидрохлорида и полистиролсульфоната натрия были модифицированы магнитными наночастицами за счет электростатической адсорбции на противоположно заряженном слое полиэлектролита. В качестве модельного вещества для инкапсуляции использован декстран, меченый тетраметилродамин-5-изотиоцианатом (ТРИТЦ-декстран), его включали в частицы CaCO3 (растворяемые ядра для формирования капсул) методом соосаждения. Образцы капсул исследовали методами растровой электронной микроскопии, динамического рассеяния света, флуоресцентной конфокальной микроскопии. Капсулы подвергали воздействию переменного магнитного поля с амплитудой 100 мТл и частотой 30–110 Гц. Содержание меченого декстрана в оболочке микрокапсул и в супернатанте определяли с помощью флуориметрии и флуоресцентной конфокальной микроскопии. Установлены длительность воздействия и частота магнитного поля, при которых достигается наибольшее высвобождение декстрана из композитных капсул. Воздействие низкочастотного переменного магнитного поля может приводить к существенной деформации оболочки полиэлектролитных микрокапсул, модифицированных магнитными наночастицами, и успешному высвобождению инкапсулированного вещества.
ВВЕДЕНИЕ
В настоящее время важной проблемой медицины и биотехнологии является разработка и создание систем инкапсуляции и целевой доставки различных веществ в необходимые места организма с последующим контролируемым и/или постепенным высвобождением инкапсулированного вещества. Среди большого количества разнообразных систем доставки (липосомы [1], мицеллы [2] везикулы [3]) интерес вызывают полиэлектролитные микрокапсулы, предложенные в 1998 г. Е. Донат, Г.Б. Сухоруковым [4]. Такие капсулы активно исследуют и применяют для капсулирования и доставки ряда биологически активных веществ in vitro и in vivo [5, 6], в частности, полиэлектролитные капсулы перспективны для доставки вакцин [7–9].
Высвобождение веществ из полиэлектролитных микрокапсул происходит за счет диффузии, скорость которой зависит от характеристик инкапсулированных молекул (например, от размера молекулы), свойств полимерного комплекса, из которого сформирована микрокапсула, толщины оболочки и ряда других параметров [10]. Контролируемое высвобождение веществ подразумевает использование триггеров, запускающих этот процесс в композитных микрокапсулах, оболочки которых функционализированы подходящими молекулами и/или наночастицами. В качестве триггера можно использовать воздействие ферментов [11], ультразвукового поля [12, 13], микроволнового поля [14], лазерного излучения [15, 16]. Переменное магнитное поле также может влиять на высвобождение содержимого композитных капсул и их целостность [17, 18].
При помещении магнитных наночастиц в переменное магнитное поле первоначально хаотически ориентированные магнитные моменты будут стремиться повернуться в одну сторону. В зависимости от характеристик наночастиц и параметров магнитного поля выделяют два типа релаксации магнитного момента. В первом случае вращается магнитный момент, сама наночастица остается неподвижной – это так называемая неелевская релаксация, приводящая к разогреву окружающей среды. На неелевской релаксации основано явление магнитной гипертермии [18, 19]. Однако увеличение температуры может негативно влиять как на термочувствительные биологически активные вещества, так и на окружающие ткани.
Особое внимание заслуживает применение негреющего низкочастотного магнитного поля (частота 1–1000 Гц), которое обладает большей проникающей способностью относительно тканей, легкостью дозирования и контроля, большей локальностью и безопасностью по сравнению с греющим магнитным полем [20]. При приложении низкочастотного магнитного поля магнитный момент остается неподвижным относительно наночастицы, сама наночастица вращается в магнитном поле – это броуновская релаксация. Данный процесс не приводит к существенному выделению тепла, и основной канал диссипации энергии деформационно-механический (магнитомеханическая активация) [17, 21, 22]. На сегодняшний день существует лишь несколько работ, посвященных влиянию низкочастотного переменного магнитного поля на полиэлектролитные микрокапсулы [17, 22].
Целью работы был синтез композитных микрокапсул на основе не биоразлагаемых полиэлектролитов и наночастиц оксидов железа Fe3O4 и исследование процесса высвобождения инкапсулированных молекул высокомолекулярного декстрана под воздействием низкочастотного переменного магнитного поля за счет магнитомеханической активации наночастиц в полимерной оболочке.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Все химические вещества были аналитического качества и использовались без дополнительной очистки. Дигидрат хлорида кальция CaCl2·2H2O (Acros Organics, США), безводный карбонат натрия Na2CO3 (ITW Reagents, США), хлорид натрия NaCl, полистиролсульфонат натрия (ПСН) (MW = 70 кДа), полиаллиламин гидрохлорид (ПАГ) (MW = 50 кДа), ТРИТЦ-декстран (MW = 65–85 кДа), тетрагидрат хлорида железа FeCl2·4Н2О, гексагидрат хлорида железа FeCl3·6Н2О, дигидрат динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА) производства Sigma Aldrich, Германия. Воду очищали с помощью системы Milli-Q Plus.
Синтез наночастиц оксида железа Fe3O4
Наночастицы оксида железа были синтезированы химическим соосаждением ионов Fe3+ и Fe2+ в молярном соотношении 2 : 1 из водного раствора при добавлении гидрата аммиака [23]. Для предотвращения агрегации наночастицы были стабилизированы отрицательно заряженными цитрат-ионами.
Синтез полиэлектролитных микрокапсул
Микрокапсулы синтезированы с помощью метода последовательной адсорбции на частицах карбоната кальция [4]. Для получения частиц карбоната кальция и включения декстрана, меченого тетраметилродамин-5-изотиоцианатом (ТРИТЦ-декстрана), в микрокапсулы методом соосаждения смешивали по 615 мкл водных растворов CaCl2 и Na2CO3 (1 моль/л) и 2 мл раствора ТРИТЦ-декстрана (2 мг/мл). Формировавшиеся кристаллы карбоната кальция захватывали ТРИТЦ-декстран, что вело к его заключению внутри частиц. Для адсорбции наночастиц в каждую пробирку добавляли 100 мкл водной суспензии наночастиц (концентрация рассчитана из уравнения реакции [23] и составила ~2.3 × 1027 шт.), в течение 15 мин перемешивали в шейкере и промывали один раз. Для растворения частиц карбоната кальция к образцам добавляли 1 мл водного раствора динатриевой соли ЭДТА (0.2 моль/л), в течение 15 мин перемешивали в шейкере, центрифугировали и удаляли супернатант. Процесс повторяли три раза, полученные микрокапсулы промывали три раза деионизированной водой. Концентрация микрокапсул была рассчитана из уравнения реакции образования карбоната кальция и составляла ~6.9 × 108 шт. Структура композитной оболочки имела следующий вид: PAГ/ПСН/PAГ/МНЧ/ ПСН/PAГ/ПСН (МНЧ – магнитная наночастица).
Воздействие низкочастотного переменного магнитного поля на композитные микрокапсулы
Для проведения экспериментов по высвобождению ТРИТЦ-декстрана из полиэлектролитных микрокапсул использовали генератор переменного магнитного поля TOR MFG 01/12 (“Наноматериалы”, Россия). На микрокапсулы воздействовали непрерывным переменным магнитным полем с амплитудой 100 мТл и частотой 30–110 Гц. Эксперимент был проведен для четырех серий образцов, частоты воздействия 30, 50, 77 и 110 Гц. Для этого образец микрокапсул был разделен на пять частей (с учетом контрольного образца), затем пробирки с композитными микрокапсулами помещали в рабочую область генератора магнитного поля с помощью специального держателя. Концентрация микрокапсул в каждой пробирке составила ~1.4 × 108 шт., время экспозиции в магнитном поле 60 мин для каждой серии образцов. Каждую пробирку центрифугировали, супернатант отбирали и измеряли интенсивность флуоресценции с помощью флуориметра Cary Eclipse Fluorescence Spectrophotometer на длине волны возбуждения флуоресценции ТРИТЦ-декстрана 552 нм.
Для определения оптимального времени экспозиции микрокапсул использовали переменное магнитное поле с частотой 50 Гц. Интенсивность флуоресценции ТРИТЦ-декстрана в композитных микрокапсулах измеряли спустя 2 ч после воздействия магнитного поля с помощью конфокального микроскопа Leica TCS SPE (Leica Camera AG, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для определения размеров, синтезированных наночастиц были использованы просвечивающий электронный микроскоп (ПЭМ) Technai Osiris (FEI, США) и анализатор Malvern Zetasizer ZS. ПЭМ-изображение синтезированных наночастиц Fe3O4 представлено на рис. 1а. Наночастицы имеют форму, близкую к сферической, их средний размер, рассчитанный по ПЭМ-изображению с помощью программы ImageJ, составил 13 ± 1 нм. Методом динамического светорассеяния получено распределение наночастиц по размерам (рис. 1б), из которого следует, что кроме отдельных наночастиц в суспензии присутствует незначительное количество их агрегатов. Гидродинамический диаметр наночастиц Fe3O4 составляет 85 ± 16 нм. Это значение в несколько раз превышает размер, полученный методом электронной микроскопии, что говорит о формировании адсорбционного слоя из молекул и ионов, присутствующих в среде, на поверхности наночастиц.
Рис. 1.
Магнитные частицы Fe3O4: а – ПЭМ-изображение; б – гистограмма распределения по размерам d; в – порошковая дифрактограмма; г – зависимость величины дзета-потенциала от рН.
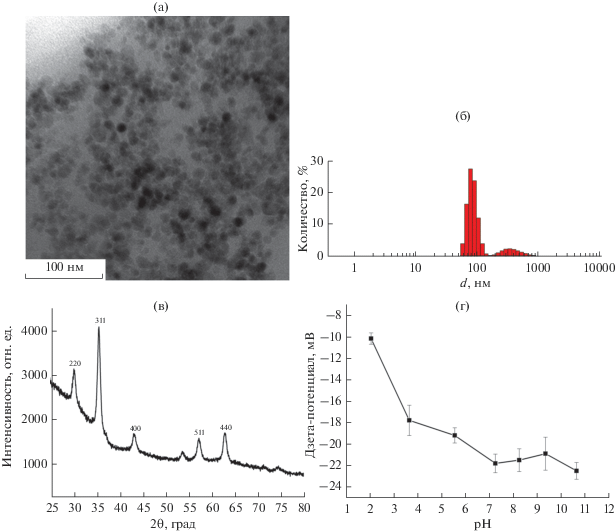
Порошковая рентгеновская дифрактограмма наночастиц (рис. 1в) получена на лабораторном порошковом дифрактометре Rigaku Miniflex 600 (λ = 1.5406 Å). Наблюдаются рефлексы 220 при 2θ = 30.0°, 311 при 35.2°, 400 при 42.9°, 511 при 56.9° и 440 при 62.5°, что согласно стандартной базе данных JCPDS (№ 89-4319) соответствует кубической кристаллической структуре шпинели, характерной для магнетита Fe3O4 (пространственная группа $Fd\bar {3}m$). Средний размер области когерентного рассеяния, оцененный по формуле Шерерра в приближении сферической формы наночастиц с постоянной K = 0.9, составил 15 нм, что согласуется с данными ПЭМ. Фазовый состав наночастиц также исследован методом мессбауэровской спектроскопии в геометрии пропускания с использованием источника гамма-излучения 57Co(Rh) и спектрометра MS-1104Em. Анализ мессбауэровских спектров показал присутствие в образце также магнитной фазы маггемита γ-Fe2O3. Изменение дзета-потенциала наночастиц Fe3O4 в зависимости от кислотности дисперсной фазы (рис. 1г) демонстрирует увеличение модуля дзета-потенциала при увеличении рН от 2 до 7. Так как дальнейшее повышение рН не приводит к увеличению модуля электрокинетического потенциала, адсорбцию наночастиц на полимерные оболочки проводили на слой поликатиона из суспензии наночастиц при нейтральном рН.
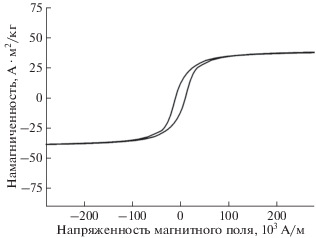
Магнитные свойства наночастиц Fe3O4 определяли по кривой гистерезиса (рис. 2). Для получения кривой использовали вибромагнитометр EG&G PARC (модель 155). Коэрцитивная сила составила 1.06 ± 0.01 кА/м, удельная намагниченность насыщения 38.7 А · м2/кг, магнитный момент (2.4 ± 0.3) × 10–19 А · м2. Наблюдаемая при комнатной температуре кривая гистерезиса свидетельствует о том, что наночастицы Fe3O4 имеют ферромагнитную природу. Согласно существующим представлениям синтезированные наночастицы являются однодоменными и могут релаксировать по броуновскому механизму в низкочастотном переменном магнитном поле, их можно использовать в качестве медиаторов локальной деформации благодаря магнитомеханической активации [20]. Для ее реализации важны параметры наночастицы (диаметр, материал) и магнитного поля (амплитудно-частотные и пространственно-временны́е характеристики). Эффективная реализация магнитомеханической активации требует применения низкочастотных переменных магнитных полей (менее 0.1–1 кГц) и магнитных наночастиц диаметром от 15 до 100 нм, поскольку, с одной стороны, наночастицы должны оставаться однодоменными (переход в многодоменное состояние у магнетита происходит при диаметре около 100 нм), а с другой стороны, увеличение размера наночастиц повышает максимальную генерируемую силу в переменном магнитном поле за счет роста магнитного момента [24]. Таким образом, используемые в исследовании поля и частицы подходят для реализации магнитомеханической активации. Для нее характерна сложная связь величины эффекта (деформации) с частотой поля, которая зависит от окружения наночастиц. Связанные с наночастицами макромолекулы могут иметь обратные времена релаксации, лежащие в области низких частот переменных магнитных полей, что приводит к псевдорезонансным эффектам увеличения отклика [24, 25].
ТРИТЦ-декстран успешно включается в частицы CaCO3 в процессе соосаждения, как видно из изображения микрокапсул, полученного с помощью флуоресцентного конфокального микроскопа (рис. 3а). Средний гидродинамический диаметр синтезированных микрокапсул, определенный методом динамического рассеяния света, составил 3.7 ± 0.5 мкм. Для изучения влияния низкочастотного переменного магнитного поля на морфологию оболочки на микрокапсулы воздействовали полем с амплитудой 100 мТл и частотами 30, 50, 77, 110 Гц. Растровый электронный микроскоп (РЭМ) JSM-7401F (Jeol, Япония) использовали для изучения нарушения целостности оболочки полиэлектролитной микрокапсулы. О нарушении судили по РЭМ-изображениям (рис. 3б–3е).
Рис. 3.
Изображения микрокапсул, полученные с помощью флуоресцентной конфокальной микроскопии (а) и РЭМ (б–е), до (а, б) и после (в–е) воздействия в течение 60 мин переменного магнитного поля амплитудой 100 мТл с частотой: в – 30; г – 50; д – 77; е – 110 Гц.

В отсутствие поля структура оболочки не нарушена, микрокапсулы остаются целыми (рис. 3б). Из сравнения изображений видно, что наибольшая деформация наблюдается при воздействии переменного магнитного поля с частотой 77 Гц (рис. 3г). При частотах 30, 50 и 110 Гц (рис. 3в, 3д, 3е) какие-либо заметные деформации отсутствуют. Основной причиной наблюдаемого разрушения микрокапсул может быть наступление псевдорезонанса в системе “оболочка–наночастицы” при совпадении обратного времени релаксации многослойной полиэлектролитной оболочки и частоты магнитного поля. При броуновской релаксации под действием низкочастотного переменного магнитного поля магнитные наночастицы начинают совершать колебательные движения. Их механическая энергия передается оболочке в форме деформаций сжатия и растяжения макромолекул, из которых состоят композитные микрокапсулы, причем на частоте 77 Гц эти деформации многократно увеличиваются, т.е. носят резонансный характер. Соответственно, при таком эффекте происходит высвобождение инкапсулированного ТРИТЦ-декстрана из микрокапсул.
Интенсивности флуоресценции ТРИТЦ-декстрана в супернатанте после воздействия на микрокапсулы переменного магнитного поля различной частоты приведены в табл. 1. Каждое измерение проводили через 2 ч после воздействия. Видно, что ТРИТЦ-декстран высвобождается во всех случаях. В случае контрольного образца (без воздействия) высвобождение связано с диффузией ТРИТЦ-декстрана из микрокапсулы в супернатант, и в сравнении с остальными образцами оно минимально. Оболочки микрокапсул практически непроницаемы для соединений с молекулярной массой больше 5 кДа [26]. Поэтому можно считать, что изменение флуоресценции из-за естественной диффузии в данном временном интервале не является статистически значимым. Максимальное значение интенсивности флуоресценции супернатанта наблюдается при воздействии поля с частотой 77 Гц, что согласуется с результатом РЭМ.
Таблица 1.
Интенсивность флуоресценции ТРИТЦ-декстрана в супернатанте после воздействия переменного магнитного поля различной частоты и центрифугирования микрокапсул
| Частота воздействия, Гц | Интенсивность флуоресценции, усл. ед. |
|---|---|
| 0 | 21.8 |
| 30 | 42.1 |
| 50 | 40.9 |
| 77 | 84.4 |
| 110 | 71.6 |
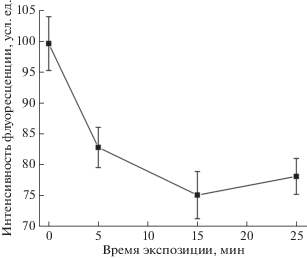
Одним из параметров воздействия является время экспозиции микрокапсул в низкочастотном переменном магнитном поле. С помощью конфокальной микроскопии были получены данные об интенсивности флуоресценции ТРИТЦ-декстрана в микрокапсулах в зависимости от времени воздействия магнитного поля (рис. 4). При длительности воздействия больше 10 мин интенсивность флуоресценции ТРИТЦ-декстрана практически не изменяется, что говорит об установлении равновесной концентрации в оболочке и дисперсной среде и об окончании процесса высвобождения. Таким образом, оптимальным временем воздействия поля является 10 мин, в течение которого устанавливается равновесная концентрация ТРИТЦ-декстрана в оболочке и среде, в которой находятся микрокапсулы.
ЗАКЛЮЧЕНИЕ
В работе продемонстрировано успешное применение низкочастотного переменного магнитного поля для контролируемого высвобождения ТРИТЦ-декстрана из композитных микрокапсул. Анализ полученных результатов позволяет заключить, что у системы многослойной полиэлектролитной оболочки, в которой находятся наночастицы магнетита, есть определенное обратное время релаксации, близкое к 77 Гц. При помещении композитных капсул со структурой ПAГ/ПСН/ПAГ/МНЧ/ПСН/ПAГ/ПСН в переменное магнитное поле частотой 77 Гц благодаря магнитомеханической активации наночастиц возникает псевдорезонанс, вызывающий появление дефектов в оболочке и стимулирующий высвобождение инкапсулированного вещества. Оптимальное время воздействия магнитного поля составляет 10 мин.
Магнитомеханическая активация является основой новой концепции локального воздействия на молекулярном уровне и перспективна для управления проницаемостью оболочек микрокапсул при доставке биологически активных веществ.
Список литературы
Dimov N., Kastner E., Hussain M., Perrie Y., Szita N. // Sci. Rep. 2017. V. 7. № 1. P. 12045.https://doi.org/10.1038/s41598-017-11533-1
Zhang Y., Huang Y., Li S. // AAPS PharmSciTech. 2014. V. 15. № 4. P. 862.https://doi.org/10.1208/s12249-014-0113-z
Elsharkasy O.M., Nordin J.Z., Hagey D.W., De Jong O.G., Schiffelers R.M., El Andaloussi S., Vader P. // Adv. Drug Deliv. Rev. 2020. V. 159. P. 332. https://doi.org/10.1016/j.addr.2020.04.004
Donath E., Sukhorukov G.B., Caruso F., Davis S.A., Möhwald H. // Ang. Chem. Int. Ed. 1998. V. 37. № 16. P. 2201. https://doi.org/10.1002/(SICI)1521-3773(19980904) 37:16<2201::AID-ANIE2201>3.0.CO;2-E
Kilic E., Novoselova M.V., Lim S.H., Pyataev N.A., Pinayev S.I., Kulikov O.A., Sindeeva O.A., Mayorova O.A., Murney R., Antipina M.N., Haigh B., Sukhorukov G.B., Kiryukhin M.V. // Sci. Rep. 2017. V. 7. № 1. P. 44159.https://doi.org/10.1038/srep44159
De Geest B.G., Willart M.A., Hammad H., Lambrecht B.N., Pollard C., Bogaert P., De Filette M., Saelens X., Vervaet C., Remon J.P., Grooten J., De Koker S. // ACS Nano. 2012. V. 6. № 3. P. 2136.https://doi.org/10.1021/nn205099c
Сомов А.Н., Дубровский А.В., Дунайцев И.А., Иванов С.А., Комбарова Т.И., Кочеткова О.Ю., Кравченко Т.Б., Титарева Г.М., Тихоненко С.А., Пинчук А.С., Фирстова В.В., Дентовская С.В. // Иммунология. 2019. Т. 40. № 5. С. 52.https://doi.org/10.24411/0206-4952-2019-15006
Селина О.Е., Белов С.Ю., Власова Н.Н., Балышева В.И., Чурин А.И., Бартковиак А., Сухоруков Г.Б., Марквичева Е.А. // Биоорганическая химия. 2009. Т. 35. № 1. С. 113.https://doi.org/10.1134/S0132342309010138
De Cock L.J., De Koker S., De Geest B.G., Grooten J., Vervaet C., Remon J.P., Sukhorukov G.B., Antipina M.N. // Ang. Chem. Int. Ed. 2010. V. 49. № 39. P. 6954. https://doi.org/10.1002/anie.200906266
She Z., Antipina M.N., Li J., Sukhorukov G.B. // Biomacromolecules. 2010. V. 11. № 5. P. 1241.https://doi.org/10.1021/bm901450r
Borodina T., Markvicheva E., Kunizhev S., Möhwald H., Sukhorukov G.B., Kreft O. // Macromol. Rapid Commun. 2007. V. 28. № 18–19. P. 1894.https://doi.org/10.1002/marc.200700409
De Geest B.G., Skirtach A.G., Mamedov A.A., Antipov A.A., Kotov N.A., De Smedt S.C., Sukhorukov G.B. // Small. 2007. V. 3. № 5. P. 804.https://doi.org/10.1002/smll.200600441
Петров А.В., Воронин Д.В., Иноземцева О.А., Петров В.В., Горин Д.А. // Вестн. Тамбовского гос. тех. ун-та. 2018. Т. 24. № 3. С. 539.https://doi.org/10.17277/vestnik.2018.03.pp.539-549
Borodina T., Yurina D., Sokovikov A., Karimov D., Bukreeva T., Khaydukov E., Shchukin D. // Polymer. 2020. V. 212. № 12. P. 123299. https://doi.org/10.1016/j.polymer.2020.123299
Marchenko I.V., Plotnikov G.S., Baranov A.N., Saletskii A.M., Bukreeva T.V. // J. Surface Invest.: X-ray, Synchrotron Neutron Tech. 2010. V. 4. № 1. P. 95.https://doi.org/10.1134/S1027451010010155
Марченко И.В., Бородина Т.Н., Трушина Д.Б., Набатов Б.В., Логачев В.В., Плотников Г.С., Баранов А.Н., Салецкий А.М., Рябова А.В., Букреева Т.В. // Коллоидный журн. 2018. Т. 80. № 4. С. 416.https://doi.org/10.1134/S0023291218040079
Lu Z., Prouty M.D., Guo Z., Golub V.O., Kumar C.S.S.R., Lvov Y.M. // Langmuir. 2005. V. 21. № 5. P. 2042.https://doi.org/10.1021/la047629q
Carregal-Romero S., Guardia P., Yu X., Hartmann P., Pellegrino T., Parak W.J. // Nanoscale. 2015. V. 7. № 2. P. 570.https://doi.org/10.1039/C4NR04055D
Hu S.-H., Tsai C.-H., Liao C.-F., Liu D.-M., Chen S.-Y. // Langmuir. 2008. V. 24. № 20. P. 11811.https://doi.org/10.1021/la801138e
Golovin Y.I., Klyachko N.L., Majouga A.G., Gribanovskii S.L., Golovin D.Y., Zhigachev A.O., Shuklinov A.V., Efremova M.V., Veselov M.M., Vlasova K.Y., Usvaliev A.D., Le-Deygen I.M., Kabanov A.V. // Nanotechnologies in Russia. 2018. V. 13. № 5–6. P. 215.https://doi.org/10.1134/S1995078018030060
Finotelli P.V., Silva D.D., Sola-Penna M., Rossi A.M., Farina M., Andrade L.R., Takeuchi A.Y., Rocha-Leão M.H. // Colloids Surfaces. B. 2010. V. 81. № 1. P. 206.https://doi.org/10.1016/j.colsurfb.2010.07.008
Luo D., Poston R.N., Gould D.J., Sukhorukov G.B. // Mater. Sci. Eng. C. 2019. V. 94. P. 647.https://doi.org/10.1016/j.msec.2018.10.031
Massart R. // IEEE Trans. Magn. 1981. V. 17. № 2. P. 1247.https://doi.org/10.1109/TMAG.1981.1061188
Golovin Y.I., Zhigachev M.V., Efremova M.V., Majouga A.G., Kabanov A.V., Klyachko N.L. // Nanotechnol. Russ. 2018. V. 13. № 5–6. P. 295.https://doi.org/10.1134/S1995078018030072
Efremova M.V., Veselov M.M., Barulin A.V. et al. // ACS Nano. 2018. V. 12. № 4. P. 3190.https://doi.org/10.1021/acsnano.7b06439
De Cock L.J., De Koker S., De Geest B.G., Grooten J., Vervaet C., Remon J.P., Sukhorukov G.B., Antipina M.N. // Ang. Chem. Int. Ed. 2010. V. 49. № 39. P. 6954. https://doi.org/10.1002/anie.200906266
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования