Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 12, стр. 86-93
Роль кислорода в процессах фазообразования с участием оксидов гомологического ряда Bam + nBimOy (m = 1–10; n = 0–5, 7–9, 11, 13, 17)
a Институт физики твердого тела им. Ю.А. Осипьяна РАН (ИФТТ РАН)
142432 Черноголовка, Россия
* E-mail: barkov@issp.ac.ru
Поступила в редакцию 21.01.2022
После доработки 28.03.2022
Принята к публикации 28.03.2022
- EDN: GMZQSN
- DOI: 10.31857/S102809602212007X
Аннотация
Обсуждается роль кислорода в процессах синтеза и фазообразования перовскитоподобных оксидов гомологического ряда Bam+nBimOy (m = 1–10; n = 0–5, 7–9, 11, 13, 17). Методами рентгенофазового и химического анализа установлено, что оксиды Bam+nBimOy формируются на воздухе с участием окислителя (кислорода) через начальную стадию образования обогащенных Bi (V) фаз. На этой стадии синтеза образцы состава Ba : Bi 17 : 9–5 : 4 двухфазны и состоят из оксидов Ba2Bi+4.78O4.39 и BaBiO3. При повышении температуры в образцах происходят сначала твердофазные превращения в оксиды Ba : Bi 9 : 4, 5 : 2, 21 : 8, а в области ликвидус–солидус – жидкофазные превращения с восстановлением Bi (V) → Bi (III) и потерей кислорода с участием кислорододефицитных фаз. При охлаждении обедненного кислородом ($\overline {{\text{Bi}}} $ = 3.00–3.06) расплава Ba–Bi–O происходит поглощение кислорода, о чем свидетельствует рост средней степени окисления висмута $\overline {{\text{Bi}}} $ с понижением температуры отжига в связи с окислением Bi (III) → Bi (V). Охлаждение образцов Ba : Bi 25 : 8, 11 : 4, 21 : 8, 5 : 2, 9 : 4 и 2 : 1 до 20°C приводит к полному насыщению их кислородом, фазы 25 : 8, 11 : 4 и 5 : 2 могут быть получены практически полностью окисленными ($\overline {{\text{Bi}}} $ = 4.95–5.00).
ВВЕДЕНИЕ
Фазовые диаграммы являются основным инструментом химиков в выборе оптимальных технологических параметров для целенаправленного синтеза индивидуальных фаз. В настоящей работе для получения однофазных образцов оксидов бария–висмута использованы результаты исследований фазовых соотношений в системе Ba–Bi–O [1–3], позволяющие дать физико-химическое обоснование выбранным оптимальным условиям синтеза. В [4–9] известные богатые барием оксиды состава Ba : Bi 7 : 2, 3 : 1, 5 : 2, 2 : 1, 3 : 2, 4 : 3 и 5 : 4 получены в эмпирически подобранных условиях, которые не обоснованы с физико-химической точки зрения, т.е. не исследована кинетика взаимодействия исходных реагентов, не определены составы промежуточных продуктов, образующихся на различных этапах отжига, не выявлены области термической устойчивости, характер плавления фаз. Не исследован и механизм формирования этих фаз.
Шольдером [4] в атмосфере кислорода в интервале температур 650–1000°С впервые синтезированы образцы катионного состава Ba : Bi 7 : 2, 3 : 1 и 5 : 2. Позже в этой системе методами рентгеновской дифракции и дифракции нейтронов [6–8] обнаружен перовскитоподобный твердый раствор Ba1 +xBi1 – xOy (0 ≤ x ≤ 0.5, 3.00 ≥ y ≥ 2.75). Наличие твердого раствора опровергнуто в [1]: методом электронной дифракции в просвечивающем электронном микроскопе установлено существование гомологического ряда оксидов Bam+nBimOy (m = 1–10; n = 0–5, 7–9, 11, 13, 17). Члены этого ряда характеризуются упорядоченной по барию и висмуту структурой, что подтверждается наличием индивидуальной сверхструктуры [1]. Структуры оксидов Bam+nBimOy слоистые вдоль выделенного направления [001] и образованы сдвоенными плоскостями ВаО, разделенными перовскитовыми блоками, содержащими одинарные слои ВаО и ВiO.
Синтезу отдельных составов обогащенного барием твердого раствора Ba1 +xBi1 –xOy (0 ≤ x ≤ 0.5, 3.00 ≥ y ≥ 2.75) посвящены работы [5–9]. Описанные в литературе образцы Ba1 +xBi1 –xOy были получены методом твердофазного синтеза, преимущественно из BaCO3 и Bi2O3, включающим длительные многостадийные (до шести–семи стадий [6]) отжиги с гомогенизацией и измельчением. Предлагаемые схемы синтеза не подтверждены в ходе поэтапного контроля фазового состава (рентгенофазовый анализ), содержания кислорода (химический или гравиметрический анализ) и кинетических исследований процесса синтеза оксидов Ba1 +xBi1 –xOy. Условия синтеза фазы состава Ba : Bi 2 : 1 с различным типом катионного упорядочения – Ba2$\left( {{\text{B}}{{{\text{a}}}_{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}{\text{Bi}}_{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}^{{3 + }}} \right)$Bi5+O5.67 [5], ${\text{B}}{{{\text{a}}}_{{\text{3}}}}{\text{BaBi}}_{2}^{{5 + }}{{{\text{O}}}_{9}}$ [7], $\left[ {{\text{B}}{{{\text{a}}}_{{{5 \mathord{\left/ {\vphantom {5 3}} \right. \kern-0em} 3}}}}{\text{Bi}}_{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}^{{3 + }}} \right]$BaBi5+O5.67 [8], Ba2+$\left[ {{\text{Ba}}_{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}^{{2 + }}{\text{Bi}}_{{{1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}}}^{{5 + }}} \right]$$\left[ {{\text{Bi}}_{{{3 \mathord{\left/ {\vphantom {3 6}} \right. \kern-0em} 6}}}^{{ + 5}}} \right]$O3 [9] − эмпирически подобраны и отличаются, по данным разных авторов, температурой, временем отжига, количеством стадий, атмосферой отжига, режимом охлаждения и другими характеристиками. Вместе с тем образцы одного и того же состава, и структуры синтезированы в существенно различающихся условиях. Сложная схема твердофазного синтеза и использование на различных этапах режима медленного охлаждения образцов [6] не позволяют адекватно соотнести фазовый состав образцов с температурой их отжига. В ряде работ отсутствует информация о способах закалки образцов, что также не позволяет корректно соотнести наблюдаемые структуры с температурой синтеза. Таким образом, процедура многостадийного синтеза образцов Ba1 +xBi1 –xOy в цитируемых работах не имеет физико-химического обоснования.
Анализ литературных данных показывает, что все синтезированные оксиды Ba1 +xBi1 –xOy характеризуются средней степенью окисления висмута $\overline {{\text{Bi}}} $ = 4.00–5.00. В исследованной области составов не обнаружены фазы, содержащие только Bi(III) или имеющие $\overline {{\text{Bi}}} $ = 3.00–4.00. Не известны методы выращивания кристаллов богатых барием оксидов системы Ba–Bi–O. Не выяснена принципиальная возможность формирования фаз оксидов бария–висмута, содержащих только Bi(III), в присутствии большого количества электроположительного катиона щелочноземельного металла Ba2+.
Основными технологическими параметрами синтеза оксидов Ba–Bi–O, строгое соблюдение которых обеспечивает получение однофазного продукта, являются температура, время отжига и атмосфера. Температуру синтеза определяет не только область термической устойчивости синтезируемого оксида, но также природа и физико-химические свойства исходных реагентов. Температура и время отжига должны быть оптимальными и обеспечивать, с одной стороны, полное взаимодействие исходных реагентов, с другой стороны, содержание кислорода, необходимое для конкретной фазы, который вносится с реагентами или из атмосферы синтеза.
Целью настоящей работы было определение оптимальных условий синтеза перовскитоподобных оксидов гомологического ряда Bam+nBimOy (m = 1–10; n = 0–5, 7–9, 11, 13, 17) с упорядоченной по катионам структурой и выявление роли кислорода в процессах фазообразования с их участием.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оксиды Bam+nBimOy получали керамическим способом в алундовых тиглях в горизонтальной трубчатой печи сопротивления, оснащенной прецизионным программным терморегулятором РИФ-101, используя в качестве исходных веществ BaO2 (Acros Organics, 95 мас. % основного вещества) или Ba(NO3)2 (ХЧ) и Bi2O3 (ОСЧ 13-3). Для соблюдения катионной стехиометрии оксида, синтезируемого из BaO2, содержание бария определяли гравиметрическим методом (массовая форма BaSO4).
Отжиги образцов начинали с температуры 600°C с повышением ее на каждой последующей стадии отжига на 50–100°C. Гомогенизацию закаленных образцов путем измельчения и прессования проводили после каждого отжига в течение 24 ч. Окончательно образцы отжигали при температуре, соответствующей области термической устойчивости синтезируемой фазы (табл. 1). При температуре ниже 600°C скорость взаимодействия исходных реагентов мала, а на воздухе в этих условиях высока вероятность образования карбонатных фаз. Эта технология позволила получить однофазные образцы обогащенных барием и Bi (V) фаз Bam+nBimOy, а в области ликвидуса – отдельных фаз, практически не содержащих Bi(V).
Таблица 1.
Области термической устойчивости (ΔТ) оксидов ряда Bam+nBimOy на воздухе [1]
| Состав оксида | ΔТ, °С | |
|---|---|---|
| Ba : Bi | Ba/Bi | |
| 15 : 4 | 3.75 | 1180–1265 |
| L-19 : 6 | 3.17 | 1000–1200 |
| H-19 : 6 | 3.17 | ~1200–1235 |
| 25 : 8 | 3.13 | 20–1000 |
| 3 : 1 | 3.00 | 845–965 |
| 17 : 6 | 2.83 | 1180–1210 |
| 11 : 4 | 2.75 | 20–845 |
| 21 : 8 | 2.63 | 2–810 |
| 18 : 7 | 2.57 | 1160–1180 |
| 5 : 2 | 2.50 | 20–770 |
| L-9 : 4 | 2.25 | 20–730 |
| H-9 : 4 | 1140–1160 | |
| 17 : 8 | 2.13 | 1120–1140 |
| L-2 : 1 | 2.00 | 20–695 |
| H-2 : 1 | 1100–1120 | |
| 17 : 9 | 1.89 | 1085–1100 |
| 9 : 5 | 1.80 | 1070–1085 |
| 3 : 2 | 1.50 | 1055–1070 |
| 4 : 3 | 1.33 | 1040–1055 |
| 5 : 4 | 1.25 | 1015–1040 |
Синтез субсолидусных фаз Bam+nBimOy катионного состава Ba : Bi 11 : 4–L-2 : 1 (L – низкотемпературная фаза) со значительными по протяженности областями термической устойчивости проводили при 1000°C с последующим медленным охлаждением образцов до температур, при которых получаемые фазы термодинамически устойчивы (табл. 1). При таком подходе образование карбонатов было минимизировано.
Среднюю степень окисления висмута $\overline {{\text{Bi}}} $ в синтезированных оксидах определяли методом йодометрического титрования.
Картины рентгеновской дифракции снимали при комнатной температуре на установке Siemens D-500 (CuKα1-излучение). Расчет параметров ячеек с погрешностью ±0.005 Å осуществляли методом профильного анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ построенных ранее схем фазовых равновесий в системе Ba–Bi–O [1–3] позволяет определить области термической устойчивости оксидов гомологического ряда Bam+nBimOy, а значит выявить оптимальные условия синтеза и выращивания кристаллов оксидов бария–висмута на воздухе (табл. 2).
Таблица 2.
Оптимальные температуры синтеза и выращивания кристаллов оксидов бария–висмута на воздухе, соответствующие их областям термической устойчивости (табл. 1)
| Синтез керамических образцов | Выращивание кристаллов | |||
|---|---|---|---|---|
| Состав фазы, Ba : Bi | Т, °С | Состав | Т, °С | |
| фаза, Ba : Bi | шихта BiO1.5, моль % | |||
| 15 : 4 | 1210 | 15 : 4 | 25–30 | 1250 |
| 19 : 6 | 1050–1150 | 19 : 6 | 27–30 | 1220 |
| 25 : 8 | 700–950 | 17 : 6 | 28–32 | 1190 |
| 3 : 1 | 900 | 18 : 7 | 30–32 | 1170 |
| 17 : 6 | 1200 | H-9 : 4 | 32–36 | 1150 |
| 11 : 4 | 700–800 | 17 : 8 | 32–40 | 1130 |
| 21 : 8 | 700 | H-2 : 1 | 35–42 | 1110 |
| 5 : 2 | 650 | 17 : 9 | 35–50 | 1095 |
| L-9 : 4 | 650 | 9 : 5 | 37–52 | 1075 |
| L-2 : 1 | 650 | 3 : 2 | 42–53 | 1060 |
| 4 : 3 | 45–54 | 1045 | ||
| 5 : 4 | 48–56 | 1025 | ||
При 600°C получаемые продукты представляют собой смеси фаз, составы которых соответствуют фазовому равновесию, исследованному при Р(O2) = 21–100 кПа [1]. При повышении температуры каждую из высокотемпературных фаз ряда Bam+nBimOy катионного состава Ba : Bi 17 : 9–5 : 4 синтезируют путем последовательного формирования оксидов, обогащенных Bi (V) – L-2 : 1 (Ba2Bi+4.78O4.39) и 1 : 1 (BaBiO3). В образцах происходят сначала твердофазные превращения в фазы 9 : 4, 5 : 2, 21 : 8, а в области ликвидус–солидус – жидкофазные превращения с потерей кислорода с участием фаз, обедненных кислородом в связи с восстановлением Bi(V) → Bi(III). Таким образом, формирование оксидов Bam+nBimOy происходит однотипно с образованием на начальной стадии двух фаз, обогащенных Bi(V) (в оксидах Ba2Bi+4.78O4.39 и BaBiO3, соответственно, 89 и 50% Bi(V) от общего висмута).
На рис. 1 для трех образцов состава Ba : Bi 9 : 4, 2 : 1 и 3 : 2 показан характер изменения средней степени окисления висмута от температуры отжига $\overline {{\text{Bi}}} $ = f(Tотж). При охлаждении расплава они поглощают кислород, о чем свидетельствует рост значений $\overline {{\text{Bi}}} $ с понижением температуры отжига в связи с окислением Bi(III) → Bi(V). Образцы в процессе поглощения “проходят” ряд двухфазных областей, в которых происходят жидкофазные (область ликвидус–солидус) и твердофазные (субсолидусная область) превращения с участием O2 и оксидов BamBim+nOy (m = 1–9; n = 0–3, 5, 7, 9) [1], ВаВiO3 и кислорододефицитных фаз ряда Ba2n${\text{Bi}}_{{n\,\, + \,\,1}}^{{3 + }}{\text{Bi}}_{{n\,\, - \,\,1}}^{{5 + }}$O6n– 1 (n = 1, 2, …) [2].
Рис. 1.
Зависимость средней степени окисления висмута $\overline {{\text{Bi}}} $ от температуры закалки Т образцов оксидов бария–висмута состава Ba : Bi 9 : 4 (1), 2 : 1 (2), 3 : 2 (3). Образцы расплавлены на воздухе, медленно охлаждены до температуры Т и закалены в жидком азоте. Прямые линии – области термической устойчивости (ОТУ) фаз Bam+nBimOy аналогичного состава.

Высокотемпературные фазы H-9 : 4 и H-2 : 1 формируются в расплаве в результате протекания реакций, обратных перитектическим, из оксидов с содержанием Ba : Bi 15 : 4, 19 : 6, 17 : 6, 18 : 7 (фаза H-9 : 4), 9 : 4 и 17 : 8 (фаза H-2 : 1). Оксиды H-9 : 4 и H-2 : 1 существуют в узком температурном интервале, соответственно, 1140–1160 и 1100–1120°C (табл. 1). При дальнейшем охлаждении фазы, окисляясь, формируют двухфазные области. Эти области образованы, с одной стороны, обогащенными барием составами с отношением Ba : Bi 19 : 6, 25 : 8, 3 : 1, 11 : 4, 21 : 8, 5 : 2 и обедненными им оксидами 17 : 8, 2 : 1 (для H-9 : 4), 17 : 9, 9 : 5, 3 : 2, 4 : 3, 5 : 4, кислорододефицитными фазами Ba2n${\text{Bi}}_{{n\,\, + \,\,1}}^{{3 + }}{\text{Bi}}_{{n\,\, - \,\,1}}^{{5 + }}$ [2] и ВаВiO3, с другой стороны. Охлаждение ниже температуры 730 и 695°C, соответственно, приводит к образованию (по данным рентгенографии) однофазных образцов низкотемпературных фаз L-9 : 4 и L-2 : 1, максимально насыщенных кислородом до значений $\overline {{\text{Bi}}} $ = 4.88–4.93 и 4.78. Аналогично формируются оксиды при Ba : Bi 19 : 6, 25 : 8, 3 : 1, 11 : 4, 21 : 8 и 5 : 2. Интенсивное поглощение кислорода происходит в интервале 900–1200°C в случае состава 9 : 4, 900–1000°C, если состав оксида 2 : 1, 800–1000°C в случае 3 : 2 и практически заканчивается при 600°C (рис. 1).
Оксид состава Ba : Bi 3 : 2, существующий в узком интервале температур (1055–1070°C) [1], не образует низкотемпературной, обогащенной кислородом фазы. Поглощение кислорода этим оксидом действует губительно: охлажденный до 20°C образец катионного состава 3 : 2 состоит из фазы L-2 : 1 и ВаВiO3 и характеризуется средней степенью окисления $\overline {{\text{Bi}}} $ = 4.33. Процесс окисления можно описать уравнением:
(1)
${\text{B}}{{{\text{a}}}_{{\text{3}}}}{\text{Bi}}_{2}^{{ + 3}}{{{\text{O}}}_{6}} + 0.695{{{\text{O}}}_{2}} \to {\text{BaBi}}{{{\text{O}}}_{3}} + {\text{B}}{{{\text{a}}}_{2}}{\text{B}}{{{\text{i}}}^{{ + 4.78}}}{{{\text{O}}}_{{4.39}}}.$При низком парциальном давлении кислорода (в атмосфере аргона при P(O2) = 1 кПа) четыре фазы ряда Bam+nBimOy состава H-9 : 4, H-2 : 1, 3 : 2 и 4 : 3 не претерпевают фазовых превращений в процессе медленного охлаждения до 20°С [1]. Окисление Bi(III) не происходит, и в образцах сохраняется неизменным содержание кислорода.
Если сравнить процессы окисления оксидов BamBim+nOy [10] и Bam+nBimOy, то общим является формирование кислорододефицитных фаз и их последовательное окисление ВаВiO2.55 → ВаВiO2.83 → → ВаВiO2.88 → ВаВiO3 в случае оксидов, существующих в области кристаллизации, как обогащенных барием, так и обогащенных висмутом. Отличие заключается в том, что оксиды Bam${\text{Bi}}_{{m + n}}^{{ + 3}}$Oy не способны к окислению без их разложения [10]. Члены ряда Bam+nBimOy состава L-19 : 6, 25 : 8, 3 : 1, 11 : 4, 21 : 8, 5 : 2, L-9 : 4 и L-2 : 1 имеют на воздухе значительные по протяженности области термической устойчивости (табл. 1), в пределах которых они не разлагаются. При медленном охлаждении до комнатной температуры эти фазы, за исключением 19 : 6 и 3 : 1, донасыщаются кислородом до максимальных, характерных для них, значений средней степени окисления висмута $\overline {{\text{Bi}}} ,$ сохраняя при этом свою структуру. Конечными продуктами окисления на воздухе ряда оксидов Bam +nBimOy состава 17 : 9, 9 : 5, 3 : 2 (реакция 1), 4 : 3, 5 : 4 являются фазы L-2 : 1 и 1 : 1.
В субсолидусной области промежуточных составов между фазами 3 : 1 и 1 : 1, 25 : 8 и 1 : 1 при P(O2) = 101 кПа формируются образцы, сингония усредненной ячейки которых согласно рентгенофазовому анализу кубическая [1]. Аналогичная картина наблюдается при отжиге в кислороде образцов, содержащих оксиды Bam${\text{Bi}}_{{m\,\, + \,\,n}}^{{ + 3}}$Oy [11]. На картинах электронной дифракции таких образцов не обнаружены сверхструктурные отражения, характерные для граничных фаз, что обусловлено малыми размерами (≈10 нм) их доменов. Их разориентация препятствует созданию дифракционных условий для возникновения сверхструктурных отражений, характерных для упорядоченных сверхъячеек граничных фаз. Формально картины рентгеновской и электронной дифракции таких образцов можно интерпретировать в рамках твердого раствора. Мелкодоменность образцов приводит к взаимному погасанию сверхструктурных рефлексов – картины рентгеновской и электронной дифракции выглядят как псевдокубические.
Примечательно, что обязательным условием образования мелкодоменных смесей оксидов как богатых барием (Bam+nBimOy), так и обедненных им (BamBim+nOy), является присутствие кислорода в процессе синтеза и участие фазы (или фаз) с высокой концентрацией Bi (V) ($\overline {{\text{Bi}}} $ ≥ 4.0). В кислороде процесс образования таких смесей ускоряется. На воздухе, как правило, требуется достаточно медленное охлаждение, порядка нескольких град./ч. В одной из ранних работ [9] такие мелкодоменные смеси были получены отжигом истинных фаз BamBim+nOy в кислороде при 550°С.
Образцы из богатой барием области системы Ba–Bi–O состава Ba : Bi (3–1.5) : 1, синтезированные в атмосфере кислорода и характеризующиеся значениями $\overline {{\text{Bi}}} $ = 4.98–4.38 [4], представляют собой смеси BaBiO3 и фазы 3 : 1. В процессе охлаждения в кислороде ниже 400°С фаза 3 : 1 изменяется на 25 : 8 ($\overline {{\text{Bi}}} $ = 4.98) [1]. Значения средней степени окисления в двухфазных образцах являются средневзвешенными для присутствующих в них фаз.
При P(O2) = 101 кПа фазы истинного катионного состава Ba : Bi 3 : 1 и 3 : 2 существуют в области высоких температур, соответственно, при ≈900–1200 и ≈1095–1130°С [1]. По всей вероятности, наложение основных рефлексов фаз BaBiO3 и 25 : 8 препятствовало их правильной идентификации в [4]. Образцы именно такого фазового состава были получены в [6, 7] в процессе дополнительного кислородного отжига и медленного охлаждения до комнатной температуры. Приведенные в [6, 7] значения средней степени окисления висмута характеризуют не индивидуальные фазы Ba : Bi 2 : 1, 3 : 2, 4 : 3 и 5 : 4, а смеси фаз, катионный состав которых определяется температурой отжига. Синтезированные на воздухе при 900 и 950°С образцы состоят из оксида 3 : 1 и кислорододефицитных фаз BaBiO2.88 или BaBiO2.83 соответственно.
Для оксидов Bam+nBimOy характерна изоструктурность, заключающаяся в идентичности картин рентгеновской дифракции и близости параметров элементарных ячеек, что приводит к наложению рефлексов и невозможности идентификации присутствующих в образце фаз. Однако на картинах электронной дифракции [1] обнаружены характерные для членов ряда Bam+nBimOy сверхструктурные отражения, что и позволило провести идентификацию фаз Bam+nBimOy. На рис. 2 показаны дифрактограммы двух оксидов – членов гомологического ряда Bam+nBimOy состава Ba : Bi 5 : 2 (n = 3 и m = 2) и 2 : 1 (n = 1 и m = 1). Несмотря на существенное отличие катионного состава и содержания кислорода (значения $\overline {{\text{Bi}}} ,$ соответственно, 4.95 и 4.78), картины рентгеновской дифракции идентичны, и параметры элементарных ячеек (пр. гр. Fm$\bar {3}$m) имеют близкие значения (соответственно, a = 8.807(5) и 8.776(5) Å).
Рис. 2.
Дифрактограммы образцов оксидов бария–висмута ряда Bam+nBimOy состава Ba : Bi 5 : 2 (а) и L‑2 : 1 (б), демонстрирующие их изоструктурность.
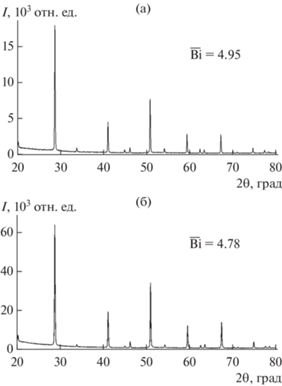
Оксиды 25:8–5:2 могут быть получены практически при полном окислении Bi(III) → Bi(V). Фазы 25:8 и 3:1, для которых $\overline {{\text{Bi}}} $ ≈ 5.00, стехиометрические по кислороду. Таким образом, в субсолидусной области в присутствии кислорода формируются оксиды с максимальным содержанием Bi(V), количество которого растет, так же, как и в случае обедненных кислородом фаз Bam+nBimOy из области ликвидус–солидус, пропорционально содержанию бария в оксиде.
По данным химических тестов [12] все оксиды Bam+nBimOy не содержат пероксидный дикислород. Единственным окислителем в оксидах является Bi (V). Исключение составляют оксиды состава Ba : Bi 4 : 3 и 5 : 4, не обладающие окислительными свойствами: они стехиометрические по содержанию кислорода и содержат только Bi(III).
ЗАКЛЮЧЕНИЕ
Явление гомологии, изначально обнаруженное во всех классах органических веществ, присуще и неорганическим веществам, в частности оксидам. Первые гомологические ряды (серии) перовскитоподобных оксидов известны с 1958 г. [14] и вошли в историю как фазы Раддлесдена–Поппера, описываемые общей формулой An + 1(B 'B)nO3n+ 1, где A = Ca, Sr, редкоземельные элементы, n = 1, 2, 3, …, B – d-элемент. Первыми фазами Раддлесдена–Поппера были оксиды ряда Srn+ 1TinO3n+ 1: Sr2TiO4 (n = 1), Sr3Ti2O7 (n = 2), Sr4Ti3O10 (n = 3) [13]. В структурах этих фаз чередуются диэлектрические слои со структурой NaCl и проводящие перовскитовые слои, что обеспечивает двумерный характер электрофизических свойств таких оксидов.
Дальнейшее развитие явления гомологии в неорганической химии связано с синтезом высокотемпературных сверхпроводящих оксидов, в частности оксидов рядов Bi2Sr2Can– 1CunO4 + 2n, Tl2Ba2Can– 1CunO4 + 2n, HgBa2Can– 1CunO2 + 2n+ δ, где n = 1, 2, 3,… [14–17]. Максимальные критические температуры сверхпроводящих переходов Tс, соответственно, 110, 127 и 135 К характерны для членов с n = 3.
Настоящая работа является доказательством гипотезы, предложенной в [18], о существовании единого гомологического ряда перовскитоподобных оксидов AmBm +nOy (Am +nBmOy), где m = 1, 2, 3, …, n = 0, 1, 2, 3, A = Ba, B = Bi. Эта гипотеза подтверждена синтезом ряда новых оксидов гомологических рядов Bam+nBimOy и BamBim+nOy, для которых определена структура и валентное состояние висмута [1, 3, 11]. Исследование фазовых равновесий в системе Ba–Bi–O комплексным методом послужило физико-химической основой направленного синтеза оксидов бария–висмута с широким набором валентных состояний висмута.
В [1, 3, 11] продемонстрирована удивительная способность висмута как металла с переменной валентностью образовывать гомологические ряды оксидов бария–висмута, включающие большое количество изоструктурных фаз с перовcкитоподобной структурой. Основная причина многообразия существующих в системе Ba–Bi–O гомологических рядов оксидов заключена в способности висмута в присутствии щелочноземельного металла стабилизировать структуру перовскита при разном соотношении в ней “разновалентных” ионов висмута в широком интервале значений $\overline {{\text{Bi}}} .$
В системе Ba–Bi–O не обнаружено твердого раствора замещения BaxBi1 –xОy (Ba1 –xBixОy), в структуре которых позиции бария и висмута (или калия и бария) смешанные. Правило Вегарда в широких интервалах составов не выполняется.
Первоначально предполагали [18], что состав оксидов Bam + nBimOy должен удовлетворять условию n ≤ 2m. Для синтезированных оксидов ряда Bam+nBimOy, обогащенных барием, состава Ba : Bi 15 : 4, 13 : 4, 19 : 6, 25 : 8 n > 2m, для фазы 3 : 1 n = 2m. Остальные оксиды удовлетворяют условию n < 2m.
Состав оксидов ряда Bam+nBimOy определяется числом перовскитовых блоков, находящихся между двойными слоями BaO [1]. Многообразие описанных в этом ряду фаз определяется валентными возможностями висмута: в отличие от перовскитоподобных оксидов ряда BamBim+nOy, представляющих собой оксиды бария–висмута(III), обогащенные барием фазы характеризуются широким набором значений $\overline {{\text{Bi}}} $ = 3.0–5.0. Впервые обнаружено, что в богатой барием области системы Ba–Bi–O при P(O2) = 21 кПа существуют оксиды Bam+nBimOy, обедненные Bi(V) до значений $\overline {{\text{Bi}}} $ = 3.01–3.04.
Формирование оксидов в системе Ba–Bi–O происходит, как правило, с участием окислителя через стадию образования фаз, обогащенных Bi(V). Окислителем, способным окислить Bi(III) → → Bi(V), является кислород – как атмосферный, так и образующийся при термическом разложении пероксида и нитрата бария. Таким образом, в основе синтеза и разложения оксидов Bam+nBimOy лежат окислительно-восстановительные процессы с участием кислорода и висмута в двух валентных состояниях – Bi(III) и Bi(V).
Оксиды ряда Bam+nBimOy, обогащенные Bi (V), не формируются без атмосферного кислорода при использовании исходных реагентов, не образующих окислителей при термическом разложении. Синтез таких оксидов происходит с участием кислорода, например:
(2)
$\begin{gathered} 4{\text{BaС}}{{{\text{O}}}_{3}} + {\text{B}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 0.89{{{\text{O}}}_{2}} \to \\ \to 2{\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{B}}{{{\text{i}}}^{{ + 4.78}}}{{{\text{O}}}_{{4.39}}} + 4{\text{С}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $При замене BaСO3 пероксидом BaO2 кислорода достаточно для окисления Bi(III), а избыток выделяется в виде газа:
(3)
$4{\text{Ba}}{{{\text{O}}}_{2}} + {\text{B}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \to 2{\text{B}}{{{\text{a}}}_{{\text{2}}}}{\text{B}}{{{\text{i}}}^{{ + 4.78}}}{{{\text{O}}}_{{4.39}}} + 1.11{{{\text{O}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} .$Кислород играет определяющую роль в процессах фазообразования в системе Ba–Bi–O. Области термической устойчивости четырех фаз (H-9 : 4, H-2 : 1, 3 : 2 и 4 : 3) значительно расширяются в инертной атмосфере (от области кристаллизации до 20°С) по сравнению с воздухом, где они составляют соответственно не более 15–20°С (табл. 1).
Синтезированные оксиды Bam+nBimOy с высокой концентрацией Bi (V) перспективны как катализаторы окислительного синтеза органических веществ, фотокализаторы. Не исключено наличие у оксидов люминесцентных свойств и свойств топологических изоляторов, какими обладает центральный оксид системы Ba–Bi–O – BaBiO3 [19–21].
Список литературы
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // ЖНХ. 1999. Т. 44. № 12. С. 2081. (Klinkova L.A., Nikolaichik V.I., Barkovskii N.V., Fedotov V.K. // Russ. J. Inorg. Chem. 1999. V. 44. № 12. P. 1974).
Клинкова Л.А., Николайчик В.И., Барковский Н.В., Федотов В.К. // ЖНХ. 1997. Т. 42. № 6. С. 905. (Klinkova L.A., Nikolaichik V.I., Barkovskii N.V., Fedotov V.K. // Russ. J. Inorg. Chem. 1997. V. 42. № 6. P. 810).
Klinkova L.A., Nikolaichik V.I., Barkovskii N.V., Fedotov V.K. // J. Solid State Chem. 1999. V. 146. № 2. P. 439. https://doi.org/10.1006/jssc.1999.8390
Von Sholder R., Ganter K.-W. // Z. Anorg. Allg. Chem. 1963. B. 19. H. 5–6. S. 375. https://doi.org/10.1002/zaac.19633190518
Licheron M., Gervais F., Coutures J., Choisnet J. // Solid State Commun. 1990. V. 75. № 9. P. 759. https://doi.org/10.1016/0038-1098(90)90241-3
Itoh M., Sawada T., Liang R., Kawaji H., Nakamura T. // J. Solid State Chem. 1990. V. 87. № 1. P. 245. https://doi.org/10.1016/0022-4596(90)90090-K
Reis K.P., Jacobson A.J., Kulik J. // Chem. Mater. 1993. V. 5. № 8. P. 1070. https://doi.org/10.1021/cm00032a007
Reis K.P., Jacobson A.J., Nicol J.M. // J. Solid State Chem. 1993. V. 107. Iss. 2. P. 428. https://doi.org/10.1006/jssc.1993.1367
Subramanian M.A. // J. Solid State Chem. 1994. V. 111. № 1. P.134. https://doi.org/10.1006/jssc.1994.1208
Барковский Н.В. // Журн. общей химии. 2021. Т. 91. № 1. С. 157. (Barkovskii N.V. // Russ. J. Gen. Chem. 2021. V. 91. № 1. P. 125. https://doi.org/10.1134/S107036322101013810.1134/S1070363221010138)https://doi.org/10.31857/S0044460X21010170
Клинкова Л.А., Барковский Н.В., Филатова М.В., Шевченко С.А. // Сверхпроводимость: физика, химия, техника. 1992. Т. 5. № 9. С. 1691.
Барковский Н.В. // Заводская лаборатория. Диагностика материалов. 2019. Т. 85. № 8. С. 16. https://doi.org/10.26896/1028-6861-2019-85-8-16-28
Ruddlesden S.N., Popper P. // Acta Cryst. 1958. V. 11. Part 1. P. 54. https://doi.org/10.1107/S0365110X58000128
Shimakawa Y., Kubo Y., Manako T., Nakabayashi Y., Igarashi H. // Physica C. 1988. V. 156. Iss. 1. P. 97. https://doi.org/10.1016/0921-4534(88)90111-6
Pickett W.E. // Rev. Mod. Phys. 1989. V. 61. P. 433. https://doi.org/10.1103/RevModPhys.61.433
Yamauchi H., Karppinen M., Tanaka S. // Physica C. 1996. V. 263. Iss. 1–4. P. 146. https://doi.org/10.1016/0921-4534(96)00075-5
Zaleski T.A., Kope T.K. // Acta Phys. Polon. A. 2004. V. 106. P. 561. https://doi.org/10.12693/APhysPolA.106.561
Клинкова Л.А. // Сверхпроводимость: физика, химия, техника. 1993. Т. 6. № 4. С. 855.
Yan B., Jansen M., Felser C. // Nature Phys. 2013. V. 9. P. 709. https://doi.org/10.1038/NPHYS2762
Tang J., Zou Z., Ye J. // J. Phys. Chem. C. 2007. V. 111. № 34. P. 12779. https://doi.org/10.1021/jp073344l
Men B., Zhang J., Diao C., Li X., Liu X., Zheng H. // J. Mater. Sci.: Mater. Electron. 2018. V. 29. № 15. P. 12729. https://doi.org/10.1007/s10854-018-9390-8
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


