Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 2, стр. 14-25
Структура и морфология медь- и селенсодержащих наносистем на основе водорастворимых полимерных стабилизаторов варьируемой природы
С. В. Валуева a, *, М. Э. Вылегжанина a, К. А. Митусова a, О. В. Назарова a, Ю. И. Золотова a, Е. Ф. Панарин a
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Россия
* E-mail: svalu67@mail.ru
Поступила в редакцию 12.03.2021
После доработки 19.06.2021
Принята к публикации 24.06.2021
- EDN: QNROJN
- DOI: 10.31857/S1028096022020182
Аннотация
Методами атомно-силовой и просвечивающей электронной микроскопии проведено сравнительное исследование новых синтезированных медь- и селенсодержащих наносистем на основе широкого спектра водорастворимых полимерных стабилизаторов (бычьего сывороточного альбумина, поли-4-акрилоилморфолина, водорастворимых статистических сополимеров 2-деокси-2-метакриламидо-D-глюкозы или 4-акрилоилморфолина с 2-диметиламиноэтилметакрилатом). На примере медь- и селенсодержащих наносистем показано влияние природы стабилизатора и наночастицы на структурно-морфологические характеристики и механизм формирования наноструктур/наночастиц. Установлено, что в водном растворе изученных наносистем формируются преимущественно сферические наноструктуры/наночастицы, размеры которых в значительной мере определяются природой наночастиц: медьсодержащие наноструктуры/наночастицы имеют меньшие значения размеров, чем селенсодержащие.
ВВЕДЕНИЕ
Создание гибридных наноматерилов полимер/металл(металлоид) путем формирования наночастиц в водных растворах полимеров дифильного строения является в последние годы востребованным направлением. В настоящее время, перспективным биогенным элементом является медь, так как, находясь в нуль-валентном (Cu0) состоянии, она обладает важными биологическими свойствами: антибактериальными, противовирусными, противоопухолевыми и фунгицидными, и в то же время характеризуется сравнительно низкой токсичностью [1–8]. Важно отметить, что соединения меди являются контактными фунгицидами в отношении большинства фитопатогенов [1, 5–8].
Синтез и результаты исследований физико-химических свойств наносистем на основе наночастиц биогенного элемента – селена с использованием полимерных стабилизаторов (ПС) различного химического строения и надмолекулярной организации представлены в работах [9–14]. Селен – жизненно важный микроэлемент, который выполняет в организме функцию антиоксиданта с иммуностимулирующим и противоопухолевым действием. В клинической медицине показана эффективность использования наночастиц селена в нуль-валентной форме (Se0) в комбинации с известными противоопухолевыми веществами [12, 14].
Однако, поскольку наночастицы являются кинетически неустойчивыми в растворе и имеют тенденцию к агломерации, то их необходимо стабилизировать. Наиболее эффективными стабилизаторами являются полимеры [14, 15]. Благодаря нековалентным (адсорбционным) взаимодействиям полимерных цепей с поверхностью растущих наночастиц образуются макромолекулярные экраны, препятствующие росту частиц и предохраняющие их от агрегации. Также необходимо отметить, что в присутствии сополимеров процесс восстановления ионов может протекать с более высокой скоростью, чем в случае соответствующих гомополимеров [15].
Стабилизация наночастиц полимерами может осуществляться как по стерическому, так и по электростерическому механизму [14–16] за счет разных по природе нековалентных (адсорбционных) взаимодействий полимерных цепей с поверхностью растущих наночастиц, при этом тип стабилизации определяется как природой наночастицы, так и природой ПС. Адсорбция макромолекул на наночастицах сопровождается формированием органической оболочки на неорганическом ядре и приводит к торможению роста наночастиц и улучшению термодинамического состояния раствора [17]. Кроме того, в таких процессах часто образуются наночастицы с достаточно узким распределением по размерам, а средний размер наночастиц, образующихся в присутствии органических соединений, существенно меньше, чем в их отсутствие [18].
Цель настоящей работы – синтез и сравнительное исследование структурно-морфологических характеристик новых медь- и селенсодержащих наносистем на основе водорастворимых полимерных стабилизаторов варьируемой природы (различного химического строения и надмолекулярной организации). В качестве стабилизаторов наночастиц Cu0 и Se0 были выбраны: глобулярный белок бычий сывороточный альбумин (БСА), статистические сополимеры 2-деокси-2-метакриламидо-D-глюкозы (СП-I) или 4-акрилоилморфолина (СП-II) с 2-диметиламиноэтилметакрилатом и гомополимер поли-4-акрилоилморфолин (ПАМ) (табл. 1). Эти ПС являются биосовместимыми нетоксичными полимерами-носителями [9, 19–22] для модификации лекарственных веществ с полифункциональной биологической активностью. Данные по молекулярным массам (ММ), составам и химическому строению этих материалов приведены в табл. 1.
Таблица 1.
Структурные формулы и молекулярные массы (ММ) полимерных стабилизаторов (ПС)
| Название | Структурная формула |
|---|---|
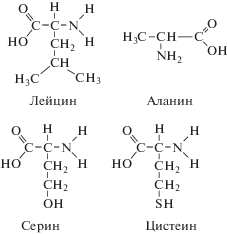
| Бычий сывороточный альбумин (БСА), ММ составляет 65 000 | Ниже представлены аминокислоты, входящие в состав БСА и имеющие гидрофобные группы:
 |
| Сополимер (СП-I) 2-деокси-2-метакриламидо-D-глюкозы (МАГ) с 2-диметиламиноэтилметакрилатом (ДМАЭМ), ММ составляет 43 000. Соотношение МАГ : ДМАЭМ составляет 30 : 70 моль. % | 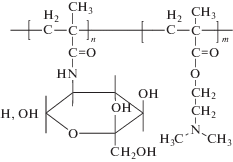 |
| Сополимер (СП-II) 4-акриломорфолина (АМ) с 2-диметиламиноэтилметакрилатом (ДМАЭМ), ММ составляет 57 000. Соотношение АМ : ДМАЭМ составляет 50 : 50 моль. % | 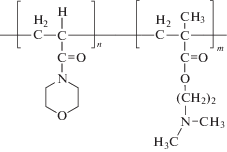 |
| Поли-4-акрилоилморфолин (ПАМ), ММ составляет 60 500 | 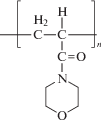 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Для синтеза наночастиц меди и селена использовали сульфат меди, аммиак водный (“Реахим”, Москва), гидразин гидрат, селенистая и аскорбиновая кислоты (“Вектон”, Санкт-Петербург).
Бычий сывороточный альбумин (БСА), лиофилизированный, стерильный, 100 мг (ООО “БиолоТ”, Санкт-Петербург). Молекулярная масса БСА 65 КДа, чистота 99%.
Синтез ПАМ, СП-I и СП-II осуществляли методом свободно-радикальной сополимеризации сомономеров в растворе N,N-диметилформамида (ДМФА) в присутствии инициатора (2,2′-азо-бис-изобутиронитрила) при температуре 60°С в течение 24 ч в запаянных ампулах в атмосфере аргона. Полученные сополимеры очищали от низкомолекулярных примесей диализом против воды. Использовали диализные мембраны Spectra/Por 7 фирмы “Spectrum Lab. Inc.” (США), позволяющие удалять соединения с молекулярной массой М ≤ 1000. Сополимеры из водных растворов выделяли лиофильной сушкой. Состав сополимеров СП-I и СП-II определяли методами потенциометрического титрования звеньев ДМАЭМ и методом 1Н ЯМР-спектроскопии. Результаты обоих методов совпадали [22, 23]. Выход СП-I составил 81 масс. %, конверсия для СП-II и ПАМ составляла 83 и 92 масс. % соответственно.
Методы исследования
Регистрация спектров поглощения. Измерения оптической плотности D гибридных медь- и селенсодержащих наносистем проводили на спектрофотометре Shimadzu UV-1280 в диапазоне длин волн 185–900 нм в термостатируемом режиме, при этом использовали кварцевые кюветы с толщиной фотометрического слоя 1 см. Относительная суммарная погрешность при регистрации спектров не превышала 2%.
Изучение морфологии гибридных медь- и селенсодержащих наносистем методом атомно-силовой микроскопии
Исследование морфологии гибридных медь- и селенсодержащих наносистем ПС/Cu0 и ПС/Se0 проводили методом атомно-силовой микроскопии (АСМ), при этом использовали атомно-силовой микроскоп Nanotop NT-206 (ОДО “Микротестмашины”, Беларусь). Наносистемы наносили на поверхность свежего скола слюды. Измерения выполняли в атмосферных условиях в контактном режиме с использованием кремниевых кантилеверов FMG01 с коэффициентом жесткости k = 3.0 Н/м и радиусом кривизны кончика острия 10 нм. Экспериментальные данные обрабатывали с помощью программы Surface Explorer, в том числе рассчитывали среднеарифметическое отклонение профиля Ra и среднеквадратичное отклонение профиля Rq для отображаемого участка поверхности.
Исследования гибридных медь- и селенсодержащих наносистем методом просвечивающей электронной микроскопии
Исследования гибридных медь- и селенсодержащих наносистем методом просвечивающей электронной микроскопии (ПЭМ) проводили на электронном микроскопе BS-500 (“Tesla”, Чехия) при ускоряющем напряжении U = 60 кВ, в диапазоне увеличений ×9000–30 000. Перед исследованием наносистемы наносили на медную сетку, покрытую углеродной пленкой, затем сушили на воздухе.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез наночастиц нуль-валентной меди
Наночастицы нуль-валентной меди получали восстановлением сульфата меди CuSO4⋅5H2O гидразин гидратом N2H4⋅H2O в водном растворе в присутствии ПС по реакции (1):
(1)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{N}}}_{2}}{{{\text{H}}}_{4}} + 4{\text{O}}{{{\text{H}}}^{ - }} \to 2{\text{C}}{{{\text{u}}}^{0}} + {{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \,4{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$Согласно работе [24], кроме наночастиц Cu0 в качестве примесей могут образоваться наночастицы оксидов меди. Чтобы избежать образования примесей, реакцию восстановления проводили в два этапа. Сначала к водному раствору CuSO4 и полимерных растворителей добавляли водный аммиак до рН = 10.8 (цвет раствора становился ярко синим), чтобы обеспечить полное связывание Cu2+ в комплексный ион:
(1')
$\begin{gathered} 2{\text{CuS}}{{{\text{O}}}_{4}} + 4{\text{N}}{{{\text{H}}}_{3}} + {{{\text{N}}}_{2}}{{{\text{H}}}_{4}} = \\ = 2{\text{C}}{{{\text{u}}}^{0}} + 2{{{\text{N}}}_{2}}{\kern 1pt} \uparrow + \,2{{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{S}}{{{\text{O}}}_{4}}. \\ \end{gathered} $Концентрация наночастиц меди в дисперсиях составляла: СCu = 0.005 маcс. %, концентрация полимерных стабилизаторов СПС = 0.1 маcс. % (ν = = СCu/СПС = 0.05, где ν – массовое соотношение концентраций наночастиц и полимерных стабилизаторов) [14, 15]. Полученные наносистемы стабильны не менее 1–2 мес.
Синтез наночастиц нуль-валентного селена
Синтез наночастиц нуль-валентного селена осуществлялся в результате реакции (2) между селенистой (H2SeO3) и аскорбиновой (C6H8O6) кислотами в присутствии полимерных стабилизаторов:
(2)
${{{\text{H}}}_{2}}{\text{Se}}{{{\text{O}}}_{3}} + 2{{{\text{C}}}_{6}}{{{\text{H}}}_{8}}{{{\text{O}}}_{6}} \to {\text{S}}{{{\text{e}}}^{0}} + 3{{{\text{H}}}_{2}}{\text{O}} + 2{{{\text{C}}}_{6}}{{{\text{H}}}_{8}}{{{\text{O}}}_{6}}.$В реакционную колбу помещали водный раствор ПС (СПC = 0.1 маcс. %) и раствор H2SeO3 (СSe = = 0.005 маcс. %, ν = СSe/СПС = 0.05) [14, 15]. Смесь перемешивали при комнатной температуре 20 мин, затем добавляли раствор аскорбиновой кислоты в соотношении 1 : 2. После введения всех компонентов раствор выдерживали при комнатной температуре в течение суток. По завершении реакции раствор приобретал красновато-оранжевый цвет. В отсутствие полимерных стабилизаторов наночастицы селена показали низкую агрегативную устойчивость. Введение ПС в реакционную среду позволило получить стабильные дисперсии, сохраняющие свои физико-химические свойства в течение 2–3 мес.
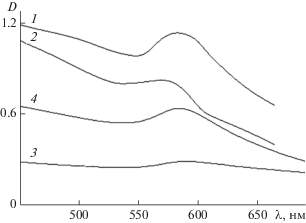
Максимум в спектрах поглощения исследуемых медьсодержащих наносистем ПС/Cu0 регистрировался при λ = 580–590 нм (рис. 1), что соответствует полосе поверхностного плазмонного резонанса (ППР) в водном растворе наночастиц меди в нуль-валентном состоянии [25]. Полосы поглощения, характерные для оксидов меди, обычно наблюдаемые в диапазонах λ = 300–450 и 700–750 нм [26], на представленных спектрах отсутствовали. Следует отметить, что ПС, представленные в табл. 1, в данном диапазоне длин волн (λ = 300–750 нм) не поглощают.
Рис. 1.
УФ/видимые спектры для гибридных медьсодержащих наносистем: БСА/Cu0 (кривая 1), (СП-I)/Cu0 (кривая 2), (СП-II)/Сu0 (кривая 3) и ПАМ/Cu0 (кривая 4).
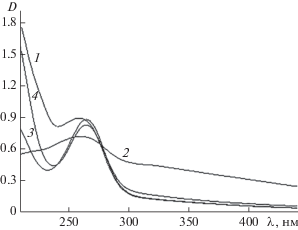
В случае селенсодержащих наносистем ПС/Se0 (рис. 2) на оптических спектрах поглощения наблюдаются четко выраженные полосы поглощения при λ = 260–270 нм, что свидетельствует об образовании в водном растворе наночастиц селена в нуль-валентном состоянии [13–15].
Рис. 2.
УФ/видимые спектры гибридных селенсодержащих наносистем: БСА/Se0 (кривая 1), (СП-I)/Se0 (кривая 2), (СП-II)/Se0 (кривая 3) и ПАМ/Se0 (кривая 4).
Ввиду того, что в щелочной области рН сополимеры не заряжены, максимум полосы ППР для наносистем (СП-I)/Cu0 и (СП-II)/Cu0 можно объяснить межмолекулярными взаимодействиями поверхностного плазмона наночастиц меди с гидрофобными (например, CH2– и CH3–) группами молекул сополимеров, т.е. имеет место стерический механизм стабилизации. Учитывая наличие заряженных в кислой среде групп на СП-I и СП-II, можно предположить, что наночастицы Se0 будут взаимодействовать с макромолекулами сополимеров по электростерическому механизму.
БСА заряжен во всем диапазоне рН: в кислой области значений рН заряжены, например, группы аланин и цистеин, а в щелочной области значений рН ионизация происходит по карбоксильным группам аминокислот; кроме того, БСА имеет различные гидрофобные фрагменты (например, аминокислоты лейцин, цистеин и аланин) (табл. 1). Учитывая это, можно предположить, что стабилизация наночастиц меди и наночастиц селена бычьим сывороточным альбумином происходит по электростерическому механизму.
При использовании в качестве ПС наночастиц меди и селена гомополимера ПАМ, который во всем диапазоне рН не проявляет зарядовых эффектов, реализуется стерический механизм стабилизации.
На рис. 3а–3г представлены 3D-изображения поверхности тонких пленок (для матрицы сканирования 5 × 5 мкм), отлитых из медьсодержащих нанодисперсий: БСА/Cu0 (рис. 3а), (СП-I)/Cu0 (рис. 3б), (СП-II)/Сu0 (рис. 3в) и ПАМ/Cu0 (рис. 3г) при ν = 0.05, полученные в контактном режиме при комнатной температуре на слюде методом АСМ. На 3D-изображении для наносистемы БСА/Cu0 (рис. 3а) наблюдаютcя как отдельные сферические наноструктуры (наночастицы меди, окруженные органической фазой) диаметром 80–150 нм (табл. 2), так и их агрегаты размером 200–400 нм, при этом пленка имеет нанопористую структуру. Поверхность пленки гладкая, параметры отклонений составляют Ra = 0.7 нм и Rq = 1.0 нм.
Рис. 3.
3D-изображения поверхности тонких пленок, полученных из водных растворов медьсодержащих наносистем на слюде: БСА/Cu0 (а), (СП-I)/Cu0 (б), (СП-II)/Сu0 (в) и ПАМ/Cu0 (г).
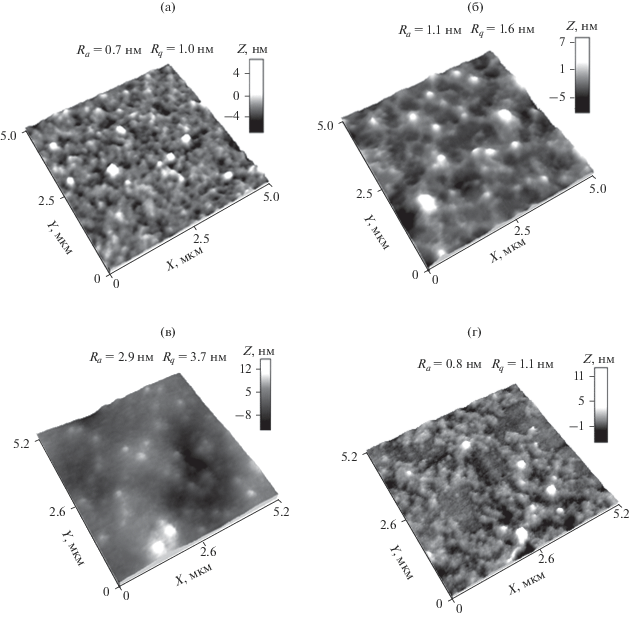
Таблица 2.
Данные по размерам ($D_{{{\text{АСМ}}}}^{*}$ и $D_{{{\text{ПЭМ}}}}^{*}$), среднеарифметическому отклонению профиля Ra и среднеквадратичному отклонению профиля Rq для медь- и селенсодержащих наносистем на основе БСА, СП-I, СП-II и ПАМ при ν = 0.05
| Наносистема | $D_{{{\text{АСМ}}}}^{*}$, нм | Ra, нм | Rq, нм | $D_{{{\text{ПЭМ}}}}^{*}$, нм |
|---|---|---|---|---|
| БСА/Cu0 | 80–150 | 0.7 | 1.0 | 7.5 |
| БСА/Se0 | 100–200 | 2.3 | 3.7 | 12.5 |
| (СП-I)/Cu0 | 100–200 | 1.1 | 1.6 | 7.5 |
| (СП-I)/Se0 | 150–300 | 6.2 | 9.2 | 20.0 |
| (СП-II)/Сu0 | 100–150 | 2.9 | 3.7 | 7.5 |
| (СП-II)/Se0 | 200–250 | 7.5 | 10.0 | 12.5 |
| ПАМ/Cu0 | 80–100 | 0.8 | 1.1 | 12.5 |
| ПАМ/Se0 | 140–200 | 3.3 | 4.5 | 35 |
На 3D-изображении, полученном для медьсодержащей наносистемы (СП-I)/Cu0 (рис. 3б), визуализируются структуры двух морфологических типов: отдельные органо-неорганические наноструктуры на основе наночастиц Cu0 и сополимера с архитектурой типа “ядро–оболочка” (наночастицы меди, окружeнные органической фазой) диаметром 10–200 нм (I тип (табл. 2)); наноструктуры сгруппированные в агрегаты микронных размеров, имеющие сложную морфологию (II тип структуры). Между собой агрегаты соединены тяжами (“тяжевая структура” пленки), имеющими толщину 100–200 нм. В ряде случаев эти тяжи “наполнены” наноструктурами I типа. Расчетные математические параметры среднеарифметическое отклонение Ra и среднеквадратичное отклонение профиля Rq для отображаемого участка поверхности пленки невелики и имеют следующие значения: Ra = 1.1 нм и Rq = 1.6 нм (табл. 2).
3D-изображение поверхности тонкой пленки, отлитой из медьсодержащей нанодисперсии (СП-II)/Cu0 (рис. 3в), кардинально отличается от предыдущего случая: здесь наблюдаютcя дискретные сферические наноструктуры с достаточно узким распределением по размерам, имеющие диаметр 100–150 нм (табл. 2). Поверхность пленки более рельефная (по сравнению с другими медьсодержащими наносистемами), параметры отклонений больше и составляют Ra = 2.9 нм и Rq = 3.7 нм (табл. 2).
Для наносистемы ПАМ/Cu0 наблюдаютcя структуры двух морфологических типов: отдельные сферические компактные наноструктуры диаметром 50–100 нм (табл. 2) и кольцевые агрегаты размером ~0.5–0.7 мкм (рис. 3г). Пленка, полученная из водного раствора наносистемы ПАМ/Cu0, имеет островковую структуру, при этом параметры Ra и Rq невелики и составляют 0.8 и 1.1 нм соответственно (табл. 2). Состояние, когда сосуществуют относительно малые наноструктуры меди (сферической формы) с крупными агрегированными образованиями (произвольной формы), возможно при взаимодействиях макромолекул с растущими наночастицами, усиливающимися по ходу реакции получения золя [14].
Анализ данных АСМ показал, что размеры наноструктур $D_{{{\text{АСМ}}}}^{*}$ для изученных медьсодержащих наносистем уменьшаются в ряду: $D_{{{\text{АСМ}}}}^{*}$ (ПАМ/Cu0) < $D_{{{\text{АСМ}}}}^{*}$ (БСА/Cu0) < $D_{{{\text{АСМ}}}}^{*}$ ((СП-II)/Сu0) < $D_{{{\text{АСМ}}}}^{*}$ ((СП-I)/Cu0).
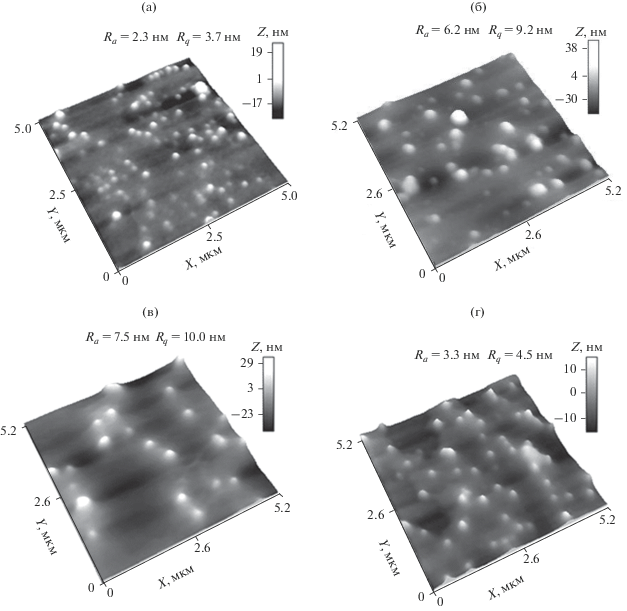
На рис. 4а–4г представлены 3D-изображения поверхности тонких пленок (для матрицы сканирования 5 × 5 мкм), отлитых из селенсодержащих нанодисперсий: БСА/Se0 (рис. 4а), (СП-I)/Se0 (рис. 4б), (СП-II)/Se0 (рис. 4в) и ПАМ/Se0 (рис. 4г), при ν = 0.05. Видно, что для селенсодержащих наносистем, в отличие от медьсодержащих наносистем, не наблюдается разнообразия в морфологии образовавшихся наноструктур. Здесь во всех случаях формируются дискретные сферы диаметром в диапазоне $D_{{{\text{АСМ}}}}^{*}$ = 100–300 нм (табл. 2). Размеры $D_{{{\text{АСМ}}}}^{*}$ селенсодержащих наноструктур уменьшаются в ряду: $D_{{{\text{АСМ}}}}^{*}$ (БСА/Se0) < $D_{{{\text{АСМ}}}}^{*}$ (ПАМ/Se0) < < $D_{{{\text{АСМ}}}}^{*}$ ((СП-II)/Se0) < $D_{{{\text{АСМ}}}}^{*}$ ((СП-I)/Se0), что практически совпадает с аналогичной тенденцией для медьсодержащих наносистем. Расчетные математические параметры (среднеарифметическое отклонение Ra и среднеквадратичное отклонение профиля Rq) для отображаемых участков поверхностей пленок, отлитых из селенсодержащих нанодисперсий, имеют большие величины, чем аналогичные параметры для соответствующих медьсодержащих наносистем: Ra = 2.3–7.5 нм и Rq = = 3.7–10.0 нм (табл. 2).
Рис. 4.
3D-изображения поверхности тонких пленок, полученных из водных растворов селенсодержащих наносистем на слюде: БСА/Se0 (а), (СП-I)/Se0 (б), (СП-II)/Se0 (в) и ПАМ/Se0 (г).
Методом просвечивающей электронной микроскопии были изучены наночастицы меди, стабилизированные БСА, гомо- и сополимерами, представленными в табл. 1. На микрофотографиях (рис. 5а–5г) видно, что сформировавшиеся наночастицы Cu0 имеют сферическую форму, причем в случае использования в качестве ПС глобулярного белка БСА наблюдаются полиядерные наноструктуры.
Рис. 5.
Микрофотографии (данные ПЭМ) наноcистем ПС/Cu0 и соответствующие гистограммы распределения наночастиц меди в наносистемах: БСА/Cu0 (а), (СП-I)/Cu0 (б), (СП-II)/Сu0 (в) и ПАМ/Cu0 (г).
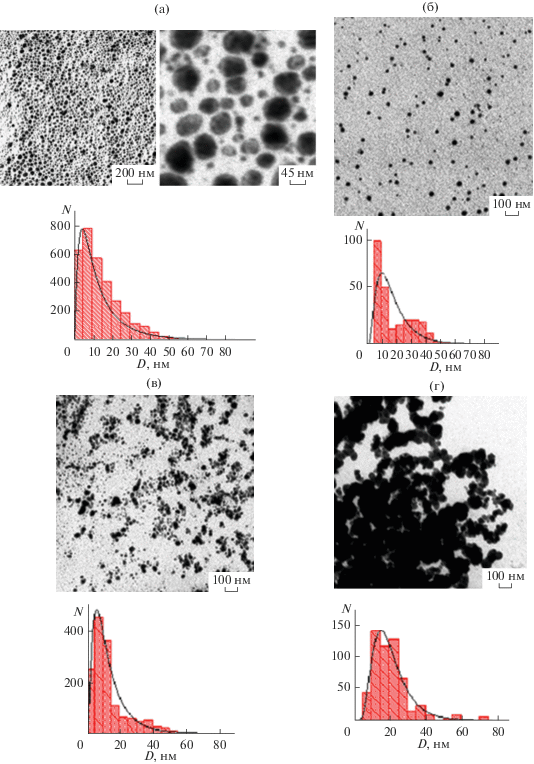
Распределения наночастиц меди по размерам (гистограммы на рис. 5а–5г) рассчитывали на основе ПЭМ-изображений с помощью программы ImageJ 1.51. Анализ полученных гистограмм позволил установить, что наиболее вероятные размеры (соответствуют точке максимума на гистограмме) наночастиц меди изменялись от 7.5 (БСА/Cu0) до 12.5 нм (ПАМ/Cu0) (табл. 2). Из литературных данных [27, 28] известно о двух принципиально возможных механизмах формирования наночастиц: последовательном и параллельном. В процессе последовательного роста частицы формируются посредством присоединения на каждой стадии одного атома. Случайный процесс присоединения, происходящий на каждой последующей стадии с равной вероятностью, приводит к образованию продукта, подчиняющегося нормальному (Гауссову) распределению. Случайный процесс, в котором реализуется параллельный механизм роста, приводит к образованию продукта, подчиняющегося логарифмически нормальному распределению (ЛНР). Как видно из рис. 5а–5г, для всех изученных медьсодержащих наносистем БСА/Cu0, (СП-I)/Cu0, (СП-II)/Сu0 и ПАМ/Cu0 формирование наночастиц меди описывается ЛНР. Размеры наночастиц меди уменьшаются в ряду: $D_{{{\text{ПЭМ}}}}^{*}$(БСА/Cu0) = $D_{{{\text{ПЭМ}}}}^{*}$((СП-II)/Cu0) = = $D_{{{\text{ПЭМ}}}}^{*}$((СП-I)//Cu0) < $D_{{{\text{ПЭМ}}}}^{*}$(ПАМ/Cu0).
Из рис. 6а–6г видно, что сформировавшиеся наночастицы Se0 имеют сферическую форму и дискретны по всей матрице ПС. Распределения наночастиц селена имеют унимодальный характер и подчиняются Гауссову закону (гистограммы на рис. 6а–6г), т.е. для селенсодержащих наносистем имеет место последовательный механизм формирования наночастиц селена. Наиболее вероятные размеры наночастиц селена изменялись от 12.5 (БСА/Cu0) до 35.0 нм (ПАМ/Cu0) (табл. 2). Аналогичная ситуация наблюдалась нами для селенсодержащих наносистем на основе других полимерных стабилизаторов различной природы (неионогенные полимеры (ПВП, ОЭЦ), катионный ПТМАЭМ и анионные (поли-2-акриламидо-2-метилпро-пансульфокислота и полиметакриловая кислота), полиэлектролиты) [29]: формировались сферические наноструктуры с размером наночастиц селена 12–30 нм. Важно отметить, что при использовании одного и того же ПС медьсодержащие наночастицы имеют меньшие значения размеров $D_{{{\text{ПЭМ}}}}^{*},$ чем селенсодержащие. Это обусловлено большей степенью гидрофобности наночастиц селена по сравнению с наночастицами меди. Размеры наночастиц селена уменьшаются в ряду: $D_{{{\text{ПЭМ}}}}^{*}$(БСА/Se0) = $D_{{{\text{ПЭМ}}}}^{*}$((СП-II)/Se0) < < $D_{{{\text{ПЭМ}}}}^{*}$((СП-I)/Se0) < $D_{{{\text{ПЭМ}}}}^{*}$ (ПАМ/Se0), что симбатно тенденции для медьсодержащих наносистем.
Рис. 6.
Микрофотографии (данные ПЭМ) наноcистем ПС/Se0 и соответствующие гистограммы распределения наночастиц селена в наносистемах: БСА/Se0 (а), (СП-I)/Se0 (б), (СП-II)/Se0 (в) и ПАМ/Se0 (г).
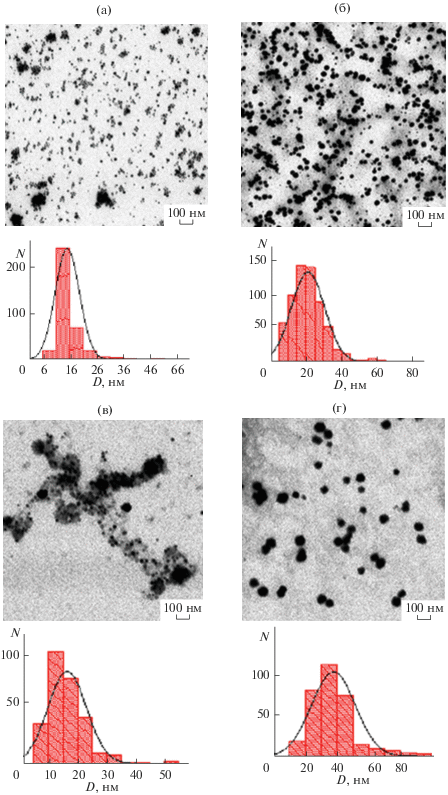
Важно отметить, что ряды по размерам наночастиц меди и селена $(D_{{{\text{ПЭМ}}}}^{*})$ не повторяют аналогичные ряды для медь- и селенсодержащих наноструктур $(D_{{{\text{АСМ}}}}^{*}).$ Так, хорошо видно, что более компактные наноструктуры ПАМ/Cu0 и ПАМ/Se0 имеют более массивное ядро, чем наноструктуры, полученные на основе других изученных стабилизаторов (БСА, СП-I и СП-II).
Таким образом, регулирование размеров/морфологии наноструктур и типа стабилизации образующихся наночастиц может осуществляться путем варьирования природы полимерного стабилизатора и наночастицы. Это может найти применение при наноструктурировании полимерных материалов, используемых для биомедицинских приложений.
ЗАКЛЮЧЕНИЕ
1. Синтезированы новые наносистемы на основе наночастиц меди и селена в нуль-валентном состоянии (Cu0 и Se0) и полимерных стабилизаторов различного химического строения и надмолекулярной организации: бычьего сывороточного альбумина (БСА), сополимера (СП-I) 2-деокси-2-метакриламидо-D-глюкозы (МАГ) с 2-диметиламиноэтилметакрилатом (ДМАЭМ), сополимера (СП-II) 4-акриломорфолина (АМ) с ДМАЭМ и гомополимера поли-4-акрилоилморфолина (ПАМ). Установлено, что восстановление в воде ионов биогенных элементов в присутствии этих полимерных стабилизаторов за счет достаточно хорошей экранировки позволяет получать сферические наноструктуры диаметром, не превышающим 300 нм. Наиболее вероятные размеры наночастиц не превышают 35 нм.
2. Показана возможность регулирования структурно-морфологических параметров наноструктур/наночастиц путем варьирования природы наночастицы и ПС. Установлено, что размеры сферических наноструктур/наночастиц в значительной мере определяются природой наночастиц: медьсодержащие наноструктуры/наночастицы имеют меньшие значения размеров ($D_{{{\text{АСМ}}}}^{*}$ и $D_{{{\text{ПЭМ}}}}^{*}$), чем селенсодержащие. Это обусловлено большей степенью гидрофобности наночастиц селена по сравнению с наночастицами меди. С другой стороны, размеры наноструктур $D_{{{\text{АСМ}}}}^{*}$ в значительной мере зависят и от химического строения и надмолекулярной организации полимерного стабилизатора и уменьшаются в ряду: $D_{{{\text{АСМ}}}}^{*}$ (ПАМ/Cu0) < < $D_{{{\text{АСМ}}}}^{*}$ (БСА/Cu0) < $D_{{{\text{АСМ}}}}^{*}$ ((СП-II)/Сu0) < $D_{{{\text{АСМ}}}}^{*}$ ((СП-I)/Cu0) и $D_{{{\text{АСМ}}}}^{*}$ (БСА/Se0) < $D_{{{\text{АСМ}}}}^{*}$ (ПАМ/Se0) < < $D_{{{\text{АСМ}}}}^{*}$ ((СП-II)/Se0) < $D_{{{\text{АСМ}}}}^{*}$ ((СП-I)/Se0).
3. Расчеты показали, что построенные по экспериментальным данным унимодальные распределения наночастиц меди и селена подчиняются Логнормальному (параллельный механизм роста наночастиц) или Гауссову закону (последовательный механизм роста наночастиц) соответственно.
Список литературы
Borkow G., Gabbay J. // Current Chemical Biology 2009. V. 3. P. 272. https://doi.org/10.2174/2212796810903030272
Lansdown A.B.G., Sampson B., Rowe A. // J. Anat. 1999. V. 195. P. 375. https://doi.org/10.1046/j.1469-7580.1999.19530375.x
Shende S., Ingle A.P., Gade A., Rai M. // World Journal of Microbiology and Biotechnology. 2015. V. 31. № 6. P. 865. https://doi.org/10.1007/s11274-015-1840-3
Halevas E.G., Pantazaki A.A. // Nanomed. Nanotechnol. J. 2018. V. 2. № 1. P. 119.
Pawan K., Choudhary R., Pal A., Mony Ch., Adholeya A. // J. Current Topics in Medicinal Chemistry. 2020. V. 20. № 1. P. 1009. https://doi.org/10.2174/1568026620666200330160810
Cioffi N., Torsi L., Ditaranto N. // Appl. Phys. Lett. 2004. V. 85. № 12. P 2417. https://doi.org/10.1063/1.1794381
Abd-Elsalam K.A., Vasil’kov A.Y., Said-Galiev E.E. et al. // Eur. J. Plant. Pathol. 2018. V. 151. P. 57. https://doi.org/10.1007/s10658-017-1349-8
Mekahlia S., Buzid B. / Physics Procedia. 2009. V. 2. P. 1045. https://doi.org/10.1016/j.phpro.2009.11.061
Sukhanova T.E., Valueva S.V., Vylegzhanina M.E., Kutin A.A., Derylo-Marczewska A. Morphology, Toxicity and bioactivity of selenium-containing nanostructures based on physiologically active polymer and proteins. Chapter 6, in “Selenium: Dietary Sources, Properties and Role in Human Health”, Nova Science Publishers, Inc. New York», USA. 2015. Editor Wanda Morrison. ISBN: 978-1-63483-690-6.
Валуева С.В., Вылегжанина М.Э., Алексеева П.Е., Суханова Т.Е. // Журн. технической физики. 2018. Т. 88. № 9. С. 1290. https://doi.org/10.21883/JTF.2018.09.46411.2585
Валуева С.В., Киппер А.И. // Журн. физ. химии. 2017. Т. 91. № 4. С. 577. https://doi.org/10.7868/S004445371704032X
Валуева С.В., Азизбекян С.Г., Кучинский М.П. и др.// Журн. Нанотехника. 2012. № 4(32). С. 53.
Valueva S.V., Vylegzhanina M.E., Kutin A.A. et al. // J. of Sol-Gel Science and Technology. 2019. V. 92. № 2. P. 408. https://doi.org/10.1007/s10971-019-05065-5
Валуева С.В., Вылегжанина М.Э., Митусова К.А., Безрукова М.А., Назарова О.В., Золотова Ю.И., Панарин Е.Ф. // Поверхность. Рентген., синхротр. и нейтрон. исслед. 2021. № 2. С. 15. https://doi.org/10.31857/S1028096021020151
Валуева С.В., Вылегжанина М.Э., Боровикова Л.Н., Назарова О.В., Безрукова М.А., Золотова Ю.И., Панарин Е.Ф. // Журнал физической химии. 2020. Т. 94. № 8. С. 1248. https://doi.org/10.31857/S0044453720080294
Mayer A.B.R. // Polym. Adv. Technol. 2001. V. 12. P. 96. https://doi.org/10.1002/1099-1581(200101/02)12:1/2<96: :AID-PAT943>3.0.CO;2-G
Тальрозе Р.В., Шандрюк Г.А., Мерекалов А.С., Шаталова А.М., Отмахова О.А. // Высокомолекулярные соединения А. 2009. Т. 51. № 11. С. 1930. https://doi.org/10.1134/S0965545X09110030
Литманович О.Е. // Высокомолекулярные соединения С. 2008. Т. 50. № 7. С. 1370. ISSN: 2308-1147eISSN: 2412-9860
Kipper A.I., Savinov A.G., Valueva S.V. et al. // Polym. Sci. Ser. B. 2003. V. 45. № 3. P. 100.
Boursier T., Georges S., Mosquet M., Rinaldi D., D’Agosto F. // Polym. Chem. 2016. V. 7. P. 917. https://doi.org/10.1039/c5py01730k
Nazarova O.V., Anan’eva E.P., Zarubaev V.V. et al. // Pharm. Chem. J. 2020. V. 53. P. 1076. https://doi.org/10.1007/s11094-020-02125-x
Nazarova O.V., Leontyeva E.A., Nekrasova T.N. et al. // J. Carbohydrate Chem. 2009.V. 28. № 1. P. 37. https://doi.org/10.1080/07328300802638480
Золотова Ю.И., Назарова О.В., Некрасова Т.Н., Безрукова М.А, Мелентьев А.В., Добродумов А.В., Панарин Е.Ф. // ЖПХ. 2018. Т. 91. № 4. С. 554.
AL-Thabaiti S.A., Obaid A.Y., Khan Z., Chen Z. // Colloid Polym Sci. 2015. V. 293. P. 2543. https://doi.org/10.1007/s00396-015-3633-5
Guzman A., Arroyoa J., Verdea L., Rengifoa J. // Procedia Materials Science. 2015. V. 9. P. 298. https://doi.org/10.1016/j.mspro.2015.04.038
Saranyaadevi K., Subha V. // Int. J. ChemTech. 2014. V. 6. № 10. P. 4533. ISSN: 0974-4290.
Литманович О.Е., Литманович А.А, Паписов И.М. // Высокомолек. соед. Б. 2010. Т. 52. № 6. С. 1066. http://elibrary.ru/item.asp?id=15109873
Оленин А.Ю. Механизмы формирования металлических наночастиц // Российские нанотехнологии. 2012. Т. 7. № 5–6. С. 53. ISSN: 1992-7223 eISSN: 1993-4068.
Валуева С.В., Боровикова Л.Н., Суханова Т.Е., Лаврентьев В.К., Волков А.Я. // Бутлеровские сообщения. 2011. Т. 25. № 7. С. 13. http://butlerov.com/bh-2011/
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


