Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2022, № 5, стр. 21-25
Фотоэлектронные процессы при облучении наночастицы магнетита монохроматическим рентгеновским пучком
В. В. Сафронов a, Е. А. Созонтов b, *, **
a Институт кристаллографии им. А.В. Шубникова,
ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Россия
b Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
* E-mail: Sozontov_EA@nrcki.ru
** E-mail: esozontov@yahoo.com
Поступила в редакцию 14.07.2021
После доработки 25.09.2021
Принята к публикации 30.09.2021
- EDN: OGRFTT
- DOI: 10.31857/S1028096022050168
Аннотация
Рассматривается возможность применения наночастиц магнетита для увеличения эффективности подавления раковых новообразований при лечении опухоли методом рентгеновской брахитерапии. Предполагаемая роль наночастиц заключается в усилении дозы ионизирующего излучения, поглощаемой опухолью, в которую произведена инъекция раствора рассматриваемых частиц. Эти частицы обладают рядом свойств, которые делают их пригодными для направленной доставки лучевой энергии к раковой опухоли. Наночастицы магнетита биоразлагаемые, магнитные и могут испускать вторичное рентгеновское излучение при облучении внешним источником рассчитывается распределение дозы вокруг частицы магнетита диаметром 10 нм, помещенной в воду, являющуюся достаточно хорошим эквивалентом биологических тканей при проведении модельных расчетов, и облучаемой монохроматическим рентгеновским излучением с энергией фотонов в диапазоне от 4 до 60 кэВ. В результате расчетов методом Монте-Карло с использованием программного пакета Geant4 было показано, что при указанных условиях действительно происходит увеличение поглощаемой водой дозы за счет генерации флуоресцентного рентгеновского излучения, однако пространственная область, внутри которой указанное увеличение существенно, достаточно мала, поэтому для эффективного применения метода потребуется доставка таких наночастиц непосредственно в клеточное ядро.
ВВЕДЕНИЕ
Брахитерапия (внутренняя радиотерапия) – один из методов, применяемых наряду с хирургией и химиотерапией для лечения раковых новообразований [1]. Его значение возрастает в случае неприменимости других методов лечения по каким-либо причинам. Эффективность брахитерапии может быть увеличена путем инъекции в опухоль наночастиц, генерирующих вторичное излучение и таким образом увеличивающих дозу ионизирующего излучения, поглощаемую окружающими тканями [2, 3]. Из всех типов вторичных излучений, испускаемых такой частицей, наиболее сильным разрушающим действием на ДНК обладают оже-электроны [4, 5]. Это, по-видимому, объясняется частым взаимодействием таких электронов с веществом вдоль траектории движения, что связано с их небольшой энергией [6]. Интервалы между точками взаимодействия в таком случае соизмеримы с диаметром молекулы ДНК [7], что приводит к возникновению множественных разрывов двойной цепи [8]. Однако длина пробега оже-электронов очень мала, поэтому для достижения максимального эффекта требуется присутствие наночастицы в ядре клетки или рядом с ним. Чаще всего в качестве источника вторичного излучения используют наночастицы золота или гадолиния (как правило, в составе хелатов). Существуют эксперименты по внедрению наночастиц золота в ядро клетки [9], а также по синтезу наночастиц, содержащих гадолиний, непосредственно внутри живой клетки [10].
Другое направление усилий по усовершенствованию метода брахитерапии заключается в замене излучения традиционных радиоизотопных источников [11] излучением рентгеновской трубки. Известны два таких подхода. Первый заключается в разработке миниатюрной рентгеновской трубки, имплантируемой в составе иглы в опухоль [12]. Второй использует флуоресцентное излучение вторичной мишени, расположенной на конце полой иглы и облучаемой внешним источником с коллиматором [13]. Эффективность этих методов может быть увеличена с помощью инъекции наночастиц.
В настоящей работе исследована возможность применения для увеличения доставляемой в опухоль дозы ионизирующего излучения наночастиц альтернативного материала – магнетита [14]. Он обладает рядом важных для применения в медицине свойств, отсутствующих у наночастиц золота и хелатов гадолиния. Так, во-первых, наночастицы магнетита обладают способностью к биодеградации в живом организме [15]. Во-вторых, они способны к магнитному упорядочению при наложении внешнего магнитного поля, с помощью внешних полей их можно удерживать в локальной области. Они также могут быть источником вторичного излучения при облучении рентгеновским пучком из лабораторной трубки или синхротрона. Возможны два варианта генерации такого излучения: фотоэлектронные процессы и эффект Мессбауэра. В настоящей работе ионизирующее излучение получено в результате фотоэлектронных процессов при облучении внешним пучком. С помощью модельных подходов изучено распределение дозы ионизирующего излучения, поглощенной средой вокруг наночастицы магнетита. Возможность использования для указанной цели эффекта Мессбауэра рассматривается в [16, 17].
МЕТОДИКА МОДЕЛИРОВАНИЯ
Расчеты проводили методом Монте-Карло с помощью пакета Geant4 [18] версии 10.00.p01. Использовали входящий в его состав набор данных G4EMLOW, включающий данные из библиотеки EPDL97 (Evaluated Photon Data Library from Livermore) и рекомендованный для медицинских расчетов [19].
В настоящей работе модельным объектом была частица магнетита диаметром 10 нм, помещенная в центр куба со стороной 100 нм. Спектры вторичного излучения частицы рассчитывали в пустом кубе. Для получения распределения поглощенных доз куб был “заполнен” водой, которая считается достаточно хорошим аналогом биологических тканей для подобных расчетов. Частицу облучали первичными пучками с сечениями двух типов. В первом случае использовался пучок круглого сечения с диаметром, равным диаметру частицы (узкий пучок), во втором – пучок квадратного сечения со стороной, равной стороне модельного куба (широкий пучок). Количество первичных фотонов в этих случаях было выбрано 108 и 2 × 109 соответственно. Пространственное распределение поглощенной дозы в случае узкого пучка определялось как функция двух координат – положения вдоль оси пучка и удаления от этой оси в радиальном направлении. В случае широкого пучка дозу рассчитывали, как функцию одной координаты – расстояния от центра частицы. Энергию, поглощенную веществом в результате пропускания указанного числа первичных фотонов, суммировали в пространственных ячейках соответствующей криволинейной формы с размером сторон 1 нм. Усиление дозы рассчитывали, как отношение значений энергии, накопленной в соответствующих ячейках модельного вещества с наночастицей, к значениям энергии, рассчитанным без нее.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сначала был проведен ряд предварительных расчетов с использованием первичного пучка того же диаметра, что и частица. При таком идеализированном модельном подходе сразу виден вклад излучения от самой частицы, слабо заметный на общем фоне при облучении всего объема воды широким пучком. На рис. 1 показано взаимодействие как первичного, так и вторичного излучений с окружающей частицу водной средой. Спектры вторичных электронов наночастицы в вакууме показаны на рис. 2. Распределение поглощенной водой дозы вокруг наночастицы – на рис. 3.
Рис. 1.
Вторичное излучение частицы магнетита диаметром 10 нм, находящейся в воде и облучаемой узким параллельным монохроматическим пучком фотонов с энергией: а – 4; б – 7; в – 8; г – 14.4 кэВ. Точками обозначено поглощение энергии веществом. Первичный пучок направлен слева направо. Число падающих фотонов для всех значений энергии равно 105.
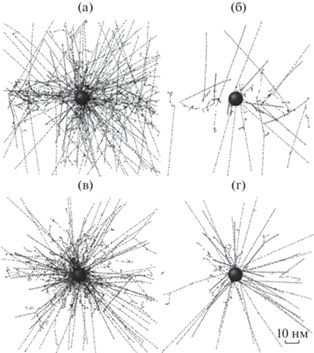
Рис. 2.
Спектры вторичных электронов, испускаемых наночастицей магнетита в вакууме при ее облучении фотонами различной энергии: а – 4; б – 7; в – 8; г – 14.4 кэВ. Число падающих фотонов для всех значений энергии равно 108, ячейка гистограммы – 100 эВ.

Рис. 3.
Распределение поглощенной водой дозы ионизирующего излучения вокруг наночастицы магнетита (показана черным) при облучении узким пучком фотонов с энергией: а – 4; б – 7; в – 8; г – 14.4 кэВ. Уровень дозы (в относительных единицах), соответствующей внешней изолинии, одинаков для всех значений энергии. От изолинии к изолинии поглощенная доза меняется в два раза. Число падающих фотонов для каждого значения энергии равно 108. Первичный пучок направлен слева направо.

Как и ожидалось, сильное взаимодействие низкоэнергетического излучения с водой делает эффект вторичного излучения частицей малозаметным. Поэтому при возможном терапевтическом применении будет необходимо отфильтровать низкоэнергетическую часть спектра рентгеновской трубки. При облучении частицы пучком с энергией выше K-края поглощения железа (7.1 кэВ) [20] заметно усиливается вторичное излучение частицы, включающее фотоны и электроны (фотоэлектроны и оже-электроны). Увеличение количества оже-электронов (с энергией 700 эВ и менее), обладающих наибольшим биологическим действием, отчетливо видно на рис. 2в. При дальнейшем увеличении энергии падающего пучка его взаимодействие как с частицей, так и с окружающей водой ослабевает.
На практике облучение будет производиться широким, почти параллельным пучком. Для этого случая были рассчитаны распределения поглощенных доз вокруг наночастицы при облучении параллельным пучком, покрывающим все сечение модельной ячейки, что потребовало увеличение числа входящих фотонов. Эти распределения доз практически сферически симметричны ввиду слабого поглощения и преломления первичного пучка одной частицей и отсутствия корреляции направлений распространения вторичных частиц с падающим пучком. Были проведены расчеты также в случае облучения аналогичного объема воды без частицы магнетита внутри. На рис. 4 показаны коэффициенты увеличения поглощенной дозы в зависимости от удаления от поверхности частицы при различной энергии падающего пучка. Как видно из рисунка, наибольший эффект достигается при энергии падающих фотонов ~8 кэВ. Однако даже при этой энергии пространственной областью, поглотившей по крайней мере вдвое большую дозу, является сферический слой толщиной всего лишь 10 нм вокруг наночастицы. Поэтому для практического применения необходим механизм доставки таких наночастиц в область, находящуюся в непосредственной близости к ДНК клетки, т.е. в клеточное ядро. Для наночастиц золота такая методика была продемонстрирована в [3]. Вероятно, подобное возможно и для частиц магнетита.
Рис. 4.
Коэффициент усиления дозы поглощенного водой ионизирующего излучения вокруг наночастицы магнетита при облучении широким рентгеновским пучком в зависимости от удаления от поверхности частицы при разной энергии падающего пучка: ◼ – 4; ◆ – 7; ⚫ – 8; ▼ – 14.4; ▲ – 59.3 кэВ.

Еще одним препятствием на пути использования исследуемых наночастиц для целей брахитерапии является малая глубина проникновения рентгеновского излучения с оптимальной энергией (8 кэВ) – всего порядка 1 мм, чего явно недостаточно для клинического применения метода. Применение же более жесткого первичного пучка для увеличения глубины его проникновения неэффективно из-за существенного уменьшения “полезной области” – пространственной области значимого увеличения поглощенной дозы. Так, для энергии 59.3 кэВ, соответствующей Kα1-линии вольфрама, “полезная область” составит всего лишь около 3 нм (рис. 4). Поэтому потребуется применение одного из упомянутых выше методов доставки излучения к опухоли: миниатюрная рентгеновская трубка или полая игла с вторичной мишенью на ее конце.
Список литературы
Каприн А.Д., Бирюков В.А., Черниченко А.В., Корякин А.В., Поляков В.А., Карякин О.Б., Галкин В.Н., Аполихин О.И., Иванов С.А., Сивков А.В., Ощепков В.Н., Алексеев Б.Я., Неледов Д.В., Гришин Г.Н., Лепилина О.Г., Обухов А.А. // Онкоурология. 2018. Т. 14. С. 94. https://doi.org/10.17650/1726-9776-2018-14-1-94-99
Hainfeld J.F., Slatkin D.N., Smilowitz H.M. // Phys. Med. Biol. 2004. V. 49. № 18. P. N309. https://doi.org/10.1088/0031-9155/49/18/n03
Hainfeld J.F., Dilmanian F.A., Slatkin D.N., Smilowitz H.M. // J. Pharm. Pharmacol. 2008. V. 60. № 8. P. 977. https://doi.org/10.1211/jpp.60.8.0005
Panyutin I.G., Neumann R.D. // Trends Biotechnol. 2005. V. 23. № 10. P. 492. https://doi.org/10.1016/j.tibtech.2005.08.001
Hofer K.G. // Acta Oncologica. 2000. V. 39. № 6. P. 651. https://doi.org/10.1080/028418600750063686
Feinendegen L.E. // Rad. Environ. Biophys. 1975. V. 12. P. 85. https://doi.org/10.1007/BF01328970
Зенгер В. Принципы структурной организации нуклеиновых кислот. Москва: Мир, 1987. 584 с.
Kim E.-H. // Nucl. Engin. Technol. 2008. V. 40. № 7. P. 551. https://doi.org/10.5516/NET.2008.40.7.551
Dam D.H.M., Lee J.H., Sisco P.N., Co D.T., Zhang M., Wasielewski M.R., Odom T.W. // ACS Nano. 2012. V. 6. № 4. P. 3318. https://doi.org/10.1021/nn300296p
Cao C.-Y., Shen Y.-Y., Wang J.-D., Li L., Liang G.-L. // Sci. Rep. 2013. V. 3. P. 1024. https://doi.org/10.1038/srep01024
Enger S.A., Fisher D.R., Flynn R.T. // Phys. Med. Biol. 2013. V. 58. P. 957. https://doi.org/10.1088/0031-9155/58/4/957
Rivard M.J., Davis S.D., DeWerd L.A., Rusch T.W., Axelrod S. // Med. Phys. 2006. V. 33. P. 4020. https://doi.org/10.1118/1.2357021
Liu Y., Sozontov E., Safronov V., Gutman G., Strumban E., Jiang Q., Li S. // J. Phys.: Conf. Ser. 2010. V. 250. P. 012069. https://doi.org/10.1088/1742-6596/250/1/012069
Онтоев Д.О. // Тр. минералогического музея. 1959. Т. 9. С. 74.
Gabbasov R.R., Cherepanov V.M., Chuev M.A., Polikarpov M.A., Nikitin M.P., Deyev S.M., Panchenko V.Y. // IEEE Trans. Magnetics. 2013. V. 49. № 1. P. 394. https://doi.org/10.1109/TMAG.2012.2226148
Габбасов Р.Р., Юреня А.Ю., Поликарпов М.А., Сафронов В.В., Созонтов Е.А., Черепанов В.М., Панченко В.Я. // Ядерная физика и инжиниринг. 2015. Т. 6. № 9–10. С. 512. https://doi.org/10.1134/S207956291505005X
Gabbasov R., Polikarpov M., Safronov V., Sozontov E., Yurenya A., Panchenko V. // Hyperfine Interactions. 2016. V. 237. P. 34. https://doi.org/10.1007/s10751-016-1267-8
Agostinelli S., Allison J., Amako K. et al. // Nucl. Instrum. Methods Phys. Res. A. 2003. V. 506. № 3. P. 250. https://doi.org/10.1016/S0168-9002(03)01368-8
Rivard M.J., Coursey B.M., DeWerd L.A., Hanson W.F., Huq M.S., Ibbott G.S., Mitch M.G., Nath R., Williamson J.F. // Med. Phys. 2004. V. 31. № 3. P. 633. https://doi.org/10.1118/1.1646040
Уманский Я.С., Скаков Ю.А., Иванов А.Н., Расторгуев Л.Н. Кристаллография, рентгенография и электронная микроскопия. М.: Металлургия, 1982. 632 с.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования


