Поверхность. Рентгеновские, синхротронные и нейтронные исследования, 2023, № 1, стр. 9-19
Структуры наноалмазов с фотоактивными модификаторами
В. Т. Лебедев a, *, Ю. В. Кульвелис a, М. А. Сорока a, Е. А. Кизима b, А. Я. Вуль c
a Петербургский институт ядерной физики им. Б.П. Константинова,
НИЦ “Курчатовский институт”
188300 Ленинградская область, Гатчина, Россия
b Объединенный институт ядерных исследований
141980 Московская область, Дубна, Россия
c Физико-технический институт им. А.Ф. Иоффе
194021 Санкт-Петербург, Россия
* E-mail: lebedev_vt@pnpi.nrcki.ru
Поступила в редакцию 24.04.2021
После доработки 20.06.2022
Принята к публикации 20.06.2022
- EDN: BLGLKV
- DOI: 10.31857/S1028096023010156
Аннотация
Впервые получены бинарные и тройные комплексы фуллеренов и дифталоцианинов европия с детонационными наноалмазами, способными служить платформами для доставки этих гидрофобных молекул в водные биологические среды для задач магнитно-резонансной томографии, фотодинамической терапии, диагностики с помощью люминесцентных меток. Детонационные наноалмазы (размер ~4–5 нм) имели положительный потенциал (30–70 мВ) в водной среде за счет привитых к поверхности групп (CH, COH) в результате термообработки в атмосфере водорода. При взаимодействии положительно заряженных алмазов с электроотрицательными гидратированными фуллеренами в водной среде исходные агрегаты каждого из компонентов разрушались, а электростатическое притяжение между ними приводило к формированию устойчивых компактных комплексов размером ~20 нм по данным динамического рассеяния света и рассеяния нейтронов в коллоидах (20°С). Бинарные комплексы включали в среднем по две молекулы фуллерена на 30–40 алмазных частиц. При введении молекул дифталоцианина в бинарный коллоид формировались устойчивые тройные структуры. Полученные комплексы алмазов, фуллеренов и молекул дифталоцианина перспективны для биомедицинских применений благодаря люминесцентным и магнитным свойствам компонентов.
ВВЕДЕНИЕ
Наноструктуры с магнитными, люминесцентными, фотокаталитическими свойствами востребованы в биомедицине для задач фотодинамической терапии, магнитно-резонансной (МРТ) и компьютерной рентгеновской томографии, диагностики с применением люминесцентных меток [1–11]. Фотодинамическая терапия – область фотохимиотерапии, в которой введенный препарат (фотосенсибилизатор) облучают светом, и его возбужденные молекулы передают энергию молекулярному кислороду в тканях. Кислород переходит из основного триплетного состояния в возбужденное химически активное синглетное состояние, разрушая опухоли, поскольку фотосенсибилизатор преимущественно накапливается на мембранах и митохондриях опухолевых клеток [12–14]. В связи с потребностями фотодинамической терапии продолжается поиск веществ для флюоресцентной диагностики среди производных гематопорфирина, хлоринов, бензопорфиринов, феофорбидов, порфиценов, фталоцианинов, нафталоцианинов [12]. При разработке новых фотосенсибилизаторов [15–25] важно придать им также люминесцентные свойства для задач диагностики [26, 27], найти способы адресной доставки препаратов, например, путем их адсорбции на магнитные частицы, сохранив фотодинамическую активность [28]. Так, гидрофобный фотосенсибилизатор (бактериохлорин) соединяли с частицами магнетита для его целевой доставки в ткани организма с применением магнитных полей, а также для контрастирования препарата в МРТ-тестах, чтобы контролировать его накопление в пораженном органе и сократить время хирургического вмешательства [28]. Биологические применения магнитных частиц рассмотрены в обзоре [29].
Среди веществ с высоким потенциалом для фотодинамической терапии выделяется фуллерен С60 и эндофуллерены с металлонитридами (M3N@C80) [30]. В тестах на антимикробную активность эти вещества в виде пленок показали сильный эффект уничтожения грамположительных и грамотрицательных бактерий [30]. Металлофуллерены Dy@C82, Gd@C82, La@C82 активно генерировали синглетный кислород, окислявший олефины [31, 32], а соединение Li@C60 по фотоиндуцированной реакционной способности превзошло С60 [33].
Однако для реализации указанных возможностей эндофуллеренов еще не созданы продуктивные методы синтеза, который освоен лишь в лабораторных масштабах. Поэтому актуален поиск альтернативных металлоорганических соединений, например, среди водорастворимых производных фталоцианинов, которые фотоинактивируют бактерии [34]. По данным [35] дифталоцианины лантаноидов (LnPc2) в основном приобретали способность генерировать синглетный кислород в результате протонирования кислотами, а в исходном состоянии только молекулы LuPc2 показали такой эффект.
Дифталоцианины (ДФЦ) лантаноидов перспективны для применений тем, что синтезируются проще и с меньшими затратами, чем эндофуллерены. Ряд LnPc2 можно внедрить в фотодинамическую терапию при условии переноса гидрофобных молекул ДФЦ в водные среды, например, путем прививки к ним гидрофильных атомных групп (молекул), связывания с гидрофильными наноплатформами (полимерами, алмазами и другими частицами).
К нерастворимым в воде фуллеренам С60 прививали функциональные группы для связывания с частицами золота [36]. Фуллерены были не только эффективны как фотосенсибилизаторы, но и устойчивы к действию синглетного кислорода в основном энергетическом состоянии. Окисление С60 и С70 происходило лишь при взаимодействии синглетного кислорода с триплетно-возбужденной молекулой фуллерена [37]. Это стимулировало поиск способов стабилизации фуллеренов в водных средах. Авторы [38], заключив молекулу С60 в металлический квадрат атомов палладия, получили эффективный, фотохимически стабильный фотосенсибилизатор для генерации синглетного кислорода. Молекулы С60 и С70 связывали также с гидрофильными полимерами (γ-циклодекстрином, поливинилпирролидоном), диспергируя фуллерены в воду и сохраняя каталитические свойства [39]. При гидратации эффективность генерации синглетного кислорода фуллеренами в опытах на клетках фибробластов крысы (5RP7) была в два–три раза выше, чем у известного фотосенсибилизатора – бенгальского розового (RB). Для тех же целей авторы [40] модифицировали молекулы С60 атомами углерода, кислорода и водорода, создавая sp3-гибридизированные сайты на поверхности фуллерена среди sp2-углерода. В водных растворах наночастиц на основе фуллерена и водорастворимых фуллеренолов C60(OH)X(ONa)Y (X + Y = 24, Y = 6–10) детектировали люминесценцию синглетного кислорода (1O2). Квантовый выход 1O2 в случае фуллеренов достиг 0.15–0.2 против 0.06 в случае фуллеренолов. При УФ-возбуждении (350 нм) фуллеренолы показали гауссов спектр флуоресценции (полоса 500–750 нм, максимум при ~600 нм, квантовый выход 0.3%).
Важно, что такой спектр включает длины волн в полосе поглощения серийно применяемого фотосенсибилизатора – Радахлорина (РХ, 662 нм). Фуллеренолы могут служить конверторами УФ- и рентгеновских квантов в излучение видимого диапазона для активации РХ в фотодинамической терапии. Не менее важно учитывать, что фотохимическое действие фуллеренов и производных не ограничено генерацией синглетного кислорода. У комплексов [(γ-CyD)2/C60], где фуллерен лежит в полости между молекулами γ-циклодекстрина, и фуллеренолов C60(OH)24 анализировали фототоксичность для кератиноцитов человека [41]. При УФ-возбуждении (γ-CyD)2/C60 и C60(OH)24 в D2O квантовые выходы синглетного кислорода различались на порядок (0.76 и 0.08). Кроме того, посредством C60(OH)24 образовался преимущественно супероксид, причем активнее при добавлении донора электронов – никотинамида адениндинуклеотида (восстановленного) (НАДН). За счет комплексов (γ-CyD)2/C60 супероксид формировался лишь в присутствии НАДН. Судя по жизнеспособности клеток, комплекс (γ-CyD)2/C60 был в ~60 раз фототоксичнее фуллеренола C60(OH)24. Фототоксичность, связанная с комплексом (γ-CyD)2/ C60, определялась синглетным кислородом при незначительной роли супероксида, а при наличии C60(OH)24 – в основном супероксидом ${\text{O}}_{2}^{ - }$. Конфокальная флуоресцентная микроскопия показала высокий уровень производства перекиси водорода в клетках, инкубированных с фуллеренолом при освещении. Следовательно, у фуллеренола токсичность фотохимическая, как следствие свободно-радикальных реакций (тип I), но не за счет синглетного кислорода (тип II) [41].
Фуллерены С60 выгодны для генерации синглетного кислорода благодаря квантовому выходу 96%. Функционализация фуллеренов снижает этот показатель, в частности, на порядок у фуллеренолов С60(ОН)24 [39]. Факторы, определяющие эффективность фотокатализа производными фуллеренов, обсуждали в обзоре [42]. Там рассмотрена стратегия синтеза фотокатализаторов, модифицированных фуллеренами, для задач органического синтеза, производства водорода, дезинфекции воды и разложения загрязняющих веществ, получения антибактериальных средств.
Для развития фотодинамической терапии вместе с созданием препаратов важен поиск многоцелевых наноплатформ для фотосенсибилизаторов, что актуально при переходе от лазерного излучения к рентгеновскому для лечения крупных, глубоко залегающих опухолей.
Целью работы было объединение синтеза и структурных исследований молекулярных комплексов с гидрофильными детонационными наноалмазами (ДНА). Они могут служить не только эффективными платформами для доставки в биологические среды функциональных молекул (антибактериальных средств, контрастирующих агентов в МРТ, люминофоров и фотосенсибилизаторов в фотодинамической терапии), но и выполнять роль люминесцентных меток для контроля распределения препаратов в органах.
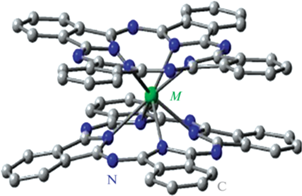
В качестве функциональных молекул выбраны фуллерены С60 – сильно выраженные антиоксиданты и фотосенсибилизаторы, устойчивые к УФ-, рентгеновскому, гамма- и нейтронному излучениям [8, 10, 39–41, 43–45], а также ДФЦ EuPc2, в которых атомы металла прочно связывают лиганды C32N16H8 (рис. 1) [46]. В молекуле EuPc2 ион в зарядовом состоянии Eu3+ – сильный люминофор в красной области спектра (~600–700 нм) [35], где биологические ткани слабо поглощают, что важно для биомедицинских применений. В молекуле EuPc2 атом европия, обладающий магнитным моментом, способен ускорить поперечную спиновую релаксацию протонов в окружающей биологической среде, т.е. создать контраст при МРТ-диагностике.
Рис. 1.
Молекула дифталоцианина: лиганды включают азот и углерод и соединены через атом металла (M).
Связывание гидрофобных молекул ДФЦ алмазами – способ получить МРТ-препараты с магнитными молекулами на алмазных наночастицах с огромной поверхностью взаимодействия этих частиц и функциональных молекул с окружением для усиления контрастирования. Чтобы создать комбинированный эффект (магнитно-контрастный, фотодинамический, люминесцентный), требуется сочетать модификаторы – ДФЦ и фуллерены, что достигается в тройных комплексах ДНА–С60–ДФЦ.
В настоящей работе впервые полученные бинарные и тройные системы на основе алмазов, фуллеренов и ДФЦ анализировали в растворах методами динамического рассеяния света и малоуглового рассеяния нейтронов, что позволило изучить структуру и устойчивость комплексов в водных коллоидах в широком диапазоне масштабов – от единиц нанометров до десятков микрон.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы и методы
Были поставлены задачи изучить взаимодействие гидратированных фуллеренов С60 и ДФЦ EuPc2 с ДНА в водных средах. В них гидрофобные электроотрицательные молекулы стремятся ассоциировать с положительно заряженными алмазами – ДНАZ+ (размер частиц 4–5 нм, поверхностный потенциал 30–70 мВ), на поверхности которых имеются функциональные группы (CH, COH) [47, 48].
Для приготовления комплексов брали также и другие ДНА, прошедшие технологическую обработку (деагломерацию, химическую очистку, отжиг) [47, 48]. Частицы ДНА отжигали в потоке воздуха, прививая к ним кислотные карбоксильные группы (COOH). Диссоциация этих кислотных групп в водной среде обеспечивала отрицательный потенциал у алмазов (ДНАZ–).
Термообработка порошка ДНА в потоке водорода (500°C) приводила к заселению поверхности частиц группами H, OH. Такие частицы ДНАZ+ приобретали положительный потенциал потенциал в водной среде (передача электронов с поверхности алмаза молекулам воды с гидратного слоя). Достаточно большой поверхностный потенциал (~50 мВ) у частиц ДНАZ– и ДНАZ+ гарантировал долговременную стабильность гидрозолей [48]. В них кроме отдельных частиц присутствовали цепные агрегаты, возникшие не только из-за контактов гидрофобных участков поверхности частиц, но и вследствие электростатического притяжения частиц (заряды у граней кристаллов могут отличаться знаком) [49, 50].
Чтобы снизить эффекты агрегации, исходные водные дисперсии ДНАZ+ с концентрацией 3.1 мг/мл разбавляли вдвое, до содержания 1.55 мг/мл (табл. 1, образец 1). Разбавленную дисперсию далее использовали для приготовления бинарных и тройных комплексов.
Таблица 1.
Состав образцов
| Образец | Концентрации компонент, мг/мл | Способ приготовления | ||
|---|---|---|---|---|
| алмаз | фуллерен | дифталоцианин | ||
| 1 | 1.55 | – | – | Разбавление исходной дисперсии ДНАZ+ |
| 2 | – | 0.01 | – | Замена растворителя, диспегирование С60 в воде |
| 3 | 1.49 | 0.00039 | – | Смешивание водных дисперсий ДНАZ+ и С60 |
| 4 | 1.47 | 0.00039 | 0.015 | Смешивание дисперсий ДНАZ+ и С60, добавление раствора ДФЦ |
| 5 | 1.47 | 0.00039 | 0.015 | Смешивание дисперсий, ДНАZ+ и раствора ДФЦ, добавление дисперсии С60 |
Водную дисперсию фуллеренов получали путем замены растворителя [51] по методике [52–54]. Исходный порошок С60 (NeoTecProduct, Россия, степень чистоты не ниже 99.5%) растворяли в толуоле при ультразвуковой обработке. Раствор смешивали с водой (пропорция 1 : 5), подвергая длительному действию ультразвука (23 дня по 12 ч) до полного испарения толуола. Затем раствор нагревали до кипения, охлаждали и пропускали через фильтр (поры 0.45, 20 мкм). В итоге получали водную дисперсию гидратированных фуллеренов концентрацией 0.01 мг/мл, в которой детектировали полосы оптического поглощения С60 на длинах волн 220, 268, 349 нм. Устойчивость системы была обеспечена за счет присоединения гидроксилов к фуллеренам [52], у молекул C60(OH)X числа гидроксилов X могли достигать десятка и более.
Первоначально на основе водных дисперсий фуллерена и алмазов ДНАZ+ готовили бинарные системы. Алмазный образец (концентрация 1.55 мг/мл в легкой воде) разбавляли водной дисперсией фуллерена (концентрация 0.01 мг/мл) в объемной пропорции 1 : 25. После ультразвуковой обработки смеси при комнатной температуре получали систему с долями фуллерена (0.00039 мг/мл) и ДНАZ+ (1.49 мг/мл), что отвечало пропорции молекула фуллерена: ~20 алмазных частиц.
Для приготовления тройных систем с парамагнитным компонентом, обладающим люминесцентными свойствами, брали ДФЦ европия, синтезированный методом [55]. Соль ацетата Eu смешивали с расплавленным о-фталонитрилом в кварцевом реакторе, продуваемом током аргона при нагревании до 220–250°C (пропорция соль: о-фталонитрил = 1 : 6). Расплав интенсивно перемешивали в течение 1–2 мин. Реакция образования ДФЦ длилась 25–30 мин, затем температуру поднимали до 350–400°C, удаляя избыток о-фталонитрила, сконденсированного в верхней части реактора. Конечный продукт очищали от остатков о-фталонитрила и побочных продуктов реакции. Структура молекул ДФЦ европия Eu(C32N8H16)2 (рис. 1) была подтверждена методом ИК-спектроскопии.
Чтобы приготовить тройную систему, гидрофобный ДФЦ Eu растворяли в диметилформамиде (ДМФА) и добавляли воду, с которой ДМФА неограниченно смешивался. В растворе преимущественно на водной основе концентрация ДФЦ была низкой (1.1 мг/мл) во избежание коагуляции.
Из алмазной дисперсии (1.55 мг/мл) готовили тройные комплексы, последовательно добавляя в нее водную суспензию фуллерена и раствор ДФЦ Eu на водной основе. Смешанную дисперсию обрабатывали ультразвуком при комнатной температуре. В тройной системе доля ДНАZ+ составляла 1.47 мг/мл при малых количествах фуллерена (0.00039 мг/мл) и ДФЦ (0.015 мг/мл). Применяли также обратный порядок приготовления, соединяя алмазы с ДФЦ Eu, добавляя гидратированный фуллерен.
Молекулы фуллерена, ДФЦ и алмазы ДНАZ+ в водной среде формировали гибридные структуры на уровне субмикронных и микронных масштабов, которые анализировали методом динамического рассеяния света (20°С) в сравнении с данными для однокомпонентных дисперсий ДНАZ+ и фуллерена. Те же системы изучали (20°С) с помощью малоуглового рассеяния нейтронов (дифрактометр ЮМО, реактор ИБР-2, ОИЯИ, Дубна) [56, 57]. Структурные данные были получены в диапазоне масштабов R ~ 100–104 нм. Интенсивность рассеяния нейтронов I(q), измеренную в зависимости от переданного импульса q, калибровали по стандарту ванадия (пакет SAS) [58]. Сечения рассеяния образцов dΣ(q)/dΩ находили в абсолютных единицах в расчете на единицу телесного угла и 1 см3 объема образца. Пакет ATSAS применяли для восстановления корреляционных функций [59, 60].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Бинарные комплексы
Данные динамического рассеяния света в водных дисперсиях ДНАZ+, гидратированных фуллеренов С60 и бинарной системе приведены на рис. 2. В однокомпонентных коллоидах (ДНАZ+, С60) обнаружены агрегаты размерами dH ~ 10–300 нм с наиболее вероятным гидродинамическим диаметром (максимум основного пика) dHmax ~ 50 и ~40 нм для алмазов и фуллеренов соответственно. Наблюдались также крупные структуры (~5000 нм) с амплитудами пиков на порядок ниже, чем основного максимума (рис. 2).
Рис. 2.
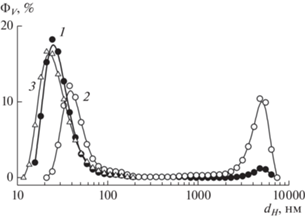
Объемные доли агрегатов ΦV в водных дисперсиях алмазов ДНАZ+ (1), гидратированных фуллеренов (2) и смеси этих компонентов (3) в зависимости от гидродинамического диаметра агрегатов dH.
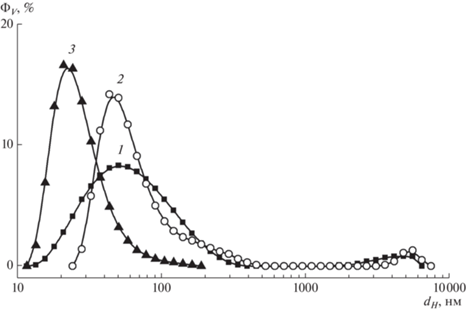
Профили главных пиков распределений ΦV(dH) различны для алмазной и фуллереновой систем. В случае фуллеренов ширина пика на полувысоте δdH ~ 50 нм (размеры частиц 30–80 нм в пределах ширины). В случае алмазов ширина пика δdH ~ ~ 125 нм в 2.5 раза выше, размер частиц 25–150 нм значительно варьируется в пределах этой ширины.
Если минимальный масштаб алмазных агрегатов порядка диаметра частиц ДНАZ+ (4–5 нм), то фуллерены формируют структуры размерами dH ≥ ≥ 30 нм на порядок и более крупнее отдельной молекулы. Максимальный масштаб структур в том и другом коллоиде примерно одинаковый ~300 нм (рис. 2).
Особенности структурирования систем объясняются разной спецификой взаимодействий частиц в этих случаях. Гидрофильные алмазы с положительным потенциалом (30–70 мВ) взаимно отталкиваются, что придает устойчивость водной дисперсии, хотя в ней вместе с отдельными частицами есть агрегаты. Они формируются, когда потенциал отталкивания частиц локально компенсируется при сближении их граней с зарядами разного знака. Баланс сил притяжения и отталкивания между частицами достигается при формировании цепей из алмазов, ассоциированных по граням, несущим заряды разных знаков [49, 50]. Образуется множество агрегатов разного размера, что дает профиль распределения ΦV(dH). В противоположность алмазам молекулы гидратированных фуллеренов в большей степени гидрофобные, но могут нести некоторый отрицательный заряд за счет диссоциации гидроксилов на их поверхности [51–54], что в сумме определяет размер агрегатов (30–300 нм) на два порядка больше диаметра молекулы (рис. 2).
В смеси алмазной и фуллереновой дисперсий конкуренция взаимодействий частиц одинаковой и разной природы в итоге ведет к доминированию притяжения между положительно заряженными алмазами и гидратированными, отрицательно заряженными фуллеренами. Поэтому наблюдается переход к компактным структурам при ведении фуллеренов в алмазную дисперсию и перемешивании компонентов в ультразвуковом поле (рис. 2, кривая 3). Исходные агрегаты фуллеренов разрушаются, и молекулы присоединяются к алмазам, которые экранируют фуллерены от водного окружения. Образуются компактные бинарные агрегаты с характерным диаметром DB ~ dHmax ~ 20 нм (позиция максимума пика распределения шириной δdH ~ 20 нм). В отличие от исходных структур алмазов и фуллеренов по отдельности бинарные агрегаты имеют размеры в узком интервале значений 15–35 нм. Полагая, что в бинарной системе сохраняется цепное связывание частиц алмазов, получаем оценку числа частиц алмазов в комплексе ~(DB/dP)2 ~20. При таком количестве частиц в среднем комплекс содержит один гидратированный фуллерен как стабилизирующий центр внутри цепного клубка из алмазных частиц. С учетом разброса размеров комплекса его ядро может включать до трех молекул С60. Более детальное представление о структуре дисперсий алмазов, фуллеренов и комплексов было получено на основе данных рассеяния нейтронов.
Импульсные зависимости сечений рассеяния нейтронов в водных дисперсиях алмазов и фуллеренов (рис. 3) аппроксимировали функцией Гинье σ(q) = σ0 exp[–(qRG)2/3], чтобы найти сечение рассеяния в пределе малых импульсов σ0 = σ (q → 0) и радиус инерции наблюдаемых частиц RG.
Рис. 3.
Аппроксимация Гинье сечений рассеяния нейтронов в водных системах алмазов (а) и фуллеренов (б).
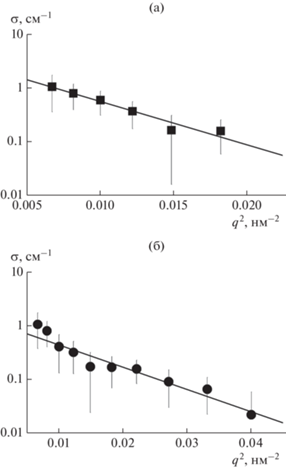
Как выяснилось, радиус инерции алмазных агрегатов превосходит размер формирований фуллеренов: RGДНА = 23.6 ± 1.4 нм > RGС60 = 16.9 ± 1.2 нм. В том и другом случаях оцененные диаметры частиц 2(5/3)1/2RG ~ 61 и 44 нм в приближении сфер примерно согласуются с данными динамического рассеяния света. В пределах точности найденный радиус инерции кластера фуллерена соответствует ранее измеренной величине RGС60 = 18.8 ± 0.2 нм в водной дисперсии с утроенной концентрацией фуллерена (0.03 мг/мл) [53], что свидетельствует о стабильности размера структур фуллерена в водной среде при вариации концентрации коллоида.
Хотя агрегаты алмазов и фуллеренов сопоставимы по размерам, по своему строению эти образования заметно различаются. В первом приближении алмазную структуру с радиусом инерции RGДНА ~ 20 нм можно рассматривать как гауссову цепь с числом частиц nДНА ~ 6(RGДНА/dP)2 ~ 100. Однако при такой высокой степени агрегации алмазных цепей в 1 см3 раствора сечение рассеяния σ0ДНА = 3.66 ± 0.89 см–1 всего на порядок выше расчетной величины для неассоциированных алмазов при данной концентрации. Следовательно, только ~10% алмазов агрегированы на масштабах десятков нанометров, остальные свободные из-за электростатического отталкивания.
В случае гидратированных фуллеренов в коллоиде концентрацией 0.01 мг/мл с объемной долей молекул ~4.6 × 10–6 на порядок ниже, чем в алмазной дисперсии, сечение рассеяния в пределе малых импульсов составляет σ0F = 1.15 ± ± 0.29 см–1. Отсюда следует огромное число агрегации ~7.5 × 104 у наблюдаемых структур, представляющих собой плотные глобулы.
Сечение σ0F втрое ниже аналогичной величины [53] для дисперсии с долей фуллерена 0.03 мг/мл. В обоих случаях агрегаты практически равного размера имеют и одинаковые массы, т.е. не различаются характером упаковки молекул. Повышение доли фуллерена в растворе (0.01–0.03 мг/мл) ведет лишь к увеличению количества агрегатов без особых изменений их структуры.
Как показали данные динамического рассеяния света (рис. 2), гидратированные фуллерены даже при низкой доле 0.00039 мг/мл (на четыре порядка меньше концентрации алмазов 1.49 мг/мл) сильно структурируют ансамбли алмазных частиц при образовании комплексов.
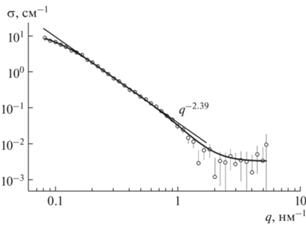
Информация о строении и характеристиках комплексов была получена из нейтронных экспериментов. Эти данные относятся практически только к рассеянию на алмазах, эффектом крайне малого количества фуллеренов можно пренебречь. Кривая сечения рассеяния σ(q) демонстрирует три характерные области поведения (рис. 4). При импульсах q ≥ 1 нм–1 данные описывают преимущественно алмазные частицы. Участок 0.15 < q < 1 нм–1 фрактального поведения сечения σ(q) ~ 1/qβ с показателем β = 2.39 ± 0.02 подтверждает, что комплексы включают цепные (разветвленные) фрагменты из алмазов, что наблюдали и ранее в алмазных дисперсиях [49, 50]. Тенденция выхода сечения на насыщение при q < < 0.1 нм–1 указывает на размер структур ~1/q ≥ ≥ 10 нм. В экспериментальном q-диапазоне сечение подчиняется функции
(1)
$\begin{gathered} \sigma (q) = {{{{\sigma }_{{01}}}} \mathord{\left/ {\vphantom {{{{\sigma }_{{01}}}} {{{{[1 + {{{(q{{r}_{{\text{C}}}})}}^{2}}]}}^{2}} + }}} \right. \kern-0em} {{{{[1 + {{{(q{{r}_{{\text{C}}}})}}^{2}}]}}^{2}} + }} \\ + \,\,{{\sigma }_{{02}}}{{[1 + {{(q{{R}_{{\text{C}}}})}^{2}}]}^{2}} + B, \\ \end{gathered} $Тройные комплексы
На основе алмазной дисперсии (1.55 мг/мл) получали тройные комплексы, добавляя гидратированный фуллерен, затем раствор ДФЦ Eu на водной основе (парамагнитный модификатор алмазов). Применяли также обратный порядок приготовления, смешивая раствор ДФЦ с алмазной дисперсией с последующим добавлением гидратированного фуллерена.
Из данных динамического рассеяния света найдены объемные доли частиц в образцах ΦV(dH) с зависимости от их гидродинамического размера, которые сравнивали с результатами для комплекса алмаз–фуллерен. Согласно данным (рис. 5), компонент ДФЦ, введенный в систему алмаз–фуллерен, мало меняет известный для бинарного комплекса характер структурирования алмазов (кроме появления некоторой доли микронных образований). По сравнению с комплексом алмаз–фуллерен наиболее вероятный размер тройных структур увеличился до DT ~ 25 нм при сужении пика распределения (ΔDT/DT = ±30%), что указывает на формирование более упорядоченных комплексов с числом агрегации по алмазам ~(DT/dP)2 ~ 25 при наличии в структуре одного–двух фуллеренов.
Рис. 5.
Объемные доли агрегатов в зависимости от их размера в водных дисперсиях: 1 – комплекс, полученный добавлением гидратированного фуллерена, затем раствора ДФЦ в алмазную дисперсию; 2 – комплекс, приготовленный в обратном порядке; 3 – бинарный комплекс алмаз–фуллерен.
Как выяснилось, при формировании тройного комплекса важен порядок добавления компонентов в алмазную дисперсию. Попытки получить комплекс в обратном порядке, сначала добавив ДФЦ, затем фуллерен, не привели к успеху. Взаимодействие ДНАZ+ с добавленным ДФЦ вызвало интенсивное образование микронных структур (рис. 5, кривая 2). В них гидрофильные алмазы стремились экранировать гидрофобные молекулы ДФЦ от водного окружения, что можно представить, как физическое сшивание первичных алмазных агрегатов через молекулы ДФЦ. Последующее введение фуллерена не могло разрушить крупные коагуляты из алмазов и ДФЦ. Не вошедший в коагуляты избыток алмазов формировал агрегаты примерно тех же размеров (~40 нм) с участием фуллеренов, которые наблюдались в чистых дисперсиях ДНАZ+ и фуллеренов (рис. 2), но в тройной системе размер агрегатов вдвое превосходил диаметр бинарных агрегатов алмаз–фуллерен (рис. 5, кривая 3).
Таким образом, найденный способ получения тройных комплексов включает начальную стадию взаимодействия фуллеренов с алмазами с образованием компактных комплексов диаметром ~25 нм и конечную стадию, на которой вводят ДФЦ как стабилизирующую добавку. Детальные структурные данные на масштабах от единиц до десятков нанометров были получены в нейтронных экспериментах, подтвердивших результаты динамического рассеяния света.
Для тройных систем, как и для бинарных, наблюдались области поведения сечения, отвечающие рассеянию на отдельных алмазах, цепных фрагментах и комплексах в целом (рис. 6). Данные рассеяния аппроксимировали функцией (1). Для частиц алмаза найден корреляционный радиус rC = 1.6 ± 0.1 нм и сечение σ01 = 0.36 ± 0.04 см–1, что согласуется с данными для бинарного комплекса с учетом разбавления системы раствором ДФЦ. В тройной системе сечение σ01 соответствовало расчетной величине для набора независимо рассеивающих алмазов при заданной концентрации. Тройные комплексы имели примерно тот же размер RC = 7.5 ± 0.2 нм и сечение σ02 = = 15.9 ± 0.9 см–1, что и бинарные комплексы.
Рис. 6.
Сечение рассеяния нейтронов в водном растворе тройного комплекса алмаз–фуллерен–ДФЦ в зависимости от переданного импульса. Данные аппроксимированы функцией (1), прямая линия показывает фрактальное поведение сечения.
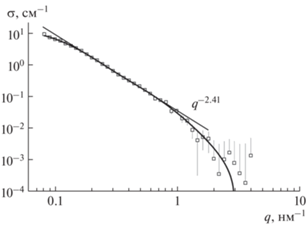
Из полученных данных и проведенного анализа следует, что ДФЦ, который добавили последним, присоединялся к алмазной поверхности частиц бинарного комплекса, не вызывая в нем радикальных структурных изменений. Числа агрегации алмазов в тройных комплексах nA = = σ02/σ01 ≈ 45, nA = (RC/rC)2.4 ≈ 39, оцененные двумя способами, возросли на 20–40% по сравнению с аналогичными величинами в бинарных комплексах. Следовательно, молекулы ДФЦ служили дополнительным фактором связывания частиц алмазов и стабилизации комплексов. Тройные комплексы, как и бинарные, демонстрировали цепные (разветвленные) фрагменты из алмазов. Фрактальная размерность этих образований β = = 2.41 ± 0.02 в пределах точности не изменилась (рис. 6).
В сумме данные рассеяния нейтронов и света показали, что устойчивые компактные тройные комплексы образуются при взаимодействии компонентов (алмазов, гидратированных фуллеренов) с полярными функциональными группами (гидроксилами на углеродной поверхности), когда могут возникать водородные связи между алмазами и фуллеренами с участием молекул воды в гидратных оболочках вокруг этих частиц. Указанные взаимодействия, приводящие к формированию тройных комплексов, схематически показаны на рис. 7.
Рис. 7.
Схема образования тройного комплекса фуллерен–(ДНАZ+)–ДФЦ. Показаны водородные связи между гидроксилами на поверхности алмазов ДНАZ+ и гидратированных фуллеренов C60(OH)X, а также связи с участием молекул воды.
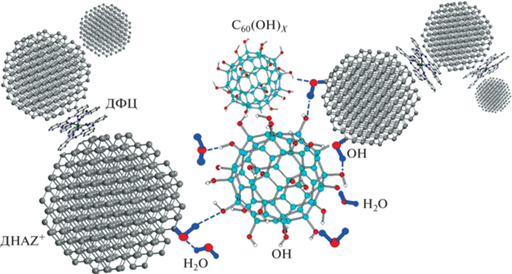
При введении ДФЦ в бинарную систему происходят гидрофобные взаимодействия алмазов и молекул ДФЦ, вероятны также слабые донорно-акцепторные связи между поверхностями алмазных граней и молекулами ДФЦ. Лиганды молекул могут быть протонированы при контактах с насыщенной водородом алмазной поверхностью.
Найденные способы создания гибридных бинарных и тройных наноструктур с люминесцентными и парамагнитными свойствами могут быть использованы для целей биомедицины в связи с работами по фотокаталитическим комплексам наноалмазов с полимерами и фотосенсибилизаторами для тераностики [61, 62].
ЗАКЛЮЧЕНИЕ
Полученные результаты продемонстрировали возможность применения детонационных алмазов в качестве платформы для молекул, обладающих люминесцентными и парамагнитными свойствами. Показано, что такие молекулы в водных средах могут быть связаны с поверхностью алмазных наночастиц в бинарные и тройные комплексы. В этих условиях ассоциация компонентов происходит не за счет валентных связей, а под действием электростатических сил, частично водородных связей и гидрофобных взаимодействий, что важно для сохранения фотокаталитических и магнитных свойств присоединенных молекулярных компонентов. Следует подчеркнуть, что химически инертные и устойчивые к ионизирующим излучениям алмазные частицы, используемые в качестве платформы, сами по себе способны служить в качестве люминесцирующих частиц и могут быть дополнительно модифицированы магнитными ионами для усиления функциональных свойств получаемых гибридных комплексов [63].
Список литературы
Wang S., Gao R., Zhou F., Selke M. // J. Mater. Chem. 2004. V. 14. P. 487.
Chen X-ng., Song J., Chen X-an., Yang H. // Chem. Soc. Rev. 2019. V. 48. P. 3073. https://doi.org/10.1039/c8cs00921j
Soares D.C.F., Domingues S.C., Viana D.B., Tebaldi M.L. // Biomed Pharmacotherapy. 2020. V. 131. P. 110695. https://doi.org/10.1016/j.biopha.2020.110695
Seaberg J., Montazerian H., Hossen N., Bhattacharya R., Khademhosseini A., Mukherjee P. // ACS Nano. 2021. V.15. № 2. P. 2099. https://doi.org/10.1021/acsnano.0c09382
Gao G., Guo Q., Zhi J. // Small. 2019. V. 15. № 48. P. 1902238. https://doi.org/10.1002/smll.201902238
Sreenivasan V.K.A., Zvyagin A.V., Goldys E.M. // J. Phys.: Condens. Matter. 2013. V. 25. P. 194101. https://doi.org/10.1088/0953-8984/25/19/194101
Lin B.-R., Chen C.-H., Chang C.-H., Kunuku S., Chen T.-Y., Hsiao T.-Y., Yu H.-K., Chang Y.-J., Liao L.-C., Chen F.-H. // J. Phys. D. 2019. V. 52. № 50. P. 505402.
Anilkumar P., Lu F., Cao L., Luo P.G., Liu J.-H., Sahu S., Tackett K. N., Wang Y., Sun Y.-P. // Current Med. Chem. 2011. V. 18. № 14. P. 2045. https://doi.org/10.2174/092986711795656225
Rak J., Pouckova P., Benes J., Vetvicka D. // Anticancer Res. 2019. V. 39. P. 3323. https://doi.org/10.21873/anticanres.13475
Bogdanović G., Djordjević A. // Srp. Arh. Celok. Lek. 2016. V. 144. № 3–4. P. 222. https://doi.org/10.2298/SARH1604222B
Anani T., Rahmati S., Sultana N., David A.E. // Theranostics. 2021. V. 11. № 2. P. 579. https://doi.org/10.7150/thno.4881
Филоненко Е. В., Серова Л.Г. // Biomed. Photonics. 2016. Т. 5. № 2. С. 26.
Гафтон Г.И., Семилетова Ю.В., Анисимов В.В., Гельфонд М.Л., Мяснянкин М.Ю., Новик А.В., Нехаева Т.Л., Балдуева И.А., Гафтон И.Г. // Сибирский онкологический журн. 2013. № 4(58). С. 23.
Гельфонд М.Л., Балдуева И.А., Барчук А.С., Гафтон Г.И., Анисимов В.В., Семилетова Ю.В., Новик А.В., Мяснянкин М.Ю., Нехаева Т.Л., Данилова А.Б., Воробейчиков Е.В., Вааль А.И., Гафтон И.Г. // Biomed. Photonics. 2016. Т. 5. № 3. С. 4.
Лyкьянeц E.A. // Biomed. Photonics. 2013. T. 2. № 3. C. 3.
Abrahamse H., Hamblin M.R. // Biochem. J. 2016. V. 473. P. 347.
Zhang J., Jiang C., Figueiró Longo J.P., Azevedo R.B., Zhang H., Muehlmann L.A. // Acta Pharm. Sin. B. 2018. V. 8. № 2. P. 137.
Abrahamse H., Hamblin M.R. Photomedicine and Stem Cells. The Janus Face of Photodynamic Therapy (PDT) to Kill Cancer Stem Cells, and Photobiomodulation (PBM) to Stimulate Normal Stem Cells. Bristol: IOP Publishing, 2017. 103 p. https://doi.org/10.1088/978-1-6817-4321-9
Kwiatkowski S., Knap B., Przystupski D., Saczko J., Kędzierska E., Knap-Czop K., Kotlińska J., Michel O., Kotowski K., Kulbacka J. // Biomed. Pharmacotherapy. 2018. V. 106. P. 1098.
Van Straten D., Mashayekhi V., de Bruijn H., Oliveira S., Robinson D. // Cancers. 2017. V. 9. № 2. P. 19.
Деев Р.В., Билялов А.И., Жампеисов Т.М. // Гены и клетки. 2018. Т. 13. № 1. С. 6.
Bagrov I.V., Dadeko A.V., Kiselev V.M., Murav’eva T.D., Starodubtsev A.M. // Opt. Spectr. 2018 V. 125. № 6. P. 903.
Isakau H.A., Parkhats M.V., Knyukshto V.N., Dzhagarov B.M., Petrov E.P., Petrov P.T. // J. Photochem. Photobiol. B. 2008. V. 92. № 3. P. 165.
Paul S., Heng P.W.S., Chan L.W. // J. Fluorescence. 2012. V. 23. № 2. P. 283.
Brilkina A., Dubasova L., Sergeeva E., Pospelov A., Shilyagina N., Shakhova N., Balalaeva I. // J. Photochem. Photobiol. B. 2018. V. 191. P. 128.
Шилягина Н.Ю., Плеханов В.И., Шкунов И.В., Шилягин П.А., Дубасова Л.В., Брилкина А.А., Соколова Е.А., Турчин И.В., Балалаева И.В. // Современные технологии в медицине. 2014. Т. 6. № 2. С. 15.
Шилов И.П., Иванов А.В., Румянцева В.Д., Миронов А.Ф. // Фундаментальные науки – медицине. Биофизические медицинские технологии / Ред. Григорьев А.И., Владимиров Ю.А. М.: МАКС Пресс, 2015. Т. 2. С. 1104.
Ostroverkhov P.V., Semkina A.S. Naumenko V.A., Plotnikova E.A., Melnikov P.A., Tabakumova O., Yakubovskaya R.I., Mironov A.F., Vodopyanov S.S., Abakumov A.M., Majouga A.G., Grin M.A., Chekhonin V.P., Abakumov M.A. // J. Colloid Interface Sci. 2019. V. 537. P. 132.
Senthilkumar N., Sharma P. K., Sood N., Bhalla N. // Coord. Chem. Rev. 2021. V. 445. P. 214082. https://doi.org/10.1016/j.ccr.2021.214082
McCluskey D.M., Smith T.N., Madasu P.K., Coumbe C.E., Mackey M.A., Fulmer P.A., Wynne J.H., Stevenson S., Phillips J.P. // ACS Appl. Mater. Interfaces. 2009. V. 1. № 4. P. 882. https://doi.org/10.1021/am900008v
Tagmatarchis N., Okada K., Tomiyama T., Yoshida T., Kobayashi Y., Shinohara H. // Chem. Commun. 2001. Iss.15. P. 1366.
Tagmatarchis N., Kato H., Shinohara H. // Phys. Chem. Chem. Phys. 2001. V. 3. P. 3200. https://doi.org/10.1039/B103522N
Kawashima Y., Ohkubo K., Fukuzumi S. // J. Phys. Chem. A. 2012. V. 116. № 36. P. 8942.
Васильев Н.Е., Огиренко А.П. // Лазерная медицина. 2002. № 6(1). С 32.
Dyrda G., Zakrzyk M., Broda M.A., Pedzinski T., Mele G., Słota R. // Molecules. 2020. V. 25. P. 3638. https://doi.org/10.3390/molecules25163638
Dallas P., Velasco P.Q., Lebedeva M., Porfyrakis K. // Chem. Phys. Lett. 2019. V. 730. P. 130. https://doi.org/10.1016/j.cplett.2019.05.055
Juha L., Hamplova V., Kodymova J., Spalek O. // J. Chem. Soc. Chem. Commun. 1994. Iss. 21. P. 2437.
Martínez-Agramunt V., Peris E. // Inorg. Chem. 2019. V. 58. № 17. P. 11836. https://doi.org/10.1021/acs.inorgchem.9b02097
Yoko I., Toshiya O., Minfang Z., Masako Y., Sumio I. // Bull. Chem. Soc. Jpn. 2008. V. 81. Iss. 12. P. 1584. https://doi.org/10.1246/bcsj.81.1584
Stasheuski A.S., Galievsky V.A., Stupak A.P., Dzhagarov B.M., Choi M.J., Chung B.H., Jeong J.Y. // Photochem. Photobiol. 2014. V. 90. P. 997. https://doi.org/10.1111/php.12294
Zhao B., He Y.Y., Bilski P.J., Chignell C.F. // Chem. Res. Toxicol. 2008. V. 21. P. 1056. https://doi.org/10.1021/tx800056w
Pan Y., Liu X., Zhang W., Liu Z., Zeng G., Shao B., Liang Q., He Q., Yuan X., Huang D. Chen M. // Appl. Catal. B. 2020. V. 265. P. 118579. https://doi.org/10.1016/j.apcatb.2019.118579
Shilin V.A., Lebedev V.T., Kolesnick S.G., Kozlov V.S., Grushko Yu.S., Sedov V.P., Kukorenko V.V. // Crystallogr. Rep. 2011. V. 56. № 7. P. 1192.
Lebedev V.T., Grushko Yu.S., Sedov V.P., Shikin V.A., Kozlov V.S., Orlov S.P., Sushkov P.A., Kolesnik S.G., Szhogina A.A., Shabalin V.V. // Phys. Solid State. 2014. V. 56. № 1. P. 178.
Дубовский И.М., Лебедев В.Т., Шилин В.А., Сжогина А.А., Суясова М.В., Седов В.П. // Кристаллография. 2018. Т. 63. № 1. С. 144.
Buchler J.W., Ng D.K.P. Metal Tetrapyrrole Double- and triple-Deckers with Special Emphasis on Porphyrin Systems // The Porphyrin Handbook. Vol. 3. / Eds. Kadish K.M., Smith K.M., Guilard R. San Diego, San Francisco, New York, Boston, London, Sydney, Toronto: Academic Press, 2000. P. 246.
Aleksenskiy A.E., Eydelman E.D., Vul A.Ya. // Nanotechnol. Lett. 2011. V. 3. P. 68.
Alexenskii A.E. Technology of Preparation of Detonation Nanodiamond // Detonation Nanodiamonds: Science and Applications / Eds. Vul A.Ya., Shenderova O.A. Singapore: Pan Stanford Publishing, 2014. Ch. 2. P. 37.
Lebedev V.T., Kulvelis Yu.V., Kuklin A.I., Vul A.Ya. // Condens. Matter. 2016. V. 1. № 10. P. 1. https://doi.org/10.3390/condmat1010010
Vul A.Ya., Eidelman E.D., Aleksenskiy A.E., Shvidchenko A.V., Dideikin A.T., Yuferev V.S., Lebedev V.T., Kulvelis Yu.V., Avdeev M.V. // Carbon. 2017. V. 114. P. 242.
Andrievsky G.V., Kosevich M.V., Vovk O.M., Shelkovsky V.S., Vashchenko L.A. // J. Chem. Soc., Chem. Commun. 1995. Iss. 12. P. 1281. https://doi.org/10.1039/C39950001281
Prylutskyy Yu.I., Petrenko V.I., Ivankov O.I., Kyzyma O.A., Bulavin L.A., Litsis O.O., Evstigneev M.P., Cherepanov V.V., Naumovets A.G., Ritter U. // Langmuir. 2014. V. 30. № 14. P. 3967. https://doi.org/10.1021/la404976k
Kyzyma E.A., Tomchuk A.A., Bulavin L.A., Petrenko V.I., Almasy L., Korobov M V., Volkov D. S., Mikheev I.V., Koshlan I.V., Koshlan N.A., Bláha P., Avdeev M.V., Aksenov V.L. // J. Surf. Invest.: X-ray, Synchrotron Neutron Tech. 2015. V. 9. P. 1. https://doi.org/10.1134/S1027451015010127
Kyzyma E.A., Kuzmenko M.O., Bulavin L.A., Petrenko V.I., Mikheev I.V., Zabolotnyi M.A., Kubovcikova M., Kopcansky P., Korobov M. V., Avdeev M.V., Aksenov V.L. // J. Surf. Invest.: X-Ray, Synchrotron Neutron Tech. 2016. V. 10. P. 1125. https://doi.org/10.1134/S1027451016050517
Москалев П.Н. // Кoорд. химия. 1990. Т. 16. № 2. С. 147.
Kuklin A.I., Soloviov D.V., Rogachev A.V., Utrobin P.K., Kovalev Yu.S., Balasoiu M., Ivankov O.I., Sirotin A.P., Murugova T.N., Petukhova T.B., Gorshkova Yu.E., Erhan R.V., Kutuzov S.A., Soloviev A.G., Gordeliy V.I. // J. Phys.: Conf. Ser. 2011. V. 291. P. 012013. https://doi.org/10.1088/1742-6596/291/1/012013
Kuklin A.I., Islamov A.Kh., Gordeliy V.I. // Neutron News. 2005. V. 16. № 3. P. 16. https://doi.org/10.1080/10448630500454361
Soloviev A.G., Solovjeva T.M., Ivankov O.I., Soloviov D.V., Rogachev A.V., Kuklin A.I. // J. Phys.: Conf. Ser. 2017. V. 848. P. 012020. https://doi.org/10.1088/1742-6596/848/1/012020
Svergun D.I. // J. Appl. Crystallogr. 1992. V. 25. P. 495. https://doi.org/10.1107/S0021889892001663
Konarev P.V., Petoukhov M.V., Volkov V.V., Svergun D.I. // J. Appl. Crystallogr. 2006. V. 39. P. 277.
Kulvelis Y.V., Lebedev V.T., Yevlampieva N.P., Cherechukin D.S., Yudina E.B. Enhancement of Singlet Oxygen Generation of Radachlorin® Conjugated with Polyvinylpyrrolidone and Nanodiamonds in Aqueous Media // Green Photocatalytic Semiconductors. Green Chemistry and Sustainable Technology / Eds. Garg S., Chandra A. London: Springer, 2022. Ch. 10. P. 281. https://doi.org/10.1007/978-3-030-77371-7_10
Lebedev V.T., Török Gy., Kulvelis Yu.V., Soroka M.A., Ganzha V.A., Orlova V.A., Fomin E.V., Sharonova L.V., Shvidchenko A.V. New Photocatalytic Materials Based on Complexes of Nanodiamonds with Diphthalocyanines of Rare Earth Elements // Green Photocatalytic Semiconductors. Green Chemistry and Sustainable Technology / Eds. Garg S., Chandra A. London: Springer, 2022. Ch. 7. P. 179. https://doi.org/10.1007/978-3-030-77371-7_7
Kulvelis Yu., Lebedev V., Yudina E., Shvidchenko A., Aleksenskii A., Vul A., Kuklin A. // J. Surf. Invest.: X‑Ray, Synchrotron Neutron Tech. 2020. V. 14. Suppl. 1. P. S132.
Дополнительные материалы отсутствуют.
Инструменты
Поверхность. Рентгеновские, синхротронные и нейтронные исследования