Приборы и техника эксперимента, 2019, № 1, стр. 79-85
ПРИБОР ДЛЯ ВЫСОКОСПЕЦИФИЧНОГО ДЕТЕКТИРОВАНИЯ БИОМАРКЕРОВ НА КВАРЦЕВОМ РЕЗОНАТОРЕ
Ф. Н. Дульцев a, b, *, Д. В. Некрасов a, Е. А. Колосовский a, А. В. Гусаченко c, А. А. Моисеев c, В. В. Васильев c
a Институт физики полупроводников им. А.В. Ржанова СО РАН
630090 Новосибирск, пpосп. Академика Лавpентьева, 13, Россия
b Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
c Новосибирский филиал Института физики полупроводников им. А.В. Ржанова СО РАН
“Конструкторско-технологический институт прикладной микроэлектроники”
630090 Новосибирск, просп. Академика Лаврентьева, 2/1, Россия
* E-mail: fdultsev@isp.nsc.ru
Поступила в редакцию 12.04.2018
После доработки 29.05.2018
Принята к публикации 27.06.2018
Аннотация
Разработан прибор для измерения силы аффинных взаимодействий, в том числе в биологических системах, и описано его устройство, куда входит сменный картридж с кварцевым резонатором для анализа различных биосистем по сигналу отрыва молекул от поверхности резонатора. Прибор представляет собой сенсорное устройство, с помощью которого можно анализировать различные биологические объекты, в том числе вирусы, бактерии, а также проводить идентификацию ДНК. Разработано программное обеспечение, позволяющее автоматизировать обработку полученных результатов и идентификацию объектов. Прибор может применяться для экспресс-анализа в медицинских учреждениях и научных лабораториях.
ВВЕДЕНИЕ
Разработка и создание биосенсоров на протяжении последних десятилетий является актуальным направлением исследований, объединяющим такие далекие на первый взгляд области, как электроника и биохимия. Большой интерес к биосенсорам вызван их высокой чувствительностью и малыми размерами. Кроме того, данный тип устройств перспективен в качестве инструмента для экспресс-диагностики на ранних стадиях развития заболеваний.
Биосенсоры – это аналитические устройства, использующие биологические материалы для “узнавания” определенных молекул и выдающие информацию об их присутствии и количестве в виде электрического сигнала. Любой биосенсор состоит из двух принципиальных функциональных элементов: биоселективной мембраны, использующей различные биологические структуры, и физического преобразователя сигнала, трансформирующего его в электрический. Для считывания и записи информации используют электронные системы усиления и регистрации сигнала.
На поверхности биоселективной мембраны иммобилизируют специфичные биологические молекулы-рецепторы (антитела, антигены), которые связываются с молекулами искомого вещества. Специфичность партнеров по связыванию характеризуется их аффинностью, т.е. прочностью связывания активных центров молекулы антитела с детерминантными группами антигена. Аффинность партнеров по связыванию может быть определена путем измерения силы разрыва связи между ними.
Измерение сил разрыва связей в биологических молекулах является нетривиальной задачей, результаты которой могут быть полезны для широкого круга работ исследовательского и прикладного характера, в том числе и при создании биосенсоров. При исследовании биологических систем для минимизации вносимых искажений предпочтительно избегать электромагнитного воздействия, поэтому особую ценность приобретают методы, основанные на механическом воздействии.
Существует ряд методов измерения сил разрыва химических связей в молекулярных комплексах, например методы, основанные на применении оптических пинцетов [1–3], магнитных пинцетов [4], кварцевых резонаторов [5]. Наиболее широкое применение в исследованиях нуклеиновых кислот, и в частности олигонуклеотидов (ДНК), получил метод атомно-силовой спектроскопии, в котором одна цепочка закрепляется на зонде атомно-силового микроскопа, а комплементарная – на поверхности подложки [6–8]. В течение одного цикла приближения и отведения зонда от поверхности происходит образование и разрыв дуплекса ДНК. При этом, в зависимости от способа иммобилизации цепочек, внешняя сила может быть приложена вдоль, поперек либо под углом к сахар-фосфатному скелету, и разрыв водородных связей будет происходить в одном из трех режимов: сдвиговом, с последовательным разделением нуклеотидов или в смешанном режиме [9]. В случае реализации сдвигового режима вклад в величину измеряемой силы разрыва будут вносить взаимодействия между соседними нуклеотидами внутри каждой цепочки, в то время как при последовательном разделении нуклеотидов вклад в измеряемую величину преимущественно будут давать силы разрыва водородных связей в отдельных парах оснований [10]. Стоит отметить, что величина силы разрыва связи зависит от множества факторов: солевых условий [10] и температуры среды [4, 11, 12], в которой проводится измерение длины олигонуклеотида [7, 12], и скорости движения зонда. Таким образом, для корректной оценки экспериментальных данных необходимо учитывать все эти факторы. В данной работе мы используем методику определения силы отрыва по искажениям на вольт-частотной зависимости кварцевого резонатора, появляющимся при отрыве помещенной на нем частицы, и представим прибор для получения вольт-частотной зависимости [13]. При отрыве частицы от поверхности на резонансной кривой появляются искажения. По местоположению и величине искажений на резонансной кривой, зная силу связывания вещества с поверхностью, можно определить массу оторванного вещества. И наоборот, зная величину оторванной массы, можно определить силу связывания вещества с поверхностью [14]. Резонансная кривая кварцевого резонатора часто значительно отличается от идеальной, что может быть связано с химической обработкой поверхности резонатора, наличием объектов на поверхности, а также качеством самого кварца. Поэтому необходимо знать причины появления искажений и учитывать их при обработке полученных результатов.
Сила разрыва связи может быть измерена путем сканирования явлений отрыва молекул от поверхности кварцевых микровесов.
Кварцевые микровесы являются разновидностью пьезосенсоров и представляют собой тонкую пластинку, вырезанную из монокристалла кварца. При наложении на нее переменного электрического поля возникают механические автоколебания пластинки с частотой порядка нескольких мегагерц, которые определяются свойствами кристалла и состоянием его поверхности. Так как изменение частоты резонатора пропорционально массе покрытия, данный тип сенсоров получил название “кварцевых микровесов” (Quartz Crystal Microbalance – QCM). При увеличении массы поверхностного слоя частота колебаний кварца меняется в соответствии с уравнением Сауэрбрея (Sauerbrey) [15]:
В составе биосенсоров QCM применяют для прямого измерения прироста массы поверхностного слоя в результате аффинных взаимодействий – образования комплекса антиген–антитело или связывания комплементарных нуклеотидных последовательностей ДНК-зонда и однонитевой ДНК в анализируемом растворе.
В работе [14] предложено использовать QCM для измерения силы разрыва физических и химических связей. В данном подходе кварцевый резонатор работает в активном режиме, т.е. измеряется не изменение массы по изменению частоты, а регистрируется акустический сигнал, возникающий при отрыве молекулы от поверхности кварцевого резонатора при постепенном увеличении амплитуды его осцилляций. Присутствие объекта на поверхности резонатора приводит к незначительному искажению формы колебаний мембраны. При массе объекта, составляющей 10–12 от массы пластины кварца, изменения частоты гораздо ниже, чем дает фон температурных неоднородностей материала кварца. Несмотря на то, что наличие или отсутствие малого объекта на поверхности не может быть зафиксировано (по массе), момент отрыва определяется, поскольку в резонаторной пластинке возникает переходный процесс в виде акустического шума, что и приводит к появлению искажений на вольт-частотной зависимости. Сигнал указывает не только на присутствие аналита, но и на его количество, а также на сродство к рецептору. И важный вопрос – как зафиксировать этот сигнал?
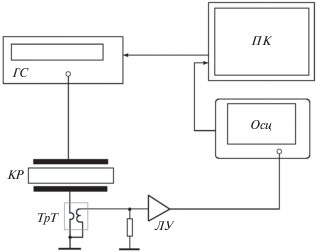
В работе [13] было показано, что сигнал отрыва можно зафиксировать из анализа вольт-частотной зависимости. Блок-схема измерительной установки, собранной на основе готовых приборов, представлена на рис. 1. На кварцевый резонатор (КР) от генератора (ГС) подается переменное напряжение, и проводится сканирование в области резонансной частоты. Увеличение напряжения на поверхности резонатора вызывает увеличение амплитуды сдвиговых осцилляций. При каждом значении напряжения записывается амплитудно-частотная характеристика с проходом через резонансную частоту. Затем напряжение увеличивают и сканирование повторяют. Амплитуда сдвиговых осцилляций зависит от величины прикладываемого напряжения. При определенной величине напряжения (пороговое напряжение) инерционные силы сравниваются по величине с силой разрыва связи, и связанные с поверхностью молекулы отрываются. Таким образом, получают семейство амплитудно-частотных характеристик, снятых при разных значениях напряжения. Величина силы разрыва связи может быть определена из порогового напряжения. При отрыве молекулы от поверхности резонатора на амплитудно-частотной характеристике в области резонансной частоты наблюдаются искажения. Форма этих искажений зависит от типа и количества связей, а также от положения молекулы на поверхности резонатора.
Рис. 1.
Схема для измерения амплитудно-частотной зависимости. ГС – генератор напряжения, КР – кварцевый резонатор, ТрТ – трансформатор тока, ЛУ – логарифмический усилитель (AD8307), Осц – осциллограф Tektronix TDS2012 (используется как аналого-цифровой преобразователь), ПК – персональный компьютер.
Вследствие того, что измерения проводятся в окрестности резонансной частоты, даже малые воздействия на колебательную систему вызывают значительные искажения амплитудно-частотной характеристики, чем и объясняется высокая чувствительность данного метода (<1% от монослоя). Эта методика позволяет изучать поведение макромолекул, поскольку по диапазону сил она лежит в области водородных связей, которые играют большую роль в биологических системах. Другая важная ее черта – эта методика не вносит искажений в измеряемый сигнал. В данной работе описан прибор для измерения сил разрыва связи.
ПРАКТИЧЕСКАЯ РЕАЛИЗАЦИЯ ПРИБОРА
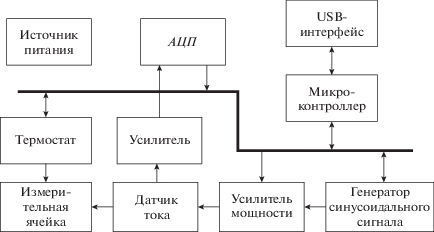
Функциональная схема прибора приведена на рис. 2. Общее управление режимом работы прибора, а также взаимодействие с персональным компьютером обеспечивается микроконтроллером STM32F103. Получение управляющих команд и передача текущих измерений в ПК осуществляется через USB-интерфейс. Для реализации аппаратной части USB-интерфейса используется встроенный в микроконтроллер интерфейсный модуль. При получении управляющей команды микроконтроллер определяет параметры требуемого выходного измерительного сигнала и соответствующим образом настраивает генератор синусоидального сигнала и усилитель мощности. Генератор синусоидального сигнала выполнен на интегральной схеме (и.с.) DDS (Direct Digital Synthesizer – схема прямого цифрового синтеза) AD9852. Частота выходного сигнала изменяется прямым программированием внутренних регистров и.с. генератора. Усилитель мощности собран на двух и.с. – AD8336 и ADA4870: AD8336 обеспечивает регулирование амплитуды выходного синусоидального сигнала, а ADA4870 – усиление сигнала по мощности. С выхода усилителя мощности сигнал подается на измерительную ячейку.
В процессе проведения измерения фиксируется изменение тока, протекающего через измерительную ячейку (картридж). Датчиком тока служит трансформатор тока на ферритовом кольце (см. рис. 1). На выходе трансформатора формируется выходное переменное напряжение, пропорциональное протекающему через ячейку току. Это напряжение, усиленное и выпрямленное логарифмическим усилителем, подается на аналого-цифровой преобразователь АЦП (рис. 2). В качестве усилителя используется и.с. AD8307. На выходе усилителя формируется постоянное напряжение, пропорциональное логарифму амплитуды напряжения на входе. Для оцифровки выходного сигнала усилителя используется 16-разрядный АЦП последовательного приближения AD7680. Оцифрованные значения входного напряжения передаются в микроконтроллер через последовательную 4-проводную шину SPI. Тактовая частота шины SPI составляет 5 МГц. По этой же шине осуществляется управление генератором синусоидального сигнала, усилителем мощности и термостатом.
Измерительная ячейка представляет собой сменный картридж, изготовленнный из пластика (см. рис. 3). Ячейка состоит из нижнего основания 2 с контактами 1 и верхней крышки 3, внутри ячейки находится кварцевый резонатор 4. По периметру кварцевый резонатор уплотняется силиконовыми прокладками. Верхняя и нижняя части ячейки соединяются и удерживаются с помощью четырех магнитов.
Рис. 3.
Измерительная ячейка (1 – контакты; 2 – нижнее основание; 3 – верхняя крышка; 4 – кварцевый резонатор); справа показан ее внешний вид.

Кварцевый резонатор был изготовлен из полированных кварцевых пластин диаметром 8.25 мм (АТ-срез), срез сделан под углом 35о (кварц работает в сдвиговой моде), что было сделано для получения колебаний с максимальной амплитудой. На центральную часть пластин с обеих сторон наносились электроды – слой хрома толщиной 20–30 нм для увеличения адгезии, затем слой золота толщиной 100–120 нм в виде круга ∅4 мм. Резонансная частота кварца составляла 14.3 МГц. В зависимости от модифицирования поверхности кварцевого резонатора картридж может быть использован для обнаружения вирусов, фагов, различных видов бактерий или для измерения силы разрыва связи. При подготовке поверхности мы использовали стандартные методы, разработанные для объемных образцов, но применили их к поверхности [13]. Схема модифицирования поверхности для изучения олигонуклеотидов выглядит следующим образом. Сначала делали монослойное покрытие поверхности золота (электрода) тиолом, для этого использовали тиол с концевой функциональной СООН-группой. Реакция протекает в растворе метанола в течение 12 ч. Затем полученный образец промывается с использованием ультразвуковой ванны, и проводится активация поверхности с использованием EDC/NHS-процедуры [16]. Для этого в буфере MES растворяли EDC и NHS и наносили на поверхность в виде капли, затем выдерживали в течение 20 мин, промывали деионизованной водой и наносили 2 мкл раствора олигонуклеотида концентрацией 10–9 М с концевой NH2-группой; время реакции 2 ч. Молекула олигонуклеотида пришивается к поверхности по аминной группе.
При проведении измерений температура измерительной ячейки стабилизируется при помощи термостата. Значение температуры ячейки задается с помощью ПК. Поддержание температуры на установленном уровне осуществляет микроконтроллер. Для измерения текущей температуры используется и.с. ADT7310. В качестве нагревательного элемента использован полевой транзистор IRLI520NPBF.
После включения прибора проводится внутренняя инициализация, и устройство переходит в режим ожидания команд. Ниже представлен перечень основных команд:
CMD_STOP – остановить процесс;
CMD_START – запустить процесс;
CMD_GETSTATUS – получить статус устройства;
CMD_GETPARAM – получить параметр;
CMD_SETPARAM – установить параметр;
CMD_GETT – температура;
CMD_GETADC – данные АЦП.
Для начала работы передаются необходимые параметры и подается команда “Запустить процесс”. Устройство устанавливает параметры и передает полученные значения АЦП в управляющий компьютер. Процесс установки и передачи повторяется необходимое количество раз. Процесс работы можно в любой момент остановить командой “Остановить процесс”.
Передача команд и данных осуществляется в виде последовательности байтов. Протокол передачи основан на модифицированном варианте пакетов протокола WAKE. Структура пакета передачи представлена в таблице 1.
Таблица 1.
Структура пакета
| Поле | Размер, байт | Описание | Примечания |
|---|---|---|---|
| Start | 1 | Маркер начала пакета | Больше нигде в потоке не встречается, что позволяет однозначно определить начало пакета |
| Cmd | 1 | Команда | Всегда имеет нулевой старший бит, таким образом, доступно не более 128 различных команд |
| Len | 2 | Длина поля данных | Количество полезных байт данных |
| Data | N | Данные | Поле присутствует, только если длина Len не равна нулю |
| CRC | 1 | Контрольная сумма | Рассчитывается, начиная с поля Start и заканчивая последним байтом поля данных |
Чтобы маркер начала пакета однозначно определялся в потоке данных, используется символ подмены:
Если в потоке данных встречаются байты, значения которых совпадают с кодом начала пакета или символа подмены, производится подмена этих байт управляющими ESC-последовательностями.
В управляющем компьютере устройство опознается как виртуальный COM-порт. После запуска программы требуется выбрать порт подключения (см. рис. 4). Программа регулярно проверяет статус устройства. Статус индицируется на соответствующей кнопке. В полях необходимо ввести параметры работы. При нажатии клавиши Enter параметр передается в устройство. После нажатия кнопки Start на графике начинают появляться результаты измерения. Время измерения зависит от выбранных параметров количества и времени.
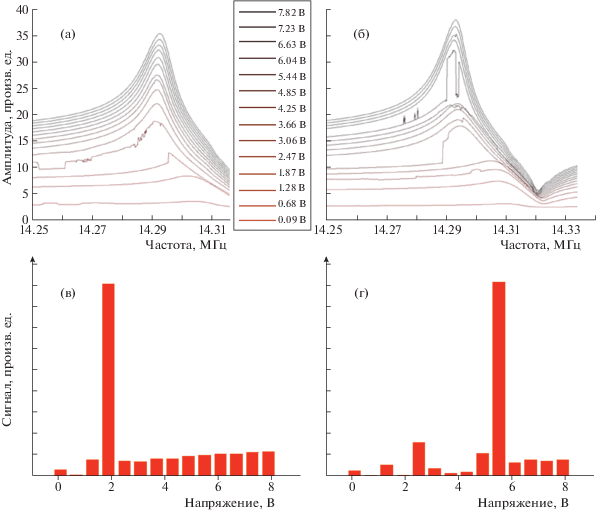
Данный прибор был протестирован с использованием картриджей различных типов. В качестве примера на рис. 5 показано, как взаимодействует бактерия Staphylococcus aureus (концентрация 109 бактерий в 1 мл в PBS-буфере). На рис. 5a, 5б показаны вольт-частотные зависимости для картриджей разных типов, поверхности которых имеют разную модификацию: один тип дает специфическое связывание поверхности с бактериями (рис. 5б), а второй – неспецифическое (рис. 5a). Более подробно про модифицирование кварцевых резонаторов для определения бактерий разных типов можно посмотреть в работе [17]. Нами разработана процедура математической обработки полученных вольт-частотных зависимостей, которая зависит от типа бактерий и их количества; методика подробно описана в работе [18]. Эту процедуру удалось полностью оптимизировать с помощью компьютера. Результаты работы программы показаны на рис. 5в, 5г, где приведена зависимость сигнала отрыва от напряжения сканирования.. По величине сигнала можно судить о количестве объектов на поверхности, а по значению напряжения, при котором происходит отрыв, – о силе связывания. Таким образом, можно определить, специфически связана данная бактерия с поверхностью или нет, и по этим данным можно определить тип бактерий.
Рис. 5.
Амплитудно-частотные зависимости для Staphylococcus aureus (109 бактерий в 1 мл, в буфере PBS) в случае неспецифического (а) и специфического (б) связывания. После инкубации в течение часа картриджи промывали деионизованной водой, а затем проводили измерения в жидкости, в буфере PBS. Сигнал после обработки – зависимость сигнала отрыва от напряжения сканирования: в – неспецифическое связывание, г – специфическое связывание.
ЗАКЛЮЧЕНИЕ
Разработан и изготовлен прибор, позволяющий измерять силу разрыва связей биообъектов. Данный тип устройств перспективен в качестве инструмента для экспресс-диагностики на ранних стадиях развития заболеваний. В устройстве используется принцип измерения силы аффинных взаимодействий по сигналу отрыва молекул от поверхности кварцевого резонатора, и поэтому прибор может найти широкое применение при создании различных биологических сенсоров на основе аффинных взаимодействий.
Список литературы
Duguid J.G., Bloomfield V.A., Benevides J.M., Tho-mas G.J. Jr. // Biophys. J. 1996. V. 71. № 6. P. 3350. doi 10.1016/S0006-3495(96)79528-0
Gross P., Laurens N., Oddershede L.B., Bockelmann U., Peterman E.J.G., Wuite G.J.L. // Nature Phys. 2011. V. 7. № 9. P. 731. doi 10.1038/NPHYS2002
Bockelmann U., Thomen P., Essevaz-Roulet B., Viasnoff V., Heslot F. // Biophys J. 2002. V. 82. № 3. P. 1537. doi 10.1016/S0006-3495(02)75506-9
Danilowicz C., Kafri Y., Conroy R.S., Colijee V.W., Weeks J., Prentiss M. // Phys. Rev. Lett. 2004. V. 93. № 7. P. 078101. doi 10.1103/PhysRevLett.93.078101
Dultsev F.N., Kolosovsky E.A., Mik I.A., Lomzov A.A., Pyshnyi D.V. // Langmuir. 2014. V. 30. № 13. P. 3795. doi 10.1021/la402971a
Cao M., Deng L., Xu H. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2015. V. 470. P. 46.
Strunz T., Oroszlan K., Schafer R., Guntherodt H.J. // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 20. P. 11277.
Pope L.H., Davies M.C., Laughton C.A., Roberts C.J., Tendler S.J., Williams P.M. // Eur. Biophys. J. 2001. V. 30. № 1. P. 53.
Mosayebi M., Louis A.A., Doye J.P.K., Ouldridge T.T. // ACS Nano. 2015. V. 9. № 12. P. 11993. doi 10.1021/ acsnano.5b04726
Zhang T., Zhang C., Dong Z., Guan Y. // Sci. Rep. 2015. V. 5. P. 9143. doi 10.1038/srep09143
Schumakovitch I., Grange W., Strunz T., Bertoncini P., Guntherodt H., Henger M. // Biophys. J. 2002. V. 82. № 1. P. 517. doi 10.1016/S0006-3495(02)75416-7
Grange W., Strunz T., Schumakovitch I., Guntherodt H., Hegner M. // Single Molecules. 2001. V. 2. № 2. P. 75.
Dultsev F.N., Kolosovsky E.A., Mik I.A. // Langmuir. 2012. V. 28. № 39. P. 13793. doi 10.1021/la302907r
Dultsev F.N., Ostanin V.P., Klenerman D. // Langmuir. 2000. V. 16. P. 5036. doi 10.1021/la990789v
Sauerbrey G. // Z. Phys. 1959. V. 155. P. 206.
Dultsev F.N., Kolosovsky E.A., Mik I.A., Lomzov A.A., Pyshnyi D.V. // Langmuir. 2014. V. 30. P. 3795. doi 10.1021/la402971a
Cooper M.A., Dultsev F.N., Ostanin V.P., Klenerman D. // Analytica Chimica Acta. 2011. V. 702. P. 233. doi 10.1016/j.aca.2011.06.025
Dultsev F.N., Nekrasov D.V. // Sensors & Actuators: B. Chemical Sensors and Actuators B. 2018. V. 267. P. 70. doi 10.1016/j.snb.2018.04.029
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента