Приборы и техника эксперимента, 2019, № 1, стр. 153-155
УСТАНОВКА ДЛЯ ИССЛЕДОВАНИЯ ЛАЗЕРНО-ИНДУЦИРОВАННОГО ПЕРЕНОСА ГЕЛЕВЫХ МИКРОКАПЕЛЬ С ЖИВЫМИ КЛЕТОЧНЫМИ И МИКРОБНЫМИ ОБЪЕКТАМИ
Н. В. Минаев, В. И. Юсупов, Е. С. Чурбанова, С. Н. Чурбанов, В. И. Жигарьков, А. А. Антошин
Поступила в редакцию 13.08.2018
После доработки 13.08.2018
Принята к публикации 15.08.2018
Одним из наиболее перспективных направлений биотехнологии и медицины является метод лазерно-индуцированного прямого переноса (в англоязычной литературе Laser Induced Forward Transfer – LIFT) [1–3]. Метод позволяет осуществлять печать гелевыми микрокаплями с находящимися внутри них живыми клетками, клеточными агрегатами и микроорганизмами, в том числе расположенными на различных носителях (например, микрочастицах почвы) [4]. Такая технология позволяет, в частности, значительно повысить биоразнообразие культивируемых микроорганизмов [3, 4]. Преимущество метода заключается в высоком проценте выживания живых объектов, который близок к 100%.
При реализации этого процесса лазерное импульсное излучение фокусируется через объем прозрачной стеклянной подложки (донорный носитель) на ее поверхность с поглощающим слоем (обычно золото толщиной 50 нм). На эту поверхность предварительно наносится тонкий слой геля с микрообъектами, например живыми клетками. Поглощение энергии сфокусированного лазерного импульса приводит к испарению участка поглощающего слоя, резкому повышению давления и выбросу микроструи геля с микрообъектами. В результате этого микрокапля геля переносится на акцепторную подложку. На процесс формирования микрокапель в значительной степени влияют параметры лазерного излучения и поглощающего слоя, тип и вязкость геля, а также концентрация микрообъектов. Одной из важнейших задач является определение диапазона параметров, при котором реализуется необходимый воспроизводимый режим печати микрокапель заданного объема без разрушения живых объектов.
Нами предложена установка, которая позволяет проводить процесс лазерной печати микрокаплями гелей (объемом от 1 пл до 1 мкл) с широким диапазоном вязкости, содержащими клеточные и микробные объекты, с одновременной диагностикой процесса переноса с помощью акустических и оптических методов.
Принципиальная схема и общий вид установки для диагностики процесса лазерной печати методом лазерно-индуцированного прямого переноса представлены на рис. 1. Источником излучения служит лазер (1) YLPM-1-4x200-20-20 (ООО НТО “ИРЭ-Полюс”, Россия). Длина волны 1064 нм (M2 < 1.5), длительность импульса 4−200 нс, энергия в импульсе от 2 мкДж до 1 мДж. Для управления излучением используется двухзеркальная гальваносканирующая головка LscanH-10-1064 (2) (“АтекоТМ”, Россия) с F-theta объективом SL-1064-110-160 (“Ronar-Smith”, Сингапур) c фокусным расстоянием 160 мм (диаметр пятна в фокусе 30 мкм). Цифровая камера 3 позволяет проводить прицеливание лазерного излучения по микрообъектам, расположенным на донорной подложке. Лазерная головка установлена на моторизированном вертикальном трансляторе 4, что позволяет точно настраивать положение фокуса. Под объективом размещается короб 5 из оргстекла, в котором поддерживаются стерильные условия, а с помощью термостатирующего устройства 6, выполненного на основе двухкаскадного элемента Пельтье 7, обеспечивается необходимая температура. При работе со специфическими живыми клеточными и микробными объектами также возможно поддержание требуемой газовой атмосферы.
Рис. 1.
Принципиальная схема (а) и внешний вид установки (б); пример фотографии гелевой струи с микрочастицами (в). 1 – лазер; 2 − гальваносканирующая головка с объективом; 3 − цифровая камера; 4 – моторизированный вертикальный транслятор; 5 – стерильный бокс; 6 – термостатирующий контроллер; 7 – элемент Пельтье с двумя радиаторами; 8 – донорный носитель; 9 – акцепторный носитель; 10 – скоростная камера; 11 – источник непрерывного лазерного излучения; 12 – источник импульсного лазерного излучения; 13 – акустический гидрофон с аналого-цифровым преобразователем; 14 – спектрофотометр с волоконным зондом; 15 – компьютер для управления лазерным излучением; 16 – компьютер для сбора диагностической информации; 17 – цифровая камера-микроскоп.
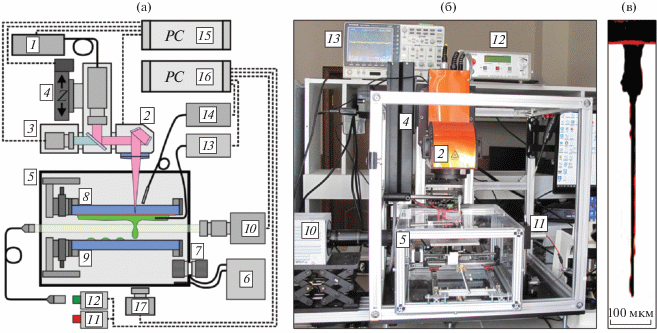
Во внутреннем объеме бокса размещены крепления для донорной 8 и акцепторной 9 подложек, позволяющие размещать подложки в необходимом положении на требуемом расстоянии друг от друга. Для визуальной регистрации процесса формирования струи и перелета капли используется высокоскоростная камера Fastcam SA-3 (10) (“Photron”, Япония) с фронтальной подсветкой от непрерывного 11 или импульсного 12 лазера. Это позволяет снимать серию кадров со скоростью до 105 кадров/с либо одиночные кадры с необходимой задержкой относительно лазерного импульса. Для контроля динамических процессов используется оптоакустический метод [5, 6]. Акустические сигналы регистрируются с помощью игольчатого гидрофона (13) (Precision Acoustics, UK) диаметром 1 мм с предусилителем с шириной полосы 10 кГц–50 МГц. Для диагностики и регистрации параметров облака плазмы используется волоконный спектрофотометр USB4000 (14) (Ocean Optics, США).
Все системы, используемые в работе, синхронизированы между собой. Управление процессом лазерного воздействия осуществляется с помощью компьютера 15. Второй компьютер 16 используется для комплексной диагностики процесса формирования и перелета гелевых микрокапель, а также для получения изображений перелетевших микрокапель на акцепторной подложке с помощью цифровой камеры 17.
Созданный комплекс позволяет проводить диагностику процесса лазерной печати, необходимую для подбора оптимальных режимов при различных сочетаниях гелей и живых микробиологических объектов. Такие исследования крайне востребованы при разработке технологии лазерной биологической трехмерной печати живыми клеточными культурами, агрегатами (сфероидами) из клеток, микробными объектами на почвенных носителях и т.д. Комплекс позволяет также исследовать фазовые переходы в области лазерного воздействия, включающие процессы формирования сверхкритической флюидной (с.к.ф.) среды, “фазового взрыва”, сверхинтенсивное кипение и т.п.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках исполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части разработки технологии для клеточной лазерной печати, грантов РФФИ: № 18-32-00607 в части исследования процесса лазерно-индуцированного переноса гелевых микрокапель для клеточной печати и № 18-29-06056 в части исследования воздействия эффектов с.к.ф.-сред при импульсном лазерном получении гелевых частиц.
Список литературы
Ovsianikov A., Gruene M., Pflaum M., Koch L., Maiorana F., Wilhelmi M., Haverich A., Chichkov B. // Biofabrication. 2010. V. 2. № 1. doi 10.1088/1758-5082/2/1 /014104
Minaev N.V., Yusupov V.I., Zhigarkov V.S., Churbanova E.S., Cheptsov V.S., Gorlenko M.V., Bagratashvili V.N. // KnE Energy Phys. 2018 P. 23 ISSN 2413-5453. doi 10.18502 /ken.v3i3.2010
Yusupov V.I., Zhigar V.S., Churbanova E.S., Chutko E.A., Evlashin S.A., Gorlenko M.V., Cheptsov V.S., Minaev N.V., Bagratashvili V.N. // Quantum Electron. 2017. V. 47. № 12. P. 1158. doi 10.1070/QEL16512
Yusupov V.I., Gorlenko M.V., Cheptsov V.S., Minaev N.V. // Laser Phys. Lett. IOP Publishing. 2018. V. 15. № 6. P. 1. doi 10.1088/1612-202X/aab5ef
Карабутов А.А., Пеливанов И.М., Подымова Н.Б., Скипетров С.Е. // Квантовая электроника. 1999. Т. 29. № 3. С. 215.
Юсупов В.И., Коновалов А.Н., Ульянов В.А., Баграташвили В.Н. // Акустический журнал. 2016. Т. 62. № 5. С. 531.
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента


