Приборы и техника эксперимента, 2021, № 3, стр. 119-122
УСТАНОВКА ДЛЯ ЛАЗЕРНОЙ ИНЖЕНЕРИИ МИКРОБИОЛОГИЧЕСКИХ СИСТЕМ
Н. В. Минаев a, Е. О. Епифанов a, В. И. Юсупов a, *
a Институт фотонных технологий ФНИЦ “Кристаллография и фотоника” РАН
108840 Москва, Троицк, ул. Пионерская, 2, Россия
* E-mail: iouss@yandex.ru
Поступила в редакцию 25.09.2020
После доработки 25.10.2020
Принята к публикации 27.10.2020
Аннотация
Описана установка для лазерной биопечати, принцип действия которой основан на переносе микроскопического количества геля с живыми системами с донорной подложки под действием наносекундных лазерных импульсов на произвольные (акцепторные) подложки. Использование в установке наносекундного импульсного лазерного источника, объектива “Пи-шейпер” и моторизированной телескопической системы позволяет в автоматическом режиме настраивать параметры лазерного воздействия под различные задачи. С помощью установки можно проводить лазерную печать различными по размерам и физическим свойствам микроорганизмами, клетками и их агломератами. Установка позволяет, используя разнообразные по вязкости гели, подобрать параметры, обеспечивающие стабильные режимы печати и минимизирующие негативные факторы, воздействующие на переносимые живые микроорганизмы.
1. ВВЕДЕНИЕ
В настоящее время лазерное излучение, благодаря своим уникальным свойствам, широко используется в различных областях науки и техники. Так, лазерная печать, основанная на переносе микроскопического количества вещества под действием лазерно-индуцированного импульсного давления, используется в тканевой инженерии при создании искусственных биотканей и органов [1]. Этот же механизм переноса лежит в основе лазерной инженерии микробных систем – перспективного метода, позволяющего выделять некультивируемые стандартными способами бактерии [2] и разделять “неразделимые” симбионты [3]. Технология лазерной инженерии микробных систем востребована при синтезе новых антибиотиков, производстве биологически активных веществ, создании своеобразного всемирного банка – “Ноева ковчега” микроорганизмов [4].
В практических исследованиях для проведения процесса лазерной печати необходимо иметь возможность настраивать в широких диапазонах параметры лазерного воздействия. Основными параметрами являются диаметр лазерного пятна и энергия в импульсе, а также, в отдельных случаях, распределение интенсивности лазерного излучения в пятне. Такими возможностями обладает предлагаемая установка для лазерной биопечати.
2. КОНСТРУКЦИЯ СИСТЕМЫ
Фотографии установки для лазерной биопечати и ее основных частей представлены на рис. 1. Установка состоит из импульсного лазерного источника (1) Tech-1053 Express (ООО “Лазер-экспорт”, Россия); расширителя лазерного пучка 2; системы зеркал 3 и 6 для юстировки положения хода лазерного пятна; моторизированной телескопической системы (4) MEX13 (Optogama UAB, Литва); оптического элемента “Пи-шейпер” (5) Focal-piShaper 9_1064_HP (AdlOptica Optical Systems GmbH, Германия); компактного однозеркального гальваносканера (7) LscanXY (Атеко-ТМ, Россия) в сочетании с F-theta-объективом SL-100-45-80 (Ronar-Smith, Сингапур).
Рис. 1.
Фотографии установки для лазерной биопечати (а) и ее отдельных частей: узла с донорной и акцепторной подложками (б), а также узла держателя с донорной подложкой (в). 1 – лазер; 2 – расширитель лазерного пучка; 3 и 6 – система зеркал; 4 – моторизированная телескопическая система; 5 – объектив “Пи-шейпер”; 7 – гальваносканер с F-theta-объективом; 8 – оптическая оправка; 9 – кварцевая пластина с поглощающим металлическим слоем; 10 – ограничительная шайба; 11 – слой гидрогеля; 12, 13 – моторизированные подвижки соответственно для донорной и акцепторной подложек. Сплошной желтой линией показан ход лазерного луча.

Моторизированная телескопическая система 4 позволяет корректировать диаметр лазерного пятна и расходимость пучка, задавая его размер, а оптический элемент “Пи-шейпер” 5 – настраивать распределение интенсивности в лазерном пятне.
С помощью оптической схемы лазерное излучение с необходимыми параметрами, задаваемыми компьютерной системой управления, фокусировалось в заданную область на донорной подложке (см. рис. 1в), закрепленной в оптической оправке 8. Донорная подложка состоит из круглой кварцевой пластины 9 диаметром 25 мм, на которую методом магнетронного напыления нанесен тонкий (50–100 нм) поглощающий металлический слой (обычно золото или титан). Поверх подложки размещена ограничительная стеклянная шайба 10, вырезанная методом LIBWE [5] из покровного стекла, необходимой толщины (обычно 110, 160, 200 мкм и более), которая задает толщину слоя гидрогеля. Во внутреннюю часть шайбы помещен необходимый объем гидрогеля 11, в который предварительно замешаны пробы целевых культур микроорганизмов либо частицы субстрата с локализованными на них целевыми культурами.
Оправка, в которой зафиксирована донорная подложка, закреплена на моторизированной двухкоординатной подвижке 12. Последняя состоит из набора микрорельсовых направляющих MGNR07H и опорных модулей MGN7CH (Hiwin, Тайвань), шаговых моторов форм-фактора NEMA8 с резьбовым валом с трапецеидальной резьбой 4.76 × 0.635 мм и комплекта пластиковых деталей, изготовленных с помощью трехмерного принтера. Двухкоординатная моторизированная подвижка 12 установлена на металлической пластине, снизу которой расположена двухкоординатная моторизированная подвижка 13. Она используется для перемещения акцепторной подложки, в качестве которой могут выступать чашки Петри, культуральные планшеты и другие произвольные подложки.
Моторизированные подвижки 12 и 13 управляются с помощью платы управления Bigtreetech SKR PRO v1.1 (Bigtreetech, Китай) с установленной прошивкой Marlin 2.0 (https://marlinfw.org/), что позволяет настроить необходимую комбинацию перемещений донорной и акцепторной подложек синхронно с гальваносканером 7 и импульсным лазерным источником 1. Вся установка собрана на сотовой оптической плите.
Часть установки – узел перемещения донорной и акцепторной подложек – при необходимости изолируется с помощью перчаточного бокса, выполненного из оргстекла, что позволяет поддерживать чистоту проведения экспериментов, контролировать температуру и влажность либо организовывать специфическую среду (например, бескислородную).
Управление процессом лазерной печати осуществляется с помощью компьютера, к которому подключены отдельные элементы лазерной системы (лазер 1, гальваносканер 7, моторизированный телескоп 4, плата управления шаговыми моторами 14), управляемые синхронно.
3. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Эксперименты по лазерной печати проводились с суспензией 2%-ного или 4%-ного водного раствора гиалуроновой кислоты с микрочастицами почвы. Предварительно на донорную подложку наносился слой суспензии гидрогеля толщиной от 110 до 300 мкм. Лазерное излучение фокусировалось на донорной подложке в пятно диаметром 30 мкм с гладким (близким к гауссову) поперечным распределением интенсивности.
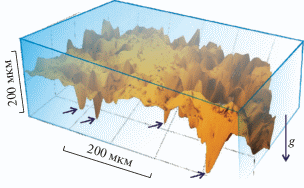
Наблюдение, выполненное с помощью оптического 3D микроскопа HRM-300 (Huvitz, Korea), показало, что микрочастицы почвы в слое геля на донорной подложке распределяются крайне неравномерно: наиболее крупные частицы (носители микроорганизмов) располагаются внизу, на максимальном удалении от металлического поглощающего покрытия (рис. 2). Таким образом, воздействие различных негативных факторов (скачки температуры, ударные волны, прошедшее импульсное излучение) [6] на живые системы, находящиеся на относительно тяжелых и крупных носителях, можно минимизировать, используя достаточно толстый слой геля.
Рис. 2.
Распределение частиц почвы в слое геля толщиной 270 мкм на донорной подложке. Стрелками показано положение наиболее крупных частиц. g – направление ускорения свободного падения.
Эксперименты показали, что размеры полученных на акцепторной подложке микрокапель практически линейно зависят от энергии лазерного излучения (рис. 3). При этом с увеличением вязкости и толщины слоя геля их размер увеличивается. Таким образом, варьируя эти параметры [2], легко получить микрокапли заданного размера.
Рис. 3.
Зависимость размера гелевых микрокапель с частичками почвы на акцепторной подложке от энергии лазерного излучения для различных толщин слоя геля на донорной подложке и процентного содержания в нем гиалуроновой кислоты. Диаметр лазерного пятна 30 мкм, длительность лазерного импульса 8 нс. На вставке показан пример изображения микрокапли, полученного сканирующим электронным микроскопом.

На рис. 4а представлены кадры скоростной съемки, иллюстрирующие образование струи геля с частичками почвы в процессе лазерной печати. При использованной энергии лазерного импульса скорость струи достигала ~10 м/с. Биологическое тестирование показало, что лазерная печать не оказывала существенного негативного воздействия на переносимые микроорганизмы, которые активно прорастали на питательных средах акцепторной подложки (рис. 4б).
Рис. 4.
а – последовательные кадры образования струи геля с частичками почвы в процессе лазерной печати; б – фотографии колоний микроорганизмов, выросших на питательной среде акцепторной подложки в местах с перенесенными микрокаплями. Длительность лазерного импульса 8 нс, энергия 25 мкДж. Съемка проводилась скоростной камерой Fastcam SA3 (Photron, USA) на скорости 4000 кадров/с.

4. ЗАКЛЮЧЕНИЕ
Разработанная установка для лазерной биопечати может эффективно использоваться в практической работе и научных исследованиях. Благодаря использованию оптической схемы, содержащей импульсный наносекундный лазерный источник, моторизированную телескопическую систему и объектив “Пи-шейпер”, можно легко варьировать в широких диапазонах параметры лазерного воздействия на донорную подложку. Это позволяет существенно расширить сферы применения технологии лазерной инженерии микробных систем по сравнению с известными аналогами [7, 8]. Предложенная установка позволяет реализовать стабильные режимы печати, исключающие перенос образующихся при разрушении поглощающей металлической пленки наночастиц [9]. С ее помощью можно проводить лазерную печать различными по размерам и физическим свойствам микроорганизмами, клетками и их агломератами, а также использовать разнообразные по вязкости гели.
Список литературы
Koch L., Kuhn S., Sorg H., Gruene M., Schlie S., Gaebel R., Polchow B., Reimers K., Stoelting S., Ma N., Vogt P.M., Steinhoff G., Chichkov B. // Tissue Eng. Part C Methods. 2010. V. 16. № 5. P. 847. https://doi.org/10.1089/ten.tec.2009.0397
Yusupov V., Churbanov S., Churbanova E., Bardakova K., Antoshin A., Evlashin S., Timashev P., Minaev N. // Int. J. Bioprinting. 2020. V. 6. № 3. P. 1. https://doi.org/10.18063/ijb.v6i3.271
Kochetkova T.V., Zayulina K.S., Zhigarkov V.S., Minaev N.V., Chichkov B.N., Novikov A.A., Toshcha-kov S.V., Elcheninov A.G., Kublanov I.V. // Int. J. Syst. Evol. Microbiol. 2020. V. 70. № 2. P. 1192. https://doi.org/10.1099/ijsem.0.003902
Bello M.G.D., Knight R., Gilbert J.A., Blaser M.J. // Science. 2018. V. 362. № 6410. P. 33. https://doi.org/10.1126/science.aau8816
Минаев Н.В., Шубный А.Г., Юсупов В.И., Цветков М.Ю., Баграташвили В.Н. // ПТЭ. 2018. № 6. P. 127. https://doi.org/10.1134/S0032816218060101
Yusupov V.I., Zhigarkov V.S., Churbanova E.S., Chutko E.A., Evlashin S.A., Gorlenko M.V., Cheptsov V.S., Minaev N.V., Bagratashvili V.N. // Quantum Electron. 2017. V. 47. № 12. P. 1158. https://doi.org/10.1070/QEL16512
Минаев Н.В., Юсупов В.И., Чурбанова Е.С., Чурбанов С.Н., Жигарьков В.И., Антошин А.А. // ПТЭ. 2019. № 1. P. 153. https://doi.org/10.1134/S0032816219010191
Минаев Н.В., Юсупов В.И., Чичков Б.Н. Патент на полезную модель № 198221 РФ // Опубл. 25.06.2020. Бюл. № 18.
Жигарьков В.С., Минаев Н.В., Юсупов В.И. // ПТЭ. 2020. № 1. P. 153. https://doi.org/10.31857/S0032816219060326
Дополнительные материалы отсутствуют.
Инструменты
Приборы и техника эксперимента


