Прикладная биохимия и микробиология, 2019, T. 55, № 1, стр. 38-45
Исследование физико-химических и биологических свойств белково-пептидного комплекса, выделенного из ткани яичников крупного рогатого скота
А. П. Ильина 1, М. С. Краснов 1, П. А. Елистратов 1, Н. В. Ямскова 2, В. П. Ямскова 2, **, А. К. Буряк 3, ***, И. А. Ямсков 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, Россия
2 Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Россия
** E-mail: Yamskova-vp@yandex.ru
*** E-mail: AKBuryak@ipc.rssi.ru
* E-mail: Yamskov@mail.ru
Поступила в редакцию 22.01.2018
После доработки 04.07.2018
Принята к публикации 25.07.2018
Аннотация
Изучен белково-пептидный комплекс, выделенный из ткани яичников крупного рогатого скота. Показано, что в его состав входят полипептиды с молекулярными массами от 800 до 6000 Да и белок – представитель семейства альбуминов млекопитающих с молекулярной массой 66690 Да, содержащий 16-членную N-концевую аминокислотную последовательность DTHKSEIAHRFKDLGE. На модели роллерного органотипического культивирования яичников крысы было показано, что действие данного белково-пептидного комплекса при низких концентрациях общего белка 10–8–10–15 мг/мл способствовало повышению жизнеспособности и созреванию вторичных фолликул в ткани яичников крысы in vitro.
Мембранотропные гомеостатические тканеспецифические биорегуляторы (МГТБ) были обнаружены в различных тканях млекопитающих [1, 2]. Установлено, что основу МГТБ составляют белково-пептидные комплексы, локализованные внеклеточно. Показано, что они оказывают влияние на такие основные биологические процессы, как клеточная адгезия, миграция, пролиферация и дифференцировка. Они стимулируют также процессы восстановления и репарации вследствие способности дополнительно активировать клеточные источники регенерации в тканях [2–4]. Активность МГТБ характеризуется наличием тканевой, но отсутствием видовой специфичности [1, 2]. В основном были изучены МГТБ, которые получали из тканей глаза, внутренних желез, костной ткани и сыворотки крови млекопитающих [1, 2].
Органы репродуктивной системы млекопитающих, продуцирующие гаметы – гаплоидные клетки, отличаются от соматических одинарным набором хромосом и способностью к мейотическому делению. Например, оогенез – процесс формирования женских гамет, включает мейоз, проходящий в диплоидном первичном ооците, который необходим для получения гаплоидной гаметы (яйцеклетки) [5]. Ранее из ткани семенников крупного рогатого скота (КРС) был выделен МГТБ, который в условиях проведения органного роллерного культивирования in vitro оказывал в низких дозах протекторное действие по отношению к тканям и клеткам семенников мыши [3].
Цель работы – поиск МГТБ в тканях яичников КРС, изучение их состава и биологического действия.
МЕТОДИКА
Выделение и очистка биорегулятора. В работе использовали яичники половозрелых коров, полученные при забое КРС (Bos taurus taurus) на мясокомбинате (“Новый Мелет”, Россия).
Ткани яичников нарезали на небольшие фрагменты, размером 1.5–2.0 см2, и экстрагировали в течение 3 ч при 4°С в растворе следующего состава: 0.15 М NaCl, 2.5 × 10–3 М KCl, 2 × 10–3 М CaCl2 и 1 × 10–3 М HEPES. Полученный экстракт фильтровали и центрифугировали при 3000 g в течение 30 мин. К охлажденному раствору тканевого экстракта постепенно при постоянном перемешивании добавляли сухой сернокислый аммоний до образования насыщенного раствора соли (780 г/л). Суспензию белков оставляли на 10 сут при 4°С, после чего центрифугировали при 12 000 g в течение 30 мин.
Фракции супернатанта и осадка диализовали в течение 8–10 сут до полного удаления ионов сульфата аммония. Фракцию супернатанта диализовали против дистиллированной воды, а фракцию осадка – против 0.01 M трис буфера, pH 7.4. Диализованные фракции концентрировали на роторном вакуумном испарителе при 37°С, определяли содержание белка и мембранотропную активность.
Содержание белка. На всех стадиях работы содержание белка определяли спектрофотометрически по методу Варбурга и Кристиана [6].
Исследование мембранотропной активности адгезиометрическим методом. При определении биологической активности фракций, содержащих биорегуляторы данной группы, использовали разработанный ранее адгезиометрический метод, в основе которого лежит оценка параметра, отражающего их влияние на вязкоупругие свойства ткани печени в условиях множественного кратковременного органного культивирования in vitro при стандартном деформационном воздействии [7].
В работе были использованы мыши-гибриды СВА/С57ВL, самцы весом 18–20 г, содержащиеся в стандартных условиях вивария ИБР им. Н.К. Кольцова РАН. Из центральной части большой доли печени вырезали фрагменты весом 0.8–1.2 мг, при этом не использовали края большой доли и области с крупными кровеносными сосудами. Пять фрагментов ткани помещали в пенициллиновые флаконы, содержащие 0.9 мл питательной среды 199 (Предприятие по производству бактерийных и вирусных препаратов Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН, Россия) и 0.1 мл изучаемого раствора соответствующей фракции яичников КРС в необходимой концентрации. В качестве контроля в смеси вместо раствора фракции яичников вносили 1 мл среды. Органные культуры инкубировали в течение 2 ч при 37°С, затем каждый фрагмент ткани стандартно осушали, взвешивали и подвергали в специальном дезинтеграторе ткани с зазором 50 мкм диспергированию в условиях стандартного деформационного воздействия в 0.1 мл 0.1%-ного раствора трипанового синего, приготовленного на среде 199. Полученную суспензию клеток и клеточных ядер исследовали микроскопически в камере Горяева. Подсчет клеточных ядер осуществляли в объеме камеры 0.02 мм3. Биологическое действие активных концентраций изучаемых белковых препаратов определяли, после последовательного разведения в 10, 100, 1000 и более раз.
Полученный биологический эффект рассчитывали по формуле:
Все изученные в одном эксперименте эксплантаты получали из печени одного и того же животного. В каждом отдельном эксперименте на каждую экспериментальную точку (соответствующая концентрация раствора белка) испольховали не менее 5 фрагментов ткани. Для определения мембранотропной активности каждого биорегулятора проводили не менее 3 опытов. Статистическую обработку результатов проводили с использованием t-критерия Стьюдента. Вероятность ошибки цифровых данных находилась в пределах 5%.
Данным методом были изучены фракции супернатанта и осадка, полученные из тканевого экстракта яичников КРС, а также компоненты, полученные при обращенно-фазовой ВЭЖХ-хроматографии осадка тканевого экстракта.
Обращенно-фазовая высокоэффективная жидкостная хроматография. Фракцию осадка разделяли методом обращенно-фазовой ВЭЖХ на жидкостном хроматографе высокого давления “Agilent 1260” (“Agilent Technologies”, США), используя колонку (4.6 × 250 мм) с Kromasil C4 (“AkzoNobel”, Швеция), уравновешенную водным раствором 0.1%-ной трифторуксусной кислоты, рН 2.2. Связавшийся с сорбентом материал элюировали градиентом концентрации ацетонитрила 0–60% в 0.1%-ной трифторуксусной кислоте, рН 2.2, в течение 60 мин. Скорость элюции – 1 мл/мин. Содержание продуктов определяли спектрофотометрически при 210 нм.
Масс-спектрометрический анализ. Анализ осуществляли на времяпролетном MALDI-TOF масс-спектрометре UltraFlex 2 (“Bruker Daltonics”, Германия), оснащенном азотным лазером 337 нм с частотой импульса до 20 Гц. Все измерения проводили в линейном и рефлекторном режиме, определяя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образцов. Внешнюю калибровку проводили с использованием точных значений молекулярных масс известных белков. Образцы наносили на три ячейки планшета, для каждой из которых измеряли и записывали спектр, полученный в результате суммирования 10 серий спектров по 50 импульсов лазера для каждой серии. Для записи, обработки и анализа масс-спектрометрических данных использовали программное обеспечение фирмы “Bruker Daltonics” (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс в эксперименте составляла ±2 Да. В качестве матрицы использовали насыщенный раствор α-циано-4-гидроксикоричной кислоты (“Sigma-Aldrich”, Германия) в смеси 50%-ного ацетонитрила и 2.5%-ной трифторуксусной кислоты. Все использованные реактивы, включая воду, были аналитической или специальной для масс-спектрометрии чистоты.
Определение N–концевой аминокислотной последовательности. Определение проводили на автоматическом секвенаторе белков Shimadzu PPSQ-33A (“Shimadzu Corp.”, Япония) по методу Эдмана [8] с использованием программы производителя.
Электрофорез белков в полиакриламидном геле (ПААГ). Электрофоретическое разделение белков осуществляли по методу Лэммли [9] в вертикальных пластинах ПААГ толщиной 0.75 мм. Концентрация акриламида в разделяющем и концентрирующем гелях составляла 12.5 и 4% соответственно. Электрофорез проводили при постоянном токе 20–30 мА в течение 1 ч на приборе для вертикального электрофореза Minivertical gel system EC120 (“Bio-Rad”, США). После окончания электрофореза гель фиксировали и окрашивали красителем Кумасси бриллиантовый синий R-250 [10]. Использовали белки-маркеры молекулярной массы 2–250 кДа “Bio-Rad” (США).
Триптический гидролиз белка. Полученный в результате электрофореза в ПААГ компонент, соответствующий белку с молекулярной массой 66 000 Да, вырезали из геля (площадь 3 мм2), промывали в 100 мкл 50%-ного метанола и дегидратировали в 400 мкл ацетонитрила. Дисульфидные связи восстанавливали в 100 мкл 10 мМ дитиотреитола (“Fermentas”, Латвия) с последующим их алкилированием 100 мкл 55 мМ йодацетамида (“Sigma-Aldrich”, Германия). После этого модифицированный белок гидролизовали в геле в течение ночи при 37°С, добавляя 20 мкл (1 мг/мл) трипсина (“Promega”, США) в 25 мМ NH4HCO3. Полученные пептиды экстрагировали 10 мкл 50%-ного ацетонитрила в 1%-ой трифторуксусной кислоте. Супернатант (1 мкл) смешивали на стальной мишени с 0.5 мкл (20 мг/мл) раствора α-циано-4-гидроксикоричной кислоты (“Sigma-Aldrich”, Германия) в смеси 50%-ного ацетонитрила и 2.5%-ной трифторуксусной кислоты и подвергали масс-спектрометрическому анализу.
Идентификация белков по базам данных. Белки идентифицировали с помощью программного пакета Mascot (http://www.matrixscience.com/ search_form_select.html). Поиск проводили по данным масс-спектров в базе данных Swiss-Prot и NCBI белков всех организмов и, в частности, белков, обнаруженных у КРС (B. taurus), с указанием типа гидролиза – трипсин с фиксированной модификацией Цис-карбамоилметил.
Денатурация белково-пептидного комплекса. Комплекс денатурировали в течение 24 ч при 45°С в растворе 6.0 М гуанидин гидрохлорида, содержащего 3.0 мМ этилендиаминтетрауксусную кислоту и 0.3 М NaCl, а затем разделяли методом обращенно-фазовой ВЭЖХ на колонке (4.6 × × 250 мм) с Kromasil C4 (“AkzoNobel”, Швеция), уравновешенным водным раствором 0.1%-ной трифторуксусной кислоты, рН 2.2. Связавшийся с сорбентом материал элюировали в течение 60 мин градиентом концентрации 0–60% ацетонитрила в 0.1%-ной трифторуксусной кислоте, рН 2.2. Скорость элюции – 1 мл/мин. Содержание продуктов определяли спектрофотометрически при 210 нм.
Изучение специфической активности биорегулятора из ткани яичников на модели органного культивирования. В работе использовали 5 (10 яичников) крыс линии Wistar, выращенных в виварии ИБР им. Н.К. Кольцова РАН. Яичники были вырезаны и целиком помещены во флаконы с 6 мл культуральной среды 199, содержащей 10% эмбриональной телячьей сыворотки (ЭТС) (“HyClone”, США) и 1% антибиотика/антимикотика (“Sigma”, Германия). Перед культивированием питательную среду стерилизовали пропусканием через мембранные фильтры GV с диаметром пор 0.22 мкм (“Millipore”, США). В контрольной и опытной серии изучали по три яичника. . Во флаконы опытной серии добавляли такое количество компонента, полученного при ВЭЖХ, которое обеспечивало конечную концентрацию белка в культуральной среде, равную 10–9 мг/мл. В контроль ничего не добавляли. Культивирование проводили в течение 5 сут при 37°С. Использовали роллер RM5 (“Assistant”, Германия) со скоростью вращения 35 об./мин. Для изучения интактной ткани были зафиксированы 4 яичника в растворе Буэна.
После завершения эксперимента все яичники (опытной и контрольной групп) были помещены в фиксатор Буэна. Фиксацию проводили в течение 4 ч, а затем в течение 12 ч трижды отмывали 70%-ным этанолом. После этого осуществляли дегидратацию фрагментов ткани и заливали их парафином. Из парафиновых блоков готовили серию срезов толщиной 4–5 мкм, которые после депарафинирования и гидратирования окрашивали гематоксилином и эозином и заключали в канадский бальзам под покровное стекло. Изучение полученных гистологических образцов, подсчет числа фолликул на срезах и фотофиксацию изображений проводили с помощью микроскопа VANOX, AHBT3 (“Olympus”, Япония) и цифровой камеры U-PMTVC (“Olympus”, Япония).
Для оценки количества фолликул, находящихся на отдельной стадии развития в яичниках крыс всех экспериментальных серий, проводили определение параметра Δ, который рассчитывали по формуле:
Δx = Nx/100, где Nx – число фолликул, подсчитанное на ста гистологических срезах, NI – число первичных фолликул, NII – число вторичных фолликул, NIII – число третичных фолликул (граафовы пузырьки), ΔН/Ж – число нежизнеспособных фолликул.
Живые и нежизнеспособные фолликулы, а также фолликулы на разных стадиях развития определяли по их морфологии. Живые фолликулы визуально можно было определить по выраженному ядру ооцита, находящегося внутри фолликула, и структурированному слою гранулезных клеток. Нежизнеспособные фолликулы характеризовались отсутствием ядра ооцита или наличием его фрагментов, а также нечеткой формой, вследствие отделения гранулезных клеток от блестящей оболочки ооцита. Первичные фолликулы визуально характеризовались небольшим по размеру ядром ооцита, одним слоем гранулезных клеток и отсутствием полости. Вторичные фолликулы выделялись более крупным размером ядра ооцита, наличием полости и несколькими слоями гранулезных клеток. Третичные фолликулы (граафовы пузырьки) хорошо идентифицировались визуально благодаря крупному размеру ядра ооцита, большому размеру полости и наличию в полости фолликула яйценосного бугорка, в котором находился ооцит.
Результаты экспериментов обрабатывали методами вариационной статистики по t-критерию Стъюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
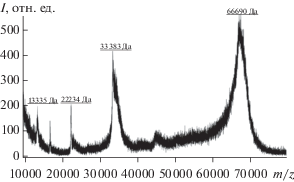
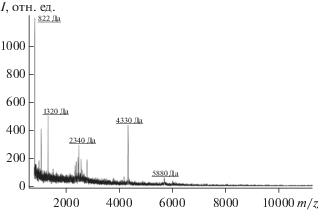
Для выделения и очистки МГТБ из тканевого экстракта яичников КРС применяли методический подход, ранее разработанный для выделения биорегуляторов данной группы [2]. Для этого биорегулятор экстрагировали из ткани водно-солевом раствором при 4°С, затем при высаливании тканевого экстракта сернокислым аммонием получали две фракции – осадка и супернатанта, из которых осадок проявлял мембранотропную активность, характерную для МГТБ (рис. 1). Методом обращенно-фазовой ВЭЖХ были получены 4 компонента (рис. 2) со временами удерживания 28.1, 55.9, 57.3 и 60.2 мин, при этом только компонент со временем удерживания 57.3 мин обладал биологической активностью (рис. 3). Методом MALDI-TOF-масс-спектрометрии показано, что этот компонент содержал белок с молекулярной массой 66 690 Да (рис. 4). Секвенированием по методу Эдмана была определена N-концевая аминокислотная последовательность, содержащая 16 аминокислотных остатков, DTHKSEIAHRFKDLGE-. Эта последовательность оказалась идентичной N-концевой аминокислотной последовательности зрелой молекулы бычьего сывороточного альбумина (БСА). Как было показано ранее, в состав МГТБ, выделенных из различных тканей млекопитающих, входили изоформы альбумина сыворотки крови [11–13]. В связи этим ВЭЖХ-компонент с временем удерживания 57.3 мин изучали методом электрофореза в ПААГ. После окрашивания геля красителем Кумасси R-250 был идентифицирован компонент, содержавший белок с молекулярной массой приблизительно 66 кДа. Анализ пептидов его триптического гидролизата показал, что они являются фрагментами сывороточного альбумина B. taurus (номер в базе данных Uniprot gi | 1351907).
Рис. 1.
Мембранотропная активность (%) на органотипической культуре печени мыши in vitro компонентов из осадка (исходная концентрация 1.91 мг/мл), полученного из экстракта ткани яичников КРС B. taurus, при различной степени последовательного десятикратного разведения (по оси X): К – контроль, 6 и 9 – компоненты, у которых была обнаружена мембранотропная активность (р < 0.05).
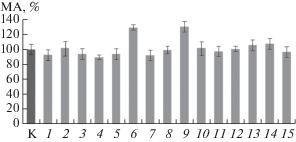
Рис. 2.
Обращенно-фазовая ВЭЖХ фракции осадка, полученного из экстракта ткани яичников КРС B. taurus.
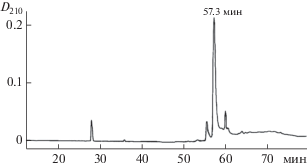
Рис. 3.
Мембранотропная активность (%) на органотипической культуре печени мыши in vitro ВЭЖХ-компонента со временем удерживания 57.3 мин (0.162 мг/мл) при различной степени его последовательного десятикратного разведения (по оси Х): К – контроль, 6, 9 и 12 соответствовали разбавлениям, в которых была обнаружена мембранотропная активность (р < 0.05).
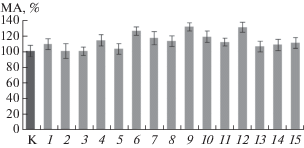
Рис. 4.
MALDI-TOF масс-спектр компонента со временем удерживания 57.3 мин (рис. 2), полученного с помощью обращенно-фазовой ВЭЖХ.
Методом MALDI-TOF-масс-спектрометрии в ВЭЖХ-компоненте с временем удерживания 57.3 мин были также обнаружены пептиды с молекулярными массами 1000–6000 Да. На основании полученных результатов было высказано предположение о том, что этот компонент представлял собой белково-пептидный комплекс, который проявлял биологическую активность. Для разрушения этого комплекса и выделения пептидов, взаимодействующих с альбумином, компонент обрабатывали гуанидин гидрохлоридом, ЭДТА и этиловым спиртом. После такой обработки денатурированный белок осаждался. ВЭЖХ показано, что в надосадочной жидкости содержалось 7 компонентов, но только один из них со временем удерживания 35.8 мин содержал пептиды с молекулярными массами от 800 до 6000 Да (рис. 5). Ни один из полученных после денатурации компонентов не обладал мембранотропной активностью.
Рис. 5.
MALDI-TOF масс-спектр компонента со временем удерживания 35.8 мин после его инкубации в денатурирующих условиях и последующего разделения с помощью обращенно-фазовой ВЭЖХ.
Таким образом, в осадке тканевого экстракта яичников КРС удалось идентифицировать МГТБ, основу которого составлял белково-пептидный комплекс, содержащий пептиды с молекулярными массами от 800 до 6000 Да и белок с молекулярной массой 66 690 Да, который представлял собой сывороточный альбумин, идентичный БСА B. taurus, имеющий в базе данных Uniprot номер gi|1351907. Этот комплекс проявлял характерную для МГТБ биологическую активность, то есть в низких дозах оказывал влияние на вязкоупругие свойства плазматической мембраны клеток млекопитающих [14]. Эти результаты полностью согласовывались с результатами изучения МГТБ, выделенных из других тканей млекопитающих, которые также содержали белково-пептидный комплекс, образованный изоформой БСА и небольшими, связанными с ним пептидами. МГТБ локализованы в межклеточном пространстве тканей, а в условиях органотипического роллерного культивирования in vitro они оказывали выраженное тканеспецифическое протекторное действие на состояние ткани, которое выражалось в сохранении ее пространственной организации, поддержании адгезионных межклеточных взаимодействий и увеличении жизнеспособности клеток и тканей [2].
Как и в случае других биорегуляторов данной группы специфическая биологическая активность МГТБ, выделенного из ткани яичников, была изучена на модели роллерного органотипического культивирования ткани яичников крыс in vitro [2]. Было изучено действие ВЭЖХ-компонента со временем удерживания 57.3 мин в дозе, соответствующей 10–9 мг белка.
Для оценки его биологической активности применяли метод прямого подсчета живых и нежизнеспособных фолликул и общего числа фолликул на парафиновых срезах ткани яичников животных опытной и контрольной групп, а также нативной ткани яичников. Полные данные подсчета фолликул приведены в табл. 1. Графические данные их подсчета представлены на рис. 6 и 7. Полученные результаты (число живых и нежизнеспособных фолликул в контрольной, нативной и опытной группах) были статистически достоверными (р < 0.05).
Таблица 1.
Результаты расчета параметра Δx, характеризующего число живых (ΔЖ)и нежизнеспособных (ΔН/Ж) фолликул при роллерном органотипическом культивировании ткани яичников крыс in vitro
| Исследуемый объект | ΔЖ | ΔН/Ж | ||
|---|---|---|---|---|
| ΔI (I фолликулы) |
ΔII | ΔIII | ||
| Нативная ткань | 9.73 ± 1.1 | 2.91 ± 0.55 | 1.27 ± 0.3 | 0 |
| Контрольная группа | 0.07 ± 0.02 | 0.06 ± 0.02 | 0 | 8.32 ± 1.6 |
| Опытная группа ВЭЖХ-компонент со временем удерживания 57.3 мин и концентрацией белка 10–9 мг/мл | 1.63 ± 0.5 | 3.2 ± 0.6 | 0.51 ± 0.1 | 6.03 ± 1.5 |
Рис. 6.
Количество живых (а) и нежизнеспособных (б) фолликул в нативной ткани яичника (1), контрольной (2) и опытной (3) группах при Δ – параметре, рассчитанном как указано в “Методике”.
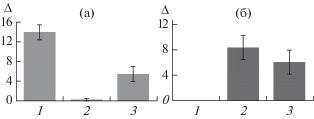
Рис. 7.
Диаграмма значений параметров ΔI, ΔII и ΔIII, характеризующих среднее количество живых первичных (а), вторичных (б) и третичных (в) фолликул в нативной ткани (1), контрольной (2) и опытной (3) группах.
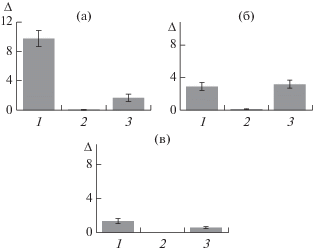
Как видно из данных, приведенных в табл. 1, добавление в среду культивирования ВЭЖХ-компонента со временем удерживания 57.3 мин способствовало повышению жизнеспособности фолликул. Наиболее эффективно биорегулятор воздействовал на количество жизнеспособных вторичных фолликул (рис. 7б). Параметр, характеризующий их количество, оказался существенно выше, чем аналогичный параметр для жизнеспособных первичных (рис. 7а) и третичных (рис. 7в) фолликул.
Анализируя полученные результаты, следует отметить, что МГТБ, выделенный ткани яичников, не только повышал жизнеспособность фолликул, но положительно влиял и на процесс их созревания, оказывая наиболее существенное протекторное действие по отношению к вторичным фолликулам, что чрезвычайно важно для нормального развития у млекопитающих, в частности человека, процессов оогенеза, фолликулогенеза и овуляции.
В ряде работ было показано обновление зародышевых клеток и клеток фолликул во взрослом яичнике [15–17]. В рамках этих работ зародышевые клетки были получены из стволовых клеток in vitro. Так, сначала была описана методика выделения мультипотентных клеточных линий мужских зародышевых стволовых клеток [18], а затем, используя ту же стратегию, получали линии стволовых клеток из яичников постнатальной мыши [19]. Также было показано, что стволовые клетки яичника присутствуют во взрослых, стареющих и постменопаузальных яичниках и дифференцируют in vitro в новые ооциты [20, 21]. После одного года культивирования и многих пассажей стволовые клетки зародышевой линии яичников сохраняли свои характеристики, теломеразную активность, экспрессировали маркеры как зародышевых, так и стволовых клеток, и демонстрировали кариотип, присущий клеткам данного биологического вида [20]. Установлено наличие потомства из линии зародышевых стволовых клеток, полученной из неонатальных яичников мыши [21]. Важно подчеркнуть, что роллерное органотипическое культивирование яичников крысы проводилось in vitro, что исключало возможность активации и воздействия эндокринной системы, в частности гипоталамо-гипофизарных факторов и антимюллерова и фолликулостимулирующего гормонов, на процесс поддержания жизнеспособности и развития фолликул на разных стадиях их созревания. Известно, что при роллерном типе культивирования тканей происходит дополнительное активирование клеточных источников регенерации тканей взрослых особей [22–24]. Результаты ранее проведенных исследований показали, что МГТБ способны дополнительно активировать клеточные источники регенерации [25].
На основании полученных результатов, а также данных литературы, можно предположить, что значительное улучшение выживаемости фолликул, особенно вторичных, в яичниках опытной группы по сравнению с контрольной могло осуществляться за счет дополнительной активации клеточных источников регенерации в ткани, которая происходила при добавлении в культуральную среду МГТБ, выделенного из ткани яичников КРС. Проверка данного предположения будет предметом дальнейшего изучения.
Список литературы
Ямскова В.П., Краснов М.С., Ямсков И.А. Наноразмерные биорегуляторы тканей глаза млекопитающих как основа для фармакологических препаратов нового поколения. М.: Макс Пресс, 2009. 82 с.
Ямскова В.П., Краснов М.С., Ямсков И.А. Новые экспериментальные и теоретические аспекты в биорегуляции. Механизм действия мембранотропных гомеостатических биорегуляторов. Saarbucken: Lambert Academic Publishing, 2012. 127 с.
Краснов М.С., Ямскова В.П., Березин Б.Б., Ямскова Н.В., Ямсков И.А. // Клеточные технологии в биологии и медицине. 2014. № 1. С. 63–67.
Ильина А.П., Молявка А.А., Ямскова В.П., Буряк А.К., Ямсков И.А. // Прикл. биохимия и микробиология. 2014. Т. 50. № 4. С. 442–448.
Blandau R.J. // Anat. Rec. 1945. V. 92. № 1. P. 449–457.
Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика. М.: Мир, 1991. 544 с.
Ямскова В.П., Модянова Е.А., Резникова М.М., Маленков А.Г. // Молек. биол. 1977. Т. 11. № 5. С. 1147–1154.
Edman P. // Arch. Biochem. 1949. V. 22. № 3. P. 475–476.
Laemmli U.K. // Nature. 1970. V. 227. № 259. P. 680–685.
Wilson C.M. // Methods Enzymol. 1983. V. 91. P. 236–247.
Ямскова В.П., Рыбакова Е.Ю., Виноградов А.А., Вечеркин В.В., Ямсков И.А. // Прикл. биохимия и микробиология. 2004. Т. 40. № 4. С. 407–413.
Ямскова В.П., Скрипникова В.С., Молявка А.А., Ильина А.П., Краснов М.С., Маргасюк Д. В., Борисенко А.В., Березин Б.Б., Кузнецова Е.С., Буряк А.К., Ямсков И.А. // Биохимия. 2009. Т. 74. № 9. С. 1195–1203.
Сидорский Е.В., Ильина А.П., Краснов М.С., Ямскова В.П., Буряк А.К., Ямсков И.А. // Прикл. биохимия и микробиология. 2018. Т. 54. № 1. С. 82–88.
Ямскова В.П., Резникова М.М. // Журн. общей биологии. 1991. Т. 52. № 2. С. 181–191.
Bukovsky A. // Reprod. Biol. Endocrinol. 2004. V. 2. № 1. P. 27–29.
Bukovsky A. // Curr. Stem. Cell Res. Ther. 2006. V. 1. № 3. P. 289–303.
Oktem O., Oktay K. // Ann. N. Y. Acad. Sci. 2008. V. 1127. № 1. P. 20–26.
Izadyar F., Pau F., Marh J., Slepko N., Wang T., Gonzalez R., Ramos T., HowertonK., Sayre C., Silva F. // Reproduction. 2008. V. 6. № 1. P. 771–784.
Pacchiarotti J., Maki C., Ramos T., Marh J., Howerton K., Wong J., Pham J., Anorve S., Chow Y.C., Izadyar F. // Differentiation. 2010. V. 79. № 1. P. 159–170.
Bukovsky A. // Anat. Rec. 2011. V. 294. № 8. P. 1284–1306.
Zou K., Yuan Z., Yang Z., Luo H., Sun K., Zhou L., Xiang J., Shi L., Yu Q., Zhang Y., Hou R., Wu J. // N-ature Cell Biol. 2009. V. 11. № 5. P. 631–636.
Александрова О.П., Лыжин A.A., Викторов И.В. // Бюлл. экспер. биол. и мед. 2001. № 9. С. 333–337.
Краснов М.С., Григорян Э.Н., Ямскова В.П. // Изв. РАН Серия биол. 2003. № 1. С. 22–36.
Викторов И.В., Александрова О.П., Алексеева Н.Ю., Лыжин А.А. // Морфология. 2004. Т. 125. № 1. С. 124–125.
Маргасюк Д.В., Краснов М.С., Ямсков И.А., Ямскова В.П. // Известия РАН. Серия биол. 2008. № 6. С. 736–745.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


