Прикладная биохимия и микробиология, 2020, T. 56, № 4, стр. 342-351
Влияние биогенных полиаминов на антибиотикочувствительность и поверхностные свойства клеток Mycobacterium smegmatis
Л. Ю. Нестерова 1, 2, *, И. В. Цыганов 1, 2, А. Г. Ткаченко 1, 2
1 Институт экологии и генетики микроорганизмов, Пермский федеральный исследовательский центр
Уральского отделения Российской академии наук
614081 Пермь, Россия
2 Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
* E-mail: larisa.nesterova@bk.ru
Поступила в редакцию 09.12.2019
После доработки 20.02.2020
Принята к публикации 25.02.2020
Аннотация
Биогенные полиамины оказывают влияние на свойства поверхности клеток Mycobacterium smegmatis. Присутствие в среде культивирования спермидина и спермина значительно изменяет способность к скольжению и заряд клеточной поверхности, однако не влияет на степень ее гидрофобности/гидрофильности. В присутствии полиаминов усиливается агрегация клеток и способность к формированию биопленок. В то же время, полиамины снижают чувствительность к антибиотикам как планктонных форм микобактерий, так и биопленок, что может быть обусловлено действием этих соединений на поверхностные структуры клеток. Впервые показано, что спермин усиливает действие рифампицина, что может представлять интерес с точки зрения терапии заболеваний, вызванных микобактериями.
Одной из наиболее актуальных проблем медицины и микробиологии в течение многих лет остается лечение туберкулезной инфекции. Это заболевание входит в десятку ведущих причин смертности. По данным ВОЗ в настоящее время около четверти населения земного шара инфицированы Mycobacterium tuberculosis [1]. Несмотря на то, что частота патологических процессов, вызванных нетуберкулезными микобактериями, относительно невелика по сравнению с возбудителем туберкулеза, в последние два десятилетия неуклонно растет заболеваемость микобактериозами [2]. Особую тревогу вызывает снижение чувствительности к антибактериальным препаратам как у штаммов M. tuberculosis, так и среди других бактерий [1].
Пониженная чувствительность к антибактериальным препаратам в большинстве случаев возникает в результате появления специфических мутаций либо приобретения бактериями детерминант резистентности в процессе горизонтального переноса генов. Однако причиной снижения эффективности антибактериальных препаратов, наряду с генетически закрепленной антибиотикорезистентностью, является физиологическая толерантность, которая формируется в ответ на специфические факторы внутренней и внешней среды и, в ряде случаев, создает условия для отбора высокорезистентных форм [3, 4]. Ранее показано, что одним из факторов, которые участвуют в формировании физиологической толерантности у бактерий, являются биогенные полиамины [5] – эволюционно древние соединения, которые обнаруживаются в клетках представителей всех таксонов живых организмов.
Полиамины относятся к группе алифатических углеводородов, имеют в составе амино- и иминогруппы и различаются длиной углеродной цепи. В биологических объектах наиболее часто обнаруживаются диамины – путресцин, кадаверин; триамины – спермидин, норспермидин, и тетраамины – агматин и спермин [6]. В клетках эукариотических организмов синтезируются в основном спермин и спермидин, а также в небольших количествах путресцин. Бактерии в значительном количестве продуцируют путресцин, кадаверин и в меньшем – спермидин. Некоторые из них способны синтезировать спермин и другие полиамины [6, 7]. Поликатионная природа этих соединений определяет возможность их присутствия в клетках как в свободном, так и в связанном с полианионными структурами состоянии. Это же свойство обусловливает участие полиаминов во многих процессах, обеспечивающих жизнедеятельность микроорганизмов. Известно, что полиамины способны оказывать влияние на транспортные процессы, изменяя проницаемость пориновых каналов [8], регулировать процессы репликации [9], транскрипции, трансляции и деградации белков [10, 11], а также модулировать генную экспрессию, в том числе, при адаптации к различным стрессовым факторам [12, 13] и формировании персисторного состояния у бактерий [5].
В литературе приводятся данные о влиянии биогенных полиаминов на чувствительность к антибиотикам некоторых грамотрицательных микроорганизмов [14]. Синтез полиаминов и накопление их в клетках в больших количествах характерны именно для этой группы бактерий. Однако гены синтеза этих соединений обнаружены и у некоторых грамположительных микроорганизмов, например, у лактобактерий [14], а также у микобактерий [15]. Кроме того, благодаря развитым системам транспорта, полиамины, присутствующие в тканях хозяина, становятся доступными для бактерий-симбионтов и паразитов животных и человека [16]. Однако в литературе практически не встречаются данные о накоплении полиаминов в клетках микобактерий, несмотря на наличие у них соответствующих ферментов [15, 17]. Вместе с тем, известно, что полиамины, благодаря присутствию в их структуре положительно заряженных аминогрупп, способны взаимодействовать с отрицательно заряженными компонентами клетки, в том числе, с фосфолипидами мембраны и отдельными структурами клеточной стенки [18]. При наличии полиаминов во внешней среде это может воздействовать на свойства поверхностных структур клетки и изменять их функциональную активность. Подобные изменения могут оказывать влияние на способность к адгезии и другие свойства, обусловливающие патогенность и колонизирующую способность бактерий, а также вносить вклад в изменение их чувствительности к антибиотикам.
Цель работы − изучение влияния биогенных полиаминов на чувствительность к антибактериальным препаратам и поверхностные свойства клеток микобактерий.
МЕТОДИКА
Микроорганизмы и условия культивирования. В качестве объекта исследования использован штамм Mycobacterium smegmatis mc2 155. Согласно недавно опубликованным результатам пересмотра систематики рода Mycobacterium [19], M. smegmatis присвоено новое видовое название Mycolicibacterium smegmatis. Этот объект остается удобной моделью для исследования, поскольку является быстрорастущим и по многим свойствам сходен с патогенными формами микобактерий.
Культуру, хранившуюся на чашках Петри с агаризованной средой Luria-Bertani (LB) (“Sigma”, США), высевали на пробирку с 5 мл жидкой среды Middlebrook 7H9 (“Difco”, Франция), содержащей глицерин, 50 мкг/мл ампициллина (“Аpplichem”, Германия) и 0.05% Твин 80 (“Panreac”, Испания). Затем пересевали на пробирку со свежей средой и после 22–24 ч культивирования в термостатируемом шейкере (“GFL 1092”, Германия) при 37°С и 200 об./мин полученную культуру использовали в качестве инокулята. Для изучения влияния полиаминов в среду культивирования добавляли гидрохлориды путресцина, кадаверина, спермидина и спермина (“Sigma”, Швейцария) в концентрациях, указанных в подписях к рисункам.
Биопленкообразование. Для определения влияния полиаминов на биопленкообразование культуру M. smegmatis, выращенную в течение 24 ч, центрифугировали, удаляли надосадочную жидкость и ресуспендировали в свежей среде Middlebrook 7H9 без добавления Твина 80, доводя до оптической плотности (ОП600) 0.1. Затем суспензию клеток разводили ещe в 5 раз и вносили по 100 мкл в лунки полистиролового 96-луночного плоскодонного планшета (“Минимед”, Россия), куда предварительно вносили по 100 мкл раствора полиаминов в питательной среде с таким расчетом, чтобы конечная концентрация составляла 0.5, 1.0 и 2.0 мМ и культивировали в термостате при 37°C без встряхивания 72 ч. Для изучения придонных биопленок планктонную культуру удаляли, 3-кратно промывали лунки дистиллированной водой, биопленки подсушивали и окрашивали в течение 10 мин 0.1%-ным раствором генцианвиолета (“Вектон”, Россия). После 5-кратного промывания водой и полного высыхания краситель экстрагировали из биопленок 200 мкл 96%-ного этанола в течение 1 ч. Интенсивность биопленкообразования оценивали путем измерения оптической плотности окрашенного экстракта при длине волны 570 нм [20]. Расчет удельного биопленкообразования (Specific biofilm formation, SBF) проводили по методике [21] с использованием формулы: SBF = (ОП570 – ОПК)/ОП625, где ОП570 и ОПК – оптическая плотность экстрагированного красителя в опытной и контрольной лунке (570 нм) соответственно; ОП625 – оптическая плотность культуры (625 нм), выращенной в условиях, аналогичных биопленкам с добавлением Твин 80. Для количественной оценки поверхностных биопленок планктонную культуру осторожно удаляли таким образом, чтобы поверхностные пленки оставались в лунках планшета. Пленки высушивали, окрашивали генцианвиолетом, как описано выше, и вычисляли общее удельное биопленкообразование, из которого вычитали значения удельного придонного биопленкообразования.
Скольжение. Скользящие колонии выращивали в стеклянных чашках Петри (90 мм). В жидкую среду Middlebrook 7H9 добавляли агарозу (“Хеликон”, Россия) в концентрации 0.3%. Полиамины вносили в остывшую до температуры 50°С питательную среду, которую затем разливали по чашкам и подсушивали в течение 40 мин. Культуру M. smegmatis выращивали на питательной среде Middlebrook 7H9 до ОП600 1.0, разводили до ОП600 0.4 и наносили на агар в центр чашки Петри каплей (2 мкл) и оставляли в термостате при 37°С на 48 ч.
Для определения плотности скользящих колоний их выращивали на пластиковых чашках Петри (40 мм). Измерение площади колонии проводили после фотографирования камерой Olympus C-3040 ZOOM (Япония) по количеству пикселей, сопоставляя с размером чашки. Затем колонию вырезали вместе с полужидким агаром и помещали в микропробирку, куда вносили физиологический раствор с добавлением Твина 80 (0.05%) до конечного объема 1.0 мл и стеклянные бусы (2 мм, “Hofmann Glastechnik”, Германия). Микропробирку встряхивали на вортексе YellowLine TTS2 (“IKA-Works Inc”, США) при 1400 об./мин. 1 ч. После этого производили подсчет клеток в камере Горяева в 60 малых квадратах по диагонали. При необходимости культуру дополнительно разводили. Число клеток на мм2 колонии рассчитывали по формуле: N = ((m × 4000d/q) × 1000)/s, где N – число клеток на мм2 площади скользящей колонии; m – сумма посчитанных клеток; d – степень разведения; q – число малых квадратов сетки камеры Горяева, в которых считали клетки; s – площадь колонии (мм2), 4000 – коэффициент для пересчета на 1 мкл; 1000 – коэффициент для пересчета на 1 мл.
Антибиотикочувствительность. Минимальную ингибиторную концентрацию (minimal inhibitory concentration, MIC) антибиотиков определяли модифицированным методом серийных разведений (шаг между концентрациями 1.5) в 96-луночных полистироловых планшетах на среде Middlebrook 7H9 с добавлением Твина 80 (0.05%). Культуру M. smegmatis выращивали на питательной среде Middlebrook 7H9 до ОП600 1.0, разводили до ОП600 0.1 и разводили ещe в 5 раз питательной средой, что соответствует 6 × 105 КОЕ/мл. В лунки планшета, содержащие 100 мкл питательной среды с антибиотиком и полиаминами (конечная концентрация 2 мМ), вносили 100 мкл инокулята. Культивировали 72 ч в термошейкере Biosan PST-60HL (Латвия) при 37°С и 300 об./мин. За величину МIC принимали минимальную концентрацию антибиотика, подавляющую видимый рост микроорганизмов. Для определения минимальной бактерицидной концентрации для планктонных клеток (minimal bactericidal concentration, MBC) делали высевы из лунок планшетов, засеянных для определения MIC, на агаризованную питательную среду LB каплями по 5 мкл. МBC рассчитывали как минимальную концентрацию антибиотика, при которой количество колоний в высеве было менее 5 (количество КОЕ/мл менее 1 × 103). Минимальную бактерицидную концентрацию для клеток в составе биопленки (Minimal biofilm eradication concentration, MBEC) определяли по методу, описанному в работе [22] с использованием технологии Calgary Biofilm Device.
Степень гидрофобности поверхности бактериальных клеток оценивали по адгезии к гексадекану с использованием MATH-теста [23]. Клетки после культивирования с полиаминами отмывали в физрастворе, центрифугировали и ресуспендировали в PUM буфере [24] до ОП600 0.6. К 3 мл культуры добавляли 0.3 мл гексадекана, интенсивно встряхивали на вортексе V1 (“Biosan”, Латвия) 90 с, отстаивали 20 мин и измеряли ОП600 водной фазы. Расчет значений гидрофобности клеточной поверхности производили в процентах относительно контроля (культура без внесения гексадекана).
Дзета-потенциал. О поверхностном заряде бактериальных клеток судили по величине дзета-потенциала (ζ), который определяли с помощью анализатора размера частиц Zetasizer nano ZS (“Malvern Instruments”, Великобритания) [25]. Клетки выращивали на LB бульоне до ОП600 1.0, затем отмывали от среды и ресуспендировали в фосфатно-солевом буфере (KH2PO4 – 1.7 мM; Na2HPO4 – 5.2 мM; NaCl – 150 мM; pH 7.0), добавляли полиамины и инкубировали необходимое количество времени. Непосредственно перед измерением клетки отделяли центрифугированием, ресуспендировали в 0.01 М калий-фосфатном буфере, pH 7.0, и измеряли дзета-потенциал в клеточной суспензии ОП600 0.3.
Агрегация бактерий. Для характеристики размера агрегатов определяли площадь проекции агрегата на плоскость. Культуру, выращенную на среде Middlebrook 7H9 без добавления Твина 80, фотографировали с помощью камеры МС 6.3 (“ЛОМО”, Россия) под микроскопом МИКМЕД 6 (“ЛОМО”, Россия) в камере Горяева. Затем сопоставляли площадь малого квадрата камеры (2500 мкм2) с числом пикселей, соответствующих этой площади на фото. Далее определяли размер агрегата в пикселях, затем вычисляли площадь его проекции на плоскость в мкм2. В каждой пробе оценивали размер не менее 30 агрегатов.
Статистическая обработка результатов. Обработку результатов проводили с использованием пакета стандартных программ Statistica 6.0 (“StatSoft, Inc.”). Критерии оценки статистической значимости и вид представленных данных указаны в подписях к рисункам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние полиаминов на чувствительность M. smegmatis к антибиотикам. В качестве показателей, характеризующих чувствительность микобактерий к антибактериальным препаратам, оценивали минимальную ингибиторную концентрацию MIC, а также минимальную бактерицидную концентрацию как для планктонных клеток MBC, так и для клеток в составе биопленки MBEC. Параметр MBEC был впервые предложен для определения Цери с соавт. [26]. Одновременное определение этого показателя, MIC и MBC позволяет дифференцировать эффект антибиотиков на планктонные клетки и бактерии в составе биопленки, а соотношение этих показателей характеризует эффективность антибиотиков по отношению к этим двум типам клеток [27].
Показано, что в большинстве случаев присутствие в среде полиаминов уменьшало чувствительность микобактерий к антибиотикам. При этом значение MIC возрастало в 1.5–2.5 раза, а показатель MBC – до 4 раз (табл. 1). Наибольшее действие оказывали полиамины спермидин и спермин, что согласуется с данными, полученными ранее на E. coli [13].
Таблица 1.
Влияние полиаминов на чувствительность M. smegmatis к антибиотикам**
| Полиамин, 2 мМ |
MIC, мкг/мл | |||
|---|---|---|---|---|
| ИЗН | ЛФЦ | РИФ | СТР | |
| Контроль | 4.58 | 0.11 | 1.22 | 0.07 |
| Путресцин | 6.09 | 0.11 | 2.44 | 0.09 |
| Кадаверин | 4.58 | 0.11 | 1.83 | 0.14 |
| Спермидин | 9.14 | 0.17 | 1.83 | 0.19 |
| Спермин | 9.14 | 0.22 | 0.46 | 0.09 |
| MBC, мкг/мл | ||||
| Контроль | 9.16 | 0.15 | 19.53 | 0.14 |
| Путресцин | 9.16 | 0.30 | 29.30 | 0.19 |
| Кадаверин | 9.16 | 0.23 | 19.53 | 0.28 |
| Спермидин | 9.16 | 0.30 | 19.53 | 0.28 |
| Спермин | 12.19 | 0.46 | 7.32 | 0.19 |
| MBEC, мкг/мл | ||||
| Контроль | 9.77 | 1250 | 0.7 | |
| Путресцин | 19.53 | 2500 | 1.4 | |
| Кадаверин | 39.06 | 2500 | 0.7 | |
| Спермидин | 39.06 | 1250 | 1.4 | |
| Спермин | 39.06 | 620 | 1.4 | |
Присутствие в среде биогенных полиаминов при воздействии антибиотиков повышало жизнеспособность не только планктонных клеток микобактерий, но и клеток в составе уже сформированной биопленки, о чем свидетельствует возрастание MBEC (табл. 1). Несмотря на то, что антибиотикочувствительность биопленок исходно была значительно ниже, чем планктонных клеток, присутствие полиаминов способствовало еще большему ее снижению.
Исключение составляли результаты, полученные при исследовании чувствительности M. smegmatis к рифампицину в присутствии спермина. В этом случае антибиотикочувствительность возрастала, о чем свидетельствует 3-кратное снижение значений MIC и MBC при 2-кратном уменьшении MBEC.
Среди возможных механизмов влияния полиаминов на чувствительность бактерий к антибактериальным препаратам в литературе описаны такие, как стабилизация структуры нуклеиновых кислот, снижение окислительного повреждения макромолекул, а также формирование персисторного состояния [13, 5 ]. Однако эти данные касаются грамотрицательных микроорганизмов, которые продуцируют и накапливают значительное количество полиаминов в клетках и культуральной среде. В то же время, отсутствуют данные о накоплении этих соединений в значимых количествах клетками микобактерий. Однако при их присутствии в окружающей среде, полиамины могли бы активно взаимодействовать с отрицательно заряженными внешними структурами микобактериальных клеток, что, как известно, может привести к снижению их антибиотикочувствительности, за счет ограничения транспорта антибиотиков в клетку [28].
Влияние полиаминов на свойства клеточной поверхности микобактерий. В качестве параметров, характеризующих поверхностные свойства микобактериальных клеток, оценивалась их способность к скольжению, а также степень гидрофобности/гидрофильности и дзета-потенциал клеточной поверхности.
Клетки микобактерий не имеют жгутиков, вследствие чего им недоступны плавание или роение, более того, долгое время считалось, что они вообще не способны к передвижению. Однако, сравнительно недавно показано, что микобактерии способны перемещаться по поверхностям полужидких сред посредством скольжения [29]. Из всех описанных для микроорганизмов видов перемещения, этот является наименее изученным. Скольжение представляет собой способ перемещения микроорганизмов по влажным поверхностям, который осуществляется за счет действия экспансивной силы, возникающей при давлении друг на друга делящихся клеток.
Путресцин, кадаверин, спермидин и спермин в использованных в данной работе концентрациях не оказывали значимого влияния на ростовые характеристики М. smegmatis (данные не показаны), однако, присутствие полиаминов в среде приводило к ограничению скользящей подвижности клеток и, как следствие, к сокращению размеров скользящих колоний микобактерий (рис. 1). При этом статистически значимые изменения вызывали только спермидин и спермин. Величина их отрицательного эффекта на скольжение возрастала с увеличением концентрации (табл. 2). При этом колония, выросшая на среде с добавкой 5 мМ спермина, имела значительно меньший диаметр по сравнению с контрольной, и составляющие ее клетки практически не распространялись по поверхности в виде монослоя, а располагались в несколько слоев, что характеризовалось увеличением количества клеток на единицу площади колонии (рис. 1). Подобный эффект полиаминов может положительно сказаться на выживаемости клеток в колонии в присутствии антибактериального препарата, поскольку верхние слои клеток будут менее доступны для воздействия антибиотика.
Рис 1.
Влияние полиаминов на площадь и плотность скользящих колоний M. smegmatis: а − скользящие колонии при добавлении в среду 5 мМ полиаминов, б − изменение размера и плотности скользящих колоний в присутствии Сд и См. N – число клеток на мм2 колонии; К – контроль; Пт – путресцин; Кд – кадаверин; Сд – спермидин; См – спермин. I – площадь колоний; II – число клеток на мм2 колонии. I и II рассчитаны в % относительно контроля. На графиках приведены значения медианы и 1, 3 квартилей. * Статистически значимое отличие от контроля (с использованием критерия Манна–Уитни, р ≤ 0.05). × Статистически значимое отличие между разными концентрациями одного полиамина (с использованием критерия Манна–Уитни, р ≤ 0.05).

Таблица 2.
Влияние полиаминов на скольжение микобактерий*
| Диаметр колоний, мм | ||||
|---|---|---|---|---|
| контроль | 50.25 (45.5; 55.7) | |||
| добавка полиаминов, мМ | Путресцин | Кадаверин | Спермидин | Спермин |
| 0.1 | 47.5 (37.7; 53.5) |
54.5 (51.0; 58.2) |
44.5 (37.0; 46.2) |
39.0 (34.5; 42.0)** |
| 1.0 | 45.0 (38.2; 49.5) |
48.3 (42.0; 51.0) |
42.5 (42.5; 45.1)** |
35.8 (34.0; 37.5)** |
| 5.0 | 46.5 (43.0; 48.0) |
43.0 (38.7; 52.5) |
40.0 (36; 42.5)** |
23.0 (19.7; 31.5)**Х |
Согласно модели скользящего движения микобактерий, описанной в работе [30], гликопептидолипиды (GPL), присутствующие во внешних слоях клеточной стенки, благодаря их ацильным концам создают гидрофобную среду на поверхности клеток, которая уменьшает трение о гидрофильную поверхность. Таким образом, можно предположить, что полиамины оказывают влияние на скольжение микобактерий взаимодействуя с GPL, тем самым изменяя степень гидрофобности клеточной поверхности. Однако нам не удалось обнаружить значимых изменений показателя, характеризующего гидрофобность/гидрофильность клеточной поверхности M. smegmatis, в присутствии полиаминов (табл. 3). В то же время в присутствии биогенных полиаминов значительно изменялся заряд клеточной поверхности, который возникает при ионизации заряженных компонентов клеточной оболочки в водной среде. Об изменении поверхностного заряда свидетельствовало изменение электрокинетического потенциала (дзета-потенциала) клеток. Наибольшее действие на этот параметр оказывали спермидин и спермин. При этом величина эффекта зависела от времени экспозиции клеток в среде, содержащей полиамины (табл. 3).
Таблица 3.
Влияние полиаминов на заряд и гидрофобность клеточной поверхности*
| Концентрация полиаминов, 2 мМ | Дзетапотенциал (mV) | Степень гидрофобности, % | |
|---|---|---|---|
| 30 мин | 180 мин | ||
| Контроль | –24.80 (22.60; 25.70) | –28.30 (24.40; 28.75) | 81.59 (77.95; 85.25) |
| Путресцин | –23.10 (22.80; 23.50) | –24.70 (23.37; 25.75) | 81.78 (73.69; 89.94) |
| Кадаверин | –23.45 (22.25; 25.22) | –24.95 (24.32; 25.50) | 82.32 (76.16; 88.31) |
| Спермидин | –15.15 (13.10; 16.60)** | –8.99 (8.24; 9.45)**х | 84.65 (80.98; 88.53) |
| Спермин | –10.95 (8.50; 13.50)** | –6.05(5.52; 6.52)**х | 84.58 (79.59; 89.59) |
Влияние полиаминов на агрегацию микобактерий и их способность к формированию биопленок. Изменение поверхностных свойств, как правило, приводит к изменению взаимодействий между клетками и клеток с поверхностью. Для оценки этих изменений исследована степень агрегации микобактерий, а также их способность к формированию биопленок в присутствии биогенных полиаминов.
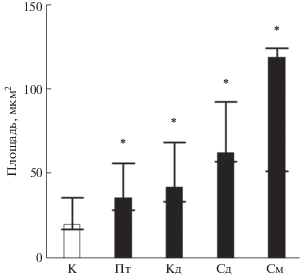
Показано, что при добавке в среду каждого из четырех исследуемых полиаминов увеличивался размер агрегатов, сформированных клетками М. smegmatis при выращивании в среде без добавки поверхностно-активных веществ (Tвин 80). Наибольший эффект, как и в других случаях, оказывали спермидин и спермин (рис. 2).
Рис. 2.
Влияние полиаминов на агрегацию клеток M. smegmatis. Обозначения как на рис. 1. На графике приведены значения медианы и 1, 3 квартилей. * Статистически значимое отличие от контроля (с использованием критерия Манна−Уитни, р ≤ 0.05)).
Известно, что микобактерии, как и большинство других бактерий, способны формировать биопленки [31]. При этом поверхностные биопленки являются гораздо более массивными, чем придонные. Присутствие биогенных полиаминов в среде культивирования стимулировало биопленкообразование М. smegmatis. Массивность поверхностной биопленки статистически значимо возрастала в присутствии 2 мМ кадаверина, спермидина и спермина, в то время как придонное биопленкообразование стимулировалось спермидином и спермином, начиная с минимальной из использованных нами концентраций (0.5 мМ). Наиболее выраженным действием, как в случае придонных, так и в отношении поверхностных биопленок, обладал спермин, эффект которого носил концентрационно-зависимый характер (рис. 3).
Рис. 3.
Влияние полиаминов на формирование биопленок M. smegmatis: а – поверхностное биопленкообразование; б – придонное биопленкообразование; в – фото поверхностной биопленки. SBF – удельное биопленкообразование; К – контроль; Пт – путресцин; Кд – кадаверин; Сд – спермидин; См – спермин. I – 0.5 мМ; II – 1.0 мМ; III – 2 мМ полиаминов. На графиках приведены значения медианы и 1, 3 квартилей. * Статистически значимое отличие от контроля (с использованием критерия Манна–Уитни, р ≤ 0.05).

Известно, что существование бактерий в форме биопленок обеспечивает им ряд преимуществ по сравнению с планктонными клетками, в том числе, повышенную способность к выживанию при различных неблагоприятных воздействиях. Бактерии в составе биопленки демонстрируют высокую устойчивость к факторам иммунной системы макроорганизма [32], а также к действию антибактериальных препаратов [33, 34], что позволяет им эффективно выживать в условиях организма хозяина. Повышенная способность к биопленкообразованию в присутствии полиаминов в окружающей среде может также рассматриваться как один из факторов снижения чувствительности микобактерий к антибиотикам. Помимо этого, полиамины, как показано выше, снижают чувствительность уже сформированных биопленок к действию антибактериальных препаратов (табл. 1), что также является фактором, способствующим выживанию и длительной персистенции микобактерий.
Таким образом, биогенные полиамины оказывают влияние на такие параметры как способность микобактерий к скольжению, поверхностный заряд клетки, агрегация, формирование биопленок и чувствительность к антибиотикам.
Практически во всех проведенных нами исследованиях наибольший эффект оказывал спермин, который за очень редким исключением не продуцируется бактериями, но содержится в тканях макроорганизма, являющихся окружающей средой для патогенных и симбионтных форм бактерий. Это свидетельствует в пользу того, что действие на исследуемые параметры оказывают преимущественно не эндогенные, а экзогенные полиамины, которые находятся в клеточном окружении. Учитывая, что до сих пор не показано накопление значимых количеств полиаминов в клетках микобактерий, можно предполагать, что их эффект на исследуемые параметры реализуется за счет влияния на поверхностные структуры. В пользу этого говорит и тот факт, что воздействие полиаминов почти во всех случаях было прямо пропорционально количеству аминогрупп в их молекулах. Атомы азота в амино- и имминогруппах полиаминов при нейтральных значениях рН протонированы и несут положительный заряд, что позволяет этим соединениям образовывать связи с отрицательно заряженными компонентами клетки, в том числе поверхностными структурами. Взаимодействие с поликатионами, по-видимому, приводит к снижению величины отрицательного заряда поверхности клеток, о чем свидетельствует изменение дзета-потенциала.
Известно, что величина дзета-потенциала характеризует степень устойчивости любых коллоидных систем, к которым можно отнести и культуру микроорганизмов в жидкой среде. Возрастание дзета-потенциала при значениях выше 30 мВ (по модулю) сопровождается увеличением стабильности системы, в то время как при снижении этого показателя ниже указанного уровня системы перестают быть устойчивыми, что может сопровождаться агрегацией частиц [35]. Подобную картину мы наблюдали в культуре микобактерий, когда в присутствии полиаминов происходила агрегация клеток, что сопровождалось снижением отрицательных значений дзета-потенциала (табл. 3). Эффект, который оказывают различные полиамины как на дзета-потенциал, так и на агрегацию клеток пропорционален количеству аминогрупп в молекулах этих соединений. Помимо этого, изменение поверхностного заряда, по-видимому, может отрицательно сказываться на скольжении бактериальных клеток и приводить к усилению биопленкообразования, что и наблюдается в присутствии полиаминов (рис. 1, 3).
В то же время, при воздействии полиаминов на агрегацию микобактерий, а также на их способность к биопленкообразованию и скольжению, нельзя полностью исключать эффект этих соединений на генную экспрессию. Известно, что у грамотрицательных микроорганизмов существует широкий, постоянно пополняющийся спектр генов, регулируемых полиаминами, выделенный в отдельную структурную единицу, называемую ”полиаминовый модулон” [36]. В структуру полиаминового модулона входят, в том числе, гены, оказывающие влияние на формирование биопленок и выживаемость клеток [37]. Не исключено, что подобный эффект имеет место и у микобактерий. Среди генов, экспрессия которых регулируется полиаминами, могут быть участвующие, например, в метаболизме GPL, или ответственные за функционирование системы межклеточной коммуникации, под контролем которой находятся многие процессы, включая агрегацию и биопленкообразование [38]. Существование такого механизма можно предположить исходя из того, что у микобактерий были обнаружены гены гомологичные тем, которые кодируют компоненты системы Quorum sensing грамотрицательных бактерий [39]. При этом биогенные полиамины, как показано, способны оказывать влияние на активность данной системы [38]. Однако для реализации всех вышеописанных механизмов у микобактерий необходимо накопление значительных количеств полиаминов в клетке, что потенциально возможно, однако до сих пор не обнаружено.
Тот факт, что полиамины уменьшали чувствительность к антибиотикам как планктонных клеток, так и клеток в составе сформированной биопленки, изменяя показатели MIC, MBC и MBEC аналогичным образом, указывает на возможность сходства механизма их действия в отношении обеих форм клеток. Учитывая существование значительных различий между этими двумя группами клеток по физиологическим параметрам и набору экспрессируемых генов [40], можно считать обоснованным предположение о преимущественном эффекте полиаминов на поверхностные структуры клеток.
Снижение чувствительности к антибиотикам в присутствии экзогенных полиаминов может быть связано с уменьшением проницаемости клеточной оболочки. Ранее показано, что полиамины способны изменять проницаемость пориновых каналов, взаимодействуя с белками, формирующими поры, что может препятствовать транспорту веществ в клетку через эти структуры [28, 41 ]. По-видимому, в этом случае эффективное действие могут оказывать именно внешние полиамины. Возможно, что свой вклад в регуляцию эффективности транспортных процессов вносит изменение заряда клеточной поверхности, хотя конкретные механизмы этого явления пока неизвестны.
Спермин, в отличие от остальных полиаминов, повышал чувствительность микобактерий к антибиотику рифампицину. Механизм такого эффекта пока не ясен, однако, он представляет интерес с точки зрения антибиотикотерапии туберкулеза. Ранее показано, что возрастание устойчивости персисторных форм микобактерий к действию рифампицина связано с ограничением транспорта антибиотика в клетку. Предполагается, что это является следствием увеличения количества полисахаридных комплексов в клеточной оболочке, что приводит к возрастанию отрицательного поверхностного заряда клеток и способствует снижению транспорта в клетку незаряженных молекул антибиотика [42]. Можно предположить, что наблюдаемое нами усиление действия антибиотика связано со значительным снижением отрицательного заряда клеточной поверхности в присутствии спермина, что способствовало увеличению транспорта незаряженных молекул, в том числе рифампицина, в клетку. Данный феномен, нуждается в дальнейшем изучении.
Таким образом, присутствие в среде биогенных полиаминов, в первую очередь спермидина и спермина, вызывает изменение свойств клеточной поверхности микобактерий, что приводит к ограничению скольжения, стимуляции агрегации и биопленкообразования, а также способствует изменению чувствительности к антибитику.
Работа выполнена при поддержке гранта РНФ № 18-73-10156.
Список литературы
WHO. Global Tuberculosis Report 2019. Geneva, 2019. https://www.who.int/tb/global-report-2019
Diaz M.A.A., Huff T.N., Libertin C.R. // J. Clin. Tuberc. Other Mycobact. Dis. 2019. V. 15. P. 100091.
Harms A., Maisonneuve E., Gerdes K. // Science. 2016. V. 354. № 6318. P. aaf4268 1-9.
Ткаченко А.Г. // Прикл. биохимия и микробиология, 2018. Т. 54. № 2. С. 110–133.
Tkachenko A.G., Kashevarova N.M., Tyuleneva E.A., Shumkov M.S. // FEMS Microbiol. Lett. 2017. V. 364. № 9. P. fnx084 1-9.
Michael A.J. // J. Biol. Chem. 2016. V. 291. № 29. P. 14896–14903.
Herbst E.J., Weaver R.H., Keister D.L. // Arch. Biochem. Biophys. 1958. V. 75. № 1. P. 171–177.
Samartzidou H., Mehrazin M., Xu Z., Benedik M.J., Delcour A.H. // J. Bacteriol. 2003. V. 185. № 1. P. 13–19.
Tabor C.W., Tabor H. // Annu. Rev. Biochem. 1984. V. 53. № 1. P. 749–790.
Igarashi K., Kashiwagi K. // Biochem. Biophys. Res. Commun. 2000. V. 271. № 3. 559–564.
Gevrekci A.Ö. // World J. Microbiol. Biotechnol. 2017. V. 33. № 11. P. 204.
Igarashi K., Kashiwagi K. // J. Biochem. 2006. V. 139. № 1. P. 11–16.
Tkachenko A.G., Akhova A.V., Shumkov M.S., Nesterova L.Yu. // Res. Microbiol. 2012. V. 163. № 2. P. 83–91.
Romano A., Trip H., Lolkema J.S., Lucas P.M. // J. Bacteriol. 2013. V. 195. № 6. P. 1249–1254.
Замахаев М.В., Григоров А.С., Капрельянц А.С., Шумков М.С. // Вестн. перм. ун-та. Сер. Биология. 2018. № 3. С. 284–291.
Kashiwagi K., Igarashi K. // Methods Mol. Biol. 2011. № 720. P. 295–308.
Balasundaram D., Tyagi A.K. // Eur. J. Biochem. 1989. V. 183. № 2. P. 339–345.
Souzu H. // Biochim. Biophys. Acta. 1986. V. 861. № 2. P. 361–367.
Gupta R. S., Lo B., Son J. // Front. Microbiol. 2018. V. 9. № 67. P. 1–9.
O’Toole G.A., Kolter R. // Mol. Microbiol. 1998. V. 30. № 2. P. 295–304.
Naves P., del Prado G., Huelves L., Gracia M., Ruiz V., Blanco J., Dahbi G., Blanco M., del Carmen Ponte M., Soriano F. // Microb. Pathog. 2008. V. 45. № 2. P. 86–91.
Ceri H., Olson M.E., Stremick C., Read R.R., Morck D., Buret A. // J. Clin. Microbiol. 1999. V. 37. № 6. P. 1771–1776.
Rosenberg M. // FEMS Microbiol. Lett. 2006. V. 262. № 2. P. 129–134.
McNeil M.B., Dennison D., Parish T. // Microbiology. 2017. V. 163. № 7. P. 1065–1070.
Halder S., Yadav K.K., Sarkar R., Mukherjee S., Saha P., Haldar S., Karmakar S., Sen T. // Springerplus. 2015. V. 4. № 1. P. 642.
Ceri H., Olson M., Morck D., Storey D., Read R., Buret A., Olson B. // Methods Enzymol. 2001. V. 337. P. 377–385.
Garrison A.T., Huigens III R.W. // Curr. Top. Med. Chem. 2017. V. 17. № 17. P. 1954–1964.
Sarathy J., Lee E., Dartois V. // PLoS One. 2013. V. 8. № 6. P. e65806 1-6.
Martínez A., Torello S., Kolter R. // J. Bacteriol. 1999. V. 181. № 23. P. 7331–7338.
Recht J., Martínez A., Torello S., Kolter R. // J. Bacteriol. 2000. V. 182. № 15. P. 4348–4351.
Kulka K., Hatfull G., Ojha A. K. // J. Vis. Exp. 2012. № 60. P. e3820 1-6.
Mulcahy L.R., Isabella V.M., Lewis K. // Microb. Ecol. 2014. V. 68. № 1. P. 1–12.
Stickler D. // Curr. Opin. Microbiol. 1999. V. 2. № 3. P. 270–275.
Mah T.F. // Future Microbiol. 2012. V. 7. № 9. P. 1061–1072.
Андреев В.С. // VI Международный конгресс “Слабые и сверхслабые поля и излучения в биологии и медицине”. 2012. 118 с.
Igarashi K., Kashiwagi K. // Methods Mol. Biol. 2011. V. 720. P. 51–65.
Sakamoto A., Terui Y., Yamamoto T., Kasahara T., Nakamura M., Tomitori H., Yamamoto K., Ishihama A., Michael A.J., Igarashi K., Kashiwagi K. // Int. J. Biochem. Cell. Biol. 2012. V. 44. № 11. P. 1877–1886.
Нестерова Л.Ю., Негорелова Е.В., Ткаченко А.Г. // Вестн. Перм. ун-та. Сер. Биология. 2019. № 3. С. 300–308.
Sharma I.M., Petchiappan A., Chatterji D. // IUBMB Life. 2014. V. 66. № 12. P. 823–824.
O'Toole G., Kaplan H.B., Kolter R. // Annu. Rev. Microbiol. 2000. V. 54. P. 49–79.
Samartzidou H., Delcour A.H. // J. Bacteriol. 1999. V. 181. № 3. P. 791–798.
Jees S., Sharmada S., Parthasarathi A. // bioRxiv. 2019. Cold Spring Harbor Laboratory. https://doi.org/ (дата обращения: 09.12.2019)https://doi.org/10.1101/624569
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


