Прикладная биохимия и микробиология, 2020, T. 56, № 6, стр. 561-570
Получение рекомбинантного химозина марала (Cervus elaphus sibiricus Severtzov) в прокариотической системе экспрессии и изучение комплекса его биохимических свойств, важных для сыроделия
С. В. Беленькая 1, 2, Д. Н. Щербаков 1, 3, Д. В. Балабова 3, А. Н. Белов 4, А. Д. Коваль 4, В. В. Ельчанинов 4, *
1 ГНЦ вирусологии и биотехнологии “Вектор”
630559 Кольцово, Россия
2 Новосибирский государственный университет
630090 Новосибирск, Россия
3 Алтайский государственный университет
656049 Барнаул, Россия
4 Федеральный Алтайский научный центр агробиотехнологий, Сибирский НИИ сыроделия
656016 Барнаул, Россия
* E-mail: ve3636@yandex.ru
Поступила в редакцию 15.05.2020
После доработки 11.06.2020
Принята к публикации 02.07.2020
Аннотация
В системе экспрессии Escherichia coli (штамм SHaffle express) получен рекомбинантный химозин марала и изучены его биохимические свойства, важные для сыроделия. Наибольшее содержание в тельцах включения рекомбинантного прохимозина марала наблюдалось при культивировании продуцента в течение 6 ч при 25°С с момента внесения индуктора – 10 мМ изопропил-β-D-1-тиогалактопиранозида. Биохимические свойства полученного фермента сравнивали со свойствами рекомбинантных химозинов коровы и одногорбого верблюда. Показано, что общая протеолитическая активность рекомбинантного химозина марала была сопоставима с активностью фермента коровы, но примерно в 3.8 раза превышала активность фермента одногорбого верблюда. Термостабильность рекомбинантного химозина марала оказалась на 5–10°С выше, чем у химозинов коровы и одногорбого верблюда. Зависимость коагуляционной активности фермента марала от рН и концентрации хлорида кальция в коровьем молоке соответствовала требованиям сыроделия. Высокая протеолитическая активность и термостабильность ограничивают сферу применения рекомбинантного химозина марала выработкой сыров с короткими сроками созревания и хранения.
Аспартатная пепсиноподобная эндопептидаза химозин (КФ 3.4.23.4) широко применяется в сыроделии для свертывания молока. Химозин (Хн) избирательно и с высокой скоростью гидролизует “ключевую” пептидную связь – F105-M106 – в молекуле каппа-казеина, что приводит к дестабилизации казеиновых мицелл и образованию сычужного сгустка. Долгое время по совокупности биохимических свойств, включающих высокую молокосвертывающую активность (МА) в сочетании с низкой общей протеолитической активностью (ПА), умеренной термостабильностью (ТС) и оптимальной зависимостью МА от концентрации Са2+ и рН Хн коровы (Bos taurus) считался эталонным молокосвертывающим ферментом (МФ) [1].
В 2006 г. был получен рекомбинантный химозин (рХн) одногорбого верблюда (Camelus dromedarius) [2]. Было установлено, что по специфичности (соотношению МА и общей ПА) этот рХн в 7 раз превосходит Хн коровы, но уступает ему по термостабильности [2]. Таким образом, в настоящее время существует два эталонных МФ для сыроделия – рХн коровы (рХн Bos) и рХн одногорбого верблюда (рХн Cam).
Открытие и внедрение в сыродельную практику рХн Cam позволяет предположить, что в природе существуют и другие МФ, которые превосходят по биохимическим свойствам эталонные коагулянты молока. Это является предпосылкой для поиска новых химозинов не коровьего происхождения. В настоящее время уже получены и исследованы рХн овцы (Ovis aries) [3], козы (Capra hircus) [4–6], яка (Bos grunniens) [7], буйвола (Bubalus bubalis) [4, 8] и альпака (Vicugna pacos) [9]. Однако по комплексу биохимических характеристик ни один из этих ферментов не может сравниться с рХн Bos или рХн Cam. Нахождение и внедрение в практику химозина, абсолютно превосходящего существующие эталонные МФ является актуальной биотехнологической задачей, поскольку позволит повысить эффективность стратегической технологии переработки молока – сыроделия.
Объектом данного исследования является химозин алтайского марала (Cervus elaphus sibiricus Severtzov, 1873), обитающего на территории России, который относится к подвиду благородного оленя (C. elaphus Linnaeus, 1758).
Цель работы – получение рХн марала (рХн Cer) в прокариотической системе экспрессии, сравнение его биохимических свойств с характеристиками эталонных коагулянтов молока и оценка перспектив использования нового МФ в сыроделии.
МЕТОДИКА
Получение рекомбинантного химозина марала. Конструирование экспрессионного вектора. В работе использовали нуклеотидную последовательность, кодирующую прохимозин (ПроХн) марала, представленную в базе GenBank (MT225406). Для экспрессии в системе Escherichia coli (штамм SHaffle express) оптимизировали кодонный состав последовательности при помощи онлайн сервиса “Codon Optimisation Tool” (“Integrated DNA Technologies”, США). Оптимизированная нуклеотидная последовательность ПроХн марала (CYM-Cer) была синтезирована ООО “ДНК-синтез” (Россия) и получена в составе клонирующего вектора pGH. Синтезированный ген был клонирован в состав экспрессионного вектора pET21a (“Novagen”, “Merck”, ФРГ) по уникальным сайтам рестрикции (HindIII и BamHI). В результате, был получен плазмидный вектор pET21-CYM-Cer.
Получение препарата рХн марала. Сконструированной экспрессионной плазмидой (pET21-CYM-Cer) проводили химическую трансформацию клеток E. coli, штамм SHaffle express. Индивидуальные колонии, содержавшие рекомбинантные плазмиды, культивировали на орбитальном шейкере (180 об./мин) в среде LB в течение ночи при 37°C. Инокулят в соотношении 1 : 100 переносили в колбы Эрленмейера, содержавше свежую среду LB, и растили до оптической плотности (при 600 нм), равной 0.8. Для оптимизации продукции целевого белка варьировали концентрацию вносимого индуктора, а также время и температуру дополнительной стадии культивирования. В инокулят вносили изопропил-β-D-1-тиогалактопиранозид (ИПТГ) до конечной концентрации 0.1, 1.0, 10.0 мМ, и дополнительно культивировали штамм-продуцент на шейкере (180 об./мин) в течение 2, 6 и 12 ч при 25 и 37°C.
После завершения культивирования из биомассы клеток продуцента выделяли тельца включения, содержавшие рекомбинантный ПроХн марала (рПроХн Cer). Для этого биомассу осаждали центрифугированием при 5000 g в течение 20 мин при 4°С. Полученный осадок ресуспендировали в буфере STET, рН 8.0, (содержавшем 8% сахарозы, 50 мМ трис, 20 мM ЭДТА, 5% тритона X-100), из расчета 20 мл на 1 грамм биомассы и инкубировали в течение ночи при 4°С. После окончания инкубации клетки разрушали при 4°С с использованием ультразвукового (УЗ) гомогенизатора Soniprep 150 Plus (“MSE”, КНР). Суспензию клеток подвергали УЗ воздействию (2000 Вт/литр и 283 Вт/см2) в течение 1 мин, затем смесь охлаждали до 4°С. Процедуру повторяли трижды. Тельца включения осаждали центрифугированием при 20 000 g в течение 20 мин при 4°С.
Солюбилизацию телец включения и последующий рефолдинг целевого белка проводили по методу [10] с небольшими модификациями. Осажденные тельца включения солюбилизировали в буфере А, рН 10.7 (50 мМ KH2PO4, 150 мМ NaCl) в который добавляли мочевину, до конечной концентрации 8 М, инкубировали 24 ч при 15°С и центрифугировали при 20 000 g в течение 20 мин. В полученном супернатанте определяли концентрацию белка. Для ренатурации полученного рПроХн супернатант разбавляли буфером А до конечной концентрации белка 0.7 мг/мл и оставляли на 12 ч при 15°С. Затем в раствор вносили 1.0 М HCl до рН 8.0, выдерживали смесь 60 мин при 15°С и диализировали против буфера В, рН 8.0, содержавшего 50 мМ трис и 150 мМ NaCl, в течение ночи при 4°С. По завершении диализа получали препарат ренатурированного рПроХн Cer.
Зимоген активировали методом ступенчатого изменения рН. В образец рПроХн Cer, при постоянном перемешивании, вносили 2.0 М НCl до рН 3.0 и инкубировали его в течение 24 ч при комнатной температуре. После окончания инкубации рН образца доводили до 5.8, используя 0.5 М NaOH. В результате активации получали препарат рХн Cer.
Исследование биохимических свойств. Молокосвертывающую активность, общую ПА, ТС и зависимость продолжительности коагуляции от рН и концентрации хлорида кальция в коровьем молоке определяли по ранее опубликованным методикам [11, 12] с незначительными модификациями. Биохимические свойства рХн Cer сравнивали с коммерческими препаратами рХн Bos (сухая форма) и рХн Cam (жидкая форма) производства компании “Chr. Hansen” (Дания). Для проведения исследований готовили 0.5–1.0%‑ный водный раствор рХн Bos, а рХн Cam разбавляли дистиллированной водой в 80–100 раз. При определении биохимических свойств рХн Cer, рХн Bos и рХн Cam нормировали по МА. Исследование каждого биохимического параметра проводили дважды с интервалом 1–3 сут между сериями. Все измерения повторяли трижды.
Общая молокосвертывающая активность. В качестве стандарта использовали 0.5%-ный водный раствор сухого коммерческого препарата рХн Bos с заявленной активностью, равной 2235 IMCU/г. Для перевода значений IMCU (International Milk Clotting Units) в УЕ, использовали повышающий коэффициент 125. Субстратом служило сборное непастеризованное коровье молоко, в которое вносили NaN3 до конечной концентрации 0.02% и доводили рН до 6.5. Субстрат (2.5 мл), прогретый на водяной бане при 35°С не менее 5 мин, быстро смешивали с 0.2 мл исследуемого рХн и регистрировали время образования первых хлопьев коагулята. Общую МА жидких препаратов рХн рассчитывали по формуле (1) и выражали в условных единицах на миллилитр (УЕ/мл).
(1)
${\text{МА}} = {{{\text{М}}{{{\text{А}}}_{{{\mathbf{St}}}}}} \mathord{\left/ {\vphantom {{{\text{М}}{{{\text{А}}}_{{{\mathbf{St}}}}}} {{{200{{Т}_{1}}} \mathord{\left/ {\vphantom {{200{{Т}_{1}}} {{{Т}_{2}}}}} \right. \kern-0em} {{{Т}_{2}}}}}}} \right. \kern-0em} {{{200{{Т}_{1}}} \mathord{\left/ {\vphantom {{200{{Т}_{1}}} {{{Т}_{2}}}}} \right. \kern-0em} {{{Т}_{2}}}}}},$МАSt – заявленная МА стандарта в условных единицах (УЕ/г);
200 – фактор разведения (мл/г);
Т1 – время (с) свертывания субстрата стандартом;
Т2 – время (с) свертывания субстрата раствором исследуемого фермента.
Удельная молокосвертывающая активность. Удельную МА (УЕ/мг белка) препарата рХн Cer рассчитывали после определения общей МА и концентрации белка. Для оценки удельной МА эталонных коммерческих препаратов готовили 1.0%-ный водный раствор рХн Bos, а жидкий препарат рХн Cam разбавляли в 100 раз дистиллированной водой. В полученных растворах определяли МА, концентрацию белка и рассчитывали удельную МА.
Общая протеолитическая активность и специфичность. В качестве субстрата использовали 1%‑ный раствор казеина по Гаммерстену в 20 мМ Na-фосфатном буфере, рН 5.6. Аликвоты субстрата (2.0 мл) выдерживали на водяной бане в течение 15 мин при 35°С, затем вносили в них раствор исследуемого МФ (0.5 мл), тщательно перемешивали и отмечали время начала инкубации. Через 30, 90 и 180 мин инкубации реакцию останавливали, добавляя к 2.5 мл фермент-субстратной смеси 2.5 мл 5%-ной трихлоруксусной кислоты (ТХУ), тщательно перемешивали, оставляли на 30 мин при комнатной температуре и фильтровали через бумажный фильтр. В фильтрате определяли оптическую плотность при 280 нм (D280). В качестве спектрофотометрического контроля использовали компоненты фермент-субстратной смеси которые вносили непосредственно в 5%‑ную ТХУ. Общую ПА выражали в единицах D280. Для оценки специфичности препаратов рХн использовали ПА, за которую принимали значения D280 образцов, после инкубации в течение 180 мин. Строили график зависимости D280 от продолжительности инкубации. Специфичность определяли, как соотношение удельной МА и общей ПА (МА/ПА).
Термостабильность. Растворы исследуемых МФ прогревали в диапазоне 30–60°С в течение 30 мин, быстро охлаждали до комнатной температуры и определяли их остаточную МА. За 100% принимали значения МА, полученные для образцов, прогретых при 30°С. Строили график зависимости остаточной МА от Т (°С) прогревания.
Зависимость продолжительности коагуляции от рН молока. Субстратом служило сборное непастеризованное коровье молоко, в которое вносили NaN3 до конечной концентрации 0.02%. Готовили субстрат с рН 6.0, 6.2, 6.4, 6.6, 6.8 и 7.0 и определяли в них продолжительность образования сгустка, после внесения раствора исследуемого МФ. За 100% принимали продолжительность свертывания субстрата при рН 6.0. Строили график зависимости продолжительности коагуляции (%) от рН молока.
Зависимость продолжительности коагуляции от концентрации хлорида кальция. Субстратом служило сборное пастеризованное коровье молоко, в которое вносили NaN3 до конечной концентрации 0.02% и доводили рН до 6.5. В субстрат добавляли CaCl2 до конечной концентрации 1–5 мM и определяли продолжительность образования сгустка после внесения раствора исследуемого МФ. За 100% принимали значения, полученные на субстрате, в который не вносили CaCl2. Строили график зависимости продолжительности коагуляции (%) от концентрации CaCl2.
Другие методы. Продукцию рекомбинантного белка в клетках E. coli анализировали методом электрофореза по Лэммли [13]. В качестве маркеров молекулярных масс (ММ) использовали смеси белков “PageRuler™ Unstained Protein Ladder” (“Thermo Fisher Scitntific”, США) и М31 (“Сибэнзим”, Россия). Для определения на электрофореграммах площадей полос белковых компонентов и концентрации в них белка использовали программу GelAnalyzer 19.1. Для калибровки применяли препараты бычьего сывороточного альбумина (БСА) различной концентрации. Концентрацию белка в растворах, содержащих рПроХн и рХн, определяли по методу Брэдфорда [14].
Статистическую обработку полученных данных проводили в вычислительной среде табличного процессора Excel 2008 (“Microsoft Corporation”, США). Для количественных переменных результаты представляли в виде среднего арифметического (М) с указанием среднеквадратического отклонения (±SD). На графиках не указан 95%-ный доверительный интервал, поскольку его абсолютные значения были <10% от М.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение рХн марала. Для получения рХн могут использоваться системы экспрессии бактерий (E. coli), дрожжей (Pichia (Komagataella) pastoris, Saccharomyces cerevisiae и Kluyveromyces lactis), плесневых грибов (Aspergillus niger), а также высших млекопитающих и растений [1]. В настоящее время в производстве сыров официально применяются рХн Bos и рХн Cam, синтезируемые в эукариотических системах экспрессии высшего плесневого гриба A. niger var. awamori и молочных дрожжей K. lactis [1]. В то же время, для большого сегмента научно-исследовательских и скриннинговых работ, использование хорошо изученных и простых прокариотических систем экспрессии предпочтительнее и намного выгоднее, чем получение стабильных эукариотических продуцентов.
Система продукции рекомбинантных белков на основе E. coli позволяет получать за относительно короткий промежуток времени целевой продукт в количествах, достаточных для первичной биохимической характеристики. Ранее при помощи векторной системы pET21 в сочетании с E. coli штамм BL21(DE3) был получен эффективный продуцент рПроХн альпака [9]. Для продукции рПроХн Cer мы использовали другой штамм E. coli – SHaffle express, разработанный для обеспечения корректного формирования дисульфидных связей в рекомбинантных белках, синтезируемых de novo [15].
Нуклеотидная последовательность, соответствующая последовательности ПроХн марала (ПроХн Сer), с оптимизированным для экспрессии в системе E. coli кодонным составом, была клонирована в составе вектора pET21 в единой рамке трансляции с экспрессионным тагом Т7, представляющим лидерную последовательность (11 аминокислотных остатков) гена 10 бактериофага Т7 (рис. 1). Присутствие этой последовательности на N- или C-концевой части целевого рекомбинантного белка способно значительно повысить его выход [16].
Рис. 1.
Генетическая карта плазмидного вектора pET21-CYM-Cer: T7 promoter – промотор гена белка 10 фага Т7; T7 tag – лидерная последовательность гена 10 бактериофага Т7; Cer – последовательность ПроХн марала; T7 terminator – терминатор бактериофага Т7.

Зависимость эффективности продукции целевого белка от концентрации индуктора, температуры и продолжительности культивирования анализировали методом электрофореза (рис. 2). Наибольший выход рПроХн Cer наблюдался при концентрации ИПТГ, равной 10 мМ и культивировании продуцента при 25°С в течение 6 ч с момента внесения индуктора (рис. 2а, 6).
Рис. 2.
Электрофорез препаратов биомассы клеток, полученных при культивирования штамма-продуцента при 25 (а) или 37°С (б) и концентрации ИПТГ 0.1 (1, 4, 7), 1.0 (2, 5, 8), 10.0 (3, 6, 9) мМ; М – маркеры молекулярных масс. Рамкой обведены фракции с ММ, близкой к расчетной для рПроХн марала.

После подбора оптимальных условий продукции целевого фермента был исследован белковый состав биомассы, лизата и телец включения клеток продуцента (рис. 3). На долю протеина, концентрация которого составляла около 3 мг/мл, а ММ была близка к расчетной для рПроХн Cer (41 кДа), приходилось не менее 30% от общего количества белков биомассы (рис. 3, 1). Растворимая часть биомассы клеток E. coli, несущих плазмиду pET21а-Cer, почти не содержала целевой белок (рис. 3, 2), в то время как фракция телец включения более чем на 95% состояла из рПроХн Cer (рис. 3, 3). Это свидетельствовало о том, что подобранные условия экспрессии гена ПроХн Cer в системе E. coli обеспечивали эффективный синтез целевого белка и его накопление в тельцах включения.
Рис. 3.
Результаты электрофореза белковых препаратов, полученных из клеток штамма-продуцента: 1 – биомасса клеток продуцента; 2 – растворимая фракция биомассы после обработки буфером STET; 3 – нерастворимая фракция (тельца включения) после обработки лизирующим буфером; 4, 5, 6 – калибровочные препараты БСА, с нагрузкой 1, 2 и 3 мкг на трек соответственно; 7 – рХн марала, полученный после активации зимогена; М – маркеры молекулярных масс.
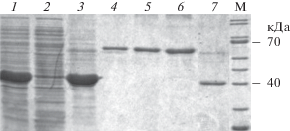
Препарат рХн Cer, полученный после рефолдинга и активации рПроХн, содержал лишь незначительное количество балластных белковых примесей (рис. 3, 7 ).
Молокосвертывающая активность. По общей МА рХн Cer незначительно уступал коммерческому рХн Bos (табл. 1). Для того, чтобы сравнить коагуляционную способность рХн Cer и коммерческих химозинов, была рассчитана удельная МА этих препаратов. По удельной МА рХн Cer уступал рХн Bos и рХн Cam на 36 и 104% соответственно. Можно предположить, что низкая удельная МА рХн Cer, по сравнению с эталонными коагулянтами молока обусловлена недостаточной эффективностью рефолдинга, поскольку восстановление корректной трехмерной структуры затруднено при получении рХн в системах экспрессии E. coli [10, 17–19],
Таблица 1.
Общая и удельная молокосвертывающая активность рекомбинантных химозинов
| Препарат | Общая МА, УЕ/мл |
Концентрация белка мг/мл | Удельная МА УЕ/мг | Удельная МА, % |
|---|---|---|---|---|
| рХн Cer | 2330 ± 10 | 0.044 ± 0.002 | 52 955 ± 2184 | 64 |
| рХн Bos (1.0% раствор) | 2752 ± 88 | 0.033 ± 0.005 | 83 394 ± 10 203 | 100 |
| рХн Cam (концентрат) | 129 660 ± 1620 | 0.928 ± 0.029 | 13 9720 ± 2623 | 168 |
Удельная МА рХн Cam в 1.68 раза превосходит удельную коагуляционную активность рХн Bos (табл. 1). Это хорошо согласовывалось с результатами работы [2], в которой было показано, что соотношение удельной МА рХн Bos и рХн Cam составляет 1 : 1.7.
Таким образом, полученный препарат рХн Cer оказался способным свертывать коровье молоко, но по удельной коагуляционной активности заметно уступал эталонным коммерческим МФ. Это означает, что при использовании в сыроделии его расход будет выше, чем у эталонных коагулянтов. При увеличении удельной МА рХн Cer в 1.6–2.6 раза, его дозировка для получения молочного сгустка может быть сопоставима с дозировками рХн Bos и рХн Cam.
Общая протеолитическая активность и специфичность. Для биохимической характеристики нового МФ крайне важна оценка его общей ПА. В сыроделии высокая ПА коагулянта молока считается негативным фактором, поскольку приводит к снижению выхода готовой продукции, способствует формированию пороков вкуса и консистенции сыра и ухудшает технологические характеристики подсырной сыворотки, используемой в качестве сырья при производстве ряда молочных продуктов [20].
Протеолитическую активность коагулянтов молока можно условно разделить на специфическую и неспецифическую. В результате специфической или молокосвертывающей активности происходит только гидролиз связи F105-M106 в молекуле κ-казеина. Протеолиз κ-казеинов по этому сайту дестабилизирует казеиновые мицеллы и приводит к образованию молочного сгустка. Неспецифическая или общая ПА, характеризует способность МФ гидролизовать любые пептидные связи за исключением связи F105-M106 κ-казеина. Соотношение МА и общей ПА (МА/ПА) называется специфичностью. Идеальный коагулянт молока для сыроделия должен обладать высокой специфичностью, то есть проявлять максимальную МА при минимальной общей ПА [21]. Чем выше специфичность, тем универсальнее МФ и шире ассортимент сыров, для выработки которых он может использоваться.
После инкубации с субстратом в течение 180 мин рХн Cer демонстрировал более высокую общую ПА, чем рХн Cam и рХн Bos (табл. 2).
Таблица 2.
Зависимость изменения оптической плотности (D280) ТХУ-растворимых продуктов протеолиза от продолжительности инкубации (мин) фермент-субстратных смесей
| Препарат | Оптическая плотность, D280 | |||
|---|---|---|---|---|
| 0 мин | 30 мин | 90 мин | 180 мин | |
| рХн Cer | 0.0 | 0.184 ± 0.002 | 0.513 ± 0.004 | 0.789 ± 0.013 |
| рХн Bos | 0.0 | 0.187 ± 0.002 | 0.424 ± 0.003 | 0.694 ± 0.006 |
| рХн Cam | 0.0 | 0.124 ± 0.005 | 0.138 ± 0.002 | 0.208 ± 0.010 |
Динамика накопления продуктов протеолиза рХн Cer оказалась похожей на динамику рХн Bos и заметно отличалась от рХн Cam (рис. 4а). Эти различия наблюдались уже через 30 мин инкубации. Если принять за 100% ПА рХн Bos, проявляемую в течение 180 мин инкубации, то ПА рХн Cer и рХн Cam составят ≈114 и ≈30% соответственно.
Рис. 4.
Результаты сравнительного изучения зависимостей общей протеолитической активности (D280) от продолжительности инкубации (а), остаточной молокосвертывающей активности (МА, %) от температуры прогревания (б), продолжительности коагуляции молочного субстрата (%) от концентрации хлорида кальция (в) и рН (г); 1 – рХн марала, 2 – рХн коровы, 3 – рХн одногорбого верблюда.

Полученные низкие значения общей ПА характерны для рХн Cam и согласуются с данными работы [2], в которой показано, что рХн Cam обладает вчетверо меньшей ПА, чем рХн Bos. Ранее установлено, что общая ПА рХн близкого родственника одногорбого верблюда, альпака (Vicugna pacos), при одинаковой МА была примерно в 2.9 раза ниже, чем у рХн Bos [9]. По-видимому, низкая общая ПА и высокая специфичность характерны для химозинов представителей семейства Верблюдовые (Camelidae).
Для сравнения специфичности рХн Cer и эталонных рХн были использованы величины их удельной МА и общей ПА. При этом показатели рХн Bos принимали за 100%. Рассчитанная специфичность рХн Cer оказалась в 1.8 и 10.0 раза ниже, чем у рХн Bos и рХн Cam (табл. 3). Таким образом, по специфичности, а следовательно и по степени универсальности, исследованные ферменты располагались в следующей последовательности: рХн Cam > рХн Bos > рХн Cer.
Таблица 3.
Удельная МА, общая ПА и специфичность (МА/ПА) препаратов рекомбинантных химозинов
| Препарат | Удельная МА, % | Общая ПА, % | Специфичность, МА/ПА |
|---|---|---|---|
| рХн Cer | 64 | 114 | 0.56 |
| рХн Bos | 100 | 100 | 1.00 |
| рХн Cam | 168 | 30 | 5.60 |
Очевидно, что низкая специфичность рХн Cer являлась следствием его малой удельной МА, которая, в свою очередь, может быть обусловлена неполным рефолдингом. Следует отметить, что эффективность рефолдинга генно-инженерных химозинов, полученных после солюбилизации телец включения, в среднем редко превышает 30% [10, 17–19]. Можно предположить, что использование эукариотической системы экспрессии вместо E.coli (штамм SHaffle express) позволит повысить выход активного рХн Cer, а также его удельную МА и специфичность.
Литературные сведения о специфичности рХн Bos и рХн Cam носят противоречивый характер. Согласно работе [4], специфичность рХн Cam примерно на 11% ниже, чем у рХн Bos. А по данным работы [2], соотношение МА/ПА рХн Cam в 7 раз превосходит рХн Bos. Представления о более высокой специфичности рХн Cam по сравнению с рХн Bos, подтверждаются результатами изучения ПА этих ферментов непосредственно в сырах [22].
Таким образом, общая ПА полученного в данной работе рХн Cer оказалась выше, чем ПА рХн Bos и рХн Cam в 1.14 и 3.79 раза соответственно. Совокупность высокой ПА и малой удельной МА, обусловливает низкую специфичность рХн Cer. Это ограничивает его применение производством сыров с короткими сроками созревания и хранения. Для повышения специфичности и универсальности рХн Cer, требуется существенное увеличение его удельной МА. В случае ее повышения в 3–5 раз, рХн Cer сможет конкурировать по специфичности с одним из эталонных МФ – рХн Bos.
Термостабильность является важной характеристикой любого нового МФ, поскольку коагулянт с высоким порогом термоинактивации может проявлять нежелательную ПА на стадиях выработки сыров, связанных с повышением температуры нагревания, а также при длительном созревании и хранении готовой продукции. Активность химозинов, остающихся в сырном зерне после удаления сыворотки, вносит весомый вклад в “протеолитическое созревание” различных видов сыров, от мягких до сверхтвердых. Например, таких, как Camembert [23], Beyaz Peynir [24], Maasdam [25], Grana Padano [26], Parmigiano Reggiano [27, 28]. Используя информацию о диапазоне температурной устойчивости коагулянта молока можно регулировать степень протеолиза и сроки созревания сыров как путем варьирования температуры обработки сырного зерна, так и за счет применения МФ с различной ТС [25].
Согласно данным работы [2] общая ПА рХн Bos и рХн Cam увеличивалась при повышении температуры. Максимальную ПА рХн Cam проявлял при 55.0°С, а рХн Bos – при 52.5°С. При выработке сыров типа Reggianito с их применением увеличение температуры нагревания сгустка с 50 до 56°С приводило к значительному снижению концентрации продуктов протеолиза αs1-казеина. Но даже после повышения температуры второго нагревания до 56°С в созревающих и хранящихся сырах, выработанных с применением более термостабильного рХн Cam, интенсивность протеолиза была выше, чем при использовании рХн Bos. И это несмотря на то, что общая ПА рХн Cam в 3.5–4.0 раза ниже, чем у рХн Bos [2, 22].
Термостабильность рХн одного и того же вида, полученного в разных системах экспрессии, может различаться. Так, пороги полной температурной инактивации рХн Cam, экспрессированного в клетках высших плесневых грибах (A. niger) [2] и дрожжей (P. pastoris) [22], отличались на 10°С, что указывало на возможную роль посттрансляционных модификаций в формировании температурной устойчивости фермента.
Порогом термоинактивации считали Т (°С), при которой МФ сохранял не менее 80% от исходной коагуляционной активности. Согласно этому критерию порог ТС для рХн Bos составил 50°С, а для рХн Cer и рХн Cam – 55°С. Несмотря на одинаковый порог термоинактивации, ферменты марала и верблюда различались по динамике снижения МА в диапазоне температур 50–60°С (рис. 4б). После прогревания при 55°С коагуляционная активность рХн Cer оказалась в 3.5 раза выше, чем у рХн Cam. Это свидетельствовало о более высокой температурной стабильности рХн Cer по сравнению с рХн Cam. Следует также отметить, что эталонные химозины полностью инактивировались после прогревания при 60°С в то время, как рХн Cer при этой температуре еще сохранял примерно 8% от исходной МА (табл. 4).
Таблица 4.
Остаточная молокосвертывающая активность (%) рекомбинантных химозинов марала, коровы и одногорбого верблюда при различных температурах прогревания
| Препарат | Молокосвертывающая активность, % | |||||||
|---|---|---|---|---|---|---|---|---|
| 30°С | 35°С | 40°С | 45°С | 50°С | 55°С | 60°С | 65°С | |
| рХн Cer | 100 | 101 ± 3 | 101 ± 3 | 100 ± 3 | 96 ± 1 | 70 ± 2 | 8 ± 1 | 0 |
| рХн Bos | 100 | 101 ± 3 | 100 ± 2 | 95 ± 5 | 66 ± 8 | 8 ± 5 | 0 | н.д.* |
| рХн Cam | 100 | 101 ± 5 | 101 ± 6 | 101 ± 5 | 85 ± 5 | 20 ± 1 | 0 | н.д.* |
В системе экспрессии E. coli (штамм BL21(DE3)), ранее были получены рХн альпака и рХн Bos, которые на 10–15°С превосходили по ТС контрольный коммерческий рХн Bos, продуцируемый в эукариотической системе A. niger var. awamori [9]. Можно предположить, что повышенная ТС рХн Cer также обусловлена особенностями посттрансляционного процессинга эукариотического фермента, синтезируемого в прокариотической системе экспрессии.
Таким образом, порог термоинактивации рХн Cer составил 55°С, что на 5°С превосходит данный показатель для рХн Bos. Несмотря на то, что порог термоинактивации рХн Cam и рХн Cer был одинаковым, скорость снижения МА верблюжьего фермента после прогревания при 55°С оказалась в 3.5 раза выше, чем у рХн Cer. Это позволяет считать рХн Cer более термостабильным. Повышенная, по сравнению с эталонными ферментами ТС ограничивает сферу применения рХн Cer и предполагает его использование, прежде всего, в производстве сыров с короткими сроками созревания и хранения.
Зависимость МА от концентрации хлорида кальция. Большинство видов сыров вырабатывается из пастеризованного молока. При высокотемпературной обработке необратимо осаждается часть присутствующих в молоке солей кальция. В результате этого концентрация ионизированного кальция снижается, что приводит к увеличению продолжительности образования молочного сгустка под действием МФ. Для того, чтобы избежать повышения дозы вносимого МФ и улучшить коагуляционную способность пастеризованного молока в него вносят ≈1–4 мM CaCl2 [29].
Важно отметить, что увеличение концентрации CaCl2 в молочном субстрате особенно на стадии свертывания молока вызывает повышение не только коагуляционной активности, но и общей ПА фермента [30]. Поэтому использование МФ с высокой чувствительностью к концентрации Ca2+ связано с опасностью негативных последствий увеличения его общей ПА. В связи с этим необходимо, чтобы любой новый коагулянт молока по чувствительности к концентрации Ca2+ был эквивалентен современным эталонным ферментам – рХн Bos и рХн Cam.
Все исследованные рХн увеличивали МА в ответ на повышение концентрации CaCl2 в диапазоне 0–1 мМ, при этом время образования сгустка сокращалось на 40.5–44.8% (табл. 5). Однако на дальнейшее повышение концентрации CaCl2 ферменты реагировали по-разному. Наиболее чувствительным к увеличению содержания Са2+ в молоке оказался рХн Bos. При повышении концентрации хлорида кальция с 2 до 5 мМ его МА увеличивалась в 2.5–4.5 раза. Коагуляционная активность рХн Cer и рХн Cam в меньшей степени зависела от нарастания концентрации СaCl2. По чувствительности к изменениям концентрации ионов кальция в молоке оба фермента оказались похожими (рис. 4в). В диапазоне 2–5 мМ CaCl2 продолжительность образования молочных сгустков при действии рХн Cer и рХн Cam сокращалась в 2.0–3.1 раза.
Таблица 5.
Продолжительность коагуляции (%) при различных концентрациях CaCl2 (мM) в молоке
| Препарат | Продолжительность коагуляции, % | |||||
|---|---|---|---|---|---|---|
| 0 мM | 1 мM | 2 мM | 3 мM | 4 мM | 5 мM | |
| рХн Cer | 100 | 59.5 ± 0.9 | 50.6 ± 0.7 | 41.0 ± 0.6 | 35.6 ± 1.3 | 31.9 ± 1.5 |
| рХн Bos | 100 | 55.2 ± 1.3 | 39.7 ± 0.9 | 31.6 ± 1.0 | 25.6 ± 0.9 | 22.3 ± 0.6 |
| рХн Cam | 100 | 58.0 ± 0.6 | 49.7 ± 0.9 | 42.6 ± 1.0 | 37.2 ± 1.4 | 35.1 ± 1.0 |
Полученные данные, позволили сделать вывод о том, что по чувствительности коагуляционной активности к концентрации CaCl2 в молоке рХн Cer не уступает эталонным генно-инженерным коагулянтам и полностью соответствует требованиям сыроделия.
Зависимость МА от рН субстрата. Продолжительность коагуляции молока под действием МФ зависит от электростатических и гидрофобных свойств мицелл казеина, которые связаны с концентрацией ионов водорода. При подкислении молока суммарный отрицательный заряд казеинов снижается, вследствие приближения рН к значениям их рI. Это уменьшает силы электростатического отталкивания между мицеллами и одновременно усиливает казеин-казеиновые гидрофобные взаимодействия, что способствует ускорению образования молочного сгустка [21]. В случае нарастания рН казеин-казеиновые гидрофобные взаимодействия ослабевают, поскольку суммарные отрицательные заряды казеинов увеличиваются. Растущие силы электростатического отталкивания препятствуют сближению одноименно заряженных казеиновых мицелл и замедляют образование сычужного сгустка.
Оптимумы действия химозинов различных видов животных находятся в диапазоне рН 4.5–5.5 [http://www.brenda-enzymes.org/enzyme.php?ecno=3.4.23.4]. Однако при выработке большинства видов сычужных сыров МФ вносится в молочную смесь при рН 6.5–6.6. В связи с этим, одним из требований к любому новому МФ для сыроделия является способность эффективно коагулировать молоко в слабокислом диапазоне рН, удаленном от рН-оптимума.
Наименьшую чувствительность к увеличению рН молока в диапазоне 6.0–7.0 продемонстрировал рХн Cer, а наибольшую – рХн Bos (рис. 4г). В диапазоне рН 6.0–6.4 все ферменты проявляли близкую МА. При рН 6.6 продолжительность свертывания молока для рХн Cer, рХн Cam и рХн Bos увеличивалась в 1.9, 2.1 и 2.3 раза соответственно (табл. 6). Полученные результаты согласуются с данными других публикаций, в которых были показаны аналогичные зависимости продолжительности свертывания от рН молочного субстрата для рХн Bos, рХн Cam и рХн альпака [2, 4, 9, 30].
Таблица 6.
Продолжительность коагуляции (%) при различных значениях рН молока
| Препарат | Продолжительность коагуляции, % | |||||
|---|---|---|---|---|---|---|
| рН 6.0 | рН 6.2 | рН 6.4 | рН 6.6 | рН 6.8 | рН 7.0 | |
| рХн Cer | 100 | 120.0 ± 4.0 | 146.9 ± 4.5 | 187.7 ± 9.5 | 276.2 ± 12.9 | 480.0 ± 5.8 |
| рХн Cam | 100 | 124.8 ± 3.8 | 155.4 ± 2.4 | 208.9 ± 2.4 | 326.7 ± 6.5 | 624.8 ± 35.3 |
| рХн Bos | 100 | 121.3 ± 8.2 | 158.7 ± 7.8 | 230.2 ± 12.7 | 392.1 ± 12.7 | 885.7 ± 42.6 |
Результаты исследования свидетельствуют о том, что рХн марала способен эффективно свертывать коровье молоко при рН 6.5–6.6 и не уступает по этому показателю коммерческим генно-инженерным химозинам.
Таким образом, в прокариотической системе экспрессии E.coli (штамм SHaffle express) получен рХн Cer. Оптимальными условиями для достижения максимального выхода рПроХн Cer в тельцах включения были: концентрация изопропил-β-D-1-тиогалактопиранозида, равная 10 мМ, температура культивирования продуцента – 25°С и продолжительность культивирования – 6 ч с момента внесения индуктора.
Исследован комплекс биохимических свойств рХн Cer, важных для использования при производстве сычужных сыров. По чувствительности МА к изменениям рН и концентрации хлорида кальция в молоке, рХн Cer оказался сопоставимым с эталонными МФ и по данным показателям полностью соответствует требованиям сыроделия. По удельной МА, общей ПА, специфичности и ТС рХн Cer уступает коммерческим эталонным ферментам, что ограничивает его применение производством сыров с короткими сроками созревания и хранения. Можно предположить, что продукция рХн Cer в эукариотической системе, не требующей проведения рефолдинга целевого белка и обеспечивающей качественно иной уровень посттрансляционной модификации, позволит в дальнейшем улучшить его биохимические показатели, важные с точки зрения современного сыроделия и расширить область его применения.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования РФ (номер темы FZMW-2020-0002, “Разработка продуцентов рекомбинантных ферментов для сыроделия”).
Список литературы
Uniacke-Lowe T., Fox P.F. Cheese: Chemistry, Physics and Microbiology. Oxford, UK: Elsevier, Acad. Press, 2017. P. 69–113.
Kappeler S.R., van den Brink H.(J.)M., Rahbek-Nielsen H., Farah Z., Puhan Z., Hansen E.B., Johansen E. // Biochem. Biophys. Res. Commun. 2006. V.2. № 342. P. 647–654.
Rogelj I., Perko B., Francky A., Penca V., Purgenčar J. // J. Dairy Sci. 2001. V. 84. № 5. P. 1020–1026.
Vallejo J.A., Ageitos J.M., Poza M., Villa T.G. // J. Dairy Sci. 2012. V. 95. № 2. P. 609–613.
Vega-Hernandes M.C., Gomes-Coello A., Villar J., Claverie-Martin F. // J. Biotechnol. 2004. V. 114. № 1–2. P. 69–79.
Liu W.-G., Wang Y.-P., Zhang Z.-J., Wang M., Lv Q.-X., Liu H.-W., Lu M. // Protein Expr. Purif. 2017. V. 135. P. 78–82.
Ersöz F., İnan M. // Protein Expr. Purif. 2019. V. 154. P. 126–133.
Tyagi A., Kumar A., Mohanty A.K., Kaushik J.K., Grover S., Batish V.K. // LWT-Food Sci. Technol. 2017. V. 84. P. 733–739.
Belenkaya S.V., Rudometov A.P., Shcherbakov D.N., Balabova D.V., Kriger A.V., Belov A.N., Koval A.D., Elchaninov V.V. // Appl. Biochem. Microbiol. 2018. V. 54. № 6. P. 569–576.
Wei C., Tang B., Zhang Y., Yang K. // Biochem. J. 1999. V. 340. № 1. P. 345–351.
Ельчанинов В.В. // Сыроделие и маслоделие. 2006. № 4. С. 42–44.
Ельчанинов В.В., Уманский М.С., Белов А.Н., Коваль А.Д., Шелепов В.Г. // Сыроделие и маслоделие. 2005. № 4. С. 13–16.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680–685.
Bradford M.M. // Anal. Biochem. 1976. V. 72 № 1–2. P. 248–254.
Lobstein J., Emrich C.A., Jeans C., Faulkner M., Riggs P., Berkmen M. // Microb. Cell Fact. 2012. V. 11. № 1. P. 56.
Studier F.W., Moffatt B.A. // J. Mol. Biol. 1986. V. 189. № 1. P. 113–130.
Chen H., Zhang G., Zhang Y., Dong Y., Yang K. // Biochem. 2000. V. 39. № 40. P. 12140–12148.
Wei C., Zhang Y., Yang K. // J. Protein Chem. 2000. V. 19. № 6. P. 449–456
Eskandari M.H., Hosseini A., Zarasvand S.A., Aminlari M. // Food Biotechnol. 2012. V. 26. № 2. P. 143–153.
Singh T.K., Drake M.A., Cadwallader K.R. // Compr. Rev. Food Sci. Food Safety. 2003. V. 2. № 4. P. 166–189.
Harboe M., Broe M.L., Qvist K.B. Technology of Cheesemaking. N.Y.: J. Wiley & Sons, 2010. P. 98–129.
Costabel L.M., Bergamini C.V., Pozza L., Cuffia F., Candioti M.C., Hynes E. // J. Dairy Res. 2015. V. 82. № 3. P. 375–384.
Mane A., McSweeney P.L.H. // J. Food Biochem. 2020. V. 44. № 1. P. e13101. https://doi. org/https://doi.org/10.1111/jfbc.13101
Gumus P., Hayaloglu A.A. // J. Dairy Sci. 2019. V. 102. № 7. P. 5945–5956.
Lamichhane P., Sharma P., Kennedy D., Kelly A.L., Sheehan J.J. // Food Res. Int. 2019. V. 125. P. 108525 (doi ).https://doi.org/10.1016/j.foodres.2019.108525
Masotti F., Hogenboom J.A., Rosi V., De Noni I., Pellegrino L. // Int. Dairy J. 2010. V. 20. № 5. P. 352–359.
D’Incecco P., Limbo S., Hogenboom J., Rosi V., Gobbi S., Pellegrino L. // Foods. 2020. V. 9. P. 268 https://doi.org/10.3390/foods9030268
Sforza S., Cavatorta V., Lambertini F., Galaverna G., Dossena A., Marchelli R. // J. Dairy Sci. 2012. V. 95. № 7. P. 3514–3526.
Майоров А.А., Мироненко И.М., Байбикова А.А. // Сыроделие и маслоделие. 2011. № 2. С. 19–23.
Wang N., Wang K.Y., Li G., Guo W., Liu D. // Protein Expr. Purif. 2015. V. 111. P. 75–81.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


