Прикладная биохимия и микробиология, 2023, T. 59, № 2, стр. 120-132
Пробиотические свойства сахаромицетов (обзор)
С. А. Рябцева 1, *, А. Г. Храмцов 1, С. Н. Сазанова 1, Р. О. Будкевич 1, Н. М Федорцов 1, А. А. Везирян 1
1 Северо-Кавказский федеральный университет
355017 Ставрополь, Россия
* E-mail: ryabtseva07@mail.ru
Поступила в редакцию 02.06.2022
После доработки 29.08.2022
Принята к публикации 02.09.2022
- EDN: DRZXFP
- DOI: 10.31857/S0555109923010087
Аннотация
Цель обзора – обобщение и анализ информации о молекулярно-генетических основах и методах исследования пробиотической активности грибов класса Saccharomycetes, механизмах их физиологического действия и применении в биотехнологии. В настоящее время эффективность Saccharomyces boulardii при лечении и для профилактики диарей различной этиологии, рецидивов инфекции Clostridium difficile, побочных эффектов терапии инфекции Helicobacter pylori установлена с высоким уровнем доказательности. Генетические, цитологические, культуральные и биохимические особенности S. boulardii определяют их пробиотическую активность. Другие штаммы сахаромицетов с пробиотическим потенциалом чаще всего выделяют из национальных ферментированных продуктов из растительного и молочного сырья. Единая методика исследования пробиотических свойств пока не создана, для их подтверждения необходимы клинические испытания с участием людей. Перспективными пробиотиками являются штаммы видов Saccharomyces cerevisiae и Kluyveromyces marxianus, имеющих международный статус безопасности. Возможные механизмы физиологического действия сахаромицетов включают антимикробные, антитоксические, трофические, антисекреторные и противовоспалительные эффекты. Некоторые механизмы пробиотического действия дрожжей отличаются от бактериальных и не все они пока понятны. Сахаромицеты-пробиотики могут быть использованы для повышения биологической ценности, качества и безопасности пищевых продуктов.
Сахаромицеты – это грибы класса Saccharomycetes, для которых характерны преимущественно одноклеточные формы существования, способность к почкованию и активной ферментации углеводов. Грибы с такими свойствами могут относится и к другим классам, их часто называют дрожжами, хотя этот термин не имеет таксономического значения. История применения одного из видов сахаромицетов, Saccharomyces cerevisiae, в изготовлении хлеба, вина и пива насчитывает тысячелетия. К традиционным направлениям использования сахаромицетов относится также получение кисломолочных напитков смешанного брожения (например кефира), этилового спирта, пищевых и кормовых добавок. В биотехнологии эта группа микроорганизмов широко применяется в производстве биотоплива, различных ферментов, витаминов, липидов, органических кислот, а также в качестве клеточных моделей для генно-инженерных модификаций [1].
В последние десятилетия наблюдается рост интереса к антагонистическим свойствам дрожжей, их применению в фармацевтике и пищевой биотехнологии [2, 3]. Это связано с изменениями в представлениях о кишечном микробиоме, новыми данными о разнообразии входящих в него микроорганизмов. Кроме бактерий в экосистеме кишечника человека присутствуют также археи, грибы, вирусы и простейшие, роль которых пока изучена недостаточно [4]. Согласно данным, полученным в ходе выполнения международного проекта “Микробиом человека”, два из трех наиболее распространенных родов грибов в кишечнике человека, Saccharomyces и Candida, относятся к сахаромицетам [5]. Зная особенности их метаболизма, можно предположить, что они участвуют в синтезе биологически активных соединений, влияющих на процессы пищеварения и жизнедеятельности человека.
Согласно уточненному определению ФАО/ВОЗ, живые микроорганизмы, которые при употреблении в достаточных количествах приносят пользу здоровью хозяина, называются пробиотиками. Основная группа таких хорошо изученных пробиотиков включает виды родов Bifidobacterium и Lactobacillus [6]. В настоящее время установлено, что пробиотические свойства могут проявлять и некоторые виды дрожжей, которые, принципиально отличаясь строением клетки и свойствами от бактерий-пробиотиков, могут дополнять их и даже иметь преимущества при отдельном использовании [2, 3].
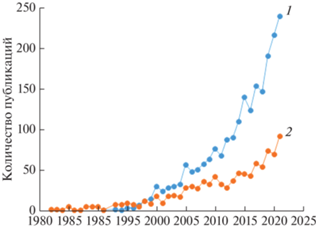
Наиболее изученными пробиотиками небактериального происхождения являются сахаромицеты Буларди (Saccharomyces boulardii). Это единственный вид грибов, полезные свойства которого подтверждены многочисленными контролируемыми клиническими исследованиями и более 60 лет применяются в медицине [7, 8]. Пробиотическая активность S. boulardii позволяет использовать их не только для лечения некоторых заболеваний, но и в производстве продуктов функционального питания [2, 3, 7, 8]. Европейское агентство по безопасности продуктов питания (EFSA) присвоило этим грибам статус QPS (Qualified Presumption of Safety) и разрешило добавлять их к пище или корму [10]. Во всем мире наблюдается рост интереса к сахаромицетам Буларди, однако еще более быстрыми темпами в последнее десятилетие увеличивается количество публикаций о пробиотических свойствах других видов дрожжей, что свидетельствует об актуальности этой темы (рис. 1).
Рис. 1.
Публикационная активность в системе PubMed по темам “дрожжи-пробиотики” (1, “yeast probiotic”) и “Saccharomyces boulardii” (2).
Целью обзора является обобщение и анализ информации о молекулярно-генетических основах и методах исследования пробиотической активности грибов класса Saccharomycetes, механизмах их физиологического действия и применении в биотехнологии.
Методы исследований и молекулярно-генетические основы пробиотической активности Saccharomyces boulardii. История изучения грибов-пробиотиков началась в 20 гг. прошлого века, когда французский биолог Генри Булар (Henri Boulard) выделил чистую культуру дрожжей, обладавшую лечебными свойствами, исследовал ее и назвал Saccharomyces boulardii. Источником ее получения стала кожура тропических фруктов личи и мангостина, напиток из которых помогал жителям Индокитая справиться с диареей во время эпидемии холеры [11]. В 1953 г. французская компания “Biocodex” приобрела права на эту культуру дрожжей и процесс их ферментации, а в 1961 г. зарегистрировала лиофилизированный штамм S. boulardii CNCM I-745 в качестве лекарственного препарата (история Biocodex https://ru.biocodex.com/ru/biocodex-v-mire/nasledie/).
В 1993 г. вид S. boulardii был представлен научному сообществу как новый биотерапевтический агент для профилактики и лечения диарей при различных заболеваниях. Основанием для этого стали результаты исследований на животных и данные, полученные при участии добровольцев и пациентов, которые показали эффективность и безопасность S. boulardii при пероральном приеме. Было подчеркнуто, что количество клеток этих дрожжей быстро достигает в кишечнике высокого стабильного уровня, который сохраняется во время ежедневного приема препарата, а после его отмены клетки S. boulardii быстро выводятся из толстой кишки [12].
Позже молекулярно-генетическое типирование методом RFLP ПЦР-амплифицированных межгенных транскрибируемых спейсерных областей, включая рибосомную ДНК 5.8S, показало, что коммерческие штаммы S. boulardii являются аспорогенными штаммами вида S. cerevisiae, а не представителями отдельного вида [13]. Так как в настоящее время вопрос таксономической принадлежности сахаромицет Буларди окончательно не решен, употребляемое далее название S. boulardii обозначает коммерческие препараты дрожжей Saccharomyces boulardii, применяемые в медицине.
В 2007 году S. boulardii уже позиционировались как пробиотики. Показано, что некоторые отличия дрожжей от бактерий, такие как особенности строения клетки, большие размеры, устойчивость к антибиотикам и отсутствие способности ее приобретать, могут давать им преимущества при использовании в качестве пробиотиков. Новые данные клинических исследований подтвердили высокую эффективность применения S. boulardii при антибиотикоассоциированной диарее и рецидивирующих кишечных инфекциях Clostridium difficile, а также показали возможность использования S. boulardii для повышения иммунитета [14].
В 2010 г. были показаны отличия S. boulardii от S. cerevisiae по метаболическим и генетическим характеристикам. Устойчивость к повышенным температурам, низким значениям pH и антибактериальным препаратам позволяют S. boulardii выживать в условиях желудочно-кишечного тракта. Концентрация клеток S. boulardii при пероральном приеме здоровыми людьми достигает равновесия в кишечнике в течение 3 дней и выводится в течение 3–5 дней после прекращения приема. Метаанализ результатов контролируемых клинических испытаний с 1976 по 2009 гг. с участием взрослых пациентов подтвердил эффективность препаратов S. boulardii при диареях, связанных с приемом антибиотиков и энтеральным питанием, инфекции Clostridium difficile и Helicobacter pylori, а также диареях путешественников. Приведены доказательства того, что потенциальные риски переноса генов устойчивости к антибиотикам, транслокации из кишечника в другие органы, сохранения в кишечнике, являются минимальными при приеме S. boulardii. Отдельные случаи фунгемии наблюдали у взрослых пациентов с серьезными сопутствующими заболеваниями и центральными венозными катетерами [11].
В 2015 г. опубликованы три систематических обзора с метаанализом, в которых показано, что препараты S. boulardii значительно улучшили первичную профилактику инфекций, вызванных C. difficile [15], повышали уровень эрадикации H. pylori до 80% (при 71% в контрольной группе) и уменьшили некоторые побочные эффекты, связанные с терапией [16], а также значимо снизили риск антибиотикоассоциированной диареи у детей (с 20.9 до 8.8%) и взрослых (с 17.4 до 8.2%) [17].
В статье [18] приведены данные доклинических и клинических исследований о влиянии S. boulardii CNCM I-745 на эпителий и ферментативные функции кишечника. Показано, что этот штамм сахаромицетов синтезирует и секретирует полиамины, которые играют роль в пролиферации и дифференцировке клеток мембраны щеточной каймы, усиливают экспрессию кишечных пищеварительных ферментов, а также переносчиков питательных веществ. Кроме того, S. boulardii CNCM I-745 выделяют ферменты, которые улучшают усвоение питательных веществ.
В 2020 г. [19] представлены результаты успешного применения S. boulardii CNCM I-745 для лечения и/или профилактики не только диарей различной этиологии, но и воспалительных заболеваний кишечника: синдрома раздраженного кишечника, кандидоза, дислипидемии и избыточного бактериального роста в тонкой кишке у пациентов с рассеянным склерозом. Приведены данные об отдельных случаях фунгемии, вызванных сахаромицетами, в том числе S. boulardii у больных с тяжелыми общими или кишечными заболеваниями и/или с постоянными катетерами. При этом отмечено, что в целом применение этих дрожжей-пробиотиков считается безопасным [19].
Вопросы безопасности S. boulardii рассмотрены также в другом обзоре [8]. Потенциальные проблемы применения бактерий-пробиотиков, связанные с переносом генов устойчивости к антибиотикам, возможным проникновением в эпителий кишечника и другие органы, не характерны или не выявлены для S. boulardii. Приведены данные рандомизированных и контролируемых клинических исследований, в которых не выявлено каких-либо серьезных побочных реакций при использовании S. boulardii. Фунгемия наблюдалась у некоторых тяжело больных людей с центральными венозными катетерами, причем такие пациенты хорошо реагировали на терапию противогрибковыми препаратами [8].
Метаанализ контролируемых исследований, опубликованный в 2021 г., подтвердил, что среди всех пробиотиков S. boulardii являются наиболее эффективными в снижении продолжительности острой диареи у детей и риска диареи продолжительностью более 2 дней [20].
Таким образом, в настоящее время эффективность пробиотиков S. boulardii при лечении острой диареи у взрослых и детей, рецидивов инфекции C. difficile, а также для профилактики антибиотикассоциированной диареи, диареи путешественников, побочных эффектов эрадикационной терапии инфекции H. pylori установлена с высоким уровнем доказательности [21].
При этом до сих пор остается спорным вопрос о таксономическом положении сахаромицетов Буларди. Изначально они рассматривались как отдельный вид дрожжей, штамм которого (S. boulardii CNCM I-745) в 1989 г. был депонирован в Институте Пастера в Париже (История Biocodex https://ru.biocodex.com/ru/biocodex-v-mire/nasledie/). При исследовании генетических характеристик с использованием ПЦР-электрофоретического кариотипирования и секвенирования рРНК ученые пришли к выводу, что S. boulardii является штаммом S. cerevisiae, известных хлебопекарных и пивных дрожжей [22]. Геномное родство этих грибов составляет 99%, они похожи по многим фенотипическим и биохимическим свойствам, но выявлены и существенные отличия, поэтому сахаромицеты Буларди некоторые ученые рассматривают как вариант (S. cerevisiae var. boulardii) [22–24].
S. boulardii отличается от S. cerevisiae более высокой скоростью роста при 30 и 37°С, повышенной устойчивостью к температуре и изменению рН [2, 3, 8, 14, 23, 24]. Например, S. boulardii показали 65%-ную выживаемость при 52°C через 1 ч и 75%-ную выживаемость при рН 2.0 через 1 ч (по сравнению с 45 и 30% у S. cerevisiae W303 соответственно) [23]. Было установлено, что пробиотики S. boulardii отличаются от других штаммов S. cerevisiae генетическими характеристиками: трисомией хромосомы IX, отсутствием элементов ТУ1/2, количеством копий отдельных генов, ответственных за синтез белков и ответ на стресс, которые определяют способность к псевдогифальному переключению при ограничении азота, диплоидию, отсутствие спорообразования и повышенную устойчивость к низким значениям рН [24].
Клеточная стенка сахаромицетов состоит из бета-глюканов и маннанов, которые могут положительно влиять на кишечный микробиом, стимулировать врожденный и приобретенный иммунитет, адсорбировать микотоксины [25]. Установлены антиоксидантные и антипролиферативные свойства экстрактов полисахаридов клеточной стенки S. boulardii, причем нерастворимый глюкан показал высокое ингибирование роста клеток колоректального рака [26].
Как и все сахаромицеты, S. boulardii являются хемоорганогетеротрофами, могут расти в аэробных и анаэробных условиях. S. boulardii сбраживают глюкозу, сахарозу, мальтозу и раффинозу, как и S. cerevisiae, но не могут сбраживать галактозу [27]. S. boulardii расщепляют пектин и целлобиозу, ассимилируют холестерин и не обладают целлюлазной активностью, как и многие штаммы S. cerevisiae, но, в отличие от них, не способны использовать инулин, мелибиозу, ксилан, трегалозу и бета-глюкан. S. boulardii вырабатывают эстеразу С4, липазу С14, лейцинариламидазу, кислую фосфатазу и фосфогидролазу, но не щелочную фосфатазу, валинариламидазу, цистинариламидазу, трипсин и химотрипсин [28].
Пробиотики S. boulardii показывают большую стрессоустойчивость, в 6–10 раз более высокий антиоксидантный потенциал по сравнению с S. cerevisiae BY4742. Их внеклеточная фракция содержит ценные флавоноиды, фенолы и полифенольные метаболиты [29]. Показано, что антибактериальная активность S. boulardii связана с их способностью продуцировать при 37°C необычно высокие для дрожжей уровни уксусной кислоты. Такая способность была обнаружена у всех исследованных штаммов этого вида, в отличие S. cerevisiae. Присутствие двух копий аллеля whi2S287, по-видимому, вызывает чувствительный к температуре дефект утилизации ацетата, приводящий к непрерывному, очень высокому накоплению уксусной кислоты [30].
При расшифровке полных геномов 5 пробиотических штаммов S. boulardii и сравнении их с геномами 145 штаммов S. cerevisiae было установлено отсутствие мобильных элементов Ty1, Ty3 и Ty4, генов переносчиков гексозы HXT11 и HXT9 и утилизации аспарагина, а также найдены различия в периодах и количестве копий повторов генов флоккулинов. Эти особенности связывают с повышенной стрессоустойчивостью и адгезивными свойствами [31]. Транскриптомные различия, демонстрируемые S. cerevisiae и S. cerevisiae var. boulardii в модели кишечной среды, могут быть причиной проявления пробиотических свойств и зависеть от дифференциальной регуляции экспрессии, основанной на изменчивости промотора [32].
Некоторые цитологические, культуральные и биохимические особенности S. boulardii, которые могут влиять на их пробиотическую активность и возможность применения в биотехнологии, обобщены в табл. 1 (приведены свойства, характерные для большинства сравниваемых микроорганизмов и штаммов S. boulardii).
Таблица 1.
Отличительные свойства S. boulardii
| Свойства | Влияние на физиологические и технологические характеристики |
|---|---|
| Общие для грибов (отличие от бактерий-пробиотиков) | |
| Клетки крупнее (диаметр около 10 мкм), чем бактерии (1 мкм) | Создают стерические помехи, перекрывают сайты прикрепления патогенов и возбудителей порчи |
| Клеточная стенка отличается от бактерий, содержит бета-глюканы и маннаны | Место прикрепления и нейтрализации клеток бактерий-патогенов, возбудителей порчи и токсинов. Питательные вещества для нормальной микробиоты |
| Устойчивость к антибиотикам | Выживание при антибиотикотерапии, отсутствие переноса генов устойчивости к антибиотикам |
| Особенности S. boulardii (отличие от S. cerevisiae) | |
| Повышенная устойчивость к температуре, более высокая скорость роста при 30 и 37°С | Способность выживать и конкурировать с другими микроорганизмами в ЖКТ. Быстрый рост при промышленном производстве |
| Повышенная устойчивость к изменению рН, в т.ч. кислой среде (выживание при рН 2) | Способность выживать в ЖКТ. Сохранение жизнеспособности в кислых пищевых продуках, в т.ч. кисломолочных |
| Повышенная способность к синтезу уксусной кислоты | Пробиотические свойства. Подавление патогенов и возбудителей порчи пищевых продуктов |
| Повышенный синтез антиоксидантов | Пробиотические свойства. Обогащение пищевых продуктов антиоксидантами |
| Повышенный синтез флокуллина | Повышенная стрессоустойчивость, адгезия патогенов и токсинов |
Таким образом, S. boulardii имеют близкое генетическое родство с другими штаммами S. cerevisiae, но отличаются некоторыми существенными физиологическими и биохимическими свойствами, поэтому рассматриваются как штамм или вариант этого вида. В научных публикациях последнего десятилетия чаще всего используют название S. cerevisiae var. boulardii, однако встречается и обозначение штамма (S. cerevisiae HANSEN CBS 5926) или подтипа (S. cerevisiae subtype boulardii). Применяется и просто название вида S. boulardii, при этом обычно (но не всегда) подразумевается пробиотический штамм CNCM I-745, ставший эталоном сравнения в различных исследованиях.
Источники выделения и методы исследований других сахаромицетов с пробиотическими свойствами. Результаты исследований S. boulardii стимулировали поиск других видов дрожжей с пробиотическими свойствами. Методология выделения и исследования свойств новых штаммов дрожжей-пробиотиков продемонстрирована учеными университета Кастилии-Ла-Манча (Испания) в публикациях последних лет [28, 33–37]. Поэтапный подход включал выделение дрожжей из различных пищевых сред (винзаводы, вино, сырзаводы, рассолы сыров, ферментированные овощи и др.), их идентификацию до уровня штаммов с помощью метода RAPD-PCR, общий скрининг пробиотических способностей (устойчивость в условиях пищеварения in vitro, в том числе влияние времени, температуры, pH и ферментов на кинетические параметры роста), определение способности к самоагрегации, гидрофобности и образованию биопленки, исследование устойчивости к антибиотикам и антимикробной активности, изучение жизнеспособности в условиях модели последовательного пищеварения “слюнно-желудочный-кишечный тракт”. В результате были отобраны потенциальные пробиотики, в том числе наиболее перспективные штаммы видов S. cerevisiaе, Hanseniaspora osmophila и Pichia kudriavzevii [33, 34].
Следующим этапом исследований стала оценка безопасности выделенных культур, которая включала тесты на устойчивость к антибиотикам и противогрибковым препаратам, продукцию биогенных аминов, активность деконъюгации солей желчных кислот и ферментативную активность. Установлено, что ни один из 20 изученных штаммов не продемонстрировал коагулазной, гемолитической или ДНКазной активности, но все они проявляли чувствительность к противогрибковым средствам. Все штаммы показали устойчивость к антибиотикам и протеазную активность, некоторые, относящиеся к видам S. cerevisiae и P. anomala (актуальное название Wickerhamomyces anomalus), проявили фосфолипазную активность, а половина штаммов была способна конъюгировать желчные соли [35].
Еще одной стадией этой работы стало уточнение функциональных и технологических характеристик отобранных штаммов по следующим показателям: адгезия к клеткам Caco-2/TC7, метаболизм олиго- и полисахаридов (мелибиозы, раффинозы, ксилана, трегалозы, пектина, бета-глюкана, целлюлозы, целлобиозы и инулина) в аэробных и анаэробных условиях, ассимиляция холестерина, ферментативная активность, антиоксидантная активность, устойчивость к антимикотикам. Наиболее перспективными для использования в качестве пробиотиков были признаны штаммы видов Hanseniaspora osmophila, Lachancea thermotolerans и S. cerevisiae [28].
В недавно опубликованном обзоре [3] обобщены сведения о новых источниках выделения и штаммах дрожжей с пробиотическими свойствами (в основном 2015–2020 гг.). Самое большое количество таких штаммов принадлежит видам S. cerevisiae, Torulaspora delbrueckii, Debaryomyces hansenii, реже упоминаются другие виды сахаромицетных грибов (Meyerozyma caribbica, Metschnikowia ziziphicola (актуальное название Metschnikowia pulcherrima), Hanseniaspora osmophila, Kluyveromyces marxianus, Candida orthopsilosis, C. tropicalis, Pichia guilliermondii (актуальное название Meyerozyma guilliermondii), P. kudriavzevii, P. fermentans, Lachancea thermotolerans, Yarrowia lipolytica). Много потенциальных пробиотических штаммов было выделено из ферментированных оливок, сока сахарного тростника, молока и молочных продуктов [3]. Новые данные по этой теме, опубликованные в 2021 и начале 2022 гг., систематизированы в табл. 2.
Таблица 2.
Виды, источники и свойства потенциальных пробиотиков
| Вид (источник выделения) | Установленные пробиотические свойства | [] |
|---|---|---|
| Diutina rugosa, Hanseniaspora guilliermondii, Aureobasidium proteae (фисташки, Испания) |
Выживаемость в условиях желудочно-кишечного тракта, способности к аутоагрегации, гидрофобность клеточной поверхности, поведение в условиях последовательного моделирования пищеварения, способность образовывать биопленку и ассимиляция источников углерода | [36] |
| Rhodotorula mucilaginosa, Meyerozyma caribbbica, Diutina rugosa (цветы и плоды бразильского леса) | Устойчивость к ЖКТ, способность к аутоагрегации, гидрофобность, способность образовывать биопленку | [37] |
| Saccharomyces cerevisiae, Pichia
guilliermondii*,Candida orthopsilosis, Candida tropicalis, Meyerozyma caribbica, Debaryomyces hansenii (ферментированные оливки, Бразилия) |
Безопасность, выживаемость в желудочно-кишечном тракте, антимикробная активность, клеточная гидрофобность, способности к аутоагрегации и адгезии к эпителиальным клеткам, коагрегации и подавлению адгезии болезнетворных бактерий | [38] |
| Yarrowia lipolytica (морская вода, Мексика) | Антиоксидантная способность и антимикробная активность in vitro. Улучшение иммунологических показателей сыворотки крови, кожно-слизистой оболочки, кишечника и лейкоцитов рыб при контрольном заражении Vibrio parahaemolyticus | [39] |
| Saccharomyces cerevisiae (ферментированные зерновые продукты, Италия) | Устойчивость к условиям ЖКТ. Высокая фитазная и антиоксидантная активность, синтез феноловых кислот, антоцианов, пропионовой кислоты, изомеров конъюгированной линолевой кислоты. Противовоспалительная способность (на мононуклеарных клетках периферической крови человека, снижение провоспалительного цитокина IL-1β) | [40], [41] |
| Zygosaccharomyces sapae (мисо, традиционная японская пища, полученная путем ферментации соевых бобов, риса, пшеницы или смеси из них) | Штамм I-6 индуцировал фенотипические изменения дендритных клеток костного мозга с повышением IL-10, противовоспалительное действие при колите, вызванном декстрансульфатом натрия (в мезентериальных лимфатических узлах мышей in vitro и на мышах) | [42] |
| Saccharomyces boulardii (тесто идли, основного индийского продукта питания, из риса и черного маша) | Высокая устойчивость к солям желчных кислот, пепсину и ферменту поджелудочной железы, низким значениям pH, устойчивость к антибиотикам, способность к аутоагрегации и коагрегации, гидрофобность в модели кишечника C. elegensin vitro и in vivo. Антимикробная активность в отношении 13 различных энтеропатогенов, комменсальные отношения с пятью пробиотическими штаммами | [43] |
| Saccharomyces cerevisiae (болло, традиционная ферментированная еда из пшеницы или пшеницы и пальчатого проса, Индия) | Толерантность к высокой концентрации желчных солей и кислой среде, резистентность к различным антибиотикам, высокая гидрофобность, безопасность (отсутствие гемолиза, активность ДНКазы и желатиназы), антибактериальная активность в отношении патогенов, высокая активность удаления свободных радикалов DPPH, противовоспалительная активность, антидиабетическая активностью, ферментативная активность (α-амилаза, липаза, β-галактозидаза) | [44] |
| Saccharomyces cerevisiae (медоносные пчелы, Тайланд) | Способность к росту в условиях симуляции желудочно-кишечного тракта, при pH 2.0–2.5, 0.3% солей желчных кислот и 37°C, аутоагрегации, продуцированию противомикробных веществ | [45] |
| Pichia kudriavzevii, Kluyveromyces marxianus, Saccharomyces cerevisiae, Kluyveromyces lactis (сыры, Китай) | Продуцирование γ-аминомасляной кислоты, высокая способность к аутоагрегации, гидрофобность (вариация 40–92%), способность выживать в желудочно-кишечном тракте (выживаемость >75% после моделирования) | [46] |
| Kluyveromyces marxianus (ферментированные пищевые продукты и напитки, Тайвань) | Толерантность к солям желчных кислот и кислоте, гидрофобность клеточной поверхности, аутоагрегация, антиоксидантная активность и активность β-галактозидазы | [47] |
| Kluyveromyces marxianus (молоко яка, Индия) | Способность продуцировать β-галактозидазу, толерантность к условиям желудочно-кишечного тракта (низкий pH, панкреатин, пепсин и соли желчных кислот), гидрофобность клеточной поверхности, способность к аутоагрегации. Бесклеточный экстракт и супернатант улучшили сенсибилизацию к инсулину, проявили антиадипогенную способность и антиоксидантную активность, супернатант показал цитотоксическое действие на клетки колоректального рака SW-480 | [48] |
| Kluyveromyces marxianus (кефир, Корея) | Безопасность штаммов in vitro (способность к гидролизу желатина, образованию псевдогиф и гемолизу), in vivo на мышах. Данные по уровню интерлейкина-6 свидетельствуют о противовоспалительном потенциале | [49] |
| Pichia kluyveri, Zygoascus hellenicus, Wickerhamomyces anomalus, Pichia membranifaciens, Candida boidinii, C. diddensiae, Saccharomyces cerevisiae (рассол для ферментации оливок, Италия) | Рост при 37 °С, низких значениях рН, в присутствии желчных солей, ферментативная активность (β-глюкозидаза и фитаза), индекс жизнеспособности при переваривании in vitro | [50] |
Почти все дрожжи, описанные в табл. 2, относятся к классу сахаромицетов (за исключением Aureobasidium proteae и Rhodotorula mucilaginosa). Дрожжи-пробиотики часто выделяют из национальных спонтанно ферментированных продуктов растительного происхождения, в этом отношении представляют интерес также сыры и кисломолочные продукты. Наиболее перспективными пробиотиками являются штаммы видов, имеющих международный статус безопасности, S. cerevisiae и K. marxianus.
Во многих работах подчеркнута строгая зависимость пробиотических свойств от штамма. Действительно, только часть выделенных штаммов дрожжей показывали способность выживать в условиях ЖКТ, еще меньше проявляли антибактериальную активность и имели другие полезные характеристики. Например, из 108 отобранных штаммов дрожжей 25 выдержали тесты на выживание в ЖКТ (температура, рН и др.), 10 из них показали способность к самоагрегации и гидрофобность, а 2 штамма проявили способность к образованию биопленки и жизнеспособность в модели ЖКТ [33]. В других работах наблюдалась та же тенденция: из 142 исследованных штаммов в качестве потенциальных пробиотиков были отобраны 3 [34], из 139 – 2 [40, 41], из 42 – 4 [44], из 104 – 4 [45].
Следует отметить, что в разных работах приводится разный перечень определяемых показателей, так как единой общепризнанной методологии оценки пробиотических свойств дрожжей пока не выработано. Более того, возникает вопрос о необходимости изучения адгезии, аутоагрегации, формирования биопленок и др. свойств, которые обычно исследуют у бактерий-пробиотиков для подтверждения их способности прикрепляться к стенкам кишечника и колонизировать их. Для дрожжей-пробиотиков это свойство может оказаться не обязательным, т. к. у них могут быть другие механизмы полезного действия. Так, у эталонных пробиотиков S. boulardii обнаружена самая низкая способность к адгезии по сравнению с 10 штаммами S. cerevisiae и 10 штаммами других видов дрожжей с пробиотическими свойствами [28].
Во всех случаях в качестве положительного контроля использовали штамм с доказанной пробиотической активностью (S. boulardii CNM I-745), причем многие штаммы других видов показали даже лучшие пробиотические характеристики in vitro, по сравнению с контролем. Однако для подтверждения возможности использования штамма микроорганизма в качестве пробиотика этого недостаточно, необходимы также испытания in vivo на лабораторных животных и рандомизированные контролируемые клинические исследования с участием людей. Только один штамм S. boulardii CNM I-745 полностью прошел все этапы и имеет подтвержденный статус лекарственного средства и пробиотика.
Основные механизмы пробиотического действия сахаромицетов. В настоящее время наиболее изучены механизмы действия штамма S. boulardii CNCM I-745. В обзоре 2010 г. выделены 7 взаимосвязанных эффектов этого пробиотика [11]:
– антитоксический эффект (действует в качестве рецептора для связывания или расщепляет патогенные токсины);
– антимикробная активность (препятствует прикреплению патогенов к участкам кишечных рецепторов, связывает и ингибирует рост клеток патогенов, способствует укреплению целостности плотных контактов между энтероцитами и снижению транслокации патогенов);
– модуляция кишечной флоры (не влияет на нормальную микробиоту у здоровых людей, но при нарушении быстро ее восстанавливает);
– метаболическая активность (стимулирует синтез короткоцепочечных жирных кислот, восстанавливает пути транспорта жидкости);
– влияние на ферментативную активность кишечника;
– повышение уровня sIgA и IgG;
– воздействие на клеточные сигналы и снижение синтеза воспалительных цитокинов.
Результаты исследований, проведенных в последующее десятилетие, подтвердили и дополнили представления о вышеперечисленных эффектах. Новые данные о влиянии S. boulardii CNCM I-745 на организм при инфекционных заболеваниях позволили выделить два основных потенциальных механизма действия этого штамма: влияние на энтеропатогенные микроорганизмы (адгезия бактерий, их уничтожение и/или воздействие на их вирулентные факторы) и прямое воздействие на слизистую оболочку кишечника (трофические эффекты, влияние на восстановление эпителия, антисекреторные эффекты, противовоспалительные эффекты, иммуномодуляция) [51]. В этой работе подробно рассмотрены возможные механизмы профилактического и/или лечебного эффекта при заболеваниях, вызванных Clostridium difficile, Vibrio cholerae, Bacillus anthracis, Salmonella typhimurium, Helicobacter pylori, Candida albicans, ротавирусом, Entamoeba histolytica, Shigella flexneri, патогенными штаммами Escherichia coli [51].
В проявлении лечебных и профилактических эффектов пробиотиков важную роль играют их метаболиты. S. boulardii отличается от S. cerevisiae повышенной выработкой уксусной кислоты, которая не только частично определяет антимикробную активность, но и положительно влияет на пролиферацию бокаловидных, Т-регуляторных клеток кишечника и секрецию слизи, ингибирует провоспалительный цитокин CXCL8 и служит субстратом для производства бутирата микробиотой кишечника [30]. Кроме того, S. cerevisiae var. boulardii обладает высоким антиоксидантным потенциалом, во внеклеточном пространстве обнаружено в 70 раз больше фенолов и в 20 раз больше флавоноидов, чем в образцах с S. cerevisiae [29].
Большое значение имеет также влияние S. boulardii CNCM I-745 на пищеварительные ферменты мембраны щеточной каймы кишечного эпителия. В работе [18] показано, что этот штамм синтезирует и секретирует полиамины, которые играют роль в пролиферации и дифференцировке эпителиальных клеток, усиливают экспрессию пищеварительных ферментов, а также переносчиков питательных веществ. Вероятный механизм связан с индукцией передачи сигналов посредством митоген-активируемого протеинкиназного пути. Увеличение активности щелочной фосфатазы, вызванное S. boulardii, может приводить к инактивации токсинов и уменьшению выработки воспалительных цитокинов. Кроме того, S. boulardii выделяют ферменты, которые улучшают усвоение питательных веществ микробиотой кишечника и самим хозяином [18]. Сахаромицеты рода Kluyveromyces вырабатывают активные бета-галактозидазы, необходимые людям с непереносимостью лактозы, и благодаря этому могут рассматриваться как пробиотики [52].
Антагонистические свойства дрожжей могут быть объяснены конкуренцией за питательные вещества, изменением рН среды в результате ускорения ионного обмена или образования органических кислот, образованием этанола, секрецией антимикробных соединений, в том числе микоцинов (киллер-токсинов) [2].
Микоцинами называют внеклеточные белки или гликопротеины, которые нарушают функцию клеточной мембраны у восприимчивых дрожжей, проявляя фунгицидное или фунгистатическое действие. К образованию микоцинов способны многие виды сахаромицетных грибов, в том числе представители родов: Saccharomyces, Candida, Cryptococcus, Debaryomyces, Kluyveromyces, Pichia, Torulopsis, Williopsis и Zygosaccharomyces. К возможным механизмам действия киллер-токсинов относят нарушение деления клеток путем блокирования синтеза ДНК, ингибирование синтеза компонента клеточной стенки β-1,3-глюкана и нарушение ионообмена, вызванного образованием каналов на цитоплазматической мембране [53].
В некоторых публикациях последних лет рассматривают микоцины как синтезированные дрожжами вещества, которые могут ингибировать рост не только грибов, но и бактерий, паразитов и вирусов. Микоцины проявляют минимальную токсичность и не вызывают резистентности, поэтому считаются перспективной заменой некоторых фунгицидных средств и антибиотиков [54].
В настоящее время накоплены многочисленные доказательства способности некоторых дрожжей подавлять рост и вирулентность патогенных бактерий, в том числе возбудителей алиментарных заболеваний и бактерий, вызывающих порчу пищевых продуктов. В частности, установлена антилистериальная активность штаммов Geotrichum candidum, K. marxianus, Pichia norvegensis, P. fermentans, Debaryomyces hansenii, Candida intermedia, C. tropicalis и Wickerhamomyces anomalus. Некоторые штаммы C. bombicola могут ингибировать рост Staphylococcus aureus и C. albicans, а штаммы D. hansenii проявляют активность против Clostridium tyrobutyricum и C. butyricum [2].
Показана способность штамма S. cerevisiae CNCM I-3856 уменьшать патогенные эффекты энтеротоксигенного (ETEC) штамма Еscherichia coli H10407, что связывают со снижением продукции энтеротоксина, стимуляцией роста Bifidobacterium и Lactobacillus в различных отделах кишечника, синтеза короткоцепочечных жирных кислот (уксусной, пропионовой, масляной) и этанола [55].
Ингибирование роста других патогенов, Salmonella аrizonae и S. typhimurium, наблюдали в среде, ферментированной Kluyveromyces lactis и Saccharomyces unisporus. Эти дрожжи являются частью симбиоза кефирных грибков и могут продуцировать ряд антимикробных метаболитов: спирт, кателицидин, ксантиндегидрогеназа, муцин-1, лактадгерин, лактопероксидаза, сывороточный амилоид А и лактотрансферрин. К возможным механизмам противосальмонеллезного действия относят также прилипание клеток сальмонелл к клеточным стенкам дрожжей [56].
Некоторые механизмы пробиотического действия дрожжей отличаются от бактериальных, и не все они пока понятны. Антимикробная активность связана в основном с прилипанием патогенов к дрожжевым клеткам, а конкуренцией за места связывания эпителия не с патогенами. Определены молекулярные массы некоторых белков, отвечающих за нейтрализацию токсинов, но какие это белки и какими генами они кодируются пока неизвестно. Предстоит выяснить и точный механизм взаимодействия дрожжей с иммунными клетками [8, 19, 51]. Однако основные доказанные полезные для здоровья эффекты сахаромицетов, показанные на рис. 2, позволяют использовать их в медицине, фармацевтической и пищевой биотехнологии.
Возможности применения сахаромицетов в качестве пробиотиков и защитных культур в пищевой биотехнологии. Результаты изучения пробиотических свойств S. boulardii и присвоение им международного статуса безопасной пищевой и кормовой добавки инициировали рост интереса к использованию этого и других видов сахаромицетов в пищевой промышленности. Прежде всего это касается ферментированных продуктов из растительного сырья, имеются также данные о применении S. boulardii в молочной отрасли [7, 9, 57].
Использование S. boulardii для ферментации экстракта рисовых отрубей позволило обогатить его функциональными метаболитами, в том числе феруловой кислотой, и повысить биодоступность полезных веществ. В ячменном солодовом сусле эти дрожжи синтезировали олигосахариды с пребиотическими свойствами, а в соевом молоке – биоактивные изофлавоны, витамины группы В. После ферментации соков из моркови, свеклы, томатов и ягод наблюдали повышение их антиоксидантной активности [7].
Проростки фасоли и чечевицы из семян, замоченных в инокуляте S. cerevisiae var. boulardii, оказались хорошими носителями для этих пробиотиков с высокой концентрацией клеток (107 КОЕ/г) и повышенной выживаемостью в условиях пищеварительного тракта человека и при низких температурах хранения. На проростках с S. boulardii обнаружено на 99% меньше плесеней, отмечено также снижение количества колиформных бактерий [58].
S. cerevisiae var. boulardii CNCM-I745 значительно повысили жизнеспособность пробиотиков Lactobacillus rhamnosus GG в кофейных напитках в течение 14 недель хранения при 4 и 25°C [59]. Предложено использовать S. boulardii для получения пробиотических видов кваса [60], безалкогольного и крафтового пива с повышенной антиоксидантной активностью [61, 62].
Совместная ферментация S. boulardii с молочнокислыми микроорганизмами приводит к обогащению продуктов витаминами и повышению их антиоксидантной активности, а также стимулирует развитие и улучшает выживаемость бактерий-пробиотиков при хранении продуктов (в основном благодаря синтезу аминокислот и нейтрализации кислой среды). Количество S. boulardii может резко увеличиться в молочных продуктах с сахаром и фруктово-ягодными наполнителями, что приводит к образованию СО2 и других метаболитов. Происходящие при этом изменения консистенции и вкуса считаются признаками порчи для традиционных кисломолочных продуктов [7, 9]. Внесение инулина способствует повышению выживаемости S. boulardii в синбиотическом йогурте и положительно влияет на его консистенцию [63].
Выделенные из сыра канастра штаммы K. lactis B10 и Torulaspora delbrueckii B14, которые показали пробиотический потенциал (устойчивость к имитированным условиям желудочно-кишечного тракта, самоагрегация, гидрофобность, ингибирование патогенов, устойчивость к антибиотикам и продукция β-галактозидазы), использовали для производства сыра. Хроматографический анализ образцов сыра позволил идентифицировать 38 летучих соединений, в том числе ароматические и функциональные метаболиты: 2,3-бутандиол, 2-фенилэтанол и изоамиловый спирт, изоамилацетат и фенэтилацетат [64].
Несколько штаммов сахаромицетов со способностью продуцировать гамма-аминомасляную кислоту, которая обладает физиологическими свойствами (снижение артериального давления, ускорение синтеза белка в головном мозге, лечение бессонницы и депрессии), применяли для созревания сыров [46]. Сыр с S. cerevisiae DL6-20 отличался выраженным приятным ароматом, в нем обнаружены высокие концентрации изоамилового спирта, этилового эфира гексановой кислоты, бензилового спирта, этилового эфира октановой кислоты, 3-гидрокси-2-бутанона и гексановой кислот [46].
Ферментация сахаромицетами Буларди смеси для мороженого не только обогащает ее пробиотиками, витаминами и антиоксидантами, но и способствует повышению взбитости смеси, снижению калорийности и обеспечению высоких микробиологических показателей готового продукта [65 ] .
К преимуществам S. boulardii и некоторых других пробиотических дрожжей относятся их биозащитные свойства: способность разлагать микотоксины, такие как афлатоксины, патулин, охратоксин А и др. [3, 4, 9]. Недавно было показано, что лиофилизация и инкапсуляция улучшили способность S. boulardii RC009 к коагрегации с патогенами E. coli, Salmonella spp., Staphylococcus aureus, Streptococcus uberis и S. haemolyticus, а также к адсорбции афлатоксина В1 [66 ] .
***
Данные о полезных для здоровья свойствах сахаромицетных грибов соответствуют представлениям о “биотиках”, которые продолжают развиваться [67 ] . Признанным пробиотиком является штамм S. boulardii CNCM I-745, активность и безопасность которого подтверждена многочисленными, в том числе и клиническими исследованиями. К наиболее доказанным свойствам этого штамма относится способность восстанавливать нормальную микробиоту после антибиотикотерапии, подавлять развитие патогенных микроорганизмов, оказывать антитоксический эффект, стимулировать выработку короткоцепочечных жирных кислот и пищеварительных ферментов эпителием кишечника, модулировать иммунный ответ. Эти свойства определяются как структурными особенностями генома, так и транскриптомными различиями, влияющими на повышенный синтез ацетатов, бактериоцинов, веществ с антиоксидантной активностью и других полезных метаболитов. В то же время пока не все механизмы действия S. boulardii раскрыты и требуют дальнейшего более подробного изучения.
Для некоторых других сахаромицетов пока установлены отдельные пробиотические эффекты in vitro (резистентность к условиям желудочно-кишечного тракта, антагонистическая активность, антиоксидантные свойства и др.). Необходимо подтвердить безопасность этих микроорганизмов и их полезное действие в доклинических и контролируемых клинических исследованиях. В целом сахаромицеты могут иметь преимущества по сравнению с пробиотиками бактериального происхождения: они невосприимчивы к действию антибиотиков, могут выполнять роль транзиторных пробиотиков, которые оказывают благоприятное воздействие на нормальную микробиоту кишечника и его эпителий, а затем быстро выводятся из организма.
Основой пробиотической активности S. boulardii и других сахаромицетов является комплекс метаболитов, включающий органические кислоты, спирты, эфиры, витамины, антиоксиданты, аминокислоты, ферменты и др. вещества, которые считаются метабиотиками. Некоторые из них, в том числе микоцины, определяют антагонистическую активность дрожжей по отношению к патогенным бактериям, грибам, вирусам и простейшим, и могут способствовать решению проблемы антибиотикорезистентности. Более того, метаболиты и компоненты клеток пробиотиков даже в отсутствие живых микроорганизмов могут приносить пользу для здоровья, и рассматриваются как постбиотики. Например, супернатант пробиотического штамма K. marxianus улучшил сенсибилизацию к инсулину, показал антиадипогенную способность и антиоксидантную активность, а также цитотоксическое действие на клетки колоректального рака [48].
Сахаромицеты могут стимулировать рост и способствовать повышению выживаемости молочнокислых бактерий, в том числе пробиотиков, как в кисломолочных напитках, так и в кишечнике. Совместное использование с пребиотиками дает возможность получать продукты-синбиотики с улучшенной усвояемостью. Добавление пробиотических сахаромицетов в ферментированные продукты из растительного и молочного сырья может не только улучшить их функциональные свойства, но и повысить качество и безопасность. Продолжение исследований в этой области расширит представления о пробиотиках и возможностях их применения в фармацевтической и пищевой биотехнологии.
Список литературы
Nielsen J. // Biotechnol J. 2019. V. 14. № 3. https://doi.org/10.1002/biot.201800421
Hatoum R., Labrie S., Fliss I. // Front Microbiol. 2012. V. 19. № 3. doi.org/ .2012.00421https://doi.org/10.3389/fmicb
Staniszewski A., Kordowska-Wiater M. // Foods. 2021. V. 10. № 6. https://doi.org/10.3390/foods10061306
Vemuri R., Shankar E.M., Chieppa M., Eri R., Kavanagh K. // Microorganisms. 2020. V. 8. № 4. https://doi.org/10.3390/microorganisms8040483
Nash A.K., Auchtung T.A., Wong M.C., Smith D.P., Gesell J.R., Ross M.C., et al. // Microbiome. 2017. V. 5. № 1. https://doi.org/10.1186/s40168-017-0373-4
Hill C., Guarner F., Reid G., Gibson G.R. et al. // Nature Reviews Gastroenterology & Hepatology. 2014. V. 11. P. 506–514.
Рябцева С.А., Сазанова С.Н., Дубинина А.А. // Современная наука и инновации. 2019. № 2(26). С. 138–151.
Pais P., Almeida V., Yılmaz M., Teixeira M.C. // J Fungi (Basel). 2020. V. 6. № 2. P. 78. https://doi.org/10.3390/jof6020078
Lazo-Vélez M.A., Serna-Saldívar S.O., Rosales-Medina M.F., Tinoco-Alvear M., Briones-García M. // A review. J. Appl. Microbiol. 2018. V. 125. P. 943–951.
Update of the list of QPS-recommended biological agents intentionally added to food or feed as notified to EFSA 5: suitability of taxonomic units notified to EFSA until September 2016 // EFSA Journal. 2017. V. 15. P. 4366.https://doi.org/10.2903/j.efsa.2017.4663
McFarland L.V. // World J Gastroenterol. 2010. V. 16. № 18. P. 2202–2222.https://doi.org/10.3748/wjg.v16.i18.2202
McFarland L., Bernasconi P. // Microbial Ecology in Health and Disease. 1993. V. 6. P. 157–171.
McCullough M.J., Clemons K.V., McCusker J.H., Stevens D.A. // J. Clin. Microbiol. 1998. V. 36. P. 2613–2617. https://doi.org/10.1128/JCM.36.9.2613-2617.1998
Czerucka D., Piche T., Rampal P. // Aliment. Pharmacol. Ther. 2007. V. 26. P. 767–778.
McFarland L.V. // A Meta-analysis and Systematic Review. Antibiotics (Basel). 2015. V. 13. P. 160–78.
Szajewska H., Horvath A., Kołodziej M. // Aliment Pharmacol Ther. 2015. V. 41. № 12. P.1237–45.
Szajewska H., Kołodziej M. // Aliment Pharmacol Ther. 2015. V. 42. № 7. P. 793–801.
Moré M.I., Vandenplas Y. // Clin Med Insights Gastroenterol. 2018. V. 11.https://doi.org/10.1177/1179552217752679
Kaźmierczak-Siedlecka K., Ruszkowski J., Fic M., Folwarski M., Makarewicz W. // Curr. Microbiol. 2020. V. 77. № 9. P. 1987–1996.https://doi.org/10.1007/s00284-020-02053-9
Li Z., Zhu G., Li C., Lai H., Liu X., Zhang L. // Nutrients. 2021. V. 13. № 12. P. 4319.https://doi.org/10.3390/nu13124319
Кайбышева В.О., Никонов Е.Л. Пробиотики с позиции доказательной медицины // Доказательная гастроэнтерология. 2019. № 8(3). С. 45–54. doi.org/https://doi.org/10.17116/dokgastro2019803145
Mitterdorfer G., Mayer H.K., Kneifel W., Viernstein H. // J. Appl. Microbiol. 2002. V. 93. P. 521–530.
Fietto J.L., Araújo R.S., Valadão F.N., Fietto L.G., Brandão R.L., Neves M.J. et al. // Can. J. Microbiol. 2004. V. 50. P. 615–621.
Edwards-Ingram L., Gitsham P., Burton N., Warhurst G., Clarke I., Hoyle D. et al. // Appl. Environ. Microbiol. 2007. V. 73. P. 2458–2467.
Liu Y., Wu Q., Wu X., Algharib S. A., Gong F., Hu J. et al. // Int. J. Biol. Macromol. 2021. V. 173. P. 445–456. https://doi.org/10.1016/j.ijbiomac.2021.01.125
Fortin O., Aguilar-Uscanga B., Vu K.D., Salmieri S., Lacroix M. // Nutr. Cancer. 2018. V. 70. № 1. P. 83–96. https://doi.org/10.1080/01635581.2018.1380204
Rajkowska K., Kunicka–Styczyńska A. // Biotechnology & Biotechnological Equipment. 2009. V. 23. P. 662–665.
Fernández-Pacheco P., Pintado C., Briones Pérez A., Arévalo-Villena M. J. // Fungi (Basel). 2021. V. 7. № 3. P. 177. https://doi.org/10.3390/jof7030177
Datta S., Timson D.J., Annapure U.S. // J Sci Food Agric. 2017. V. 97. № 9. P. 3039–3049.https://doi.org/10.1002/jsfa.8147
Offei B., Vandecruys P., De Graeve S., Foulquié-Moreno M.R., Thevelein J.M. // Genome Res. 2019. V. 9. P. 1478–1494. https://doi.org/10.1101/gr.243147.118
Khatri I., Tomar R., Ganesan K., Prasad G.S., Subramanian S. // Sci. Rep. 2017. V. 7. № 1. P. 371–385.
Pais P., Oliveira J., Almeida V., Yilmaz M., Monteiro P.T., Teixeira M.C. // Genomics. 2021. V. 113. P. 530–539.
Fernandez-Pacheco P., Arévalo-Villena M., Rosa I.Z., Briones Pérez A. // Food Res. Int. 2018. V. 112. P. 143–151. https://doi.org/10.1016/j.foodres.2018.06.008
Fernández-Pacheco P., Arévalo-Villena M., Bevilacqua A., Corbo M.R., Briones A. // LWT Food Sci Technol. 2018. V. 97. P. 332–340.https://doi.org/10.1016/j.lwt.2018
Fernández-Pacheco P., Ramos Monge I.M., Fernández-González M., Poveda Colado J.M., Arévalo-Villena M. // Front. Nutr. 2021. V. 8.https://doi.org/10.3389/fnut.2021.659328
Fernández-Pacheco P., García-Béjar B., Jiménez-Del Castillo M., Carreño-Domínguez J., Briones Pérez A., Arévalo-Villena M.J. // Sci. Food Agric. 2021. V. 101. № 6. P. 2201–2209. https://doi.org/10.1002/jsfa.10839
Fernández-Pacheco P., Rosa I.Z., Arévalo-Villena M., Gomes E., Pérez A.B. // Braz. J. Microbiol. 2021. V. 52. № 4. P. 2129–2144. https://doi.org/10.1007/s42770-021-00541-z
Simões L.A., Cristina de Souza A., Ferreira I., Melo D.S., Lopes L.A.A., Magnani M. et al. // J. Appl. Microbiol. 2021. V. 131. № 4. P. 1983–1997. https://doi.org/10.1111/jam.15065
Reyes-Becerril M., Alamillo E., Angulo C. // Probiotics Antimicrob Proteins. 2021. V. 13. № 5. P. 1292–1305. https://doi.org/10.1007/s12602-021-09769-5
Palla M., Blandino M., Grassi A., Giordano D., Sgherri C., Quartacci M.F. et al. // Sci. Rep. 2020. V. 10. P. 12856.
Palla M., Conte G., Grassi A., Esin S., Serra A., Mele M. et al. // Foods. 2021. V. 10. № 9. P. 2087.
Okada Y., Tsuzuki Y., Sugihara N., Nishii S., Shibuya N., Mizoguchi A. et al. // J. Gastroenterol. 2021. V. 56. № 9. P. 829–842. https://doi.org/10.1007/s00535-021-01804-0
Chelliah R., Kim E.J., Daliri E.B., Antony U., Oh D.H. // Foods. 2021. V. 10. № 6. P. 1428. https://doi.org/10.3390/foods10061428
Pereira R.P., Jadhav R, Baghela A., Barretto D.A. // Probiotics Antimicrob Proteins. 2021. V. 13. № 3. P. 796–808. https://doi.org/10.1007/s12602-020-09734-8
Zahoor F., Sooklim C., Songdech P., Duangpakdee O., Soontorngun N.S // Metabolites. 2021. V. 11. № 5. P. 312. https://doi.org/10.3390/metabo11050312
Li S., Zhang Y., Yin P., Zhang K., Liu Y., Gao Y. et al. // J Dairy Sci. 2021. V. 104. № 6. P. 6559–6576. https://doi.org/10.3168/jds.2020-19845
Hsiung R.T., Fang W.T., LePage B.A., Hsu S.A., Hsu C.H., Chou J.Y. // Probiotics Antimicrob Proteins. 2021. V. 13. № 1. P. 113–124. https://doi.org/10.1007/s12602-020-09661-8
Nag D., Goel A., Padwad Y., Singh D. // Probiotics Antimicrob. Proteins. 2022. V. 18. https://doi.org/10.1007/s12602-021-09874-5
Youn H.Y., Kim D.H., Kim H.J., Jang Y.S., Song K.Y., Bae D. et al // Probiotics Antimicrob. Proteins. 2022. https://doi.org/10.1007/s12602-021-09872-7
Parafati L., Palmeri R., Pitino I., Restuccia C. // Food Microbiol. 2022. V. 103. P. 103950. https://doi.org/10.1016/j.fm.2021.103950
Czerucka D., Rampal P. // World J. Gastroenterol. 2019. V. 25. № 18. P. 2188–2203. https://doi.org/10.3748/wjg.v25.i18.2188
Наумова Е.С., Садыкова А.Ж., Михайлова Ю.В., Наумов Г.И. Полиморфизм лактозных генов молочных дрожжей Kluyveromyces marxianus, потенциальных пробиотических микроорганизмов. // Микробиология. 2017. Т. 86. № 3. С. 335–343.
Голубев В.И. Микоцинотипирование // Микология и фитопатология. 2012. Т. 46. № 1. С. 3–13.
Nascimento B.L., Delabeneta M.F., Rosseto L.R.B., Junges D.S.B., Paris A.P., Persel C. et al. // FEMS Yeast Research. 2020. V. 20. № 3.https://doi.org/10.1093/femsyr/foaa016
Roussel C., De Paepe K., Galia W., de Bodt J., Chalancon S., Denis S. et al. // Gut Microbes. 2021. V. 13. № 1. P. 1953246. https://doi.org/10.1080/19490976.2021.1953246
Gut A.M., Vasiljevic T., Yeager T., Donkor O.N. // Saudi J. Biol. Sci. 2022. V. 29. № 1. P. 550–563. https://doi.org/10.1016/j.sjbs.2021.09.025
Ansari F., Alian Samakkhah S., Bahadori A., Jafari S.M., Ziaee M., Khodayari M.T. et al. // Crit. Rev. Food Sci. Nutr. 2021. V. 13. P. 1–29. https://doi.org/10.1080/10408398.2021.1949577
Swieca M., Kordowska-Wiater M., Pytka M., Gawlik-Dziki U., Seczyk L., Złotek U. et al. // LWT. 2019. V. 100. P. 220–226.
Chan M.Z.A., Toh M., Liu S.Q. // Int. J. Food Microbiol. 2021. V. 4. P. 350–109229. https://doi.org/10.1016/j.ijfoodmicro.2021.109229
Polanowska K., Varghese R., Kuligowski M., Majcher M. // J. Sci. Food Agric. 2021. V. 101. № 13. P. 5487–5497. https://doi.org/10.1002/jsfa.11197
Senkarcinova B., Graça Dias I.A., Nespor J., Branyik T. // LWT. 2019. V. 100. P. 362–367.
Sarwar A., Tariq A., Al-Dalali S., Zhao X., Zhang J., Jalal ud Din et al. // Foods. 2019. V. 8. P. 468.
Andrade R.P.,Oliveira D.R., Alencar Lopes A.C., Abreu L.R., Duarte W.F. // Food Research International. 2019. V. 125. № 2019 https://doi.org/10.1016/j.foodres.2019.108620
Poloni V.L., Bainotti M.B., Vergara L.D., Escobar F., Montenegro M., Cavaglieri L. // Curr. Res. Food Sci. 2021. V. 4. P. 132–140. https://doi.org/10.1016/j.crfs.2021.02.006
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология



