Радиационная биология. Радиоэкология, 2019, T. 59, № 1, стр. 37-45
ОЦЕНКА ВЛИЯНИЯ РАДИАЦИОННОГО ФАКТОРА НА СРЕДНЕЕ ВРЕМЯ ДОЖИТИЯ ПРИ ЗАБОЛЕВАНИИ ЛИКВИДАТОРОВ ПОСЛЕДСТВИЙ АВАРИИ НА ЧАЭС СОЛИДНЫМИ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
А. И. Горский 1, М. А. Максютов 1, К. А. Туманов 1, Е. В. Кочергина 1, В. К. Иванов 1, *
1 Медицинский радиологический научный центр им. А.Ф. Цыба – филиал НМИЦ радиологии Минздрава России
Обнинск, Россия
* E-mail: nrer@obninsk.com
Поступила в редакцию 19.02.2018
Аннотация
Цель данного исследования заключалась в оценке среднего времени дожития после выявления заболевания солидными раками в когорте ликвидаторов последствий аварии на ЧАЭС (далее – ликвидаторы), подвергшихся воздействию ионизирующего излучения. В анализе использована индивидуальная медико-дозиметрическая информация о ликвидаторах (мужчинах) за период наблюдения с 1991 по 2015 г. Численность когорты в 1991 г. составила 142 871 человек. Это ликвидаторы, которые работали в зоне ликвидации последствий аварии на ЧАЭС в 1986–1987 гг. Число заболевших солидными раками с документированными стадиями заболеваний – 7652 случая, среди них число случаев смерти 5085 (4351 человек умерли от рака). В работе использована отечественная классификация стадий распространенности рака. Среднее время дожития после выявления заболевания ликвидаторов солидными раками (МКБ-10: С00-С80.9) с документированными стадиями распространенности опухоли за период с 2000 по 2015 г. равно 4.73 года; для злокачественных новообразований органов дыхания (МКБ-10: С30-С39.9) среднее время дожития равно 2.57 года, для злокачественных новообразований органов пищеварения (МКБ-10: С15-С26.9) – 3.55 года. Среднее время дожития за период наблюдения непрерывно растет, несмотря на старение когорты и рост общей смертности. Исследована зависимость среднего времени дожития от стадии опухоли. При заболевании солидными раками время дожития при изменении от 1-й стадии к стадии 4 уменьшается в 7 раз (с 8.62 до 1.22 года). Исследована зависимость среднего времени дожития при заболевании солидными раками от дозы облучения ликвидаторов. Рассмотрены две дозовые группы: ≤100 мГр (средняя доза 56.6 мГр) и 100+ мГр (средняя доза 187.9 мГр). Значения средних времен дожития соответственно равны 4.66 и 4.72 года и их различие статистически не значимо. Проведенные исследования в когорте с изменяющейся численностью и возрастной структурой являются актуальными в контексте оценки последствий воздействия техногенных факторов на здоровье отдельных популяций и групп людей.
Радиационно-эпидемиологические исследования в когорте ликвидаторов ведутся уже более 30 лет, и результаты этих исследований приведены в отечественных публикациях, например, [1], и за рубежом [2]. Основные акценты в этих публикациях сделаны на исследовании зависимости заболеваемости и смертности ликвидаторов от дозы облучения – анализе и прогнозировании радиационных рисков.
Индивидуальная информация о динамике изменений в состоянии здоровья ликвидаторов последствий аварии на ЧАЭС, накапливаемая в Национальном радиационно-эпидемиологическом регистре (НРЭР), дает возможность оценить многие важные медицинские показатели, характерные для мужского населения России в целом, так как большинство (более 95% от общего числа) ликвидаторов – мужчины. Эти показатели могут определять стратегию развития практического здравоохранения России в лечении и профилактике наиболее социально значимых заболеваний. Действительно, ликвидаторы, представляющие большинство областей России, могут являться достаточно представительной случайной выборкой для всего взрослого мужского населения России.
Задачей исследования было представить некоторые важные эпидемиологические показатели онкологической смертности и заболеваемости, такие, как среднее время дожития после заболевания и распространенность заболеваний среди ликвидаторов.
МАТЕРИАЛЫ И МЕТОДИКА
Описание когорты
В анализе рассмотрена когорта ликвидаторов, время въезда которых в зону облучения было ограничено датой 31.12.1987 г., а возраст при облучении – 18–70 лет.
За период наблюдении 1991 по 2015 г. в данной когорте зарегистрировано 7652 случая заболеваний солидными злокачественными новообразованиями (ЗНО) с документированной по отечественной классификации стадией опухоли, число случаев смерти от всех причин среди заболевших солидными раками 5085, из них 4351 (85.6%) случаев смерти от солидных раков. Численность когорты в 1991 г. составляла 142 871 человек.
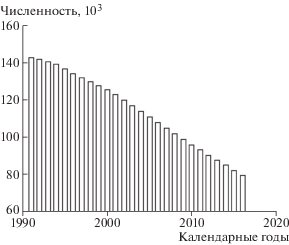
Динамика численности когорты за период наблюдения приведена на рис. 1.
Как видно на рис. 1, численность когорты в течение периода наблюдения ежегодно уменьшается за счет смертности и случаев потерь наблюдения, что закономерно для замкнутых (непополняемых) популяций.
Для проведения анализа все случаи солидных ЗНО, выявленные в исследуемой когорте, в первую очередь были распределены по основному прогностическому признаку – стадии опухолевого процесса на момент установления диагноза. Как известно, по степени распространения новообразований в России утверждено деление злокачественных опухолей на четыре стадии [3]. При клинической классификации все основные параметры злокачественного новообразования (размер первичной опухоли, прорастание в окружающие органы, наличие регионарных и отдаленных метастазов) рассматривают в совокупности. Выделяют четыре стадии заболевания:
стадия I – опухоль локализована, занимает ограниченный участок, не прорастает стенку органа, метастазы отсутствуют;
стадия II – опухоль умеренных размеров, не распространяется за пределы органа (ограничена одним или двумя слоями стенки органа), возможны одиночные метастазы в регионарные лимфатические узлы;
стадия III – опухоль больших размеров, с распадом, прорастает всю стенку органа или опухоль меньших размеров с множественными метастазами в регионарные лимфатические узлы;
стадия IV – прорастание опухоли в окружающие органы, в том числе неудаляемые (аорта, полая вена и т.д.), или любая опухоль с отдаленными метастазами.
Также существует стадия 0 – преинвазивная карцинома – начальная стадия рака, при которой в патологически измененном участке ткани имеются изолированные раковые клетки или их скопления.
Клиническая классификация удобна тем, что позволяет оценить основные параметры опухоли и сравнить опухоли разных органов. Независимо от локализации опухоли, понятно, что, чем выше стадия, тем хуже прогноз.
При оформлении диагноза каждого отдельно взятого случая злокачественного новообразования, кроме отечественной классификации, обязательно используется принятая во всем мире международная классификация по системе TNM [4], в которой уже не в совокупности, а раздельно оценивают основные параметры: величину опухоли, состояние регионарных лимфоузлов и наличие отдаленных метастазов. Эффективность этой классификации обусловлена лаконичностью, краткостью и универсальностью системы TNM для обозначения степени распространения злокачественного новообразования. Классификация по системе TNM детально характеризует все стороны злокачественного процесса. В то же время она не дает обобщенных данных о тяжести процесса, возможности излечения от заболевания. Для определения тактики лечения больного и его прогноза чаще используется клиническая стадия. Злокачественные новообразования с различным “набором” TNM для каждой конкретной локализации ЗНО группируются также в стадии IV. Стадии установлены таким образом, чтобы, насколько это возможно, каждая из образовавшихся групп была более или менее однородной по показателю выживаемости и чтобы коэффициенты выживаемости в группах для новообразований разных локализаций были различными.
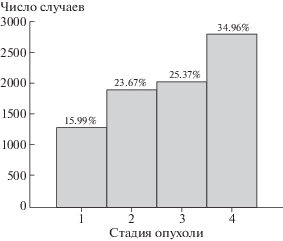
Распределение числа выявленных в исследуемой когорте случаев солидных ЗНО по стадиям заболевания за весь период наблюдения приведено на рис. 2. Наибольшее число заболевших ЗНО (35%) имеют четвертую стадию заболевания, наименьшее – всего около 16% – первую стадию.
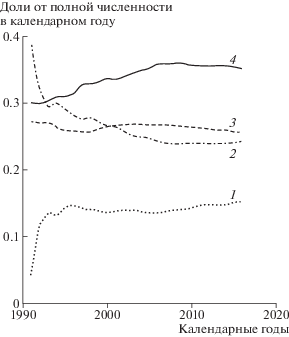
Временные тренды распространенности опухоли представлены на рис. 3, где приведено отношение численности выявленных заболеваний с определенной стадией к полному числу выявленных заболеваний в каждом году. Согласно рис. 3, после 2000 г. наблюдается небольшой рост стадии I, стадии II, III относительно стабильны, доля стадии IV после 2010 г. незначительно уменьшается.
Рассмотрим динамику среднего времени дожития (survival time) после заболевания ЗНО и распространенность (prevalence) злокачественных новообразований для наиболее социально значимых локализаций для мужского населения с различными стадиями заболевания.
Среднее время дожития после заболевания является одним из основных параметров, характеризующих состояние практического здравоохранения при лечении заболеваний определенной патологии, и играет важную роль в страховой медицине.
Распространенность заболевания определяет стратегию профилактических мер для определения социальной значимости заболевания и мероприятий (скрининга) с целью снижения ущерба для здоровья при оценке заболеваемости данной патологией путем диагностики болезни на ранних стадиях.
Методика дескриптивного анализа среднего времени дожития и распространенности заболеваний
Для анализа распространенности и времени дожития использованы следующие персональные данные о ликвидаторах:
год выявления заболевания (ЗНО), код заболевания (код заболевания по Международной классификации болезней 10-го пересмотра – МКБ-10) [4], год смерти, основная причина смерти (код МКБ-10), год последнего наблюдения за ликвидатором (в случае смерти – год смерти), стадия опухоли по отечественной классификации.
Определим время дожития как разность дат постановки диагноза заболевания (ЗНО) и смерти от всех причин для заболевших рассматриваемой патологией, а распространенность – как отношение числа лиц в популяции, страдающих от рассматриваемого заболевания в определенный момент времени, к численности популяции в этот момент времени [5].
Корректно оценить время дожития из персональных данных о датах заболевания и смерти можно только в популяциях, не цензурированных справа, т.е. в популяциях, где все члены популяции умерли, поэтому оценку среднего времени дожития D сделаем, используя известное соотношение между распространенностью заболевания Pr (prevalence) и интенсивностью (incidence) впервые выявленных заболеваний I в стационарных популяциях.
Для стационарной популяции интенсивность (показатель заболеваемости) вновь выявленных хронических заболеваний равна интенсивности (показателю) смертности больных от всех причин, т.е. численность больных стабильна во времени. Если предположить, что среди больных отсутствуют миграционные процессы, численность популяции равна N, а число больных P, тогда размер популяции под риском будет N–P. Число здоровых людей, которые заболеют, в интервал времени длиной Δt, будет $I(N - P)\Delta t$, число больных, умерших от всех причин $I{\kern 1pt} {\text{'}}P\Delta t$, где I ' представляет показатель смертности больных от всех причин, равный отношению числа умерших к числу чел.-лет наблюдения за больными. По определению [5], при отсутствии миграции отношение $\frac{1}{{I{\text{'}}}} = D$ будет равно среднему времени дожития после заболевания. Тогда для стационарной популяции:
Из выражения (1) следует:
Если P мало, скажем <0.1, тогда распространенность Pr будет равна:
Распространенность в когорте ликвидаторов рассчитывалась как разность кумулятивного числа заболеваний (ЗНО) и кумулятивного числа случаев смерти среди заболевших (ЗНО) от всех причин, деленная на численность когорты в момент времени t:
(4)
$\Pr (t) = \frac{{\int\limits_{{{t}_{0}}}^t {nm(\tau )d\tau } - \int\limits_{{{t}_{0}}}^t {nd(\tau )d\tau } }}{{n(t)}},$Произведем оценку распространенности и среднего времени дожития для солидных ЗНО (МКБ-10: С00-С80.9) и наиболее социально значимых локализаций ЗНО органов дыхания (МКБ-10: С30-С39.9) и ЗНО органов пищеварения (МКБ-10: С15-С26.9) в зависимости от стадии заболевания.
РЕЗУЛЬТАТЫ
Рисунки 4–7 иллюстрируют динамику компонент, необходимых для оценки среднего времени дожития.
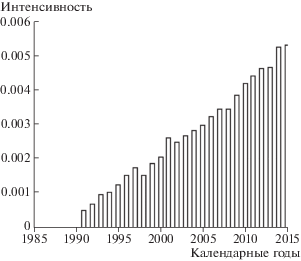
На рис. 4 приведена динамика интенсивности заболеваний солидными раками (МКБ-10: С00-С80.9). В 2015 г. в рассматриваемой когорте наблюдалось 530 случаев заболеваний на 100 000 ликвидаторов, имеющих документированную стадию заболевания.
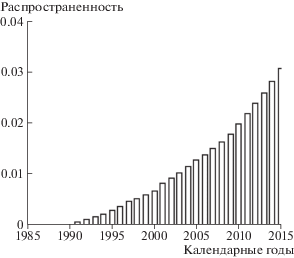
Рисунок 5 иллюстрирует динамику относительного числа выживших больных ЗНО, распространенность заболеваний. В 2015 г. в когорте было 2567 выживших больных с документированной стадией заболевания.
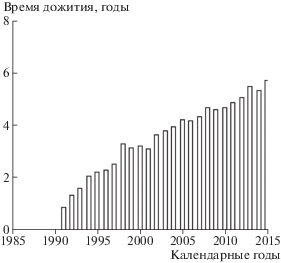
На рис. 6 представлена динамика времени дожития по календарным годам. Значение среднего времени дожития в период с 2000 по 2015 г. равно 4.73 года.
Важно отметить, что среднее время дожития, несмотря на то, что когорта стареет, увеличивается со временем. Можно предположить, что наблюдаемый эффект обусловлен как совершенствованием методов диагностики (в меньшей степени) и лечения (в большей степени), так и ежегодными диспансеризациями, которые проходят ликвидаторы 1986–1987 гг. въезда в зону облучения. Нельзя исключить и влияние естественного отбора: раннее “вымирание” наиболее слабых членов когорты.
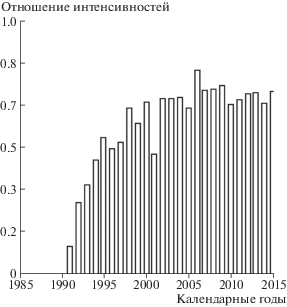
Рост среднего времени дожития до 2000 г. обусловлен ростом отношения интенсивностей смерти и заболеваний, в последующий период это отношение стабилизировалось, как показывают данные, приведенные на рис. 7.
Стабилизация этого отношения позволяет оценить летальность больных солидными раками в когорте ликвидаторов. В ином случае оценка летальности не совсем корректна, так как в конкретном рассматриваемом году заболевают одни люди, а умирают другие. Согласно рис. 7, летальность больных солидными раками в период наблюдения с 2000 по 2015 г. составляет примерно 73%.
Время дожития зависит от диагностированной стадии опухоли. Рассмотрим период наблюдения с 2000 по 2015 г., когда отношение интенсивностей смерти и заболеваемости стабилизировалось.
В табл. 1 приведены значения среднего времени дожития со стандартными отклонениями в зависимости от стадии заболевания солидными раками (МКБ-10: С00-С80.9).
Таблица 1.
Среднее время дожития в зависимости от стадии заболевания солидными раками (МКБ-10: С00-С80) за период 2000–2015 гг.
| Показатель | Стадия заболевания | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 1–4 | |
| Среднее время дожития, годы | 8.62 ± 2.00 | 7.58 ± 1.15 | 4.78 ± 1.31 | 1.22 ± 0.20 | 4.73 ± 1.09 |
| Средний возраст на момент постановки диагноза заболевания, лет | 57.2 | 57.1 | 56.7 | 57.0 | 57.0 |
Согласно данным табл. 1, средний возраст заболевания для больных всех стадий одинаков, но время дожития существенно зависит от стадии заболевания, уменьшаясь с увеличением стадии в 7 раз.
Результаты оценок среднего времени дожития для ЗНО органов дыхания (МКБ-10: С30-С39.9) и ЗНО органов пищеварения (МКБ-10: С15-С26.9) за тот же период наблюдения приведены в табл. 2, 3.
Таблица 2.
Среднее время дожития в зависимости от стадии заболевания ЗНО органов дыхания (МКБ-10: С30-С39.9)
| Показатель | Стадия заболевания | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 1–4 | |
| Среднее время дожития, годы | 6.24 ± 2.95 | 4.97 ± 1.10 | 2.81 ± 0.59 | 0.89 ± 0.15 | 2.57 ± 0.45 |
| Средний возраст на момент постановки диагноза заболевания, лет | 58.4 | 56.5 | 56.7 | 56.8 | 56.8 |
Таблица 3.
Среднее время дожития в зависимости от стадии заболевания ЗНО органов пищеварения (МКБ-10: С15-С26.9)
| Показатель | Стадия заболевания | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 1–4 | |
| Среднее время дожития, годы | 8.64 ± 3.45 | 6.64 ± 1.31 | 4.79 ± 1.38 | 1.01 ± 0.17 | 3.55 ± 0.85 |
| Средний возраст на момент постановки диагноза заболевания, лет | 56.9 | 58.1 | 57.1 | 57.3 | 57.4 |
Для ЗНО органов дыхания и пищеварения среднее время дожития также сильно зависит от стадии заболевания, уменьшаясь с увеличением стадии.
Доза облучения ликвидаторов может быть дополнительным канцерогенным фактором, влияющим, например, на сокращение времени жизни после выявления рака на различных стадиях, поэтому рассмотрим зависимость времени дожития у больных ЗНО ликвидаторов от дозы облучения. Из всей группы больных с документированными стадиями опухоли были выделены ликвидаторы с документированной дозой облучения, которые были разделены на две дозовые группы с близкой численностью: группа 1 – до 100 мГр включительно, группа 2 – с дозой свыше 100 мГр.
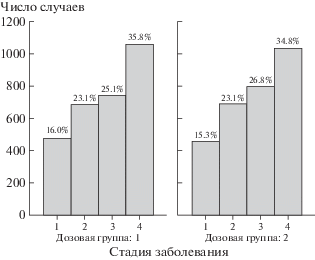
Распределение больных по стадии солидных опухолей в дозовых группах приведено на рис. 8. Из рис. 8 можно сделать вывод, что распределения стадий опухоли в дозовых группах близки.
Результаты оценки среднего времени дожития и основные характеристики сравниваемых дозовых групп приведены в табл. 4.
Таблица 4.
Основные характеристики ликвидаторов в дозовых группах за период с 2000 по 2015 г.
| Показатель | Дозовая группа, мГр | |
|---|---|---|
| ≤100 | 100+ | |
| Число больных | 2114 | 2328 |
| Средняя доза, мГр | 56.6 | 187.9 |
| Среднее время дожития в 2010 г., лет | 4.66 ± 1.11 | 4.72 ± 0.99 |
| Средний возраст на момент постановки диагноза заболевания, лет | 56.5 | 56.9 |
Для проверки значимости отличия двух средних времен дожития в дозовых группах используем t-критерий. Значение t-критерия рассчитывалось согласно [6]:
Результирующая оценка общей дисперсии s2 двух выборок в дозовых группах:
где s1, s2 – стандартные отклонения среднего времени дожития в дозовых группах, приведенные в табл. 4, m = n = 16 – число лет наблюдения.Оценкой выборочной дисперсии разности средних времен дожития в дозовых группах $\bar {x} - \bar {y}$ будет:
Стандартное отклонение разности $\bar {x} - \bar {y}$ равно:
Тогда значение t-критерия:
где $\bar {x}$ и $\bar {y}$ – значения средних времен дожития в дозовых группах.При нулевой гипотезе эта статистика подчиняется распределению Стьюдента с m + n – 2 степенями свободы. Для значений средних времен дожития и их стандартных отклонений, приведенных в табл. 4, значение t = –0.164, а критическое значение для двухсторонней нулевой гипотезы с уровнем значимости α = 0.05 равно |t | = 2.042.
Откуда следует, что различие средних времен дожития в дозовых группах статистически не значимо.
Значения средних времен дожития в дозовых группах для разных стадий заболевания приведены в табл. 5.
Таблица 5.
Значения средних времен дожития ликвидаторов в дозовых группах для разных стадий заболевания
| Стадия | Дозовая группа, мГр | Критерий Стьюдента |t | | |
|---|---|---|---|
| ≤100 | 100+ | ||
| Стадия 1 | 8.81 ± 3.48 | 9.35 ± 2.36 | 0.52 |
| Стадия 2 | 7.73 ± 1.40 | 7.83 ± 1.47 | 0.20 |
| Стадия 3 | 4.58 ± 1.15 | 4.91 ± 1.56 | 0.69 |
| Стадия 4 | 1.33 ± 0.27 | 1.03 ± 0.18 | 3.76 |
| Стадия 1–4 | 4.66 ± 1.11 | 4.72 ± 0.99 | 0.164 |
Согласно данным табл. 5, статистически значимо отличаются только средние времена дожития для 4-й стадии заболевания, но абсолютная величина этого отличия невелика.
ОБСУЖДЕНИЕ
Проведен анализ динамики средних времен дожития после заболевания солидными раками в когорте ликвидаторов последствий аварии на ЧАЭС. Также исследованы зависимость времен дожития от стадии заболевания и корреляция этого показателя с дозой облучения. Результаты данного исследования актуальны для оценки медицинских последствий воздействия техногенных факторов на отдельные популяции или группы людей. Действительно, группы людей, подвергшихся кратковременному воздействию техногенного фактора, представляют замкнутую относительно экспонирования группу, возраст которой будет увеличиваться со временем, а численность уменьшаться вследствие процессов смертности.
Самым важным результатом анализа, по мнению авторов, является непрерывное увеличение среднего времени дожития в когорте ликвидаторов, несмотря на старение ее членов и рост общей смертности, который можно объяснить совершенствованием методов диагностики и лечения в практическом здравоохранении России. Вполне ожидаемо, что рассматриваемый показатель существенно зависит от стадии опухоли – уменьшается с ее ростом, так что для 1-й и 4-й стадий солидных ЗНО время дожития отличается в 7 раз. Значимая отрицательная корреляция времени дожития с дозой облучения выявлена только для опухолей 4-й стадии, но абсолютная величина разности средних времен невелика и равна 0.3 года.
Сравним средние времена дожития в когорте ликвидаторов и среди населения России, оценка которых приведена в [7].
В работе [7] одним из основных коэффициентов, характеризующих состояние онкологической помощи населению, является индекс накопления контингента больных со злокачественными новообразованиями, который равен отношению числа больных, стоящих на учете в определенном году, к числу впервые выявленных ЗНО за это время. Индекс накопления фактически представляет отношение распространенности к интенсивности вновь выявленных заболеваний, что в соответствии с (3) является средним временем дожития в стабильных популяциях.
Следует отметить, что такой сравнительный анализ будет приближенным, так как рассматриваемые группы лиц имеют различные динамические характеристики. Популяция населения России представляет относительно стабильную популяцию с устойчивой во времени численностью, половой и возрастной структурой. В стареющей когорте ликвидаторов численность меняется во времени, а именно, уменьшается вследствие растущей смертности. Кроме того, в [7] приведена информация для всего населения, независимо от пола и для всего возрастного диапазона, а ликвидаторы в данном исследовании представляют взрослое мужское население.
Среднее время дожития за период для всех ЗНО с 2005 по 2015 г. в российской популяции, согласно [7], равно 5.94 ± 0.39, в когорте ликвидаторов – 4.98 ± 0.52, и различие средних величин статистически значимо в рамках двусторонней гипотезы (α = 0.05).
Среднее время дожития для ликвидаторов меньше, чем для населения в России, что обусловлено отличием половых и возрастных структур (для сравнения – средний возраст в когорте ликвидаторов в 2015 г. равнялся 62.1 года, а средний возраст российской популяции – 39 лет).
Работу по исследованию времени дожития после онкологического заболевания необходимо продолжить путем теоретического исследования плотности и функции распределения времени дожития на основе статистической модели “заболел-умер” (illness-death model), известной, как модель Неймана–Фикса [8, 9], провести аналогичные исследования для заболеваний системы кровообращения.
ВЫВОДЫ
1. Разработана методика оценки среднего времени дожития после онкологического заболевания в когорте ликвидаторов последствий аварии на ЧАЭС. На основе методики сделана оценка времени дожития при заболевании солидными раками, для ЗНО органов дыхания и ЗНО органов пищеварения. Среднее время дожития за период с 2000 по 2015 г. составляет: для всех солидных раков – 4.73 года, для ЗНО органов дыхания – 2.57 года, для ЗНО органов пищеварения – 3.55 года.
2. При изменении стадии солидных опухолей от 1-й к 4-й среднее время дожития уменьшается в 7 раз.
3. Среднее время дожития для ликвидаторов не зависит от дозы облучения.
Список литературы
Ivanov V., Tsyb A., Ivanov S., Pokrovsky V. Medical radiological consequences of the Chernobyl catastrophe in Russia: estimation of radiation risks. St. Petersburg: Nauka, 2004. 388 p.
Ivanov V.K., Gorsky A.I., Kashcheev V.V. et al. Latent period in induction of radiogenic solid tumors in the cohort of emergency workers // Radiat. Environ. Biophys. 2009. V. 48, № 3. P. 247–252.
TNM: Классификация злокачественных опухолей / Под ред. Л.Х. Собина и др.: Пер. с англ. и науч. ред. А.И. Щеголев, Е.А.Дубова, К.А. Павлов. М.: Логосфера, 2011. 304 с.
Международная статистическая классификация болезней и проблем, связанных со здоровьем; 10-й пересмотр в 3 т. Женева: ВОЗ, 1995–1998. Т. 1. С. 181–215.
Rothman K.J., Greenland S., Lash T.L. Modern Epidemiology. 3rd Ed. Philadelphia, PA: Lippincott Williams & Wilkins, 2008. 758 p.
Справочник по прикладной статистике / Под ред. Э. Ллойда и У. Ледермана; Пер. Ю.Н. Тюрина. М.: Финансы и статистика, 1989. 508 с.
Состояние онкологической помощи населению России в 2015 году / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена, 2016. 236 с.
Fix E., Neyman J. A simple stochastic model of reco-very, relapse, death and loss of patients // Hum. Biol. 1951. V. 23. № 3. P. 205–241.
Chiang C.L. Survival and stages of disease // Math. Biosci. 1979. V. 43. P. 159–171.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология