Радиационная биология. Радиоэкология, 2019, T. 59, № 1, стр. 82-93
РЕАКЦИЯ ЭРИТРОПОЭЗА НА ТРИПАНОСОМНУЮ ИНВАЗИЮ У РЫБ, ОБИТАЮЩИХ В РАДИОАКТИВНО ЗАГРЯЗНЕННОЙ РЕКЕ ТЕЧА
Г. А. Тряпицына 1, 2, *, Е. А. Пряхин 1, Д. И. Осипов 1, Е. А. Егорейченков 1, 2, Г. Рудольфсен 3, 4, Х.-К. Тейен 5, М. Сневе 3, А. В. Аклеев 1, 2
1 Уральский научно-практический центр радиационной медицины ФМБА России
Челябинск, Россия
2 Челябинский государственный университет
Челябинск, Россия
3 Норвежское агентство по радиационной защите
Остерас, Норвегия
4 Университет Трумсё
Трумсё, Норвегия
5 Норвежский университет наук о жизни,
Центр передового опыта и радиоактивности окружающей среды
Эш, Норвегия
* E-mail: tga28@mail.ru
Поступила в редакцию 03.11.2017
Аннотация
Выполнена оценка состояния эритропоэза у рыб (плотва (Rutilus rutilus L., 1758), окунь (Perca fluviatilis L., 1758), щука (Esox lucius L., 1758)), обитающих в радиоактивно-загрязненной р. Теча, и у рыб водотока сравнения р. Миасс при трипаносомой инвазии. Показано, что в уловах летом доля зараженных рыб (40%) более высокая, чем весной (20%); самый высокий уровень заболеваемости у окуня (45%), затем у щуки (23%) и самый низкий у плотвы (14%); уровень заболеваемости снижается от верхнего течения (44%) к более полноводному низовью (12%). В условиях хронического радиационного воздействия на рыб в диапазоне мощностей доз облучения 3–150 мкГр/сут сочетанное действие радиации и трипаносомной инвазии характеризуется антагонистическим взаимодействием на продуктивность бластных клеток и аддитивным взаимодействием на продукцию более дифференцированных (нормоциты) клеток и количество зрелых эритроцитов. Выявлено статистически значимое влияние трипаносомной инвазии на процентный состав эритроидных клеток различной степени зрелости в периферической крови у рыб. Мощность дозы облучения статистически значимо влияет на процентное содержание эритробластов и пронормоцитов и на абсолютное количество эритроидных клеток в целом. Сочетанное действие трипаносомной инвазии и радиации может приводить к модификации эффектов в делящихся пулах кроветворения.
Экосистема р. Теча (Челябинская обл., Россия) подверглась радиоактивному загрязнению в результате регламентных и аварийных сбросов жидких радиоактивных отходов (ЖРО) в 1949–1956 гг. предприятием атомной промышленности ПО “Маяк” [1–3]. В настоящее время суммарная удельная активность β-излучающих радионуклидов в донных отложениях на различных участках р. Теча находится в пределах от 101 до 106 Бк/кг сухой массы, объемная активность этих радионуклидов в воде – от 5 до 40 Бк/дм3 [4].
Несмотря на столь длительное существование уникальной радиоэкологической ситуации, исследования состояния ихтиофауны р. Теча немногочисленны и в основном касаются накопления радионуклидов в организме рыб [5, 6].
У рыб, обитающих в р. Теча, жизненный цикл на протяжении нескольких поколений проходит в естественных природных экосистемах в условиях хронического радиационного воздействия. Это, несомненно, может привести к выработке у них определенных механизмов адаптации к радиационному фактору. Представляется крайне интересным оценить адаптационные возможности у этих рыб на примере кроветворной системы.
Система крови является одной из наиболее чувствительных к действию факторов различной природы [7, 8]. У рыб отсутствует красный костный мозг, и кроветворение осуществляется в ряде органов – в жаберном аппарате, кишечнике, сердце, почках, селезенке, а также в периферической крови [9], что позволяет проводить оценку состояния гемопоэза по показателям периферической крови.
В исследованиях современного состояния ихтиофауны р. Теча было показано, что в условиях хронического радиационного воздействия у плотвы наблюдаются повышение численности эритробластов и снижение количества эритроцитов в периферической крови по отношению к этим показателям у рыб из р. Миасс, использованной в качестве водотока сравнения, и эти изменения носят дозозависимый характер [10].
В экспериментальных работах на млекопитающих показано, что вследствие компенсаторных реакций при хроническом радиационном воздействии система иммуногемопоэза переходит на качественно другой уровень организации [11, 12], который позволяет ей выполнять наиболее приоритетные функции, однако при этом в неприоритетных могут наблюдаться количественные и качественные изменения, которые могут снижать адаптационные возможности к действию других факторов.
Одним из неблагоприятных факторов для рыб может быть паразитарная инвазия. Известно, что паразитарные инвазии у рыб могут приводить к изменению картины крови [13, 14]. Представляется интересным изучение одновременного действия этих двух факторов (хронического радиационного воздействия и паразитарной инвазии) на состояние эритропоэза у рыб, тем более что в доступной литературе авторами не найдено информации по данному вопросу.
Целью данной работы была оценка реакции эритропоэза по показателям периферической крови у рыб, обитающих в условиях хронического радиационного воздействия, на трипаносомную инвазию.
МАТЕРИАЛЫ И МЕТОДИКА
Район исследований
На р. Теча были организованы три станции отбора проб [10]. Станция РТ1 располагалась в верховье вблизи выселенного ранее населенного пункта С. Асанова (33 км ниже места исторического выпуска ЖРО ПО “Маяк”, в 5 км ниже плотины П-11, замыкающей каскад водоемов хранилищ жидких радиоактивных отходов). Станция РТ2 – на среднем участке реки, в 81 км ниже плотины П-11 вблизи населенного пункта Бродокалмак (109 км ниже места исторического выпуска ЖРО ПО “Маяк”). Станция РТ3 – в нижней части реки, в 184 км ниже плотины П-11, в 30 км выше впадения р. Теча в р. Исеть, вблизи населенного пункта Першинское (212 км ниже места исторического выпуска ЖРО ПО “Маяк”). Отлов рыбы проводили вблизи станций на участках реки длиной 3–5 км.
В качестве водотока сравнения использовалась р. Миасс (станция РМ), также относящаяся к Обь-Иртышской системе, русло которой проходит на расстоянии 20–100 км южнее русла р. Теча. Химический состав воды на исследуемых станциях рек Теча и Миасс в летний период 2012 г. был схожим (за исключением содержания радионуклидов); существенные отличия в значениях показателей воды двух рек выявлены лишь для содержания Cl– и HCO$_{3}^{ - }$ [10]. В целом в р. Теча отмечена более высокая минерализация воды по сравнению с водой р. Миасс. Содержание тяжелых металлов на станциях обеих рек соответствовало фоновым уровням их содержания в водоемах Челябинской области.
Отбор проб и пробоподготовка
В качестве объекта исследования использовали представителей популяций плотвы Rutilus rutilus (Linnaeus, 1758), окуня Perca fluviatilis (Linnaeus, 1758) и щуки Esox lucius (Linnaeus, 1758). Лов рыбы проводили электроудочкой SAMUS 725MP (Польша) весной во время нереста (апрель 2012 и 2013 г.) и летом во время нагула (август 2012 и 2013 г.). Видовое определение рыб проводили по руководству Л.С. Берга [15], определение возраста рыб – по руководству И.Ф. Правдина [16], пол определяли по гонадам при вскрытии рыб.
Гематологические исследования
В гематологических исследованиях у живой рыбы шприцем отбирали кровь из хвостовой вены. Определение количества клеток в периферической крови у рыб было выполнено с использованием счетчика форменных элементов крови “Пикоскель ПС-4М” (“НПФ Лабовэй”, Россия). Из цельной крови готовили мазки, которые фиксировали метанолом в течение 3 мин и затем окрашивали по Романовскому–Гимза [17]. Для определения клеточного состава крови в каждом препарате анализировали не менее 1000 клеток крови. По результатам вычисляли показатели относительного количества эритроцитов, эритроидных клеток различной степени зрелости, а также показатели абсолютного количества этих клеток в крови. Все препараты крови были исследованы на наличие трипаносом. Всего было проанализировано 526 мазков крови.
Дозы облучения рыбы
Уровень радиоактивного загрязнения в р. Теча снижается от верховья к устью реки [2]. На основе измерений концентраций радионуклидов в воде, донных отложениях, рыбе были рассчитаны индивидуальные мощности доз облучения для рыб р. Теча [4]. В табл. 1 представлены средние значения и коэффициенты вариации мощностей доз облучения рыб, обитающих на станциях РТ1, РТ2, РТ3.
Статистический анализ
При проведении статистического анализа использовали программное обеспечение R [18]. Рассчитывали средние арифметические значения показателей и их стандартную ошибку. Для оценки зараженности рыб кровепаразитами использовали показатель экстенсивности инвазии (встречаемости) – процентная доля зараженных трипаносомами особей, к общему числу обследованных рыб. Экстенсивность инвазии рассчитывали по формуле:
где n – число зараженных особей; N – число исследованных особей [19]. Для оценки статистической значимости отличий показателей в различных группах рыб применяли критерий Уилкоксона [20]. Оценку влияния видовой принадлежности, пола, возраста рыб, сезона отлова, мощности дозы облучения, места обитания (верховье реки, среднее и нижнее течение р. Теча), трипаносомной инвазии на показатели эритропоэза у рыб проводили с использованием дисперсионного многофакторного анализа [21].РЕЗУЛЬТАТЫ
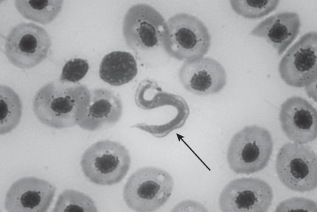
При анализе мазков крови у рыб из р. Теча и р. Миасс были обнаружены внеклеточные паразиты крови – трипаносомы (Trypanosoma).
Трипаносомы – это эндопаразиты рода простейших, класса жгутиковых (рисунок 1). Имеют веретеновидное тело, снабженное жгутиком. Между телом и жгутиком находится тонкая цитоплазматическая перепонка – ундулирующая мембрана, с помощью волнообразных движений которой трипаносома передвигается. Размножаются трипаносомы бесполым путем (продольным делением). Развитие происходит со сменой хозяев, которыми являются рыбы и пиявки. Заражение рыб происходит через кровососущих пиявок [22].
Поскольку подобных исследований по оценке сочетанного действия радиации и паразитарной инвазии на гемопоэз у рыб р. Теча не проводилось, то авторы сочли важным на первом этапе определить, существует ли взаимодействие этих факторов и каков его характер. С этой целью рыбы р. Теча и р. Миасс были распределены на группы: здоровые рыбы (незараженные трипаносомами) и больные рыбы (зараженные трипаносомами). Были рассчитаны индексы встречаемости трипаносом для исследуемых видов в уловах, а также в целом для всей выборки. В табл. 2 приведены суммарные данные встречаемости инвазии трипаносом у исследуемых видов рыб (плотва, окунь, щука) в уловах за 2012 и 2013 г. в летний и весенний периоды для всех станций отлова. Самый высокий уровень заболеваемости регистрировался у окуня (доля зараженных особей составила 45%), затем у щуки (доля зараженных особей составила 23%) и самый низкий у плотвы (доля зараженных особей составила 15%). В целом третья часть всех обследованных рыб была заражена трипаносомами (доля зараженных особей составила 29%). Как видно из таблицы, летом доля зараженных рыб более высокая, чем весной.
Таблица 2.
Показатели встречаемости инвазии трипаносом у рыб в уловах, суммарные данные за 2012–2013 гг.
| Сезон | Станции | Индекс встречаемости инвазии, % | |||
|---|---|---|---|---|---|
| плотва | окунь | щука | все виды | ||
| Весна | РМ | 0%; n = 33 | 31%; n = 45 | 10%; n = 10 | 17%; n = 88 |
| РТ3 | 4%; n = 32 | 0%; n = 33 | 0%; n = 15 | 2%; n = 80 | |
| РТ2 | 0%; n = 26 | 71%; n = 21 | 19%; n = 16 | 29%; n = 63 | |
| РТ1 | 9%; n = 26 | 55%; n = 20 | 13%; n = 9 | 29%; n = 55 | |
| Все станции | 3%; n = 117 | 39%; n = 119 | 12%; n = 50 | 20%; n = 286 | |
| Лето | РМ | 30%; n = 23 | 39%; n = 23 | 60%; n = 15 | 4%; n = 61 |
| РТ3 | 13%; n = 20 | 29%; n = 22 | 0%; n = 20 | 21%; n = 62 | |
| РТ2 | 14%; n = 22 | 64%; n = 22 | 0%; n = 10 | 31%; n = 54 | |
| РТ1 | 60%; n = 23 | 91%; n = 34 | 40%; n = 6 | 65%; n = 63 | |
| Все станции | 28%; n = 88 | 52%; n = 101 | 33%; n = 51 | 40%; n = 240 | |
| Весна + Лето | РМ | 13%; n = 56 | 34%; n = 68 | 40%; n = 25 | 27%; n = 149 |
| РТ3 | 8%; n = 52 | 19%; n = 55 | 0%; n = 35 | 12%; n = 42 | |
| РТ2 | 6%; n = 48 | 67%; n = 43 | 12%; n =26 | 30%; n = 117 | |
| РТ1 | 29%; n = 49 | 69%; n = 54 | 29%; n = 15 | 44%; n =118 | |
| Индекс встречаемости в среднем за весь период исследований | 15%; n = 205 | 45%; n = 220 | 23%; n = 101 | 29%; n = 526 | |
В р. Теча наиболее благополучная ситуация по заболеваемости рыб наблюдалась на станции РТ3. Станция РТ3 находится в нижнем, более полноводном и более быстром течении р. Теча. Возможно, более низкий уровень заражения рыб трипаносомами на станции РТ3 в большей степени обусловлен тем, что гидрологический режим (глубина реки, скорость течения и др.) на этом участке может затруднять прикрепление пиявок – переносчиков трипаносом, к рыбе-хозяину. Кроме этого, может иметь значение плотность популяции рыб на исследуемых станциях [23].
Многофакторный дисперсионный анализ с использованием главной линейной модели показал, что на экстенсивность трипаносомной инвазии у рыб статистически значимо влияет вид рыб (F = 30.3, р = 0.001), сезон отлова (F = 29.3, р = = 0.001), место обитания – верхнее, среднее, нижнее течение реки (F = 3.6, р = 0.015).
В целом в выборке, сформированной из уловов рыб трех видов со всех станций в 2012–2013 гг., присутствовали особи в возрасте от 0+ до 7+ (0+ – 3.6%; 1+ – 32.5%; 2+ – 33.7%; 3+ – 19.1%; 4+ – 7.8%; 5+ – 2.9%; 6+ – 1%; 7+ – 1%); распределение по полу было следующим – 53% самок и 47% самцов.
С целью выявления влияния факторов биологической природы и факторов окружающей среды на гемопоэз у рыб был выполнен многофакторный дисперсионный анализ, результаты которого представлены в табл. 3. Статистически значимое влияние на абсолютное количество клеток в периферической крови оказывали сезон отлова – весна или лето (F = 310; р = 4.60 × 10–54), трипаносомная инвазия (F = 4.71; р = 0.03) и мощность дозы облучения (F = 4.54; р = 0.03). Влияние видовой принадлежности, возраста, пола рыб оказалось статистически не значимым. Также не выявлено статистически значимого влияния на исследуемый показатель места обитания (верхнее/среднее/нижнее течение реки) и года отлова рыб. В работе [10] приведены результаты исследования эритропоэза у плотвы р. Теча, в которых показано, что адаптационные реакции на хроническое радиационное воздействие у плотвы выражаются в увеличении пролиферативной активности делящихся эритроидных клеток в периферической крови, что позволяет обеспечить организм функциональными клетками крови на уровне физиологической нормы (показатели в популяции сравнения из р. Миасс) при дозах 9 и 16 мкГр/сут, и является недостаточным при дозах свыше 108 мкГр/сут. При этом более выраженные эффекты регистрировались при обследовании рыб весной, но и летом эта тенденция сохранялась, т.е. физиологическое состояние рыб в различные периоды годичного цикла влияло на выраженность выявленного эффекта, но не на его направленность.
Таблица 3.
Результаты многофакторного дисперсионного анализа влияния биологических и средовых факторов на абсолютное количество клеток в периферической крови у рыб, суммарные данные за 2012–2013 гг.
| Факторы | Коэффициент Фишера (F) | Уровень значимости (р) |
|---|---|---|
| Пол | 0.09 | 0.91 |
| Вид | 2.06 | 0.13 |
| Возраст | 0.31 | 0.58 |
| Год отлова | 0.58 | 0.44 |
| Сезон отлова (весна/лето) | 310.5 | 4.6 × 10–54 |
| Трипаносомы | 4.71 | 0.03 |
| Мощность дозы | 4.54 | 0.03 |
| Место обитания (верхнее, среднее, нижнее течение реки) | 2.72 | 0.07 |
С учетом вышесказанного, с целью увеличения объема выборки и соответственно статистической силы авторы сочли возможным объединить в одну выборку данные о состоянии гемопоэза у рыб разных видов, возраста, пола, выловленных на всех станциях весной и летом в 2012 и 2013 г.
Как видно из табл. 4, у здоровых рыб из р. Миасс численность эритроцитов в периферической крови составила (1.66 ± 0.06) × 1012 кл./л, у здоровых рыб из р. Теча на станциях РТ2, РТ3 показатели количества эритроцитов в крови не отличались от показателя контроля (станция РМ). У здоровых рыб со станции РТ1 (наиболее радиоактивно загрязненный участок р. Теча, мощность дозы облучения рыб 108–150 мкГр/сут) регистрировалось статистически значимое снижение количества эритроцитов в периферической крови по отношению к контрольным здоровым рыбам на 26%.
Таблица 4.
Абсолютное количество клеток в периферической крови у здоровых и больных трипаносомозом рыб, суммарные данные за 2012–2013 гг., ×1012 кл./л
| Станция | Трипаносомная инвазия | Количество клеток (M ± m) | Количество эритроидных клеток (M ± m) |
|---|---|---|---|
| РМ | Здоровые животные | 1.85 ± 0.08 | 1.66 ± 0.06 |
| РТ3 | 1.87 ± 0.07 | 1.77 ± 0.07 | |
| РТ2 | 1.83 ± 0.08 | 1.64 ± 0.08 | |
| РТ1 | * 1.36 ± 0.09 | * 1.22 ± 0.06 | |
| Все станции | 1.75 ± 0.04 | 1.62 ± 0.04 | |
| РМ | Больные животные | 1.67 ± 0.12 | 1.52 ± 0.07 |
| РТ3 | †1.52 ± 0.22 | †1.38 ± 0.13 | |
| РТ2 | 1.73 ± 0.13 | 1.72 ± 0.12 | |
| РТ1 | 1.44 ± 0.09 | *# 1.29 ± 0.05 | |
| Все станции | †1.57 ± 0.06 | †1.45 ± 0.04 |
Примечание. Здесь и далее (M ± m) – средняя арифметическая величина и ее стандартная ошибка; статистически значимое отличие от группы сравнения при p < 0.05: * – отличия от показателя в группе сравнения здоровых рыб (РМ); # – отличия от показателя в группе сравнения больных рыб (РМ); † – отличия от показателя в аналогичной группе здоровых животных.
У больных рыб из р. Миасс, зараженных трипаносомами, количество эритроцитов в периферической крови не отличалось от показателя у здоровых рыб этой же реки и составляло (1.52 ± ± 0.07) × 1012 кл./л. У больных рыб со станций РТ3 и РТ2 количество эритроцитов не имело значимых отличий от показателя у больных рыб из р. Миасс, хотя у рыб со станции РТ3 отмечено статистически значимое снижение количества эритроцитов по сравнению со здоровыми рыбами с этой же станции. На станции РТ1 численность эритроцитов у больных рыб была статистически значимо ниже, чем у здоровых и больных рыб из р. Миасс, но не отличалась от показателя у здоровых рыб с этой же станции РТ1.
Данные о влиянии инвазии трипаносом на относительное и абсолютное количество эритроидных клеток различной степени зрелости в периферической крови у рыб приведены в табл. 5 и 6.
Таблица 5.
Влияние инвазии трипаносом на относительное количество эритроидных клеток разной степени зрелости в периферической крови у рыб, суммарные данные за 2012–2013 гг., (M ± m), %
| Станция | Трипаносомная инвазия | Эритробласты | Пронормоциты | Нормоциты | ПХЭ | НХЭ | Бластные клетки | Делящиеся клетки | Неделящиеся клетки |
|---|---|---|---|---|---|---|---|---|---|
| РМ | Здоровые животные | 0.059 ± 0.014 | 0.31 ± 0.07 | 12.8 ± 1.2 | 22.6 ± 1.0 | 62.0 ± 1.9 | 0.37 ± 0.08 | 13.7 ± 1.3 | 86.3 ± 1.3 |
| РТ3 | *0.124 ± 0.020 | *0.45 ± 0.06 | 15.3 ± 1.0 | 23.1 ± 0.6 | 57.8 ± 1.4 | *0.58 ± 0.07 | 16.6 ± 1.1 | 83.4 ± 1.1 | |
| РТ2 | *0.111 ± 0.020 | 0.33 ± 0.05 | 12.7 ± 1.3 | 22.2 ± 0.9 | 62.2 ± 2.0 | 0.44 ± 0.06 | 13.3 ± 1.3 | 86.7 ± 1.3 | |
| РТ1 | *0.160 ± 0.030 | *1.00 ± 0.30 | 13.7 ± 1.2 | 23.9 ± 1.2 | 58.0 ± 1.9 | *1.20 ± 0.40 | 15.7 ± 1.4 | 84.3 ± 1.4 | |
| Все станции | 0.110 ± 0.011 | 0.49 ± 0.07 | 13.8 ± 0.6 | 22.9 ± 0.4 | 59.9 ± 0.9 | 0.60 ± 0.07 | 14.9 ± 0.6 | 85.1 ± 0.6 | |
| РМ | Больные животные | 0.056 ± 0.015 | 0.46 ± 0.09 | 17.6 ± 2.3 | 20.6 ± 1.2 | 57.8 ± 3.2 | 0.52 ± 0.09 | 19.1 ± 2.4 | 80.9 ± 2.4 |
| РТ3 | 0.100 ± 0.050 | 0.48 ± 0.10 | 14.9 ± 3.0 | #27.7 ± 2.3 | 54.1 ± 2.8 | 0.58 ± 0.13 | 16.2 ± 3.2 | 83.8 ± 3.2 | |
| РТ2 | 0.065 ± 0.023 | 0.41 ± 0.11 | 16 ± 2.6 | 22.4 ± 1.6 | †57.2 ± 3.3 | 0.47 ± 0.12 | 17.3 ± 2.7 | 82.7 ± 2.7 | |
| РТ1 | †0.094 ± 0.023 | 0.51 ± 0.09 | †17.8 ± 1.3 | 22.9 ± 1.0 | †53.7 ± 1.6 | 0.60 ± 0.10 | 19.5 ± 1.4 | 80.5 ± 1.4 | |
| Все станции | †0.078 ± 0.013 | 0.47 ± 0.05 | †17.1 ± 1.0 | 22.6 ± 0.7 | †55.6 ± 1.4 | 0.55 ± 0.06 | #18.6 ± 1.1 | #81.4 ± 1.1 |
Таблица 6.
Влияние инвазии трипаносом на абсолютное количество эритроидных клеток разной степени зрелости в периферической крови у рыб, суммарные данные за 2012–2013 гг., (M ± m), ×1012 кл./л
| Станция | Трипаносомная инвазия | Эритробласты | Пронормоциты | Нормоциты | ПХЭ | НХЭ | Бластные клетки | Делящиеся клетки | Неделящиеся клетки |
|---|---|---|---|---|---|---|---|---|---|
| РМ | Здоровые животные | 0.00095 ± 0.00023 | 0.0052 ± 0.0010 | 0.232 ± 0.023 | 0.391 ± 0.021 | 1.07 ± 0.05 | 0.0060 ± 0.0010 | 0.239 ± 0.023 | 1.43 ± 0.05 |
| РТ3 | *0.0026 ± 0.0005 | *0.0088 ± 0.0013 | 0.281 ± 0.020 | 0.435 ± 0.022 | 1.08 ± 0.05 | *0.0112 ± 0.0015 | 0.293 ± 0.020 | 1.47 ± 0.06 | |
| РТ2 | 0.002 ± 0.0004 | 0.0051 ± 0.0008 | 0.208 ± 0.027 | 0.368 ± 0.027 | 1.01 ± 0.06 | 0.0073 ± 0.0011 | 0.220 ± 0.027 | 1.41 ± 0.08 | |
| РТ1 | *0.0019 ± 0.0004 | 0.0120 ± 0.0040 | 0.177 ± 0.017 | *0.320 ± 0.027 | *0.76 ± 0.04 | *0.0130 ± 0.0040 | 0.190 ± 0.017 | *1.03 ± 0.05 | |
| Все станции | 0.00189 ± 0.00021 | 0.0074 ± 0.0008 | 0.234 ± 0.011 | 0.389 ± 0.012 | 1.01 ± 0.03 | 0.0094 ± 0.0009 | 0.244 ± 0.012 | 1.37 ± 0.03 | |
| РМ | Больные животные | 0.00099 ± 0.00027 | 0.0069 ± 0.0013 | 0.260 ± 0.030 | 0.330 ± 0.022 | 0.96 ± 0.08 | 0.0080 ± 0.0013 | 0.270 ± 0.030 | 1.28 ± 0.08 |
| РТ3 | 0.0017 ± 0.0010 | 0.0065 ± 0.0013 | 0.240 ± 0.060 | 0.410 ± 0.050 | 0.82 ± 0.08 | 0.0081 ± 0.0019 | 0.250 ± 0.050 | 1.15 ± 0.10 | |
| РТ2 | 0.0015 ± 0.00060 | 0.0079 ± 0.0027 | 0.270 ± 0.040 | 0.410 ± 0.040 | 1.06 ± 0.10 | 0.0090 ± 0.0030 | 0.280 ± 0.040 | 1.4 ± 0.13 | |
| РТ1 | †0.0015 ± 0.0004 | 0.0079 ± 0.0016 | †0.248 ± 0.023 | 0.323 ± 0.020 | 0.77 ± 0.04 | 0.0094 ± 0.0017 | †0.257 ± 0.024 | #1.04 ± 0.05 | |
| Все станции | 0.00137 ± 0.00023 | 0.0075 ± 0.0009 | 0.255 ± 0.016 | 0.352 ± 0.014 | †0.89 ± 0.04 | 0.0088 ± 0.0011 | 0.264 ± 0.017 | †1.19 ± 0.04 |
У здоровых рыб на всех станциях р. Теча в два и более раза статистически значимо увеличено процентное содержание эритробластов в крови (табл. 5). Также у здоровых рыб р. Теча со станций РТ3 и РТ1 повышено процентное содержание пронормоцитов и в целом бластных клеток (эритробласты + пронормоциты) в крови по отношению к рыбам из р. Миасс. У больных рыб из р. Теча статистически значимое снижение процентного содержания эритробластов и НХЭ и повышение нормоцитов регистрировались на станции РТ1 по отношению к показателям здоровых рыб с этой же станции. Также регистрировалось снижение процентного содержания НХЭ у больных рыб со станций РТ1 и РТ2 по отношению к здоровым рыбам с этих же станций.
Показатели абсолютного количества эритроидных клеток различной степени зрелости в крови у больных и здоровых рыб из р. Миасс не имели значимых отличий (табл. 6). У здоровых рыб из р. Теча по сравнению со здоровыми рыбами из р. Миасс количество эритробластов в крови было в два раза выше (различия статистически значимы у рыб со станций РТ3 и РТ1, у рыб со станции РТ2 – не достигали статистической значимости; на станциях РТ1 и РТ3 у рыб в крови статистически значимо повышено количество бластных клеток (эритробласты + пронормоциты); у рыб со станции РТ1 выявлено статистически значимое снижение количества неделящихся клеток в крови на 28%.
У больных рыб из р. Теча показатели абсолютного количества эритроидных клеток различной степени зрелости в крови не имели значимых отличий от показателей у больных рыб из р. Миасс, за исключением статистически значимого снижения количества неделящихся клеток у рыб со станции РТ1.
При сравнении показателей абсолютного количества эритроидных клеток у больных и здоровых рыб из р. Теча статистически значимые отличия выявлены только у животных со станции РТ1: у больных рыб на 23% снижено содержание эритробластов, на 40% повышено содержание нормоцитов, на 35% повышено общее количество делящихся клеток. У больных рыб со станций РТ2 и РТ3 не зарегистрировано существенных отличий от показателей эритропоэза у здоровых рыб с соответствующих станций.
В целом различия в показателях состояния эритропоэза у больных рыб из р. Теча по отношению к больным рыбам из р. Миасс менее выражены, чем изменения в эритропоэзе у здоровых рыб из р. Теча по отношению к здоровым рыбам из р. Миасс.
Таким образом, хроническое радиационное воздействие на здоровых рыб вызывает увеличение содержания в периферической крови эритроидных бластов, которое позволяет обеспечить количество эритроцитов в крови на уровне контроля (показатели у рыб р. Миасс) в среднем и нижнем течении р. Теча (мощность дозы 3–16 мкГр/сут) и является недостаточным при мощности дозы свыше 100 мкГр/сут: у рыб со станции РТ1 регистрируется статистически значимое снижение количества эритроцитов в крови по отношению к контролю.
С использованием дисперсионного многофакторного анализа выполнена оценка влияния хронического радиационного воздействия и паразитарной инвазии на состояние эритропоэза у рыб (табл. 7). Как видно из таблицы, трипаносомная инвазия оказывает статистически значимое влияние на процентный состав эритроидных клеток различной степени зрелости в периферической крови, а именно на содержание пролиферирующих клеток (эритробласты, нормоциты, в целом все делящиеся клетки), а также на содержание зрелых нормохроматофильных эритроцитов. Мощность дозы облучения значимо влияет на процентное содержание эритробластов и пронормоцитов, на абсолютное количество эритроидных клеток в целом, а также на численность клеток в различных компартментах (эритробласты, пронормоциты, ПХЭ, НХЭ) в периферической крови у рыб, обитающих в радиоактивно загрязненной реке.
Таблица 7.
Результаты многофакторного дисперсионного анализа влияния биологических и средовых факторов на абсолютное количество клеток в периферической крови у рыб со станции РТ1 р. Теча, суммарные данные за 2012–2013 гг.
| Факторы | Коэффициент Фишерра (F) | Уровень значимости (р) |
|---|---|---|
| Пол | 0.22 | 0.8 |
| Вид | 1.71 | 0.18 |
| Возраст | 0.08 | 0.78 |
| Год отлова | 3.54 | 0.06 |
| Сезон отлова (весна/лето) | 69.01 | 5.9 × 10–15 |
| Трипаносомы | 6.05 | 0.01 |
| Мощность дозы | 43.89 | 2.06 × 10–10 |
Также многофакторный анализ показал, что совместное действие трипаносомной инвазии и радиации может приводить к модификации эффектов этих факторов: в основном модифицирующее действие проявляется в изменении содержания делящихся клеток (относительное количество пронормоцитов, абсолютное количество нормоцитов и суммарное количество делящихся клеток).
Для прояснения роли исследуемых факторов (радиация и трипаносомная инвазия) в работе выполнен анализ влияния сочетанного воздействия радиации и трипаносом на эффективность эритропоэза у рыб со станции РТ1 р. Теча по отношению к рыбам из р. Миасс (табл. 8).
Таблица 8.
Результаты многофакторного дисперсионного анализа влияния мощности дозы облучения и трипаносомной инвазии на эритропоэз у рыб со станции РТ1, суммарные данные за 2012–2013 гг.
| Показатель | Мощность дозы | Трипаносомы | Мощность дозы + трипаносомы | |||
|---|---|---|---|---|---|---|
| F | p | F | p | F | p | |
| Относительное количество клеток в периферической крови, % | ||||||
| Эритробласты | 5.5 | 1.9 × 10–2 | 5.9 | 1.6 × 10–2 | – | – |
| Пронормоциты | 15.6 | 9.3 × 10–5 | – | – | 8.7 | 3.3 × 10–3 |
| Нормоциты | – | – | 11.9 | 6.1 × 10–4 | – | – |
| НХЭ | – | – | 9.6 | 2.0 × 10–3 | – | – |
| Делящиеся клетки | – | – | 12.2 | 1.0 × 10–3 | – | – |
| Абсолютное количество клеток в периферической крови, ×1012/л | ||||||
| Эритробласты | 4.3 | 3.9 × 10–2 | – | – | – | – |
| Пронормоциты | 5.5 | 2.0 × 10–2 | – | – | – | – |
| Нормоциты | – | – | – | – | 3.6 | 2.7 × 10–2 |
| ПХЭ | 14.3 | 1.8 × 10–2 | – | – | – | – |
| НХЭ | 34.1 | 1.1 × 10–8 | – | – | – | – |
| Делящиеся клетки | – | – | – | – | 3.10 | 4. × 10–2 |
| Все эритроидные клетки | 38.7 | 1.3 × 10–9 | – | – | – | |
В анализ были взяты рыбы, выловленные на станции РТ1 и РМ. Распределение по возрасту в этой выборке было следующим: 0+ – 3.8%; 1+ –30.1%; 3+ – 39.79%; 4+ – 15.23%; 5+ – 6.57%; 6+ – 0.35%; 7+ – 0.35%. В выборке 48% составляли самки, 52% – самцы. В этом случае многофакторный анализ показал статистически значимое влияние на количество клеток в периферической крови у рыб следующих факторов – сезона, трипаносом, мощности дозы и отсутствие влияния вида, пола, возраста рыб и года отлова, поэтому здесь также был использован весь массив гематологических данных (абсолютные значения), полученных в 2012 и 2013 г. для трех видов рыб со станций РТ1 и РМ.
Оценивали продуктивность бластных клеток (эритробласты + пронормоциты) по соотношению нормоциты/бластные клетки; продуктивность нормоцитов по соотношению (ПХЭ + НХЭ)/нормоциты; продуктивность всех делящихся клеток по соотношению (ПХЭ + НХЭ)/(эритробласты + пронормоциты + нормоциты). В качестве физиологической нормы были приняты коэффициенты соотношения этих показателей у здоровых рыб из р. Миасс. Затем рассчитывали соотношение этих коэффициентов для больных рыб со станции РМ, здоровых и больных рыб со станции РТ1 по отношению к соответствующим коэффициентам у здоровых рыб со станции РМ (табл. 9). Эти отношения использовали для оценки эффективности эритропоэза у рыб с учетом воздействия исследуемых факторов: трипаносмы, радиационное воздействие, сочетанное действие этих двух факторов. Также были рассчитаны коэффициенты эффективности эритропоэза при аддитивном взаимодействии радиационного фактора и трипаносом как произведение коэффициентов при раздельном действии факторов.
Таблица 9.
Расчетные показатели эффективности эритропоэза у рыб со станции РТ1, суммарные данные для исследуемых видов рыб за 2012–2013 гг.
| Факторы воздействия | Отношение коэффициентов эффективности эритропоэза | ||
|---|---|---|---|
| (эритробласты + + пронормоблаты) → → нормоциты | нормоциты → → (ПХЭ + НХЭ) | (эритробласты + + пронормобласты + + нормоциты) → → (ПХЭ + НХЭ) | |
| Трипаносомы (РМ больные/РМ здоровые) | 84% (потери 16%) | 80% (потери 20%) | 79% (потери 21%) |
| Радиация (РТ1 здоровые/РМ здоровые) | 35% (потери 65%) | 94% (потери 6%) | 91% (потери 9%) |
| Трипаносомы + радиация (РТ1 больные/РМ здоровые) | 68% (потери 32%) | 68% (потери 32%) | 68% (потери 32%) |
| Расчетный ожидаемый аддитивный эффект Трипаносомы + + радиация | 30% (потери 70%) | 75% (потери 25%) | 72% (потери 28%) |
Сравнение показателей по отношению к здоровым рыбам из р. Миасс оценивает влияние на эритропоэз следующих факторов: (РМ больные/РМ здоровые) – действие трипаносом; (РТ1 здоровые/РМ здоровые) – действие радиации; (РТ1 больные/РМ здоровые) – сочетанное действие радиации и трипаносом.
Как видно из табл. 9, заражение рыб р. Миасс трипаносомами приводит к снижению до 84% продуктивности бластных эритроидных клеток ((эритробласты + пронормоблаты) → нормоциты) по отношению к здоровым рыбам из этой же реки: при одинаковом количестве бластных клеток у больных рыб образуется нормоцитов на 16% меньше, чем у здоровых рыб. Расчетные потери продукции в ряду нормоциты → зрелые клетки (НХЭ + ПХЭ) у больных рыб из р. Миасс составили 20%. В целом же потери в эритропоэзе ((эритробласты + пронормоблаты + нормоциты) → → (ПХЭ + НХЭ)) у больных рыб по отношению к здоровым составили 21%, при этом потери были практически одинаковыми во всех компартментах эритропоэза.
При хроническом радиационном воздействии на рыб в диапазоне мощностей доз 100–150 мкГр/сут в эритропоэзе наблюдается другая картина. У здоровых рыб из р. Теча наибольшие потери в эритропоэзе наблюдались в ряду бластные клетки (эритробласты + пронормоблаты) → → нормоциты и составили 65% по отношению к продуктивности эритропоэза у здоровых рыб из р. Миасс. Клеточные потери в ряду нормоциты → → (ПХЭ+НХЭ) составили всего лишь 6% по отношению к контролю. В целом потери в эритро-поэзе ((эритробласты + пронормоблаты + нормоциты) → (ПХЭ+НХЭ)) у больных рыб из р. Теча по отношению к здоровым рыбам из р. Миасс составили 9%.
При сочетанном действии факторов (трипаносомы + радиация) клеточные потери в эритропоэзе в целом ((эритробласты + пронормоблаты + нормоциты) → (ПХЭ + НХЭ)), а также в ряду (нормоциты → (ПХЭ+НХЭ)), были выше, чем при действии каждого из факторов по отдельности и выше, чем рассчитанные для аддитивного взаимодействия факторов, и составили 32%. В то же время сочетанное действие трипаносомной инвазии и радиации повысило потери в ряду (эритробласты + пронормоблаты) → нормоциты по отношению к действию трипаносомной инвазии, но снизило потери по отношению к радиационному воздействию. То есть взаимодействие этих факторов по показателю снижения эффективности в ряду (эритробласты + пронормобласты) → нормоциты носит антагонистический характер.
Следовательно, при действии радиации на рыб наибольшие потери продукции в эритропоэзе наблюдаются среди клеток с высоким уровнем пролиферации (65%), потери среди более дифференцированных клеток составляют не более 10% по отношению к контролю. Токсины трипаносом не обладают избирательным действием – наблюдается примерно одинаковый по отношению к контролю уровень потерь (около 20%) клеток различной степени зрелости.
ОБСУЖДЕНИЕ
Результаты данного исследования позволяют полагать, что при обитании рыб в условиях хронического радиационного воздействия в диапазоне мощностей доз 3–150 мкГр/сут сочетанное действие двух факторов (радиации и трипаносомной инвазии) на эритропоэз характеризуется антагонистическим взаимодействием на продуктивность бластных клеток и аддитивным взаимодействием на продукцию более дифференцированных (нормоциты) клеток и количество зрелых эритроцитов.
Выявленное в данном исследовании увеличение количества бластных клеток в периферической крови у рыб из р. Теча может являться компенсаторной реакцией на радиационно-индуцированную гибель эритроцитов. При инвазии трипаносом также может отмечаться компенсаторная реакция в эритропоэзе, выражающаяся в повышении пролиферативной активности эритроидных клеток. Живя в плазме крови, питаясь диффузно органическими веществами, трипаносомы выделяют в кровь ядовитые вещества – токсины (гемолизины), которые разрушают эритроциты крови [24]. В ответ на разрушение эритроцитов в гемопоэзе запускается компенсаторная интенсификация эритропоэза, которая проявляется обычно возрастанием содержания делящихся клеток в кроветворных органах. По-видимому, оба фактора (трипаносомы и радиация) действуют однонаправленно – стимулируют пролиферацию бластных клеток, что повышает их количество и объясняет антагонистическое взаимодействие при сочетанном воздействии облучения и трипаносомной инвазии.
Такая перестройка в эритропоэзе обеспечивает содержание эритроцитов в периферической крови на уровне физиологической нормы у рыб со станций РТ3 и РТ2 (диапазон мощностей доз облучения 3–16 мкГр/сут), но является недостаточной при радиационном воздействии, характерном для станции РТ1 – мощность дозы облучения 100–150 мкГр/сут.
Зрелые эритроциты достаточно радиоустойчивы – радиационно-индуцированные потери в этом пуле у здоровых рыб из р. Теча незначительные. Потери зрелых эритроцитов при сочетанном действии соответствуют аддитивному взаимодействию исследуемых факторов, что, вероятно, связано с тем, что цитотоксическое действие радиации и трипаносом имеет различные механизмы: основной мишенью для радиации в клетке являются молекулы ДНК, а основной мишенью токсинов трипаносом являются мембраны [24], поэтому эффекты при совместном действии этих факторов суммируются.
ВЫВОДЫ
1. На уровень зараженности рыб трипаносомами в р. Теча и р. Миасс статистически значимое влияние оказывают видовая принадлежность рыб, сезон отлова, место обитания: летом доля зараженных рыб более высокая, чем весной; самый высокий уровень заболеваемости у окуня, затем у щуки и самый низкий у плотвы; уровень заболеваемости рыб в р. Теча снижается от верхнего течения к более полноводному низовью.
2. У больных рыб из водотока сравнения р. Миасс (РМ), зараженных трипаносомами, количество эритроцитов значимо не отличалось от показателя у здоровых рыб этой же реки. У больных рыб радиоактивно загрязненной р. Теча на станции РТ1 (верхнее течение, мощность дозы 108–150 мкГр/сут) численность эритроцитов значимо не отличалась от показателя у здоровых рыб с этой же станции, но была статистически значимо ниже, чем у здоровых и у больных рыб из р. Миасс. У здоровых и больных рыб р. Теча на станциях РТ2 (среднее течение, мощность дозы 9–16 мкГр/сут), РТ3 (нижнее течение, мощность дозы 3–9 мкГр/сут) показатели количества эритроцитов в крови значимо не отличались от показателя контроля (РМ).
3. У здоровых рыб на всех станциях р. Теча статистически значимо увеличено процентное содержание эритробластов, прононормоцитов и в целом бластных клеток (эритробласты + пронормоциты) в крови по отношению к рыбам из р. Миасс. У больных рыб из р. Теча статистически значимое увеличение процентного содержания эритробластов и нормоцитов по отношению к контролю регистрируется только на станции РТ1.
4. Статистически значимые отличия абсолютного количества эритроидных клеток в периферической крови у больных и здоровых рыб из р. Теча выявлены только у животных со станции РТ1: у больных рыб на 23% снижено содержание эритробластов, на 40% повышено содержание нормоцитов; на 35% повышено общее количество делящихся клеток по отношению к здоровым рыбам этой же станции. У больных рыб со станций РТ2 и РТ3 не зарегистрировано значимых отличий от показателей эритропоэза у здоровых рыб с соответствующих станций.
5. При проведении дисперсионного анализа выявлено, что трипаносомная инвазия статистически значимое влияние оказывает на процентный состав эритроидных клеток в периферической крови: на содержание пролиферирующих клеток (эритробласты, нормоциты, в целом все делящиеся клетки), а также на содержание зрелых нормохроматофильных эритроцитов; мощность дозы облучения статистически значимо влияет на процентное содержание эритробластов и пронормоцитов, на абсолютное количество эритроидных клеток в целом, а также на численность клеток в различных компартментах (эритробласты, пронормоциты, ПХЭ, НХЭ) в периферической крови у рыб, обитающих в радиоактивно-загрязненной реке; совместное воздействие трипаносомной инвазии и радиации может приводить к модификации эффектов в делящихся пулах кроветворения.
6. При хроническом радиационном воздействии на рыб с мощностью дозы 100–150 мкГр/сут наибольшие потери продукции в эритропоэзе наблюдаются среди клеток с высоким уровнем пролиферации (65%), потери среди неделящихся клеток составляют не более 10% по отношению к контролю. Токсины трипаносом вызывают примерно одинаковый по отношению к контролю уровень потерь в различных компартментах эритропоэза (около 20% клеток различной степени зрелости). При сочетанном действии радиации и трипаносом наблюдается антагонистическое взаимодействие факторов на продуктивность бластных клеток и аддитивное действие на содержание неделящихся клеток в периферической крови.
7. Трипаносомная инвазия у рыб модифицирует радиационно-индуцированные изменения в гемопоэзе. При оценке действия радиационного фактора на гемопоэз необходимо учитывать фактор инвазии рыб трипаносомами.
Список литературы
Последствия радиоактивного загрязнения реки Теча / Под ред. проф. А.В. Аклеева. Челябинск: Книга, 2016. 400 с.
Трапезников А.В., Позолотина В.Н., Молчанова И.В. и др. Радиоэкологическая характеристика речной системы Теча–Исеть // Экология. 2000. № 4. С. 248–256.
Pryakhin E.A., Tryapitsina G.A., Osipov D.I. et al. Cha-racterization of biocenoses in the storage reservoirs of liquid radioactive wastes of mayak pa. initial descriptive report // J. Environ. Radioactiv. 2016. T. 151. C. 449–460.
Shishkina E.A., Pryakhin E.A., Popova I.Ya. et al. Eva-luation of distribution coefficients and concentration ratios of 90Sr and 137Cs in the Techa river and the Miass river // J. Environ.Radioact. 2016. V. 158–159. P. 148–163.
Марей А.Н., Ильин Д.И., Кардеева А.А. и др. Влияние промышленных стоков завода им. Д.И. Менделеева, сбрасываемых в р. Теча, на санитарные условия жизни и здоровье населения прибрежных пунктов. Отчет // Вопр. радиац. безопасности. 2009. № 2. С. 55–71.
Трапезников А.В., Трапезникова В.Н. Пресноводная радиоэкология. М.: ФГУП “Академический научно-издательский, производственно-полиграфический и книгораспространительский центр “Наука”, 2012. 544 с.
Методы исследований токсичности на рыбах: Пер. с нем. / Под ред. В.И. Лукьяненко. М.: Агропромиздат, 1985. 117 с.
Токсикозы рыб с основами патологии: Справочная книга / Сост. Н.М. Аршаница, М.А. Перевозников. СПб.: ФГНУ “ГосНИОРХ”, 2006. 178 с.
Житенева Л.Д., Полтавцева Т.Г., Рудницкая О.А. Атлас нормальных и патологически измененных клеток крови рыб. Ростов Н/Д: Кн. изд-во, 1989. 112 с.
Тряпицына Г.А., Осипов Д.И., Егорейченков Е.А. и др. Оценка состояния эритропоэза у плотвы (Rutilus rutilus) радиоактивно загрязненной реки Теча // Радиац. биология. Радиоэкология. 2017. Т. 5. № 1. С. 98–107.
Горизонтов П.Д., Белоусова О.И., Федотова М.И. Стресс и система крови. М.: Медицина, 1983. 240 с.
Шибкова Д.З., Аклеев А.В. Адаптационно-компенсаторные реакции системы кроветворения при хроническом радиационном воздействии. М.: ТОО «Издательство “Радэкон”», 2006. 346 с.
Тромбицкий И.Д. Картина крови прудовых рыб в норме и при паразитарных заболеваниях: Дис. … канд. биол. наук. Рыбное, 1984. 229 с.
Хамнуева Т.Р. Разнообразие и экология кинетопластид (Kinetoplastida: Kinetoplastidea) – паразитов рыб озера Байкал: Автореф. дис. … канд. биол. наук. М., 2001. 19 с.
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. Ч. 2. М.–Л.: Изд-во АН СССР, 1949. С. 467–925.
Правдин И.Ф. Руководство по изучению рыб (преимущественно пресноводных) / Под ред. П.А. Дрягина, В.В. Покровского. М.: Пищевая пром-ть, 1966. 376 с.
Микроскопическая техника: Руководство / Под ред. Д.С. Саркисова, Ю.Л. Перова. М.: Медицина, 1996. 544 с.
R Core Team. R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing, 2015. URL: https://www.R-project.org/
Хованский И.Е., Млынар Е.В., Кавтарадзе Т.М., Кошкин М.А. Паразитологические индикаторы экологических условий обитания рыб // Фундам. исследования. 2014. № 9 (ч. 2). С. 345–348.
Hollander M., Wolfe D.A., Chicken E. Nonparametric Statistical Methods. Hoboken, New Jersey, United States of America: John Wiley & Sons, 2014. P. 115–133.
Chambers J.M. // Statistical Models in S / Eds J.M. Chambers, T.J. Hastie. London, Great Britain: Chapman & Hall, 1997. P. 95–144.
Хайбулаев К.Х., Гусейнов М.А. Изучение развития трипаносом (Trypanosoma) и криптобий (Cryptobia) карпа и линя в пиявке Piscícola geómetra // Паразитология. 1985. Т. 19. № 1. С. 75–77.
Хамнуева Т.Р., Пронин Н.М. Особенности гостального и пространственного распределения трипаносом и криптобий (Kinetoplastidea) – паразитов рыб озера Байкал // Сиб. экол. журн. 2003. Т. 10. № 3. С. 273–278.
Kallinikova V.D., Matekin P.V., Ogloblina T.A. et al. Anticancer properties of flagellate protozoan Trypanosoma cruzi Chagas, 1909. // Izv. Akademii Nauk. Ser. Biol. 2001. № 3. P. 299–311.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология