Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 161-169
РАДИОМИТИГАТОРЫ: КЛАССИФИКАЦИЯ, ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА, ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ
В. И. Легеза 1, А. Н. Гребенюк 2, *, И. С. Драчёв 1
1 Государственный научно-исследовательский испытательный институт военной медицины
Министерства обороны РФ
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
Санкт-Петербург, Россия
* E-mail: grebenyuk_an@mail.ru
Поступила в редакцию 11.07.2018
Аннотация
Предложена классификация радиомитигаторов – противолучевых средств, предназначенных для предупреждения или снижения выраженности клинических проявлений острого радиационного синдрома, а также его отсроченных и отдаленных последствий. В предлагаемой классификации радиомитигаторы, используемые для профилактики и лечения ближайших и отдаленных клинических проявлений острой лучевой болезни, подразделены на следующие основные группы: средства борьбы с костномозговым синдромом; средства борьбы с желудочно-кишечным синдромом; средства борьбы с местными и субтотальными проявлениями лучевых поражений; средства профилактики и лечения отсроченных и отдаленных последствий. Приведен перечень и дана краткая характеристика наиболее перспективных радиомитигаторов из групп цитокинов, ростовых факторов, антиоксидантов, иммуномодуляторов, аналогов стероидных гормонов, блокаторов апоптоза.
Радиомитигаторы – относительно новое понятие в медицинской (клинической) радиологии и радиационной фармакологии, пока еще редко использующееся в отечественных публикациях. Термин достаточно широко представлен в зарубежной литературе, где понятие “радиомитигатор” (от англ. to mitigate – смягчать, ослаблять) означает химическое или биологическое вещество, способное при введении в организм в ранние сроки (часы, сутки) после радиационного воздействия оказывать лечебный эффект, проявляющийся в снижении повреждающего действия ионизирующих излучений на клетки критических систем организма, прежде всего, гематоиммунной системы [1]. По определению М.В. Васина [2], радиомитигаторы – это противолучевые препараты, которые реализуют свой эффект на системном уровне путем ускорения пострадиационного восстановления радиочувствительных тканей через активацию ряда провоспалительных сигнальных путей и усиление секреции гемопоэтических ростовых факторов, применяемые, в том числе, в ранние сроки после облучения до развития клинических проявлений острого лучевого поражения как лекарственные средства неотложной и ранней терапии радиационных поражений. Предполагается, что в системе медицинской противолучевой защиты радиомитигаторы занимают место между радиопротекторами быстрого (экстренного) действия и средствами поддерживающей и заместительной терапии, применяемыми при оказании специализированной медицинской помощи в стационаре [3, 4].
В настоящем сообщении предлагается принципиально новое определение радиомитигаторов как химических или биологических соединений, обладающих свойством снижать выраженность как острых, так и отдаленных (отсроченных) эффектов лучевого поражения при использовании до манифестации их клинических проявлений.
Новизна этого определения состоит в том, что она позволяет объединить в единую группу целый ряд противолучевых средств, ранее принадлежащих к различным классам, но обладающих сходным конечным эффектом – повышением радиорезистентности клеток и тканей и ускорением (оптимизацией) процессов их пострадиационной репарации. В частности, это относится к радиопротекторам и средствам профилактики отдаленных детерминистских и стохастических последствий облучения.
Согласно предлагаемой классификации радиомитигаторы подразделяются на группы средств, ослабляющие выраженность:
– острых эффектов облучения (костномозгового и желудочно-кишечного синдромов);
– местных лучевых поражений;
– отдаленных (отсроченных) детерминистских и стохастических последствий облучения.
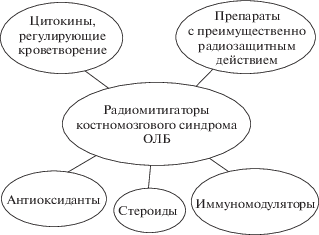
Наибольшее число радиомитигаторов относится к группе средств, предупреждающих или снижающих выраженность клинико-гематологических проявлений костномозгового синдрома острой лучевой болезни (ОЛБ). Как видно из рисунка 1, в их число входят препараты с преимущественно радиозащитным действием, иммуномодуляторы, цитокины и гематопоэтические ростовые факторы, стероиды и антиоксиданты.
Из радиопротекторов, обладающих также определенным лечебным эффектом при раннем применении после облучения, наиболее известны амифостин (гаммафос, этиол) и препарат Б-190 (индралин). Амифостин применяется при химиолучевой терапии онкологических больных для снижения лучевого поражения здоровых тканей, попадающих под действие ионизирующего излучения при радиотерапии, а также защиты их от цитотоксического эффекта химиотерапевтических противоопухолевых препаратов. Результаты клинических исследований эффективности препарата в условиях радиотерапии онкологических больных свидетельствуют, что введение радиопротектора способствует снижению лучевого повреждения кожи, слизистой оболочки кишки, легких и слюнных желез человека [5].
Показано, что этиол способствует существенному снижению частоты осложнений при радиотерапии больных раком в области головы и шеи, проявляющихся ксеростомией. Величина фактора изменения дозы (ФИД) этиола по снижению тяжести лучевого поражения слюнных желез у человека составляет 1.37 [6].
Индралин – α1-адреномиметик прямого действия, проявляет противолучевую активность уже с первых минут после его парентерального введения. Максимальный эффект отмечается через 5–10 мин после парентерального или 10–15 мин после перорального введения [7]. Препарат обладает также умеренно выраженным радиомитигирующим действием [8].
Наиболее многочисленную группу радиомитигаторов костномозгового синдрома ОЛБ составляют препараты с преимущественным действием на иммунную систему. Неоспорим приоритет отечественных ученых в доказательстве противолучевых свойств иммуномодуляторов, выделенных из природных биополимеров микробного происхождения (прежде всего полисахаридов грамотрицательных микроорганизмов). Результаты этих исследований послужили основанием для разработки направления, известного как “поиск средств ранней патогенетической терапии радиационных поражений” [9].
Оказалось, что противолучевой (радиозащитной и лечебной) активностью обладают не только препараты цельных микробных клеток (живых или убитых), но и различные их компоненты. Так, довольно выраженное радиомитигирующее действие в эксперименте оказывают вакцины (брюшнотифозная, чумная, туляремийная, бруцеллезная, сибиреязвенная, гриппозная и др.), кишечная и дизентерийная палочки, сальмонеллы тифа и паратифов, а также полисахариды – компоненты микроорганизмов (продигиозан, протейный эндотоксин, брюшнотифозный эндотоксин, эндотоксин кишечной палочки и др.) [10, 11].
Противолучевой эффект высокомолекулярных соединений природного происхождения составляет примерно 40–50% при профилактическом применении и 50–70% в условиях раннего лечебного введения. Максимальное противолучевое действие отмечено у вакцинных препаратов из бактерий кишечно-тифозной группы (брюшнотифозная и паратифозная палочки, протей, кишечная палочка), а также полисахаридных и белково-полисахаридных компонентов этих микробов. Эффект их проявляется в диапазоне доз излучения, вызывающих костномозговую форму ОЛБ, при превышении минимальной абсолютно летальной дозы противолучевое действие резко снижается. Оптимальными сроками для проявления противолучевых свойств радиомитигаторов бактериального происхождения являются (в эксперименте) 24 ч до и первые часы после облучения, при этом эффект повышения выживаемости характеризуется отсутствием видовой специфичности, т.е. проявляется практически у всех видов исследованных животных [10].
Основным фактором, ограничивающим практическое использование перечисленных соединений в качестве противолучевых средств (хотя некоторые из них, например, продигиозан и протейная вакцина разрешены к медицинскому применению) является наличие довольно выраженных нежелательных побочных эффектов (гиподинамия, нарушение гемодинамики, гипертермия, головная боль, недомогание и др.). Этих свойств в значительной степени лишены такие радиомитигаторы-иммуномодуляторы как дезоксинат (натриевая соль ДНК, полученная из молок осетровых рыб), который используется в настоящее время при лечении гипо- и апластических состояний системы крови, вызванных противоопухолевой терапией [12], и транслам – полисахарид бурых водорослей Laminaria cichorioides [13].
Выраженные радиомитигирующие свойства обнаружены у CBLB502, выделенного из жгутиков Salmonella enterica – флагеллина [14]. В опытах на грызунах установлено, что в условиях профилактического введения (за 30 мин до радиационного воздействия) CBLB502 способствует предотвращению развития острой лучевой болезни при поглощенной дозе 10 и 13 Гр. Кроме того, этот препарат почти в 2 раза увеличивает среднюю продолжительность жизни животных, облученных в дозе 17 Гр. ФИД для CBLB502 в этих экспериментах оказался равным 1,6. Эксперименты, проведенные на обезьянах, также подтвердили высокие радиозащитные свойства CBLB502.
В ходе первой фазы клинических исследований CBLB502, получившего название Protectan CBLB502 (Cleveland BioLabs, Inc.), а в дальнейшем коммерческое наименование Entolimod™, установлена его удовлетворительная переносимость (основной побочный эффект – умеренно выраженные проявления гриппоподобного синдрома, самопроизвольно проходящие в течение суток). Предполагается, что в случае положительных результатов дальнейших этапов клинических испытаний и соответствующего разрешения Федерального управления по контролю за качеством пищевых продуктов и лекарственных препаратов США (US FDA) фармакологическое средство Entolimod™ уже в ближайшие годы будет разрешено к медицинскому применению в качестве радиопротектора при лучевой терапии опухолей и в случае угрозы облучения в высоких дозах при ядерном взрыве или радиационной аварии [14].
Разработанный в Российской Федерации рекомбинантный флагеллин также обладает радиозащитными свойствами [15]. Более высокую радиозащитную эффективность по критериям выживаемости облученных мышей демонстрировал рекомбинантный флагеллин с делетированным центральным доменом белка, хотя и полноразмерный вариант флагеллина также защищал животных от лучевой гибели. Выраженность радиозащитного эффекта рекомбинантных флагеллинов при однократном профилактическом применении близка к таковой рекомбинантного интерлейкина-1β. В ходе проведенных исследований показано, что механизм радиозащитного действия флагеллина связан со стимуляцией гемопоэза.
Одно из важнейших мест среди костномозговых радиомитигаторов занимают цитокины-полипептиды, продуцируемые различными типами гематопоэтических клеток и регулирующими их рост, дифференцировку и функциональную активность [16, 17].
К числу цитокинов-радиомитигаторов следует отнести прежде всего интерлейкин-1β (ИЛ-1β) и его отечественный рекомбинантный препарат – беталейкин [18]. Установлено, что он обладает как радиозащитными (при введении за 18–24 ч до облучения), так и лечебными противолучевыми свойствами (при введении в первые минуты–часы после радиационного воздействия) [18, 19]. В настоящее время беталейкин разрешен к медицинскому применению в качестве средства лечения миелодепрессии, обусловленной химио- и лучевой противоопухолевой терапией, а также средства экстренной терапии при аварийном переоблучении человека.
Радиомитигирующей эффективностью обладает также рекомбинантный человеческий тромбопоэтин (ТПО). В эксперименте отмечено выраженное противолучевое действие ТПО, которое проявляется уже при однократном введении препарата в первые 6 ч после облучения [20]. Радиомитигирующими свойствами характеризуется и новая перспективная группа препаратов ТПО-миметиков, представленная в настоящее время такими медикаментами как ромипластин (амджек), элтромбопаг (револейд) [21]. Последний, являясь низкомолекулярным непептидным агонистом рецепторов ТПО, через трансмембранный домен рецептора активизирует другой путь транскрипции сигнала, нежели нативный тромбопоэтин. В экспериментах на облученных в дозе СД90/30 мышах однократное профилактическое применение элтромбопага за 24 ч до облучения, во втором случае – через 6 ч после облучения, характеризовалось увеличением выживаемости лабораторных животных относительно контроля до 69 и 60% соответственно [22]. Немаловажно и то обстоятельство, что ТПО значительно увеличивает эффективность других гемопоэтических ростовых факторов, в частности гранулоцитарного колониестимулирующего фактора (Г-КСФ) [23] и гранулоцитарно-макрофагального КСФ [24].
Радиомитигирующие эффекты обнаружены также у фактора стволовой клетки (ФСК) и у комбинаций различных цитокинов: ИЛ-1β + + ГМ-КСФ, ИЛ-3 + ИЛ-6, ИЛ-6 + Г-КСФ и др. [25]. Наиболее выраженный радиомитигирующий эффект наблюдали в случае двукратного (через 2 и 24 ч после облучения в дозе СД90/30) введения облученным мышам четырех- (ФСК, ТПО, ИЛ-3 и фактор рецептора Flt‑3) или пятикомпонентного “цитокинового коктейля” (ФСК, ТПО, ИЛ-3, Flt-3 и стромальный фактор развития) – выживаемость животных удалось увеличить до 80–90% при 100%-ной гибели в контроле.
Среди радиомитигаторов-стероидов большой интерес представляет препарат из группы неандрогенных стероидов 5-андростендиол (5-АЕД) – метаболит секретируемого корой надпочечников дегидроандростерона. Апробированный на различных биологических моделях, препарат показал себя как перспективный радиопротектор широкого спектра действия, эффективный в условиях как острого, так и хронического облучения, а также при сочетанном воздействии факторов радиационной, химической и биологической природы [26]. Препарат хорошо переносим, побочные эффекты минимальны, его лекарственную форму разрешено испытывать на людях. 5-АЕД предложен в качестве радиопротектора, однако, как показано в опытах на обезьянах, он обладает также выраженными радиомитигирующими свойствами при введении через 2–4 ч после облучения [27].
В настоящее время 5-АЕД рассматривается как один из наиболее перспективных радиомитигаторов. В ближайшие годы ожидается создание лицензированных радиозащитных средств на основе 5-АЕД с целью предотвращения острых и отдаленных последствий облучения.
Среди других представителей группы неандрогенных стероидов определенный радиозащитный эффект выявлен у соматотропина (гормон роста) и некоторых его рилизинг-факторов. В экспериментах на мышах показано, что при раннем терапевтическом использовании соматотропин, CJC-1295DAC и GHRP2 ослабляют проявления пост-радиационной кахексии, замедляют темп и глубину падения числа тромбоцитов, а также способствуют более раннему восстановлению их уровня в постлучевом периоде [28].
Выраженными радиомитигирующими свойствами обладают многие антиоксиданты [27, 29]. Одним из весьма перспективных соединений этой группы является генистеин – изофлафон, содержащийся в сое и полученный путем химического синтеза в Российской Федерации. В опытах на мышах установлено, что радиозащитное действие препарата в наибольшей степени проявляется при его введении в период от 1 до 24 ч до облучения, но также сохраняется при его лечебном использовании после радиационного воздействия [30–32]. Важно отметить отсутствие побочных эффектов генистеина, по крайней мере, в опытах на грызунах. Наряду с низкой токсичностью, это может быть связано с тем, что генистеин оказывает радиозащитное действие за счет активации основных систем поддержания резистентности организма – гематопоэтической и антиоксидантной, а также путем регуляции синтеза и продукции эндогенных цитокинов [33–35].
Радиомитигирующие свойства обнаружены также у препаратов селена, тиоловых соединений, синтетических и природных антиоксидантов фенольной природы и других средств профилактики оксидативного стресса.
В частности, выраженная противолучевая активность выявлена у мелатонина (гормона, синтезируемого шишковидной железой) – мощного антиоксиданта, действующего как непосредственная ловушка свободных радикалов и обладающего способностью повышать активность супероксиддисмутазы и глутатионпероксидазы, а также снижать активность прооксиданта синтазы оксида азота [36]. Показано, что введение крысам мелатонина за 30 мин до общего воздействия γ-излучения способствует снижению выраженности пострадиационной лейко- и тромбоцитопении, а также уменьшению кластогенного эффекта радиационного воздействия [37].
Среди синтетических антиоксидантов фенольной природы практический интерес в качестве потенциального радиопротектора представляет фенозан калия. Показано, что препарат усиливает процессы пострадиационной репарации ДНК и снижает выраженность программированной гибели клеток (апоптоза), индуцированной облучением [38].
За рубежом, особенно в Китае, Индии и Южной Корее, активно изучаются радиозащитные свойства растительных экстрактов, включающих различные соединения с фенольной структурой. ФИД для таких соединений составляет обычно 1.2–1.3, однако они малотоксичны, быстро метаболизируются в организме, в ряде случаев обладают не только защитным, но и лечебным противолучевым действием [39–41].
Среди растительных полифенолов интерес представляет диэкол (вещество, выделенное из бурых водорослей), производные феруловой кислоты (полифенольного вещества, содержащегося во многих травах, используемых в традиционной китайской медицине), сезамол (натуральный экстракт из кунжутного масла) и др. В частности, двукратное (за 18 и 2 ч) до радиационного воздействия введение диэкола мышам, облученным в дозе СД60‑70/30, сопровождалось увеличением 30-суточной выживаемости до 70–100% (ФИД около 1.33), стимуляцией процессов пролиферации и дифференцировки клеток гематоиммунной системы, активацией секреции гемопоэтических факторов роста [42]. Высокий радиопротекторный эффект обнаружен у феруловой кислоты [43], а сезамол по радиозащитному действию оказался значительно эффективнее мелатонина [44].
Выраженными радиомитигирующими свойствами обладают токолы. Так, при однократном введении α-токоферола (витамина Е) за 24 ч до облучения ФИД препарата составил 1.2 [45]. Применение α-токоферола сразу после воздействия летальных (8–12 Гр) или сублетальных (1–5 Гр) доз облучения способствовало существенному увеличению выживаемости белых мышей и значительному снижению количества хромосомных аберраций [46].
Радиомитигирующее действие выявлено также у инозина (рибоксина) – антиоксиданта, ранее предлагавшегося в качестве средства повышения радиорезистентности у лиц, подвергающихся длительному воздействию низкомощностного ионизирующего излучения. При введении инозина через 15 мин после облучения мышей в дозе ЛД90/30 выжило 40% животных, если же препарат вводили в более поздние сроки, его противолучевое действие прогрессивно снижалось [47]. Максимальный ФИД препарата составил 1.15.
Примерно такая же радиомитигирующая активность обнаружена и у другого антиоксиданта – рибонуклеозида гуанозина: при введении препарата через 15 мин после облучения выживаемость мышей составила 55% при 100%-ной гибели в контроле, ФИД оказался равным 1.25 [47].
Исследования по поиску радиомитигаторов желудочно-кишечного синдрома ОЛБ хотя и уступают по масштабу разработкам в области средств профилактики костномозговых нарушений, но, тем не менее, и в этой области в последние годы получены интересные результаты. В частности, показано, что кортикостероид местного действия бекламетазон (OrbeShield) при однократном пероральном введении через 24 ч после облучения в “кишечном” диапазоне доз существенно увеличивал выживаемость собак [48]. Следует отметить, что этот эффект был получен при однократном введении препарата животным, получавшим, как и в контроле, поддерживающую терапию в условиях трансплантации аллогенного костного мозга.
Перспективным представляется и дальнейшее изучение человеческого рекомбинантного ИЛ-12 (HemaMax) в качестве радиомитигатора желудочно-кишечного синдрома. Установлено, что препарат, примененный однократно через 24 ч после радиационного воздействия, у обезьян, облученных в абсолютно смертельной дозе, существенно увеличивал их выживаемость даже без поддерживающей терапии [49].
Среди других радиомитигаторов желудочно-кишечного синдрома следует отметить палифермин [50] и ИЛ-11 (Oprelvekin) [51]. Палифермин представляет собой рекомбинантный вариант фактора роста кератиноцитов (KGF). Является паракринным стимулятором репаративной пролиферации эпителиальных клеток различных тканей, включая печень, клетки волосяных фолликул, легких (пневмоциты), желудочно-кишечного тракта (энтероциты), кератиноциты. Курсовое применение палифермина (пять последовательных однократных инъекций в течение 5 сут перед облучением) снижает тяжесть поражения кишечного эпителия у мышей. Кроме того, препарат способствует снижению выраженности проявлений орального мукозита, обусловленного химиолучевой терапией, при этом его ФИД составляет 1.8–2.5 [50].
ИЛ-11 – мультифункциональный цитокин семейства ИЛ-6. Стимулирует созревание мегакариоцитов, обладает противовоспалительными свойствами и цитопротективным действием на клетки желудочно-кишечного тракта [16, 17]. Применение ИЛ-11 при хроническом лучевом поражении кишечника у мышей способствует увеличению выживаемости крипт слизистой оболочки кишечника. Проявляет себя как радиопротектор, так и радиомитигатор [51].
Значительное число препаратов описано в качестве радиомитигаторов местных лучевых поражений, главным образом радиомукозитов. К ним относятся упомянутый выше палифермин, аналоги окисленного глутатиона – препараты глутоксим и моликсан, радиопротектор амифостин, телбермин, антицерамидные антитела, трансформирующий фактор роста (TGF) и др. [52].
Из препаратов этой группы особого упоминания заслуживают отечественные радиомитигаторы местных лучевых поражений глутоксим и моликсан. В клинических исследованиях с привлечением больных плоскоклеточным местно-распространенным раком орофарингеальной области стадии III–IV, получавших лучевую терапию, применение глутоксима позволило существенно снизить частоту и выраженность клинических проявлений орофарингеального мукозита [53]. Другой препарат – аналог окисленного глутатиона – моликсан, эффективно предотвращает как местные, так и системные негативные проявления химиолучевой терапии злокачественных новообразований орофарингеальной области [54, 55]. Предполагается, что одними из механизмов лечебного действия этих препаратов являются активация рецептора эпителиального фактора роста и стимуляция продукции спленоцитами ряда гемопоэтических цитокинов (ИЛ-1, ИЛ-2, ИЛ-6, Г-КСФ и ГМ-КСФ), определяющих повышение устойчивости нормоцитов к лучевому воздействию [56].
В последние годы акцент исследований в области радиационной фармакологии в значительной степени сместился к разработке проблемы отдаленных детерминистских последствий лучевого поражения, обусловленных радиационным воспалением и развитием фиброзных и язвенно-некротических процессов [52, 57]. Это связано в первую очередь с постоянно расширяющимся внедрением методов лучевой противоопухолевой терапии в клиническую практику, повышением ее эффективности и соответственно увеличением риска отдаленных последствий. Наиболее частые виды этих последствий представлены в табл. 1.
Таблица 1.
Отсроченные и отдаленные детерминистские последствия лучевого поражения [52]
| Эффекты, обусловленные радиационным воспалением | Эффекты, обусловленные развитием фиброзных и язвенно-некротических процессов |
|---|---|
| − пневмонит | − дермофиброз |
| − колит | − пневмо-, нефросклероз |
| − энцефалопатия | − лучевая катаракта |
| − кардиомиопатия, перикардит | − поздние лучевые язвы кожи, ЖКТ |
| − индуративный отек подкожной клетчатки | − некротические процессы в костной ткани, матке и других органах |
| − цистит | − сахарный диабет |
| − ректит | − фиброз и инфаркт миокарда |
| − нейродегенеративные изменения | |
| − остеопения, остеомаляция |
Различия между отсроченными (обусловленными радиационным воспалением) и отдаленными (фиброзные и язвенно-некротические процессы) последствиями весьма условны. Тем не менее такое подразделение имеет достаточно веские основания. Прежде всего первые, как правило, предшествуют последним и часто являются обязательным этапом для их развития. Во-вторых, патогенез их различен, так же как и фармакологические средства их профилактики.
Как видно из табл. 2, радиомитигаторы эффектов, обусловленных радиационным воспалением, можно сгруппировать в две большие группы: 1) агонисты противовоспалительного цитокина ИЛ-10 (теновил, декавил, ребоксетин) и 2) антагонисты воспалительных цитокинов – фактора некроза опухоли-альфа (ФНО-α), ИЛ-6, ИЛ-8, ИЛ-1 и др. (инфликсимаб, тоцилизумаб, байкалеин и др.). Следует также отметить высокую радиомитигирующую активность отечественного препарата рексод, обладающего антиоксидантным, антимитотическим и противовоспалительным действием, при лечении больных с поздними лучевыми повреждениями органов малого таза [58].
Таблица 2.
Радиомитигаторы отсроченных (отдаленных) эффектов облучения
| Средства лечения отсроченных последствий, обусловленных воспалением | Средства лечения отдаленных последствий, обусловленных развитием фиброзных и язвенно-некротических процессов | ||
|---|---|---|---|
| Теновил | агонисты ИЛ-10 | Декавил | ингибитор ФНО-β |
| Декавил | Инфликсимаб | ингибитор ФНО-α | |
| Ребоксетин | Ваталаниб | ингибитор VEGF (эндотелиального фактора роста сосудов) | |
| Идазоксан | Пазопаниб | ||
| Инфликсимаб | антагонист ФНО-α | Цедираниб | |
| Тоцилизумаб | антагонист ИЛ-6 | Нарингенин | ингибиторы TGF-β (трансформирующий фактор роста) |
| Байкалеин | Релаксин | ||
| Правастатин | антагонист ИЛ-6, ИЛ-8 | Пирфенидон | |
| Анакинза | антагонист ИЛ-1 | Пентоксифиллин | |
| Каптоприл | ингибитор АПФ | Иматиниб | ингибитор PDGF (фактор роста тромбоцитов) |
| Рексод | супероксид дисмутаза | Ретиноевая кислота | агонист HGF (фактор роста гепатоцитов) |
Радиомитигаторы отдаленных последствий, обусловленных фиброзными и язвенно-некротическими процессами, представлены препаратами ФНО-α и ФНО-β (декавил, инфликсимаб), ингибиторами эндотелиального фактора роста сосудов – VEGF (ваталаниб, пазопаниб, цедираниб), ингибиторами трансформирующего фактора роста (нарингенин, релаксин, пирфенидон, пентоксифиллин), ингибиторами фактора роста тромбоцитов PDGF (иматиниб) и агонистом фактора роста гепатоцитов (HGF) ретиноевой кислотой [52].
В последние годы определенный прогресс наметился и в разработке проблемы профилактики отдаленных стохастических последствий облучения (лейкозы, солидные раки). В экспериментальных исследованиях показана эффективность препаратов, восстанавливающих функции белка p53 и блокирующих “эффект свидетеля” (амифостин), стимуляторов репарации двунитевых разрывов ДНК (авотермин), ингибиторов медиаторов “щелевого контакта” – коннектинов (линдан), стимуляторов экспрессии сиртуинов (ресвератрол) [52]. Указанные средства снижают риск опухолевой трансформации органов и тканей, облученных в высоких дозах. Среди перечисленных препаратов весьма перспективным представляется ресвератрол (3,4-тригидрокси-транс-стильбен) – спиртовой экстракт, полученный из красного винограда. Его применение позволяет увеличить среднюю продолжительность жизни облученных лабораторных животных, предупреждает развитие канцерогенеза, снижает выход хромосомных аберраций при радиотерапии [59]. В механизме радиомитигирующего действия ресвератрола основную роль играет стимуляция экспрессии сиртуинов – класса белков, обладающих гистондеацитилазной или монорибозилтрансферазной активностью [60].
ЗАКЛЮЧЕНИЕ
В целом анализ литературы позволяет предполагать, что под термином “радиомитигаторы” можно объединить все препараты, способные уменьшать повреждающее действие облучения на критические системы организма вне зависимости от сроков их применения. Соответственно оставшиеся “экологические ниши” в системе средств противорадиационной защиты от внешнего облучения будут занимать средства поддерживающей и заместительной терапии, предназначенные для обеспечения жизненно важных функций организма до спонтанного их восстановления, и средства симптоматической терапии радиационных поражений, предназначенные для облегчения и улучшения качества жизни пострадавших.
Как следует из представленных данных, радиомитигаторы могут применяться на всех этапах лечения и профилактики радиационных поражений, начиная от предупреждения ранних эффектов лучевого воздействия и включая лечебно-профилактические мероприятия по ликвидации его отдаленных последствий. Тем не менее очевидно, что наиболее перспективными направлениями являются поиск, разработка и внедрение радиомитигаторов в качестве средств повышения эффективности медицинской противорадиационной защиты на наиболее ранних стадиях лучевого поражения.
Список литературы
Hall E.J., Giaccia A.J. Radiobiology for the Radiologist. Philadelphia: Lippincott Williams & Wilkins, 2006. 546 p.
Васин М.В. Классификация противолучевых средств как отражение современного состояния и перспективы развития радиационной фармакологии // Радиац. биология. Радиоэкология. 2013. Т. 53. № 5. С. 459–467.
Гребенюк А.Н., Легеза В.И., Назаров В.Б., Тимошевский А.А. Медицинские средства профилактики и терапии радиационных поражений. СПб.: Фолиант, 2011. 92 с.
Гребенюк А.Н., Легеза В.И., Тарумов Р.А. Радиомитигаторы: перспективы использования в системе медицинской противорадиационной защиты // Воен.-мед. журн. 2014. Т. 335. № 6. С. 39–43.
Васин М.В. Противолучевые свойств лекарственных средств. М.: РМАПО, 2010. 180 с.
Trog D., Bank P., Wendt T.G., Beleites E. Daily amifostine given concomitantly to chemoradiation in head and neck cancer // Strahlentherapie und Onkologie. 1999. V. 175. № 9. P. 444–449.
Ильин Л.А., Рудный Н.М., Суворов Н.Н. и др. Индралин – радиопротектор экстренного действия. Противолучевые свойства, фармакология, механизм действия, клиника. М.: Изд-во МЗ РФ, 1994. 435 с.
Васин М.В., Ушаков И.Б., Ковтун В.Ю. и др. Характеристика противолучевых свойств радиопротектора Б-190 при его применении после облучения // Радиац. биология. Радиоэкология. 2008. Т. 48. № 6. С. 730–733.
Легеза В.И., Чигарева Н.Г. Средства и методы ранней патогенетической терапии радиационных поражений // Медицина катастроф. 1999. Т. 26. № 2. С. 41–45.
Андрущенко В.Н., Иванов А.А., Мальцев В.Н. Противолучевое действие веществ микробного происхождения // Радиац. биология. Радиоэкология. 1996. Т. 36. № 2. С. 195–207.
Иванов А.А., Иванова А.С., Уланова Н.М. и др. Противолучевое действие вакцины “Гриппол” // Радиац. биология. Радиоэкология. 2010. Т. 50. № 1. С. 52–57.
Чертков К.С. Лечение и профилактика острой лучевой болезни в условиях массового поражения (по экспериментальным материалам) // Радиационная медицина / Под ред. Л.А. Ильина. Т. 2. М.: ИздАТ, 2001. 432 с.
Чертков К.С., Давыдова С.А., Нестерова Т.А. Эффективность полисахарида транслама как средства раннего лечения острой лучевой болезни // Радиац. биология. Радиоэкология. 1999. Т. 39. № 5. С. 572–577.
Burdelya L.G., Krivokrysenko V.I., Tallant T.C. et al. An agonist of toll-like receptor 5 has radioprotective acti-vity in mouse and primate models // Science. 2008. V. 320. № 5873. P. 226–230.
Гребенюк А.Н., Аксенова Н.В., Петров А.В. и др. Получение различных вариантов рекомбинантного флагеллина и оценка их радиозащитной эффективности // Вестн. Рос. воен.-мед. академии. 2013. № 3 (43). С. 75–80.
Кетлинский С.А., Симбирцев А.С. Цитокины. СПб.: Фолиант, 2008. 552 с.
Симбирцев А.С. Цитокины в патогенезе и лечении заболеваний человека. СПб.: Фолиант, 2018. 512 с.
Гребенюк А.Н., Легеза В.И. Противолучевые свойства интерлейкина-1. СПб.: Фолиант, 2012. 216 с.
Рождественский Л.М., Коровкина Э. П., Дешевой Ю.Б. Применение рекомбинантного человеческого интерлейкина-1β (беталейкина) для экстренной терапии острой лучевой болезни тяжелой степени у собак // Радиац. биология. Радиоэкология. 2008. Т. 48. № 2. С. 185–194.
Wang C., Zhang B., Wang S. et al. Recombinant human thrombopoietin promotes hematopoietic reconstruction after severe whole body irradiation // Sci. Rep. 2015. № 5. P. 12–24.
Kuter D.J. New thrombopoietic growth factors // Blood. 2007. V. 109. № 11. P. 4607–4616.
Satyamitra M., Lombardini E., Graves J. et al. A TPO receptor agonist, ALXN4100TPO, mitigates radiation-induced lethality and stimulates hematopoiesis in CD2F1 mice // Radiat. Res. 2011. V. 175. № 6. P. 746–758.
Neelis K.J., Dubbelman Y.D., Qingliang L. et al. Simultaneous administration of TPO and G-CSF after cytoreductive treatment of Rhesus monkeys prevents thrombocytopenia, accelerates platelet and reconstitution, alleviates neutropenia, and promotes the recovery of immature bone marrow cells // Exp. Hematol. 1997. V. 25. № 10. P. 1084–1093.
Neelis K.J., Hartong S.C., Egeland T. et al. The efficacy of single dose administration of thrombopoietin with co-administration of either granulocyte / macrophage or granulocyte colony stimulated factor in myelosuppressed Rhesus monkeys // Blood. 1997. V. 90. № 7. P. 2565–2573.
Herodin F., Bourin P., Mayol J.-F. et al. Short-term injection of antiapoptotic cytokine combinations soon after lethal γ-irradiation promotes survival // Blood. 2003. V. 101. № 7. P. 2609–2616.
Whitnall M.H., Wilhelmsen C.L., McKinney et al. Radioprotective efficacy and acute toxicity of 5-androstenediol after subcutaneous or oral administration in mice // Immunopharmacol. Immunotoxicol. 2002. V. 24. № 4. P. 595–626.
Weiss J.F., Landauer M.R. Radioprotection by antioxidants // Ann. N. Y. Acad. Sci. 2000. V. 899. P. 44–60.
Свентицкая А.М., Никифоров А.С., Иванов И.М. и др. Сравнительная оценка лечебной эффективности соматотропина, рилизинг-факторов гормона роста и гемопоэтических цитокинов в экспериментах на облученных мышах // Радиац. биология. Радиоэкология. 2017. Т. 57. № 6. С. 621–629.
Тарумов Р.А., Башарин В.А., Гребенюк А.Н. Противолучевые свойства современных антиоксидантов // Medline. Ru. 2012. Т. 13. С. 682–700.
Landauer M.R., Srinivasan V., Seed T.M. Genistein treatment protects mice from ionizing radiation injury // J. Appl. Toxicol. 2003. V. 23. № 6. P. 379–385.
Bhatia A.L., Gaur A., Sharma A. Radiation protection by an isoflavone, genistein: a study on the survivability of mice // Nucl. Techn. Radiat. Prot. 2007. V. 22. № 1. P. 34–39.
Davis T.A., Clarke T.K., Mog S.R., Landauer M.R. Subcutaneous administration of genistein prior to lethal irradiation supports multilineage, hematopoietic proge-nitor cell recovery and survival // Int. J. Radiat. Biol. 2007. V. 83. № 3. P. 141–151.
Гребенюк А.Н., Тарумов Р.А., Башарин В.А. и др. Экспериментальная оценка влияния синтетического генистеина на гематологические показатели и цитокиновый статус облученных крыс // Радиац. биология. Радиоэкология. 2015. Т. 55. № 2. С. 160–168.
Гребенюк А.Н., Тарумов Р.А., Башарин В.А., Ков-тун В.Ю. Экспериментальная оценка радиозащитной эффективности синтетического генистеина по показателям системы глутатиона и перекисного окисления липидов в эритроцитах периферической крови облученных крыс // Радиац. биология. Радиоэкология. 2015. Т. 55. № 5. С. 501–506.
Davis T.A., Mungunsukh O., Zins S. et al. Genistein induces radioprotection by hematopoietic stem cell quiescence // Int. J. Radiat. Biol. 2008. V. 84. № 9. P. 713–726.
Vijayalaxmi, Reiter R.J., Tan D.X. et al. Melatonin as a radioprotective agent: a review // Int. J. Radiat. Oncol. Biol. Phys. 2004. V. 59. № 3. P. 639–653.
Пикалова Л.В., Легеза В.И., Горбунов В.А. Экспериментальная оценка влияния экзогенного мелатонина на генетические повреждения, индуцированные радиационным воздействием // Радиац. биология. Радиоэкология. 2013. Т. 53. № 5. С. 500–505.
Албантова А.А., Бурлакова Е.Б., Миль Е.М. Влияние антиоксиданта фенозана и облучения в малой дозе на содержание белков p53 и bcl-2 у мышей разных линий // Радиац. биология. Радиоэкология. 2010. Т. 50. № 1. С. 58–64.
Jagetia G.C. Radioprotective potential of plants and herbs against the effects of ionizing radiation // J. Clin. Biochem. Nutr. 2007. V. 40. № 2. P. 74–81.
Jagetia G.C., Baliga M.S. The evolution of the radioprotective effect of chyavanaprasha (an ayurvedic rasayana drug) in mice exposed to lethal dose of gamma-radiation: a preliminary study // Phytother. Res. 2004. V. 18. № 1. P. 14–18.
Krishna A., Kumar A. Evaluation of radioprotective effects of Rajgira (Amaranthus paniculatus) extract in Swiss albino mice // J. Radiat. Res. 2005. V. 46. № 2. P. 233–239.
Park E., Ahn G., Yun J.S. et al. Dieckol rescues mice from lethal irradiation by accelerating hemopoiesis and curtailing immunosuppression // Int. J. Radiat. Biol. 2010. V. 86. № 10. P. 848–859.
Maurya D.K., Salvi V.P., Nair C.K. Radiation protection of DNA by ferulic acid under in vitro and in vivo conditions // Mol. Cell Biochem. 2005. V. 280. № 1–2. P. 209–217.
Mishra K., Srivastava P.S., Chaudhury N.K. Sesamol as a potential radioprotective agent: in vitro studies // Radiat. Res. 2011. V. 176. № 5. P. 613–623.
Singh P.K., Wise S.Y., Ducey E.J. et al. α-Tocopherol succinate protects mice against radiation-induced gastrointestinal injury // Radiat. Res. 2012. V. 177. № 2. P. 133–145.
Singh V.K., Beattie L.A., Seed T.M. Vitamin E: tocophe-rols and tocotrienols as potential radiation countermeasures // J. Radiat. Res. 2013. V. 54. № 6. P. 973–988.
Gudkov S.V., Gudkova O.Y., Chernikov A.V., Bruscov V.I. Protection of mice against X-ray injuries by the post-irradiation administration of guanosine and inosine // Int. J. Radiat. Biol. 2009. V. 85. № 2. P. 116–125.
Soligenix, Inc. 2018. OrbeShield® for Gastrointestinal Acute Radiation Syndrome (GI ARS). Available at: https://www.soligenix.com/pipeline/vaccinesbiodefense/orbeshield-for-gastrointestinal-acute-radiation-syndrome-gi-ars/ [accessed 28.06.2018].
Gluzman-Poltorak Z., Mendonca S.R., Vainstein V. et al. Randomized comparison of single dose of recombinant human IL-12 versus placebo for restoration of hematopoiesis and improved survival in rhesus monkeys exposed to lethal radiation // J. Hematol. Oncol. 2014. V. 7. P. 31. Publ. online 2014 Apr 6. doi: https://doi.org/10.1186/1756-8722-7-31
Finch P.W., Mark Cross L.J., McAuley D.F., Farrell C.L. Palifermin for the protection and regeneration of epithelial tissues following injury: new findings in basic research and pre-clinical models // J. Cell. Mol. Med. 2013. V. 17. № 9. P 1065–1087.
Burnett A.F., Biju P.G., Lui H., Hauer-Jensen M. Oral interleukin 11 as a countermeasure to lethal total-body irradiation in a murine model // Radiat. Res. 2013. V. 180. № 6. P. 595–602.
Koukourakis M.I. Radiation damage and radioprotectants: new concepts in the era of molecular medicine // Br. J. Radiol. 2012. V. 85. № 1012. P. 313–330.
Антушевич А.А., Антонов В.Г., Гребенюк А.Н. и др. Патофизиологические основы эффективности глутоксима как средства сопровождения лучевой терапии рака ротоглотки // Вестн. Рос. воен.-мед. академии. 2013. № 3 (43). С. 32–37.
Ярцева А.А., Степанов А.В., Гребенюк А.Н., Антушевич А.Е. Влияние моликсана на микробиоценоз полости рта после комбинированного химиолучевого воздействия // Мед.-биол. и соц.-психол. пробл. безопасности в чрезв. ситуациях. 2014. № 1. С. 57–63.
Ярцева А.А., Мороз Б.Т., Гребенюк А.Н. и др. Эффективность моликсана как средства коррекции негативных проявлений химиолучевой терапии у больных раком орофарингеальной области // Радиац. биология. Радиоэкология. 2014. Т. 54. № 3. С. 265–272.
Ярцева А.А., Антушевич А.Е., Гребенюк А.Н. Экспериментальное изучение механизмов гемостимулирующей активности органической соли дисульфида глутатиона и инозина в условиях острого радиационного воздействия // Мед.-биол. и соц.-психол. пробл. безопасности в чрезв. ситуациях. 2016. № 1. С. 79–84.
Prasanna P.G.S., Narayanan D., Hallett K. et al. Radioprotectors and radiomitigators for improving radiation therapy: the small business innovation research (SBIR) gateway for accelerating clinical translation // Radiat. Res. 2015. V. 184. № 3. P. 235–248.
Жариков А.А., Терехов О.В., Пасов В.В. Лечение больных с поздними лучевыми повреждениями органов малого таза с применением препарата рексод // Онкология. 2013. № 5. С. 26–30.
Carsten R.E., Bachand A.M., Bailey S.M., Ullrich R.L. Resveratrol reduces radiation-induced chromosome aberration frequencies in mouse bone marrow cells // Radiat. Res. 2008. V. 169. № 6. P. 633–638.
Kulkarni S.S., Cantó C. The molecular targets of resveratrol // Biochim. Biophys. Acta. 2015. V. 1852. № 6. P. 1114–1123.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология