Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 117-126
ПРОБЛЕМНЫЕ ВОПРОСЫ РАЗРАБОТКИ ПРОТИВОЛУЧЕВЫХ СРЕДСТВ
Л. М. Рождественский *
Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
* E-mail: lemrod@mail.ru
Поступила в редакцию 23.07.2018
Аннотация
Статья посвящена описанию, анализу и возможным способам решения части проблем, с которыми сталкивается разработка противолучевых средств в России. Проблемы можно подразделить на научные (редкость целевых проектов, нацеленных на создание медицинских противолучевых препаратов, проведение исследований, слабо увязанных с возможными сценариями радиационного поражения человека, недостаточное использование современных научных технологий), организационные (отсталость исследовательской инфраструктуры, недостатки менеджмента, слабая подключенность к исследованиям медицинского звена технологической цепочки), нормативной регуляции (устарелость существующих нормативных документов доклинических исследований, отсутствие учета специфики противолучевых препаратов и новых подходов к их исследованию).
В настоящее время в России направление разработки противолучевых средств (ПЛС) для различных сценариев внешнего радиационного воздействия на человека находится в кризисном состоянии. Это проявляется в уменьшении числа радиобиологических и химико-технологических центров, занимающихся этой проблемой, в отставании развития научно-исследовательской инфраструктуры в части виварного хозяйства, облучательских установок, современной высокотехнологичной исследовательской аппаратуры. В работающих центрах наблюдается сворачивание соответствующей тематики по причине отсутствия запроса и ослабления менеджмента. Последнее, в частности, проявляется в отсутствии, как правило, при разработке противолучевого средства полной технологической цепочки (химик-технолог, радиобиолог-исследователь, врач-испытатель), хотя важность этого обстоятельства была продемонстрирована при реализации самого успешного проекта – создание медицинского препарата Беталейкин.
Крайне малочисленны крупные научные проекты по разработке новых или совершенствованию “старых” противолучевых препаратов. Как итог – уменьшение научной продукции и отсутствие новых препаратов. За весь 2017 г. в журнале “Радиационная биология. Радиоэкология” по разделу ПЛС было опубликовано всего девять статей, большей частью по локальным вопросам без существенной перспективы. Последним, официально зарегистрированным в 2003 г. препаратом, был беталейкин – средство экстренной противолучевой терапии. Это единственный противолучевой препарат, доведенный до уровня средства двойного назначения, т.е. используемый в широкой медицинской практике в качестве иммуномодулятора при вторичных иммунодефицитах и гемостимулятора при курсах жесткой химиотерапии онкозаболеваний.
В то же время ряд номинальных ПЛС, фигурирующих в специальной литературе (индралин, цистамин), подобного беталейкину применения не имеют, что, конечно, осложняет поддержание их производства.
В связи с резким сокращением тематики противолучевых средств и закрытием химико-технологических лабораторий практически прекратилась наработка по лабораторному регламенту многих старых эффективных препаратов, необходимых для разработки комплексных рецептур и теории противолучевой защиты.
Может создаться впечатление, что основные вопросы медикаментозного противодействия радиационному воздействию на человека решены и нет необходимости в дальнейшем развитии и совершенствовании этих исследований. Однако обзор обеспечения противолучевыми средствами реальных и возможных сценариев внешнего лучевого воздействия на человека показывает, что это не так (таблица 1). Отметим, что в этот список сознательно не включены препараты длительного применения при лечении лучевых поражений (поддерживающая терапия, колониестимулирующие факторы) как сфера разработок преимущественно медицинского звена, а также препараты, ослабляющие первичную реакцию на облучение, как симптоматические средства.
Таблица 1.
Возможные сценарии радиационного воздействия на человека и их обеспеченность противолучевыми средствами профилактического и раннего лечебного применения
| Сценарии | Введение ПЛС | ||
|---|---|---|---|
| Тип | Конкретные примеры | до облучения | после облучения |
| Аварийное, военное, террористическое (острое) | Производство, подлодка, Хиросима–Нагасаки Чернобыль | Беталейкин (?) | |
| Флагеллин (?) | |||
| Ожидаемое | Космос – редкоионизирующее, плотноионизирующее (тяжелые ядра), пролонгированное | ? | |
| Планируемое | лучевая и химиотерапия: | ||
| солидных опухолей | Беталейкин | ||
| лейкозов (тотальное, низкомощностное) | *Т-1023 (?) | ||
| компьютерная томография (КТ): | |||
| детей – | ? | ||
| взрослых – | ? | ||
| лиц с нарушениями репарации ДНК – | ? | ||
| ремонтные работы в зоне: | |||
| с высокой мощностью дозы | Индралин (?) | ||
| Чернобыль (КРТП) | Беталейкин (?) | ||
| с низкой мощностью дозы | Рибоксин (?) | ||
| Фукусима | |||
Примечание. Знак ? означает либо отсутствие ПЛС для данного сценария, либо чисто номинальное положение о применении данного средства при соответствующем сценарии (непроверенное на практике, или даже недостаточно обоснованное экспериментальными исследованиями и расчетными процедурами.) *Т-1023: производное изотиомочевины с NOS ингибирующей активностью.
СЦЕНАРИИ ВОЗМОЖНЫХ РАДИАЦИОННЫХ ВОЗДЕЙСТВИЙ НА ЧЕЛОВЕКА И ИХ ОБЕСПЕЧЕННОСТЬ ПРОТИВОЛУЧЕВЫМИ СРЕДСТВАМИ (ПЛС)
В таблице 1 представлены отечественные средства экстренной/ранней защиты и лечения, которые были официально разрешены для медицинского применения. Фактически таких средств всего три: радиопротектор индралин, средство экстренной терапии тяжелых поражений беталейкин и средство профилактики при входе в зону с повышенным уровнем радиации рибоксин. Кроме того, в таблице 1 представлены курсивом средства либо достаточно продвинутые к стадии клинических испытаний (ингибитор NOS Т-1023, позиционируемый как радиопротектор), либо имеющие все основания такие испытания пройти (дженерик флагеллин из группы полипептидов).
Представленные в таблице 1 данные свидетельствуют о том, что даже номинальная обеспеченность сценариев лучевых воздействий ПЛС очень различна – от более или менее удовлетворительной до слабой или даже отсутствующей. К первой группе относится, прежде всего, экстренная терапия тяжелых лучевых поражений. Здесь, помимо представленных препаратов, в арсенале медиков потенциально имеется зарубежный тромбопоэтин, хотя и не доведенный до статуса медицинского препарата, но уже применявшийся на основаниях “compassionate use” для лечения тяжело пораженных пациентов [1]. Но не надо забывать и о том, что даже в случае наличия номинального средства ослабления последствий радиационного воздействия, его действительная эффективность (вплоть до ее наличия) остается весьма неопределенной величиной. Это, например, относится к индралину, доза которого, рекомендованная для человека, была получена всего лишь расчетным методом [2]. Была возможность хотя бы ориентировочной оценки эффективности рекомендованной для индралина дозы на чернобыльских пожарных, но она была упущена из-за несогласованности действия различных служб во время аварии [3].
Наряду с уже имевшими место сценариями появился новый, практически совсем не изученный. Таковым, например, является компьютерная томография, в отношении которой имеются подозрения о ее негативном в плане канцерогенности влиянии на здоровье обследуемых с ее помощью лиц, особенно детского возраста. Вообще, проблема радиочувствительности как возрастной, так и у лиц с дефектами репарационной системы применительно к лечебным и диагностическим процедурам, использующим ионизирующее излучение, остается совершенно не исследованной, в том числе и в плане возможного использования у этих контингентов корректирующих противолучевых средств. Какие возможности при этом открываются для реального применения ПЛС в широкой медицинской практике – говорить излишне.
По-прежнему наиболее заманчивым сценарием применения ПЛС является лучевая терапия опухолей с ее массовым контингентом пациентов. Но перед внедрением ПЛС в эту практику стоит серьезная преграда из требований отсутствия позитивного влияния на опухоль, отсутствия любых дискомфортных побочных эффектов, отсутствия привыкания к препарату, наконец, трудности определения позитивного эффекта на здоровые ткани, учитывая фокусирование луча на опухоли. Тем не менее удачные попытки уже имеются. Они касаются применения беталейкина для поддержания приемлемого уровня лейкоцитов во время курса лучевой терапии солидных опухолей [4]. Другая надежда связана с препаратом Т-1023, который в опытах на мышах и крысах с перевитыми опухолями при введении за 30 мин до облучения оказал защитное влияние на лучевую реакцию кожи, не ослабив туморицидное действие облучения [5, 6]. Правда, этому препарату еще предстоит пройти клинические испытания и получить статус медицинского препарата.
К группе сценариев, для которых обеспечение ПЛС отсутствует или представлено очень слабо, относятся воздействие солнечных вспышек с их плотноионизирующей компонентой при космических полетах и пролонгированное воздействие низкомощностного излучения при аварийных работах. При этом для первого из этих сценариев речь в первую очередь идет о сохранении функциональных свойств организма в период полета, но для всех вариантов важна защита от отдаленных последствий, прежде всего от увеличения риска онкологических заболеваний. Хотя для сценария низкомощностного излучения в качестве защитного средства указан рибоксин, обоснование его применения у человека в относительно низкой дозе вызывает определенные сомнения и нуждается в проверке.
Таким образом, становится очевидным большой фронт работ в области сценариев радиационного воздействия на человека, нуждающихся в обеспечении противолучевыми средствами. Это слабо осознается менеджментом, определяющим приоритетность развития научных направлений исследований, тем более, что исследовательская инфраструктура радиобиологических работ оказывается весьма капиталоемкой. Такая политика очень недальновидна, ибо длительное отставание в разработках ПЛС может, в конце концов, привести к полной деградации всего направления с последующей все-таки необходимостью все начать с нуля.
Если в отношении поиска противолучевых препаратов для защиты человека во время космического полета от излучения, генерируемого солнечными вспышками, обнаружить какую-либо информацию не удалось, то со сценарием длительного низкоинтенсивного излучения дело обстоит иначе. Ниже приведены обобщенно предварительные результаты поиска препаратов от отдаленных последствий облучения как попытки выхода из кризиса на путях решения актуальной научно-практической проблемы.
ПОИСК ПРОТИВОЛУЧЕВЫХ СРЕДСТВ ОСЛАБЛЕНИЯ ОТДАЛЕННЫХ ПОСЛЕДСТВИЙ НИЗКОМОЩНОСТНОГО ПРОЛОНГИРОВАННОГО РАДИАЦИОННОГО ВОЗДЕЙСТВИЯ
В ФМБЦ им. А.И. Бурназяна силами лабораторий молекулярной генетики (зав. В.Ф. Михайлов), радиационной биофизики (зав. А.Н. Осипов) и радиационной фармакологии (зав. Л.М. Рожде-ственский) уже в течение нескольких лет осуществляется проект исследования отдаленных последствий воздействия ионизирующего излучения на биологические объекты. Это направление радиобиологических исследований может стать способом выхода из кризиса и в силу попытки решения по-настоящему масштабной и слабо изученной проблемы, и в силу его смыкания с постоянно лидирующим в биологии и медицине направлением исследования злокачественных новообразований.
Основными задачами указанного исследования полагаются характеристика отдаленных пост-лучевых реакций организма на разных уровнях его организации, поиск маркеров неблагоприятных последствий облучения организма, включая нестабильность генома, канцерогенный эффект, старение, наконец, поиск фармакологических средств ослабления этих отдаленных эффектов. В рамках этого проекта была разработана модель низкомощностного пролонгированного облучения (НМПО) мышей с исследованием на ней противолучевого действия ПЛС, относящихся к разным по механизму действия препаратам [7]. В исследование были взяты доступные ПЛС, для которых в литературе имелись сведения об их эффективности при низкомощностном облучении – беталейкин в большой и малой дозах, рибоксин [8, 9]. В отличие от исследований указанных авторов с оценкой исключительно раннего острого эффекта по тесту выживаемости в наших опытах акцент был сделан на отдаленные (от 3 до 10 мес.) последствия облучения в большой дозе – 12.6 Гр с использованием широкого набора показателей молекулярно-клеточного и органо-тканевого уровня [10, 11].
Опыты проводятся на мышах F1(CBA × C57Bl), самцах с массой 20–24 г. Животных облучали на цезиевой гамма-установке Панорама-3С в Академии ветеринарной медицины им. Скрябина, в клетках постоянного содержания, по 10 особей на клетку, при свободном доступе к брикетированному корму и воде. Половина особей в каждой клетке была контрольной (после облучения “опыт” и контроль рассаживали в разные клетки). Отдельную группу представляли необлученные животные – биоконтроль. Мощность дозы составляла 10 мГр/мин и была отработана с помощью клинического дозиметра 27012-R (ГДР), прошедшего поверку в ВНИИФТРИ, а продолжительность облучения – 21 ч. Препараты вводили до облучения, однократно, внутрибрюшинно (беталейкин – в дозах 3 или 50 мкг/кг, рибоксин – 300 мг/кг).
На модели НМПО были обнаружены разнообразные эффекты как на органо-тканевом, так и на молекулярно-генетическом уровне, связь между которыми находится в процессе изучения: феномен спленомегалии, повышенный уровень выхода структурных повреждений ДНК по уровню фосфорилированного гистона H2AX (детекция 2-нитевых разрывов ДНК в клетках селезенки) и тесту ДНК-комет (детекция однонитевых разрывов и щелочелабильных сайтов также в клетках селезенки), изменения экспрессии генов и микроРНК, регулирующих процессы апоптоза и пролиферации. В настоящее время могут быть высказаны только предположительные оценки и заключения, безусловно нуждающиеся в проверке и подкреплении дополнительными экспериментами. Далее представлена краткая феноменологическая картина полученных результатов.
Со стороны системы кроветворения наблюдалась умеренная лейкопения, наиболее выраженная в период 4–6 мес. после облучения как в гранулоцитарном, так и в лимфоидном звене. Выраженным проявлением реакции системы кроветворения была спленомегалия, фиксировавшаяся примерно у 25–30% животных, и охарактеризованная как лимфопролиферативный процесс при гистологическом исследовании [11]. На рис. 1 представлены данные о динамике этого феномена.
Рис. 1.
Динамика феномена спленомегалии по разным показателям: 1 – биоконтроль, 2 – облучение, 3 – препараты + облучение; средняя масса всех селезенок, мг: 4 – биоконтроль, 5 – облучение, 6 – препараты + облучение; средняя масса спленомегалий, мг: 7 – биоконтроль, 8 – облучение, 9 – препараты + + облучение.
По оси абсцисс – время после облучения, мес.; по оси ординат – число спленомегалий в группе, %.
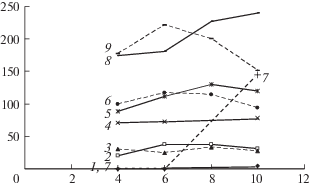
Как видно на рис. 1, статистически значимой разницы между облученным контролем и опытом с применением ПЛС не отмечено на все сроки исследования. Даже выраженная разница между ними по средней массе спленомегалий на срок 10 мес. оказалась незначимой по критерию Манна–Уитни из-за большого разброса данных в контроле. Появление спленомегалий в биоконтроле на срок 10 мес. свидетельствует о том, что радиация является не единственной причиной феномена, вероятна роль инфекции. Последнее может быть одной из причин отсутствия положительного эффекта ПЛС, и это может быть проверено путем проведения опытов на СПФ мышах как существенно менее обремененных нежелательной микрофлорой. Тем не менее гистологическое исследование отметило положительное влияние препаратов на развитие феномена: отсутствие мощных лимфоцитарных тяжей по сравнению с контролем, что позволяет ожидать статистически значимого различия в ходе кривых 8 и 9 при увеличении выборки [11].
Было также установлено, что спленомегалия значимо сопряжена с развитием анемии по тестам уровня эритроцитов, гемоглобина и полихромазии эритроцитов (появление молодых форм эритроцитов, свидетельствующее о напряженности эритропоэза) [11]. До сих пор остается недостаточно проясненным вопрос о том, что лежит в основе развития синдрома спленомегалия–анемия. Вполне возможно, что ведущей причиной является чрезмерная пролиферация лимфоидной ткани в ответ на облучение в большой дозе, что приводит к повышенной утилизации эритроцитов. Но нельзя без дополнительных исследований исключить и вероятность появления неполноценных эритроцитов, ускоренная гибель которых оборачивается спленомегалией.
На данном этапе можно предполагать, что спленомегалия в модели НМПО является проявлением нестабильности системы кроветворения, удобным для исследования. Представляет несомненный интерес исследование феномена на еще более отдаленные сроки с целью выяснения того, маркером каких отдаленных патологических процессов он может оказаться, каков конечный исход самого феномена – усиление или редукция. Необходимо также расширение поиска модифицирующих феномен веществ, выяснение роли эндогенной инфекции в его возникновении и его связи с экспрессией различных генов и регулирующих факторов.
При исследовании на модели НМПО различных функциональных показателей реакции генома на облучение был отмечен ряд значимых изменений [12].
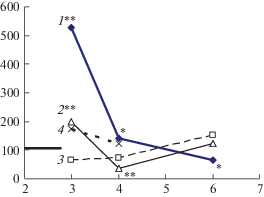
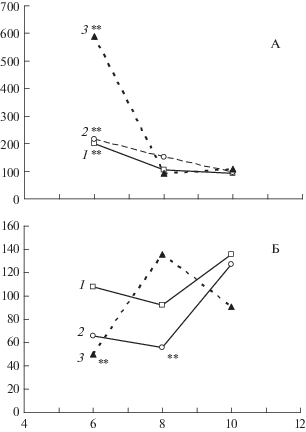
Как следует из данных, представленных на рис. 2, через 3 мес. после облучения у мышей наблюдается усиление экспрессии гена Р53, охраняющего стабильность генома. Экспрессия разных микроРНК также оказалась направленной преимущественно в сторону поддержания стабильности генома (превалирование мир-145, действующего синергически с Р53, над мир-125, синергического разгоняющим пролиферацию Г-КСФ и NF-kB). Повышение экспрессии Р53 через столь отдаленный срок позволяет предположить развитие в этот период нестабильности генома с повышенным образованием двунитевых разрывов, являющихся сильным индуктором экспрессии Р53.
Рис. 2.
Динамика экспрессии генов ТР53 (1) и Г-КСФ (4), микро РНК mir-145 (2) и mir-125 (3) в костном мозге облученных на модели НМПО мышей в интервале 3–6 мес. после облучения.
По оси абсцисс – сроки, мес.; по оси ординат – медианы экспрессии показателей в % к медиане (на те же сроки) необлученного биологического контроля.
* 0.05 < p < 0.1; ** p < 0.05.
Далее представлены данные о влиянии использованных в этих опытах ПЛС на функциональные реакции генома на НМПО в большой дозе (рис. 3).
Рис. 3.
Экспрессия разных генов и микро РНК в костном мозге защищенных от облучения на модели НМПО мышей через различные сроки после воздействия и вариантах защиты: беталейкин в дозах 3 мкг/кг за 22 ч (А) и 50 мкг/кг за 2 ч (Б), рибоксин в дозе 300 мг/кг за 0.5 ч (В). Цифры над диаграммой: срок исследования, равный 3 (1), 4 (2) и 6 (3) мес.
По оси ординат – экспрессия указанных показателей в % к собственному контролю (облучение защищенных данным препаратом и контрольных к нему мышей в одной клетке).
* 0.05 < p < 0.1; ** p < 0.05.
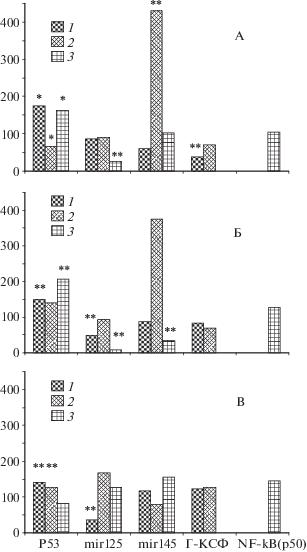
Из данных, представленных на рис. 3, следует, что варианты защиты Бл-50 и Риб. усилили экспрессию Р53 и мир-145, а вариант Бл-3 действовал в том же направлении, но более умеренно. Формально получается, что ПЛС не ослабили, а усилили развитие нестабильности генома, а отсюда – экспрессию Р53 и мир-145, снижая (или не изменяя) в то же время, что логично, экспрессию мир-125, Г-КСФ и NF-kB. Конечно, такое заключение требует подтверждения или опровержения повторными исследованиями.
К сказанному выше можно еще добавить следующее наблюдение. В более ранних исследованиях на модели НМПО, когда оценивались ранние эффекты защиты по показателю клеточности костного мозга через 9 сут после облучения, были получены данные, представленные на рис. 4.
Рис. 4.
Зависимость раннего защитного эффекта беталейкина от степени экспрессии ТР53 в костном мозге к моменту начала облучения: 1 – беталейкин в дозе 50 мкг/кг за 2 ч до начала облучения; 2 – беталейкин в дозе 3 мкг/кг за 22 ч; 3 – беталейкин в дозе 50 мкг/кг за 22 ч.
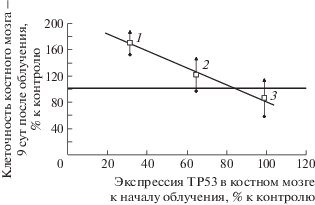
Из данных рис. 4 следует, что при сниженной под влиянием Бл-50/2 экспрессии Р53 к началу облучения (точка 1) эффект защиты проявлялся, а в случае нормализации экспрессии в варианте БЛ-50/22 (точка 3), эффект защиты исчезал. Одной из причин проявления эффекта защиты могло быть снижение апоптотической функции р53 беталейкином во время облучения мышей. Следствием этого обстоятельства могли быть прохождение части клеток с поврежденным геномом в выжившую часть популяции и усиление нестабильности генома в отдаленные сроки. Проверке этой гипотезы будут посвящены последующие исследования.
В части оценки структурных повреждений ДНК важным результатом было обнаружение через 4 мес. после НМПО повышенного уровня γH2AX в клетках селезенки (спленомегалии в исследование не брали) [13]. Отмеченный результат был интерпретирован как следствие развития нестабильности генома и/или феномена ранней старости. При этом только в варианте защиты Бл-3/22 был получен положительный значимый эффект.
Другой положительный эффект был отмечен по тесту ДНК-комет в щелочных условиях (детекция однонитевых разрывов и щелочелабильных сайтов) также в клетках селезенки на срок 6 мес. при использовании рибоксина и на срок 8 мес. в варианте защиты БЛ-50/2 (рис. 5).
Рис. 5.
Динамика показателя ДНК-комет в разных группах облученного контроля (А) – к Бл-3/22 (1), к Бл-50/2 (2), к Риб (3) и в разных группах защищенных мышей (Б) – Бл-3/22 (1), Бл-50/2 (2), Риб (3). По оси абсцисс – сроки исследования после НМПО, мес.; по оси ординат – показатель % ДНК в хвосте кометы в % к биоконтролю (А) и в % к собственному облученному контролю (Б).
** р < 0.05.
Как следует из рис. 5, А, в облученном контроле отмечена значимая реакция на облучение по данному тесту через 6 мес. после облучения, что, вероятно, должно рассматриваться как проявление нестабильности генома. На рис. 5, Б видно, что значимый положительный эффект имел место при использовании рибоксина на срок 6 мес. и беталейкина в дозе 50 мкг/кг на срок 8 мес.
Через 10 мес. после облучения у животных было отмечено появление солидных опухолей и лейкозов. У трех мышей из группы контроля регистрировали значительное увеличение общего количества лейкоцитов в крови (от 28.1 до 120.5 тыс/мм3) при уменьшении клеточности костного мозга. У двух мышей из этих трех изменения картины крови могут быть определены как лимфобластный лейкоз.
Злокачественные опухоли с локализацией в печени (преимущественно), поджелудочной железе, брюшной полости, паху и на шее при гистологическом исследовании в лаборатории экспериментальной морфологии 1-го МГМУ (зав. А.Б. Шехтер) были отнесены к разряду злокачественных лимфобластом. Представленность опухолей в разных экспериментальных группах приведена на рис. 6.
Рис. 6.
Доля злокачественных новообразований в разных экспериментальных группах. По оси абсцисс – экспериментальные группы: Б/К – биологический (необлученный контроль), К – облученный контроль, Б3 – беталейкин в дозе 3 мкг/кг за 22 ч, Б50 – беталейкин в дозе 50 мкг/кг за 2 ч, Риб – рибоксин в дозе 300 мг/кг за 0,5 ч до начала облучения; по оси ординат – число опухолей в группе, %.
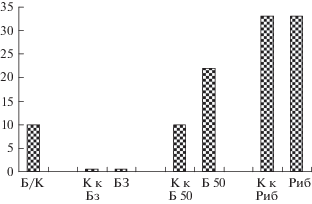
Частота злокачественных новообразований у облученных животных (11/74 – 14.9%) примерно в 1.5 раза превышала их частоту у необлученного биологического контроля (2/20 – 10%), но различие по точному критерию Фишера оказалось статистически незначимым (р = 0.7). Различие встречаемости новообразований в группах облученных контрольных (14%) и защищенных животных (20%), по сравнению с необлученным биоконтролем (10%) по критерию Фишера, также оказалось статистически незначимым.
Была проведена оценка корреляции выхода опухолей с выраженностью таких показателей, как спленомегалия, % ДНК в хвосте комет клеток селезенки и уровень гистона γН2AX в клетках селезенки.
По критерию Спирмена (ранговая корреляция) были получены следующие оценки:
| R | p | |
| Опухоли – тест ДНК- комет | 0.11 | 0.8 |
| Опухоли – спленомегалии | 0.8 | 0.27 |
| Опухоли – γН2AX-позитивные клетки | 0.9 | 0.0002 |
Сочетание же опухоли (злокачественная лимфобластома) со спленомегалией оказалось статистически значимым (р = 0.0003 по точному 2-стороннему критерию Фишера). На очереди оценка коррелированности выхода опухолей с показателями экспрессии исследованных генов и микроРНК.
Таким образом, начальные исследования отдаленных эффектов облучения на модели НМПО мышей позволили выявить эффекты, коррелирующие с выходом злокачественных лимфобластом. Такими эффектами оказались γН2AX-позитивные клетки и с оговоркой – спленомегалии. Насколько надежными маркерами канцерогенного эффекта они окажутся, могут показать только последующие опыты.
Другой важный и тоже предварительный вывод проведенных исследований заключается в неспособности использованных ПЛС, показавших свою эффективность против ранних эффектов облучения, ослабить отдаленные эффекты, прежде всего, выход злокачественных опухолей. Конечно, необходимо повторить проведенные опыты и притом на большем числе животных, особенно с вариантом введения беталейкина в малой дозе. Но надо также думать о расширении поиска ПЛС от отдаленных эффектов облучения в других классах веществ (антимутагенов, антиканцерогенов, активаторов иных сигнальных путей, кроме NF-кB). При этом важно контролировать состояние системы Р53 во время облучения и в ближайшие часы после него. Не окажется ли так, что, в отличие от ПЛС, ослабляющих ранние эффекты, ПЛС от отдаленных последствий должны не ослаблять, а усиливать активность Р53 во время и сразу после облучения.
Итак, сформировавшееся на модели низкомощностного пролонгированного облучения (НМПО) мышей в большой дозе направление исследований отдаленных эффектов и поиска средств ослабления, прежде всего канцерогенного эффекта, базируется на использовании широкого спектра показателей организменного, клеточно-тканевого и молекулярно-генетического уровня с целью выяснения корреляционных связей между ними. Это позволит понять механизм формирования отдаленных эффектов и на этой основе вести направленный поиск средств ослабления вредных для здоровья отдаленных эффектов облучения.
СОСТОЯНИЕ НОРМАТИВНОЙ БАЗЫ РАЗРАБОТКИ ПРОТИВОЛУЧЕВЫХ СРЕДСТВ
Упомянутые выше трудности в разработке противолучевых средств научного и организационного характера усугубляются неадекватной нормативной базой, регулирующей такие разработки. Нормативные документы по прохождению медицинских препаратов требуют обязательного проведения 2–3-й стадий клинических испытаний на пациентах с соответствующей патологией. Не делается исключений в этом плане и для противолучевых препаратов профилактического и экстренного лечебного применения, отличающихся как раз невозможностью проведения таких испытаний вследствие редкости радиационных инцидентов и очевидных этических принципов. Попытки проведения исследований на пациентах, подвергающихся лучевой терапии онкологических заболеваний, были прекращены из-за риска защитного эффекта на опухоль. Появившиеся сведения о возрождении специального экспертного совета по прохождению противолучевых препаратов ничего не меняют в необходимости ответа на вопрос – как и на каких основаниях будет устанавливаться доза противолучевого средства, эффективная для человека, не путем же голосования или интуитивного мнения экспертов.
Существующие Методические указания по доклиническим исследованиям противолучевых препаратов базируются преимущественно на оценке противолучевого эффекта на трех видах лабораторных животных, включая один крупный (собаки, обезьяны), с последующей экстраполяцией полученных результатов на человека [14–16]. Другими словами, по трем точкам строится зависимость эффективной (для каждого вида) дозы от средней массы тела или величины поверхности тела с последующей экстраполяцией на массу или поверхность тела человека, буквально экстраполяцией, так как человек существенно крупнее всех используемых видов животных. Но экстраполяция всегда чревата ошибкой, так как нет гарантии, что характер зависимости не изменится при выходе за пределы измеренных точек. И действительно, такой подход себя не оправдал по причине отсутствия четкой связи между эффективностью препаратов и массой тела или величиной поверхности тела (гипотеза ведущей роли основного/энергетического обмена) для различных видов животных и человека.
Выход был найден в разработке особого, индикационного подхода, оперирующего маркерами/индикаторами повышенной радиорезистентности организма или наиболее радиочувствительных тканей (МПР/ИПР) и исходящего из положения о фармакологической природе противолучевого действия разных веществ эндогенной и экзогенной природы [17–19]. Это положение, первоначально выдвинутое В.И. Кулинским, было развито в новой бинарной классификации противолучевых средств [7, 20]. При введении в организм практически любого вещества в определенной концентрации тот отвечает реакцией, инициируемой рецепторной структурой для этого вещества, будь то специфический клеточный рецептор (например, адренорецепторы, цитокиновые и толл-подобные рецепторы) или какие-то молекулярные продукты (например синтаза NO для некоторых производных тиомочевины или смешанные дисульфиды белка с глутатионом для тиолсодержащих ПЛС). Рецепторная структура передает сигнал дальше вплоть до реализации состояния повышенной радиорезистентности.
Этот подход связан с установлением всей цепи передачи сигнала от рецепторной структуры до эффектора/ов, реализующего/их противолучевой эффект. Различные компоненты такой цепи, наиболее удобные для оценки на человеке, могут быть использованы как маркеры (индикаторы) состояния повышенной радиорезистентности (МПР/ИПР). Каждый из МПР/ИПР должен быть охарактеризован строго количественно с позиций его специфичности и чувствительности (наподобие того, как это осуществляется для различных онкомаркеров) [21, 22]. Очевидно, что МПР/ИПР будут разными для различных препаратов, с одной стороны, и для различных конечных эффектов (ранних и отдаленных) радиационного поражения, с другой стороны. Нахождение одного или нескольких МПР для каждого определенного препарата в опытах на мелких лабораторных животных и на культурах клеток позволит проводить дальнейшие испытания препарата(ов) на крупных лабораторных животных и человеке без использования непосредственного радиационного воздействия.
Для многих ПЛС маркеры повышенной ими радиорезистентности уже обнаружены. Это нашло отражение в разработанной бинарной классификации ПЛС [7]. Согласно этой классификации, все ПЛС подразделены на две большие группы с принципиально разными фармакологическими свойствами и сопряженностью с разными фазами развития радиационного поражения.
Одна из этих групп (оксидомодуляторов) действует на радиационно-химической стадии посредством сдвига окислительно-восстановительного баланса внутриклеточной среды в сторону восстановительного потенциала за счет либо снижения напряжения свободного кислорода (это гипоксанты: из исторических групп биогенных аминов, арилалкиламинов, индолилалкиламинов, производных тиомочевины), либо увеличения концентрации восстановительных эквивалентов (это редуктанты: из исторических групп аминотиолов). Для гипоксантов маркерами повышенной ими радиорезистентности оказались снижение напряжения свободного кислорода (дельта рО2), повышение активности сукцинатдегидрогеназы. Для редуктантов маркером повышенной радиорезистентности является сдвиг ОВП (дельта ОВП) в отрицательную область (повышение концентрации веществ-восстановителей).
Другая большая группа ПЛС (цитомодуляторы взамен прежних исторических: стимуляторы радиорезистентности, препараты, ускоряющие репарацию, радиомодуляторы, радиомитигаторы) осуществляет свое действие, в основном, на стадии клеточных эффектов радиационного поражения. Эта группа представлена, преимущественно, высокомолекулярными соединениями как эндогенной, так и экзогенной природы, осуществляющими свое действие через различные рецепторы (цитокиновые, толл-подобные, рецепторы ростовых факторов), передающие сигнал на активизацию иммунозащитных реакций, на ослабление апоптотической гибели клеток и стимуляцию восстановительных пролиферативных процессов. Наиболее перспективными из этой группы оказались соединения полипептидной природы (Г-КСФ, беталейкин, тромбопоэтин, энтолимод/CBLB502), которые не только были квалифицированы как средства экстренной/ранней и курсовой противолучевой терапии, но и нашли применение в широкой медицинской практике в качестве стимуляторов кроветворения и иммуномодуляторов. Так как цитомодуляторы вызывают значительно более длительное состояние повышенной радиорезистентности, то они эффективны при введении за довольно длительные сроки до облучения. При этом цитомодуляторы в силу своей высокой специфичности оказываются эффективными в дозах, которые на порядки меньше эффективных доз оксидомодуляторов. Отсюда их хорошая переносимость пациентами. Несмотря на значительно меньшую продолжительность изучения цитомодуляторов, для ряда из них уже обнаружены маркеры их эффективности (в профилактическом и лечебном вариантах). Так, для препарата энтолимод были выявлены как маркеры эффективности эндогенные Г-КСФ и ИЛ-6 [19].
ЗАКЛЮЧЕНИЕ
Разработка противолучевых средств в России находится в кризисном состоянии. Основными причинами этого являются отсталость исследовательской инфраструктуры, особенно, в части γ-облучательских установок, ограниченность экспериментальных моделей исследования и игнорирование медикаментозной обеспеченности реальных сценариев лучевого поражения человека.
Лучевые воздействия с проявлениями острой лучевой болезни номинально обеспечены официнальными противолучевыми препаратами, однако их совершенствованию и поддержанию производства путем их внедрения в общемедицинскую практику уделяется совершенно недостаточное внимание. Что же касается разработки препаратов для ослабления отдаленных последствий (рак, лейкоз, фиброз) низкоинтенсивного лучевого воздействия (сценарии: пребывание в зонах с повышенным уровнем радиации, космические полеты), то здесь за редким исключением, иллюстрируемым материалом данной статьи, исследования практически отсутствуют. В этом случае отсталость научно-исследовательской инфраструктуры сказывается особенно сильно.
На пути доведения исследуемого препарата до статуса медицинского непреодолимым препятствием стоят существующие нормативные документы, требующие проведения 2–3-й стадий клинических испытаний на фактически облученных пациентах, что по целому ряду причин просто невозможно. Поэтому вопрос о незамедлительной разработке новых нормативных документов для проведения доклинических исследований и клинических испытаний стоит особенно остро.
Основным отличием новых Методических указаний по доклиническому исследованию потенциальных противолучевых средств профилактической и лечебной направленности от предыдущих документов должен стать, с одной стороны, отказ от обязательности непосредственной оценки эффективности этих средств на трех видах лабораторных животных (особенно на крупных) и от экстраполяционного расчета их эффективных доз для человека, а с другой стороны – акцент на всемерном использовании индикационного подхода как в доклинических исследованиях (разработка маркеров повышенной радиорезистентности), так и в клинических испытаниях (применение указанных маркеров в отсутствие лучевого воздействия).
Список литературы
Баранов А.Е., Рождественский Л.М. Аналитический обзор схем лечения острой лучевой болезни, используемых в клинике и эксперименте // Радиац. биология. Радиоэкология. 2008. Т. 48. № 3. С. 287–302.
Ильин Л.А., Рудный Н.М., Суворов Н.Н. и др. Индралин – радиопротектор экстренного действия. М.: Вторая типография МЗ РФ, 1994. 436 с.
Рождественский Л.М. Итоги Чернобыльской аварии с дистанции в 30 лет // Радиац. биология. Радиоэкология. 2016. Т. 56. № 3. С. 274–284.
Гершанович М.Л., Аксенова Л.В. Беталейкин (рекомбинантный интерлейкин1β) – эффективный стимулятор и протектор лейкопоэза в условиях комбинированной химиотерапии злокачественных опухолей: Пособие для врачей. СПб.: Новая Альтернативная Полиграфия, 2008. С. 1–16.
Самсонова А.С., Филимонова М.В., Корнеева Т.С. и др. Оценка способности соединения Т1023 к селективной защите нормальных тканей на экспериментальной модели карциномы Эрлиха // Тез. докл. Междунар. конф. “Проблемы химической защиты и репарации при радиационных воздействиях”, Дубна, 30–31 мая 2018 г. Дубна, 2018. С. 118.
Филимонова М.В., Ульяненко С.Е., Шевченко Л.И. и др. Радиозащитные свойства ингибитора NO-синтаз Т1023: II. Способность к селективной защите нормальных тканей при лучевой терапии новообразований // Радиац. биология. Радиоэкология. 2015. Т. 55. № 3. С. 260–266.
Рождественский Л.М. Классификация противолучевых средств в аспекте их фармакологического сигнала и сопряженности со стадией развития лучевого поражения // Радиац. биология. Радиоэкология. 2017. Т. 57. № 2. С. 117–135.
Тимошевский А.А. Клинико-экспериментальное обоснование применения интерлейкина-1β для профилактики и терапии поражений при радиационных авариях: Автореф. дис. … д-ра мед. наук. СПб., 2009. 43 с.
Вернигорова Л.А., Чертков К.С., Крылов К.П. Радиозащитное действие рибоксина при различных режимах радиационного воздействия // Химия, фармакология и механизмы действия противолучевых средств. М., 1990. С. 16–17.
Рождественский Л.М., Михайлов В.Ф., Шлякова Т.Г. и др. Поиск противолучевых препаратов на модели пролонгированного облучения мышей с низкой мощностью дозы и оценка их влияния на экспрессию генов белков теплового шока // Радиац. биология Радиоэкология. 2015. Т. 55. № 4. С. 420–430.
Рождественский Л.М., Шлякова Т.Г., Трубицина К.Ю. и др. Профилактическое применение противолучевых средств у мышей при низкоинтенсивном γ-облучении // Радиац. биология. Радиоэкология. 2017. Т. 57. № 6. С. 608–620.
Рождественский Л.М., Михайлов В.Ф., Шуленина Л.В. и др. Оценка влияния противолучевых средств на экспрессию генов и микроРНК, регулирующих апоптоз и пролиферацию, у мышей, подвергшихся низкомощностному воздействию γ-излучения: Отдаленные эффекты // Радиац. биология. Радиоэкология. 2018. Т. 58. № 6. С. 608–618.
Воробьева Н.Ю., Грехова А.К., Трубицина К.Ю. и др. Интерлейкин-1β способен снижать проявления отдаленных последствий пролонгированного воздействия низкоинтенсивного гамма-излучения // Бюл. эксперим. биол. мед. 2016. Т. 160. № 4. С. 470–473.
Методические указания по экспериментальному и клиническому изучению радиопротекторов. Министерство здравоохранения СССР. М., 1978. 32 с.
Методические указания по экспериментальному и клиническому изучению средств терапии радиационных поражений и медико-биологические требования к этим средствам. Министерство здравоохранения СССР. М., 1978. 48 с.
Методические указания по доклиническому изучению радиопротекторных свойств фармакологических веществ. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Министерство здравоохранения Российской федерации. М., 2000. С. 337–339.
Рождественский Л.М. Механизмы радиозащитного эффекта и индикация эффективности радиопротекторов. М.: Энергоатомиздат, 1985. 128 с.
Владимиров В.Г., Джаракьян Т.К. Радиозащитные эффекты у животных и человека. М.: Энергоиздат, 1982. 88 с.
Krivokrysenko V.I., Shakhov A.N., Gudkov A.V., Feinstein E. Identification of G-CSF and IL-6 as Candidate Biomarkers of CBLB502 Efficacy as a Medical Radiation Countermeasure // JPET Fast Forward. July 26, 2012. JPET № 196071. P. 1–46.
Кулинский В.И. Радиопротектоы рецепторного действия // Радиац. биология. Радиоэкология. 1993. Т. 33. № 6. С. 831–846.
Рождественский Л.М. Актуальные вопросы поиска и исследования противолучевых средств // Радиац. биология. Радиоэкология. 2013. Т. 53. № 5. С. 513–520.
Камышников В.С. Онкомаркеры: Методы определения, референтные значения, интерпретация тестов. М.: МЕДпрессинформ, 2011. 128 с.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


