Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 214-221
ИНГИБИРОВАНИЕ РЕПАРАЦИИ ДВУНИТЕВЫХ РАЗРЫВОВ ДНК В КЛЕТКАХ КОЛОРЕКТАЛЬНОГО РАКА ЧЕЛОВЕКА С ПОМОЩЬЮ НИКЛОЗАМИДА
А. С. Жирник *, Ю. П. Сёмочкина, Е. Ю. Москалёва
НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: as.zhirnik@mail.ru
Поступила в редакцию 25.06.2018
Аннотация
В работе исследовано радиосенсибилизирующее действие никлозамида в отношении клеток аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR и молекулярные механизмы, лежащие в его основе. Оценивали выживаемость опухолевых клеток при действии никлозамида, γ-излучения и их комбинации. Уровень MDR1, Bcl-2, β-катенина и гистона γH2AX – маркера двунитевых разрывов (ДР) ДНК – определяли при использовании иммуноцитохимических методов с помощью проточной цитофлуориметрии. Показано, что совместное действие никлозамида и γ-излучения приводило к более интенсивной гибели опухолевых клеток, чем при действии никлозамида и γ-излучения по отдельности. Обнаружено снижение уровня β-катенина в клетках линии COLO 320 HSR при действии никлозамида, которое было более интенсивным при совместном действии никлозамида и облучения. В то же время содержание β-катенина в клетках линии SW837 оставалось неизменным при действии никлозамида, γ-излучения и их комбинированном применении. Никлозамид не приводил к образованию ДР ДНК в необлученных клетках и не увеличивал их уровень через 1 ч после радиационного воздействия. Обработка клеток перед облучением никлозамидом приводила к тому, что уровень гистона γH2AX, отражающий количество ДР ДНК, через 24 ч после облучения в 1.6 раза превышал таковой в интактных клетках и клетках, подвергшихся воздействию только радиации. Это свидетельствует об ингибировании репарации индуцированных γ-излучением ДР ДНК. Таким образом, никлозамид обладает радиосенсибилизирующим действием в отношении клеток колоректального рака человека, в основе которого лежит ингибирование репарации ДР ДНК. Ингибирование сигнального пути Wnt/β-катенин при действии никлозамида обнаруживается не во всех типах опухолевых клеток.
Лучевая терапия является одним из основных методов лечения колоректального рака (КРР) [1]. Эффективность лучевой терапии может быть недостаточной при высокой радиоустойчивости опухолевых клеток. Поэтому актуальной проблемой является поиск новых малотоксичных радиосенсибилизаторов, способных повышать чувствительность опухолевых клеток к действию ионизирующего излучения [2, 3].
Результаты многочисленных исследований последних лет указывают на то, что антигельминтный препарат никлозамид (5-хлор-N-(2-хлор-4-нитрофенил)-2-гидроксибензамид) обладает цитотоксической активностью в отношении различных типов опухолевых клеток, в основе которой, как показано ранее, лежит нарушение функциональной активности митохондрий и ингибирование ряда сигнальных путей, включая Wnt/β-катенин, STAT3, Notch, NF-κB и mTOR [4, 5]. Кроме того, обнаружена способность никлозамида повышать чувствительность опухолевых клеток к облучению [6–8]. Lee и соавт. показали, что совместное использование никлозамида и γ-излучения приводит к повышению уровня фосфорилированных белков p38 MAPK и c-Jun в клетках линии H1299 и увеличению количества клеток в состоянии апоптоза до более высоких значений, чем в случае воздействия каждого из этих факторов по отдельности [6]. Также обнаружено, что никлозамид блокирует вызванную облучением активацию сигнальных путей STAT3/Bcl-2/Bcl-XL и mTOR и повышает чувствительность клеток рака легкого с приобретенной радиоустойчивостью к действию радиации in vitro и in vivo [7]. Радиосенсибилизирующая активность никлозамида в отношении клеток рака легкого может быть обусловлена также ингибированием молекулярного каскада HIF-1α/VEGF [8].
Целью данной работы было исследование радиосенсибилизирующей активности никлозамида в отношении клеток аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR, и молекулярных механизмов, лежащих в ее основе. В частности, было исследовано влияние никлозамида, облучения и их совместного действия на уровень β-катенина, отражающего активность сигнальной системы Wnt, и на уровень гистона γH2AX, отражающего количество двунитевых разрывов (ДР) ДНК. Уровень ДР ДНК исследовали через 1 ч – время накопления максимального количества ДР ДНК – и через 24 ч после облучения – время завершения репарации ДР ДНК и возвращения содержания гистона γH2AX к исходному уровню – уровню контроля.
МАТЕРИАЛЫ И МЕТОДИКА
Реактивы. Никлозамид, 0.4%-ный раствор трипанового синего, диметилсульфоксид (ДМСО) и бычий сывороточный альбумин приобретены в компании “Sigma-Aldrich” (США). Параформальдегид приобретен в компании “Panreac” (Испания). Никлозамид растворяли в ДМСО и хранили в виде стока с концентрацией 10 ммоль/л при –20°С. Для достижения нужной концентрации готовили разведения стока никлозамида в культуральной среде; содержание ДМСО при добавлении никлозамида к клеткам не превышало 0.1% и не оказывало токсического действия на клетки.
Культивирование клеток. Клетки аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR приобретены в Институте цитологии РАН (Санкт-Петербург, Россия). Клетки культивировали в среде DMEM с высоким содержанием глюкозы (“Gibco”, США), содержащей 10% сыворотки плодов крупного рогатого скота (СПК; “HyClone”, США) и 50 мкг/мл гентамицина (“ICN”, США), в пластиковых культуральных флаконах (“Corning-Costar”, США) в СО2-инкубаторе при 37°C в увлажненной атмосфере, содержащей 5% СО2.
Анализ выживаемости клеток. Клетки высевали в 12-луночные культуральные планшеты по 40 тыс. клеток/лунку за сутки до исследования, инкубировали с никлозамидом в концентрации 2 мкмоль/л в течение 24 ч и подвергали воздействию γ-излучения (60Co, 0.75 Гр/мин, установка “ГУТ-200М”) в дозе 2 Гр при комнатной температуре. Через 1 ч после облучения заменяли среду на среду без никлозамида и продолжали культивирование клеток в течение 7 сут. Выживаемость определяли по количеству живых клеток в контрольных и опытных пробах с помощью камеры Горяева после окрашивания трипановым синим.
Анализ содержания белков MDR1 и Bcl-2. Для анализа уровня MDR1 клетки трижды промывали фосфатно-солевым буферным раствором (ФСБ, рН 7.4), суспендировали в 100 мкл ФСБ, содержащего 3% СПК, в концентрации 2 × 106 клеток/мл и инкубировали с моноклональными антителами мыши к CD243 (MDR1), меченными фико-эритрином (1:20, “BioLegend”, США), в течение 60 мин при 4°С в темноте. Затем клетки отмывали в ФСБ, содержащем 3% СПК. Для измерения здесь и далее использовали не менее 20 тыс. клеток. Для получения отрицательного контроля использовали изотипические моноклональные антитела мыши, меченные фикоэритрином (1:20, “BioLegend”, США). Долю окрашенных клеток и среднюю интенсивность их флуоресценции анализировали при длине волны возбуждения 488 нм и полосе пропускания 585 нм на проточном цитофлуориметре BD FACSCalibur (“BD Biosciences”, США).
Для анализа уровня Bcl-2 клетки промывали ФСБ, фиксировали в 2%-ном растворе параформальдегида в течение 20 мин при комнатной температуре. Образцы хранили в ФСБ, содержащем 0.02% NaN3, при 4°C до проведения измерений. Перед исследованием клетки пермеабилизировали с помощью ФСБ, содержащего 0.25% тритона X-100 и 2% бычьего сывороточного альбумина, в течение 30 мин при комнатной температуре. Затем отмывали в ФСБ, содержащем 0.1% тритона X-100 и 10% СПК, и инкубировали с первичными моноклональными антителами мыши к Bcl-2 (1:20, “Sigma-Aldrich”, США) в течение 60 мин при комнатной температуре. Потом отмывали и инкубировали со вторичными поликлональными антителами козы к иммуноглобулинам мыши, меченными Alexa Fluor 488 (1:200, “BioLegend”, США), в течение 60 мин при комнатной температуре. Затем отмывали в ФСБ, содержащем 0.1% тритона X-100 и 10% СПК. Для получения отрицательного контроля использовали вторичные антитела. Долю окрашенных клеток и среднюю интенсивность их флуоресценции анализировали, как описано выше, но при длине волны возбуждения 488 нм и полосе пропускания 530 нм.
Анализ содержания β-катенина. Клетки высевали в 6 см чашки Петри в количестве 2 × 106 клеток/чашку за сутки до исследования, инкубировали с никлозамидом в концентрации 2 мкмоль/л в течение 4 ч, подвергали воздействию γ-излучения в дозе 2 Гр и инкубировали в среде, содержащей никлозамид, в течение 24 ч. Через 24 ч после облучения эти клетки, а также контрольные клетки и клетки, обработанные никлозамидом в концентрации 2 мкмоль/л, снимали с подложки, промывали ФСБ, фиксировали в 2%-ном растворе параформальдегида в течение 20 мин при комнатной температуре. Образцы хранили в ФСБ, содержащем 0.02% NaN3, при 4°C до проведения измерений. Перед исследованием клетки перме-абилизировали с помощью ФСБ, содержащего 0.25% тритона X-100 и 3% СПК, в течение 30 мин при комнатной температуре. Отмывали и инкубировали с моноклональными антителами мыши к β-катенину, меченными Alexa Fluor 488 (1:100, “eBioscience”, США), в ФСБ, содержащем 3% СПК, в течение 60 мин при комнатной температуре, а затем отмывали в ФСБ, содержащем 3% СПК. Для получения отрицательного контроля использовали изотипические моноклональные антитела мыши, меченные Alexa Fluor 488 (1:100, “BD Pharmingen”, США). Долю окрашенных клеток и среднюю интенсивность их флуоресценции анализировали, как описано выше.
Анализ содержания гистона γН2АХ. Клетки линий SW837 и COLO 320 HSR за сутки до исследования высевали в 3.5 см чашки Петри в количестве 700 и 500 тыс. клеток/чашку соответственно, инкубировали с никлозамидом в концентрации 2 мкмоль/л в течение 4 ч, подвергали воздействию γ-излучения в дозе 2 Гр и культивировали в присутствии никлозамида в течение 1 ч или 24 ч. Через 1 ч и 24 ч после облучения эти клетки, а также контрольные клетки и клетки, обработанные никлозамидом в концентрации 2 мкмоль/л, снимали с подложки, промывали ФСБ и фиксировали в абсолютном метаноле при 4°С в течение 20 мин. Образцы хранили в абсолютном метаноле при –20°C до проведения измерений. Перед исследованием клетки отмывали от метанола, инкубировали с моноклональными антителами мыши к гистону γH2AX, меченными Alexa Fluor 488 (1:100, “BD Pharmingen”, США), в ФСБ, содержащем 3% СПК, в течение 60 мин при комнатной температуре, отмывали в ФСБ, содержащем 3% СПК. Для получения отрицательного контроля использовали изотипические моноклональные антитела мыши, меченные Alexa Fluor 488 (1:100, “BD Pharmingen”, США). Долю окрашенных клеток и среднюю интенсивность их флуоресценции анализировали, как описано выше.
Статистическая обработка. Статистическую обработку результатов проводили с помощью программы OriginPro (“OriginLab”, США) с использованием однофакторного дисперсионного анализа. Данные представляли в виде средних значений и стандартной ошибки среднего. Статистически значимыми считали различия при р < 0.05.
В работе использован проточный цитофлуориметр BD FACSCalibur ресурсного центра молекулярной и клеточной биологии.
РЕЗУЛЬТАТЫ
Анализ экспрессии белков MDR1 и Bcl-2 в клетках линий SW837 и COLO 320 HSR
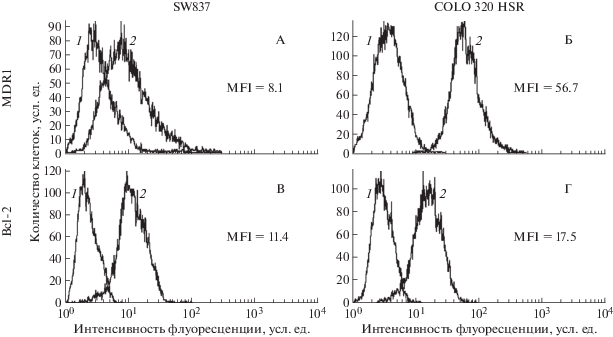
Уровень экспрессии MDR1 (ABC-транспортер ABCB1) и Bcl-2 в клетках КРР человека определяли после инкубации с соответствующими антителами с помощью проточной цитофлуориметрии. Обнаружен более высокий уровень экспрессии белка MDR1 в клетках карциномы сигмовидной кишки человека линии COLO 320 HSR, чем в клетках аденокарциномы прямой кишки человека линии SW837 (рис. 1, А, Б). В то же время содержание белка Bcl-2 в клетках обеих линий было близким (рис. 1, В, Г).
Рис. 1.
Экспрессия белков MDR1 (А, Б) и Bcl-2 (В, Г) в клетках КРР человека линий SW837 (A, В) и COLO 320 HSR (Б, Г). 1 – аутофлуоресценция; 2 – флуоресценция клеток, окрашенных соответствующими антителами. MFI – средняя интенсивность флуоресценции, усл. ед. Данные одного из трех типичных экспериментов.
Влияние никлозамида на радиочувствительность клеток линий SW837 и COLO 320 HSR
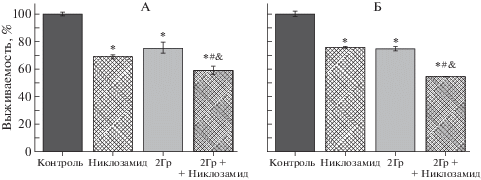
Для определения радиосенсибилизирующего действия никлозамида в отношении клеток аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR исследовали их выживаемость после инкубации с препаратом в течение 24 ч через 7 сут после облучения. Ранее нами было показано, что значение IC50 никлозамида как для клеток линии SW837, так и для клеток линии COLO 320 HSR составляет 2 мкмоль/л при их культивировании в присутствии препарата в течение 3 сут [9, 10]. В то же время для адекватной оценки влияния облучения на выживаемость опухолевых клеток, определяемую по клоногенной активности или по количеству живых клеток, необходимо более длительное культивирование, составляющее не менее 7 сут. Увеличение длительности культивирования клеток в присутствии никлозамида в указанной концентрации с 3 до 7 сут приводило к гибели 80–90% клеток. Поэтому для исследования радиосенсибилизирующей активности никлозамида при культивировании клеток КРР в течение 7 сут предварительно были подобраны условия, обеспечивающие относительно низкую цитотоксическую активность этого препарата: клетки инкубировали с никлозамидом в концентрации 2 мкмоль/л в течение 24 ч, затем облучали в дозе 2 Гр и через 1 ч после облучения среду с никлозамидом удаляли и добавляли свежую среду. Как следует из рис. 2, выживаемость опухолевых клеток линий SW837 и COLO 320 HSR при действии никлозамида в этих условиях снижалась до 68.7 ± 1.3% и 76.0 ± 0.6% от контроля соответственно, что было сравнимо с действием γ-излучения в дозе 2 Гр. Использование никлозамида в комбинации с облучением приводило к более глубокому снижению выживаемости клеток линий SW837 и COLO 320 HSR – до 58.7 ± ± 3.2% и 54.6 ± 0.2% от контроля соответственно. Полученные данные свидетельствуют о том, что никлозамид повышает эффективность действия γ-излучения на клетки исследованных линий in vitro.
Рис. 2.
Влияние никлозамида (2 мкмоль/л), γ-излучения (2 Гр) и их комбинации на выживаемость клеток линий SW837 (А) и COLO 320 HSR (Б) через 7 сут после облучения. Данные представлены в процентах от контроля. * Отличия от контроля статистически значимы, р < 0.05; & – отличия от действия никлозамида статистически значимы, р < 0.05; # – отличия от действия γ-излучения статистически значимы, р < 0.05.
Влияние никлозамида и γ-излучения на активность сигнального пути Wnt/β-катенин в клетках линий SW837 и COLO 320 HSR
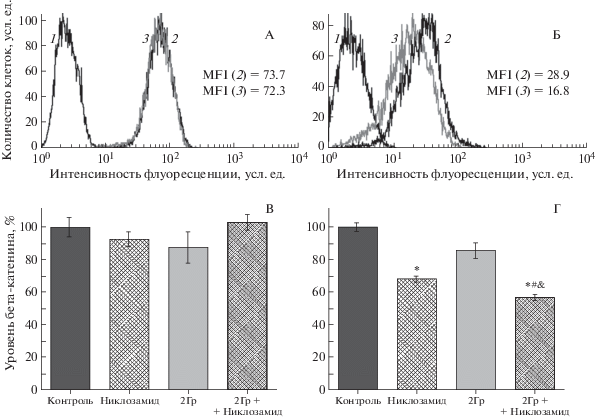
С помощью проточной цитофлуориметрии было обнаружено, что клетки аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR экспрессируют β-катенин, что свидетельствует об активном состоянии канонического сигнального пути Wnt в данных клетках (рис. 3, А, Б). Уровень β-катенина в клетках линии SW837 оставался практически неизменным, как при действии никлозамида в концентрации 2 мкмоль/л, так и γ-излучения в дозе 2 Гр (рис. 3, В). В облученных клетках данной линии, культивируемых в среде с добавлением никлозамида, количество β-катенина также было сравнимо с контролем (рис. 3, А, В). Уровень β-катенина в клетках линии COLO 320 HSR снижался при действии никлозамида в концентрации 2 мкмоль/л и γ-излучения в дозе 2 Гр до 67.9 ± 2.3% и 86.1 ± 4.5% от контроля соответственно (рис. 3, Г). Совместное действие никлозамида и γ-излучения на клетки линии COLO 320 HSR приводило к статистически значимому снижению уровня β-катенина (рис. 3, Б), более глубокому, чем при действии никлозамида и γ-излучения по отдельности (рис. 3, Г).
Рис. 3.
Уровень β-катенина в клетках линий SW837 (А, В) и COLO 320 HSR (Б, Г) после действия никлозамида (2 мкмоль/л), γ-излучения (2 Гр) и их комбинации. Окрашивание антителами к β-катенину. 1 – аутофлуоресценция; 2 – флуоресценция контрольных клеток; 3 – флуоресценция клеток при совместном действии никлозамида и γ-излучения. MFI – средняя интенсивность флуоресценции, усл. ед. * Отличия от контроля статистически значимы, р < 0.05; & – отличия от действия никлозамида статистически значимы, р < 0.05; # – отличия от действия γ-излучения статистически значимы, р < 0.05.
Определение уровня ДР ДНК в клетках линий SW837 и COLO 320 HSR при действии никлозамида и γ-излучения
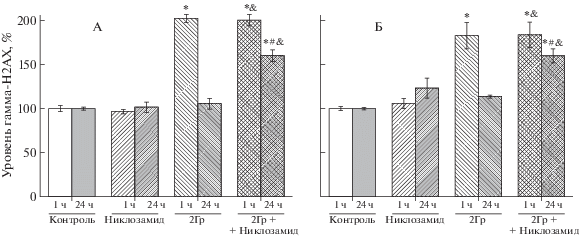
Об уровне накопления и репарации ДР ДНК в опухолевых клетках судили по содержанию гистона γH2AX через 1 ч и 24 ч после облучения (рис. 4). Действие γ-излучения в дозе 2 Гр приводило к увеличению уровня гистона γH2AX в 2.0 и 1.8 раз относительно фонового уровня в клетках аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR соответственно через 1 ч после облучения. Через 24 ч уровень гистона γH2AX в облученных клетках снижался до исходного значения. При культивировании клеток линий SW837 и COLO 320 HSR в присутствии никлозамида в концентрации 2 мкмоль/л не наблюдали изменения уровня гистона γH2AX в соответствующие интервалы времени. В то же время при совместном действии никлозамида и γ-излучения полного восстановления количества ДР ДНК в опухолевых клетках обеих линий не происходило, и их количество в 1.6 раз превышало фоновый уровень.
Рис. 4.
Уровень гистона γН2АХ в клетках линий SW837 (А) и COLO 320 HSR (Б) после действия никлозамида (2 мкмоль/л), γ-излучения (2 Гр) и их комбинации через 1 ч и 24 ч после облучения. Окрашивание антителами к гистону γН2АХ. Значение MFI в контроле составило 8.2 и 5.0 усл. ед. для клеток линий SW837 и COLO 320 HSR соответственно. Данные представлены в процентах от контроля. * Отличия от контроля значимы, р < 0.05; & – отличия от действия никлозамида статистически значимы, р < 0.05; # – отличия от действия γ-излучения через 24 ч статистически значимы, р < 0.05.
ОБСУЖДЕНИЕ
Перспективным способом повышения эффективности лучевой терапии, широко применяемой при лечении рака прямой кишки, представляется использование радиосенсибилизаторов, повышающих чувствительность опухолевых клеток к действию излучения.
Согласно данным литературы, никлозамид проявляет радиосенсибилизирующую активность в отношении опухолевых клеток после проникновения через плазматическую мембрану и взаимодействия с внутриклеточными мишенями. Ввиду высокой гидрофобности [11], никлозамид может быть субстратом ABC-транспортеров, и, в первую очередь, белка ABCB1 (MDR1), и не исключено, что в конечном итоге это приведет к снижению эффективности его радиосенсибилизирующего действия. В то же время показано, что высокий уровень экспрессии белка Bcl-2 препятствует гибели опухолевых клеток под действием излучения благодаря ингибированию развития апоптоза [12]. При исследовании уровня экспрессии белков MDR1 и Bcl-2 в клетках КРР линий SW837 и COLO 320 HSR обнаружено (рис. 1), что клетки обеих линий экспрессируют белки MDR1 и Bcl-2, а следовательно могут быть устойчивы к действию излучения и ряда противоопухолевых препаратов.
При исследовании радиосенсибилизирующей активности никлозамида в отношении клеток аденокарциномы прямой кишки человека линии SW837 и карциномы сигмовидной кишки человека линии COLO 320 HSR в выбранных условиях никлозамид приводил к снижению выживаемости клеток линий SW837 и COLO 320 HSR до 68.7 ± 1.3% и 76.0 ± 0.6% от контроля соответственно (рис. 2). Опухолевые клетки подвергали воздействию γ-излучения в дозе 2 Гр, соответствующей разовой дозе, используемой при фракционированном облучении опухолей. Выживаемость клеток обеих исследованных линий через 7 сут после облучения составила около 70% от контроля. Показано, что при совместном действии никлозамида и облучения выживаемость клеток линий SW837 и COLO 320 HSR снижалась до 58.7 ± 3.2 и 54.6 ± 0.2% от контроля соответственно. Полученные результаты свидетельствуют о высокой радиосенсибилизирующей активности никлозамида (рис. 2).
Известно, что в клетках КРР вследствие мутаций в генах, кодирующих белки “дестабилизирующего комплекса” (APC, Axin) и β-катенин, происходит активация канонического сигнального пути Wnt [13]. Ингибирование указанного молекулярного каскада под действием никлозамида может обусловливать, по крайней мере отчасти, его цитотоксическое действие в отношении опухолевых клеток [14]. Снижение активности сигнального пути Wnt/β-катенин рассматривается также в качестве возможного механизма радиосенсибилизирующего действия никлозамида в отношении клеток трижды негативного рака молочной железы [15]. Исходя из этого, повышение чувствительности клеток КРР исследуемых линий к действию излучения с помощью никлозамида могло бы быть следствием ингибирования сигнального пути Wnt/β-катенин. Для исследования влияния никлозамида на систему Wnt/β-катенин клетки инкубировали с препаратом в концентрации 2 мкмоль/л в течение 28 ч. При изучении совместного действия никлозамида и облучения на данный сигнальный путь клетки инкубировали с никлозамидом в течение 4 ч, подвергали воздействию γ-излучения и далее культивировали облученные клетки в среде с никлозамидом в концентрации 2 мкмоль/л еще в течение 24 ч. Содержание β-катенина в клетках линии SW837 оставалось неизменным при действии никлозамида в концентрации 2 мкмоль/л, облучения в дозе 2 Гр и их комбинации (рис. 3, А, В). Напротив, уровень β-катенина в клетках линии COLO 320 HSR снижался до 67.9 ± 2.3 и 86.1 ± 4.5% от контроля при действии никлозамида в концентрации 2 мкмоль/л и γ-излучения в дозе 2 Гр соответственно. При комбинированном применении никлозамида и γ-излучения в клетках данной линии наблюдали более глубокое снижение уровня β-катенина (рис. 3, Б) в сравнении с действием никлозамида и γ-излучения по отдельности (рис. 3, Г). Полученные данные свидетельствуют об ингибировании системы Wnt под действием никлозамида в клетках линии COLO 320 HSR. Однако совокупность данных, полученных в отношении действия никлозамида на клетки линии SW837 в сравнении с его действием на клетки линии COLO 320 HSR, свидетельствует о наличии и иных механизмов, обусловливающих цитотоксическую и радиосенсибилизирующую активность никлозамида в отношении клеток КРР.
Действие γ-излучения на клетки сопровождается индукцией повреждений ДНК. Репарация ДР ДНК, наиболее тяжелого типа повреждений ДНК при действии γ-излучения, сопровождается каскадом реакций фосфорилирования, что требует значительного расхода энергии АТФ. В ряде исследований было показано, что никлозамид разобщает клеточное дыхание и окислительное фосфорилирование и приводит к снижению уровня АТФ в различных типах опухолевых клеток [16–21], в том числе в клетках КРР [22]. Это позволило предположить, что никлозамид может опосредованно ингибировать репарацию ДР ДНК, снижая уровень АТФ в опухолевых клетках. Способность никлозамида влиять на количество индуцированных излучением ДР ДНК была недавно показана в отношении клеток аденокарциномы молочной железы человека линии MCF-7 [23] и карциномы носоглотки человека линий CNE-2 и HONE-1 [24]. При изучении влияния никлозамида на процесс репарации ДР ДНК, вызванных облучением, клетки инкубировали с никлозамидом в концентрации 2 мкмоль/л в течение 4 ч, подвергали воздействию γ-излучения в дозе 2 Гр и далее культивировали облученные клетки в среде с никлозамидом еще в течение 1 ч и 24 ч. При исследовании уровня гистона γH2AX, который рассматривают как суррогатный маркер ДР ДНК, в клетках линий SW837 и COLO 320 HSR было обнаружено увеличение ДР ДНК через 1 ч после действия γ-излучения (рис. 4). Через 24 ч после облучения было обнаружено полное восстановление уровня гистона γH2AX в клетках обеих исследованных линий КРР, в то время как в клетках, предварительно обработанных никлозамидом, уровень γH2AX оставался в 1.6 раза выше, чем в контрольных клетках (рис. 4). Полученные результаты свидетельствуют об интенсивном ингибировании репарации ДР ДНК при облучении опухолевых клеток в присутствии никлозамида. Длительное сохранение индуцированных γ-излучением ДР ДНК в клетках из-за ингибирования процессов репарации в присутствии никлозамида может приводить к блоку клеточного цикла и гибели опухолевых клеток в более поздние сроки.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о том, что никлозамид повышает чувствительность клеток КРР человека к действию γ-излучения, несмотря на высокий уровень экспрессии в них белков MDR1 и Bcl-2, определяющих устойчивость опухолевых клеток к разным повреждающим воздействиям. Ингибирование сигнального пути Wnt/β-катенин в опухолевых клетках не является единственно возможным механизмом действия никлозамида, так как оно, в отличие от ингибирования репарации ДР ДНК, обнаруживается не во всех типах клеток КРР. Полученные результаты позволяют заключить, что в основе радиосенсибилизирующего действия никлозамида лежит именно ингибирование репарации ДР ДНК, которое может быть опосредовано повреждением митохондрий и снижением уровня АТФ в опухолевых клетках.
Список литературы
Hafner M.F., Debus J. Radiotherapy for Colorectal Cancer: Current Standards and Future Perspectives // Visc. Med. 2016. V. 32. № 3. P. 172–177.
Ding M., Zhang E., He R. et al. Newly developed strate-gies for improving sensitivity to radiation by targeting signal pathways in cancer therapy // Cancer Sci. 2013. V. 104. № 11. P. 1401–1410.
Kumar S., Singh R.K., Meena R. Emerging targets for radioprotection and radiosensitization in radiotherapy // Tumour Biol. 2016. V. 37. № 9. P. 11589–11609.
Li Y., Li P.K., Roberts M.J. et al. Multi-targeted therapy of cancer by niclosamide: A new application for an old drug // Cancer Lett. 2014. V. 349. № 1. P. 8–14.
Москалева Е.Ю., Перевозчикова В.Г., Жирник А.С. и др. Молекулярные механизмы противоопухолевой активности никлозамида // Биомед. химия. 2015. Т. 6. № 61. С. 680–693.
Lee S.L., Son A.R., Ahn J. et al. Niclosamide enhances ROS-mediated cell death through c-Jun activation // Biomed. Pharmacother. 2014. V. 68. № 5. P. 619–624.
You S., Li R., Park D. et al. Disruption of STAT3 by niclosamide reverses radioresistance of human lung cancer // Mol. Cancer Ther. 2014. V. 13. № 3. P. 606–616.
Xiang M., Chen Z., Yang D. et al. Niclosamide enhances the antitumor effects of radiation by inhibiting the hypoxia-inducible factor-1alpha/vascular endothelial growth factor signaling pathway in human lung cancer cells // Oncol. Lett. 2017. V. 14. № 2. P. 1933–1938.
Жирник А.С., Семочкина Ю.П., Москалева Е.Ю. и др. Молекулярные механизмы противоопухолевой активности полимерной формы никлозамида в отношении клеток колоректального рака // Биомед. химия. 2017. Т. 63. № 2. С. 132–138.
Жирник А.С., Семочкина Ю.П., Москалева Е.Ю. и др. Антипролиферативная активность никлозамида в отношении клеток меланомы и колоректального рака // Xим.-фаpм. жуpн. 2016. Т. 50. № 7. С. 40–43.
World Health Organization. Specifications and evaluations for public health pesticides: Niclosamide. Geneva: WHO Press, 2002.
Mirkovic N., Voehringer D.W., Story M.D. et al. Resistance to radiation-induced apoptosis in Bcl-2-expres-sing cells is reversed by depleting cellular thiols // Oncogene. 1997. V. 15. № 12. P. 1461–1470.
Zhan T., Rindtorff N., Boutros M. Wnt signaling in cancer // Oncogene. 2017. V. 36. № 11. P. 1461–1473.
Osada T., Chen M., Yang X.Y. et al. Antihelminth compound niclosamide downregulates Wnt signaling and elicits antitumor responses in tumors with activating APC mutations // Cancer Res. 2011. V. 71. № 12. P. 4172–4182.
Yin L., Gao Y., Zhang X. et al. Niclosamide sensitizes triple-negative breast cancer cells to ionizing radiation in association with the inhibition of Wnt/beta-catenin signaling // Oncotarget. 2016. V. 7. № 27. P. 42126–42138.
Curnock A.P., Thomson T.A., Westwood R. et al. Inhibition of stimulated Jurkat cell adenosine 3',5'-cyclic monophosphate synthesis by the immunomodulatory compound HR325 // Biochem. Pharmacol. 2001. V. 61. № 2. P. 227–235.
Park S.J., Shin J.H., Kang H. et al. Niclosamide induces mitochondria fragmentation and promotes both apoptotic and autophagic cell death // BMB Rep. 2011. V. 44. № 8. P. 517–522.
Tao H., Zhang Y., Zeng X. et al. Niclosamide ethanolamine-induced mild mitochondrial uncoupling improves diabetic symptoms in mice // Nat. Med. 2014. V. 20. №11. P. 1263–1269.
Zhao J., He Q., Gong Z. et al. Niclosamide suppresses renal cell carcinoma by inhibiting Wnt/beta-catenin and inducing mitochondrial dysfunctions // Springerplus. 2016. V. 5. №1. P. 1436.
Chen L., Wang L., Shen H. et al. Anthelminthic drug niclosamide sensitizes the responsiveness of cervical cancer cells to paclitaxel via oxidative stress-mediated mTOR inhibition // Biochem. Biophys. Res. Commun. 2017. V. 484. № 2. P. 416–421.
Zhou J., Jin B., Jin Y. et al. The antihelminthic drug niclosamide effectively inhibits the malignant phenotypes of uveal melanoma in vitro and in vivo // Theranostics. 2017. V. 7. № 6. P. 1447–1462.
Mook R.A.Jr., Ren X.R., Wang J. et al. Benzimidazole inhibitors from the Niclosamide chemotype inhibit Wnt/beta-catenin signaling with selectivity over effects on ATP homeostasis // Bioorg. Med. Chem. 2017. V. 25. № 6. P. 1804–1816.
Шуватова В.Г., Кувырченкова А.П., Сёмочкина Ю.П. и др. Радиосенсибилизация опухолевых стволовых клеток аденокарциномы молочной железы человека линии MCF-7 в помощью никлозамида // Мед. радиология и радиац. безопасность. 2017. Т. 62. № 6. С. 5–11.
Li J., Li H., Zhan D. et al. Niclosamide sensitizes nasopharyngeal carcinoma to radiation by downregulating Ku70/80 expression // J. Cancer. 2018. V. 9. № 4. P. 736–744.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


