Радиационная биология. Радиоэкология, 2019, T. 59, № 2, стр. 205-213
ВЛИЯНИЕ ЛИПОСОМАЛЬНЫХ ПРЕПАРАТОВ, СОДЕРЖАЩИХ РЕКОМБИНАНТНЫЕ БЕЛКИ ЧЕЛОВЕКА АЛЬФА-ФЕТОПРОТЕИН И ГРАНУЛОЦИТАРНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР, НА ТЕЧЕНИЕ ЛУЧЕВОГО ОЖОГА КОЖИ IIIA СТЕПЕНИ У МЫШЕЙ
Е. А. Пряхин 1, *, Г. А. Тряпицына 1, 2, И. А. Шапошникова 1, М. В. Тюхай 1, 2, Ю. И. Остроумов 3, П. С. Шмелин 4, А. В. Аклеев 1, 2
1 Уральский научно-практический центр радиационной медицины ФМБА России
Челябинск, Россия
2 Челябинский государственный университет
Челябинск, Россия
3 Институт инженерной иммунологии
Московская обл., пос. Любучаны, Россия
4 ЦНИТИ “Техномаш”
Москва, Россия
* E-mail: pryakhin@yandex.ru
Поступила в редакцию 30.08.2018
Аннотация
В модели локального лучевого ожога кожи IIIA степени у мышей стока CD1 показано, что при транс-дермальной аппликации липосом, содержащих рекомбинантные белки человека (липосомы с альфа-фетопротеином (рчАФП); липосомы с гранулоцитарным колониестимулирующим фактором человека (рчГКСФ); липосомы с рчАФП и рчГКСФ), на пораженный участок кожи в течение 2 нед после облучения по клиническим показателям регистрируется существенное сокращение времени заживления ожоговой раны. Наиболее эффективным оказалось применение липосом, содержащих рчАФП: практически на 70% увеличивается длительность скрытого периода, на 60% уменьшается длительность периода влажного эпидермита, на 32% уменьшается длительность репаративной фазы и на 44% уменьшается общее время заживления по отношению к таковым показателям у мышей с нелеченным лучевым ожогом. Иммуногистохимические исследования показали, что аппликация исследуемых препаратов приводит к повышению выживаемости стволовых клеток в волосяных фолликулах кожи: наиболее выраженный эффект по гистологическим показателям регистрировался при применении липосом, содержащих рчАФП и рчГКСФ.
Радиационное повреждение кожи представляет собой комплекс поражений тканей эпидермиса, дермы и подкожных слоев. Тяжесть клинических нарушений зависит от величины дозы облучения [1]. Кожа и ее придатки являются весьма активно обновляющейся клеточной системой [2], поэтому в целом кожа достаточно радиочувствительна [3].
Радиочувствительность клеточных элементов кожи уменьшается в следующей последовательности: волосяные луковицы, эпидермис, сальные железы, подкожная соединительная ткань, эндотелий кровеносных сосудов [4]. Наиболее радиочувствительными являются стволовые клетки кожи, D0 которых составляет 1.35 Гр [5].
В механизмах развития ранних лучевых поражений кожи большое значение имеют индуцированная облучением гибель, блокирование деления стволовых клеток эпидермиса, нарушение регенерационных процессов [6]. По мере размножения и созревания клетки эпидермиса поднимаются от базального слоя к поверхности кожи, формируя роговой слой. Облучение приводит к нарушению кинетики клеточного обновления в коже: по мере того как число стволовых клеток падает, снижается поступление новых клеток из базального слоя в слой шиповатых клеток, в то же время продвижение созревающих и функционирующих клеток и их физиологическая потеря с поверхности кожи продолжаются после облучения с прежней скоростью, в результате чего эпидермис отслаивается, оголяется дерма и формируется ожоговая рана.
В работе [7] показано, что в репарации повреждений кожи участвуют как стволовые клетки эпидермиса, так и стволовые клетки волосяных фолликул. Эти клетки обладают свойствами клоногенности, мультипотентны и мигрируют в эпидермис как физиологически, так и в процессе регенерации [8, 9].
Таким образом, по степени радиочувствительности и значимости в процессах восстановления кожного эпителия критическими структурами кожи при облучении являются стволовые клетки.
В экспериментах на мышах показано, что по клиническим показателям липосомы на основе фосфолипидов, содержащие рекомбинантные белки человека альфа-фетопротеин (рчАФП) и гранулоцитарный колониестимулирующий фактора (рчГКСФ), оказывают благоприятное действие на течение лучевого ожога кожи при транс-дермальной аппликации на пораженный участок [10].
Как было сказано выше, в механизмах развития ранних лучевых поражений кожи большое значение имеют радиационно-индуцированная гибель стволовых клеток и блокирование их деления. Представляется важным изучение влияния липосомальных препаратов (отдельно рчАФП, рчКГСФ и их комбинации) на патогенез радиационного поражения кожи в модели лучевого ожога степени IIIA и сопоставление рассмотренных клинических показателей с состоянием стволовых клеток кожи.
Целью данной работы являлась оценка влияния липосомальных препаратов (липосом, содержащих белки рчАФП и рчГКСФ; липосом, содержащих рчАФП; липосом, содержащих рчГКСФ) на течение лучевого ожога кожи степени IIIA у мышей по клиническим показателям и показателям состояния стволовых клеток волосяных фолликулов кожи.
МАТЕРИАЛЫ И МЕТОДИКА
В экспериментах были использованы самцы мышей стока CD1 в возрасте 3–4 мес, массой 24–26 г, полученные из питомника НПП Питомник лабораторных животных ФИБХ РАН (г. Пущино, Московская обл.). Животных содержали в оптимальных для данного вида условиях: температура воздуха в помещении – (+22)°С; влажность воздуха – 50–60%; регулируемая длина светового дня – 12 ч; подстилочный материал – гранулят из стержней початков кукурузы (ООО “Реттенмайер Рус”, Германия). Животные содержались на стандартном рационе (гранулированный комбикорм для лабораторных животных “Чара”, г. Сергиев-Посад, Московская обл.) с неограниченной подачей питьевой воды. В эксперименте использовали здоровых животных, не подвергавшихся ранее другим экспериментальным процедурам. Группы формировали методом сплошной выборки.
Условия содержания и процедура эксперимента соответствовали общим правилам работ с использованием экспериментальных животных [11]. При проведении исследований соблюдались правила гуманного обращения с экспериментальными животными в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, утвержденными приказом Минздрава СССР (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г № 775) и стандартами Этического комитета ФГБУН УНПЦ РМ.
Получение лучевого ожога кожи степени IIIА. Местное радиационное поражение кожи у мышей выполнено в соответствии с ранее разработанной авторами методикой [12]. Согласно методике, на спине у мышей проводится депиляция участка кожи, затем с помощью специального приспособления формируется складка кожи и проводится прицельное облучение ограниченного участка складки кожи на установке, предназначенной для лучевой терапии. Эта методика исключает облучение подлежащих тканей и организма в целом. Облучение кожи животных проводили с помощью гамма-установки Theratron® Equinox (Канада) Государственного лечебно-профилактического учреждения “Челябинский областной клинический онкологический диспансер”. В данной установке использовали источник γ-излучения, содержащий 60Со. Для локального облучения кожи мышей применяли дополнительный коллиматор с круглым отверстием диаметром 14 мм. Мощность дозы в зоне кожной складки мышей составляла 1.87 Гр/мин. Таким образом, время облучения в дозе 60 Гр составило 32 мин, а площадь формируемого ожога – 1.5 см2.
Характеристика тестируемых препаратов. В эксперименте тестировали препараты:
1. Липосомы, содержащие 1 мг/мл рчАФП, 0,02 мг/мл рчГКСФ, 10 мг/мл фосфолипидов (Lipoid S80, Германия).
2. Липосомы, содержащие 1 мг/мл рчАФП, 10 мг/мл фосфолипидов.
3. Липосомы, содержащие 0.02 мг/мл рчГКСФ, 10 мг/мл фосфолипидов.
Получение рекомбинантных белков человека рчАФП и рчГКСФ и липосомальных препаратов с этими белками подробно описано в работе [10].
Схема эксперимента. Было сформировано пять групп мышей численностью по 25 животных в каждой:
1-я группа – необлученный контроль;
2-я группа – облученный контроль;
3-я группа – γ-облучение + липосомы, содержащие рчАФП и рчГКСФ;
4-я группа – γ-облучение кожи + липосомы, содержащие рчАФП;
5-я группа – γ-облучение кожи + липосомы, содержащие рчГКСФ.
В группе 1 (необлученный контроль) были выполнены депиляция кожи спины у мышей и формирование кожной складки, после чего животных помещали на стол установки на время, равное времени облучения в дозе 60 Гр, но установку не включали.
В группе 2 (облученный контроль) были выполнены депиляция кожи спины у мышей, формирование кожной складки и локальное облучение кожи в дозе 60 Гр.
В группах 2–5 были выполнены депиляция кожи спины у мышей, формирование кожной складки и локальное облучение кожи в дозе 60 Гр. Мыши 3–5-й групп получали лечение исследуемыми препаратами.
Препараты на место радиационного воздействия наносили однократно через 5 мин после облучения, затем ежедневно в течение 5 сут и далее на 7-, 9-, 11-, 13-е сут после облучения (всего 10 аппликаций). Разовые дозы составили: фосфолипиды – 2 мг; рчАФП – 0.2 мг; рчГКСФ – 0.004 мг. Суммарные дозы составили: рчАФП – 2 мг; рчГКСФ – 0.04 мг; фосфолипидов – 20 мг. Животным в группе облученного контроля по той же схеме наносили физиологический раствор. Трансдермальную аппликацию 180–200 мкл липосомального препарата и физиологический раствор проводили с использованием дозатора-распрыскивателя с расстояния 3 см от поверхности кожи с тем расчетом, что основной объем приходился на место радиационного поражения кожи.
Клинические исследования патогенеза лучевого ожога. Каждая экспериментальная группа состояла из десяти животных, которым присваивали индивидуальный номер и метили стандартными способами. Клинический осмотр каждого животного проводили ежедневно в течение 60 сут после облучения. Выполняли тщательный осмотр животного, оценивали и регистрировали в журнале визуальные признаки локального радиационного поражения кожи. Каждый день проводили фотографирование зоны лучевого ожога у мышей с целью объективного документирования клинических проявлений лучевого поражения кожи [13].
Для каждого животного по визуальным наблюдениям и фотоматериалам рассчитывали длительность деструктивной и репаративной фаз, а также отдельных периодов этих фаз. Деструктивная фаза включает латентный период, период сухого эпидермита, период влажного эпидермита; репаративная фаза включает период струпа, период эпителизации ожоговой раны [13].
Гистологические исследования кожи. Для гистологических исследований были сформированы шесть экспериментальных групп численностью по 15 мышей в каждой. Кроме перечисленных выше пяти групп, была сформирована группа биологического контроля. Все группы были введены в эксперимент одновременно. Гистологические исследования кожи проводили на 7-е (деструктивная фаза местных лучевых поражений кожи), 21-е (репаративная фаза местных лучевых поражений кожи) и 35-е (период эпителизации репаративной фазы) сутки после облучения животных с использованием рутинных методов [14]. Отбор животных по пять особей на каждый срок обследования осуществляли методом случайной выборки. Животных умерщвляли методом дислокации шейных позвонков, иссекали в месте радиационного поражения фрагмент кожи, который включал периферийные и центральный участки ожога. Материал фиксировали в 10%-ном растворе забуференного формалина (рH = 7.2) и заливали в специальную среду “Гистомикс”. С каждого блока-кассеты были изготовлены серийные плоскопараллельные срезы толщиной 4–5 мкм. Серийные гистологические срезы депарафинировали, окрашивали гематоксилином-эозином по общепринятым рутинным методикам. Анализ линейных значений и площадей исследуемых структур и подсчет волосяных фолликулов проводили при помощи программно-аппаратного комплекса для анализа и обработки изображений в микроскопии – “ВидеоТест – Морфология 5.0”.
Стволовые клетки эпидермиса определяли с помощью иммуно-гистохимической реакции с применением сыворотки CD34 (CD34 производства Dako, разведение 1/65) [15]. В каждом фолликуле определяли количество CD34+ и СD34- клеток.
Площадь поля зрения измерялась автоматически при помощи программно-аппаратного комплекса для анализа и обработки изображений в микроскопии, состоящей из тринокулярного микроскопа Motic ВА-400Т, цифровой цветной системы ввода изображений на базе цифровой камеры ProgRes СЗ, 1/1.8″ высокого разрешения (не менее 2080 × 1542) и программного обеспечения “ВидеоТест – Морфология 5.0”, и составляла 1.2 мм2.
Подсчет исследуемых показателей проводили в 10 полях зрения при увеличении ×400.
Статистический анализ. Для исследуемых показателей проводили расчет средней арифметической величины и ее стандартной ошибки. Статистическую значимость отличий показателей в экспериментальных группах определяли с использованием t-критерия Стьюдента. Различия считали статистически значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты клинических наблюдений, выполненных с использованием визуального и фотонаблюдения радиационного ожога кожи степени IIIA у мышей, представлены на рисунке 1.
Рис. 1.
Длительность периодов течения лучевого ожога кожи степени IIIA у мышей, сут. * Статистически значимые отличия от показателя в группе облученного контроля, р ≤ 0.05.
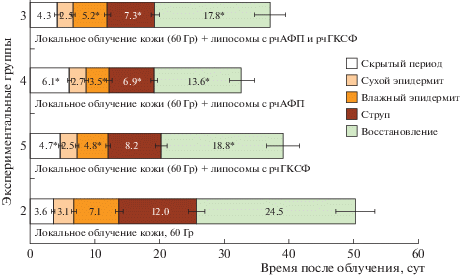
Полное заживление ожоговой раны от момента облучения до восстановления эпителия в группе облученного контроля составило 50.3 ± 3.0 сут. Длительность скрытого периода составила 3.6 ± ± 0.2 сут, сухого эпидермита – 3.1 ± 0.3 сут, длительность влажного эпидермита – 7.1 ± 0.5 сут, длительность периода струпа – 12.0 ± 1.2 сут. Длительность деструктивной фазы составила у животных этой группы 13.8 ± 0.6 сут. Начиная с 26.8 ± 1.6 сут, у животных наблюдался период эпителизации ожоговой раны (восстановление эпителия), который длился 24.5 ± 2.9 сут. Длительность репаративной фазы составила у животных этой группы 36.5 ± 3.1 сут.
При нанесении на кожу в зоне радиационного воздействия липосом, содержащих рчАФП и рчГКСФ, наблюдалось статистически значимое по отношению к показателю в облученном контроле укорочение периода влажного эпидермита до 4.3 ± 0.4 сут (t = 2.82, p = 0.01), периода струпа до 7.3 ± 0.6 сут (t = 3.40, p = 0.003). Период эпителизации в этой группе составил 17.8 ± 2.4 сут, но отличия от облученного контроля не достигали статистической значимости. Длительность деструктивной фазы у животных этой группы составила 12.0 ± 0.4 сут, репаративной фазы – 25.1 ± 2.4 сут; общее время заживления лучевого ожога кожи составило 37.1 ± 2.4 сут. Все три эти показателя были статистически значимо меньше, чем таковые в группе облученного контроля: t = 3.48, p = = 0.003; t = 2.99, p = 0.008; t = 3.45, p = 0.003 соответственно.
При нанесении на ожоговую рану липосом, содержащих рчАФП, регистрировалось статистически значимое по сравнению с группой облученного контроля удлинение скрытого периода до 6.1 ± 0.3 сут (t = 6.96, p = 0.001), сокращение периода влажного эпидермита до 3.5 ± 0.3 сут (t = 5.74, p = 0.001), периода струпа до 6.9 ± 0.5 (t = 3.79, p = = 0.001) сут. Это привело к тому, что период эпителизации у мышей данной группы регистрировался, начиная с 20 ± 0.6 сут, и составил 13.6 ± 1.9 сут, что статистически значимо меньше, чем в облученном контроле (t = 3.12, p = 0.006). Общее время заживления ожога кожи в этой группе составило 32.8 ± 2.0 сут; длительность деструктивной фазы – 12.3 ± 0.5 сут; длительность репаративной фазы – 20.5 ± 1.9. Все три эти показателя были также статистически значимо меньше, чем таковые в облученном контроле: t = 2.90, p = 0.01; t = 2.76, p = = 0.01; t = 2.46, p = 0.02 соответственно.
При нанесении на ожоговую рану липосом, содержащих рчГКСФ, также регистрировался положительный эффект по сравнению с группой облученного контроля. Выявлено статистически значимое удлинение скрытого периода до 4.7 ± ± 0.3 сут (t = 3.02, p = 0.01), укорочение периода влажного эпидермита до 4.8 ± 0.3 сут (t = 3.64, p = = 0.001) и периода струпа до 8.2 ± 0.9 сут (t = 3.64, p = <0.001). Период эпителизации у животных этой группы наблюдался с 21.3 ± 0.9 сут, и его длительность составила 18.8 ± 2.5 сут; длительность деструктивной фазы составила 12.0 ± 0.2 сут; репаративной фазы – 27.0 ± 2.5 сут; общее время заживления – 39.0 ± 3.1 сут. Все три эти показатели были статистически значимо меньше, чем таковые в группе облученного контроля: t = 2.76, p = = 0.01; t = 2.46, p = 0.02; t = 2.90, p = 0.009 соответственно.
Таким образом, по показателям длительности периодов течения лучевого ожога кожи степени IIIA у мышей исследование показало, что применение всех испытуемых препаратов оказывало благоприятное действие на течение лучевого ожога по сравнению с группой облученного контроля. Наиболее эффективным оказалось применение липосом, содержащих рчАФП: практически на 70% увеличивается длительность скрытого периода, на 60% уменьшается длительность периода влажного эпидермита, на 32% – длительность репаративной фазы и общее время заживления ожога – на 44% по отношению к облученному контролю.
При сравнении показателей клинической картины течения лучевого ожога у животных, получавших лечение различными препаратами, выявлено, что в группе, где животные получали лечение липосомами, содержащими рчАФП, статистически значимо удлинен латентный период, по сравнению с показателями в группах “γ-облучение + + липосомы c рчАФП и рчГКСФ” (t = 4.26, p = = 0.0005) и “γ-облучение + липосомы c рчГКСФ” (t = 3.76, p = 0.001) и сокращена длительность периода влажного эпидермита (соответственно t = = 3.20, p = 0.005; t = 2.91, p = 0.009). Это, несомненно, является важным положительным эффектом липосомального препарата, содержащего рчАФП, так как удлинение латентного периода увеличивает время для проведения диагностики степени поражения кожи, экстренной профилактики лучевого ожога и госпитализации больного, а сокращение длительности влажного эпидермита снижает опасность инфицирования ожоговой раны. Однако общее время заживления у животных всех трех экспериментальных групп, получавших лечение различными препаратами, не имело статистически значимых отличий друг от друга.
В гистологических исследованиях выполнено определение количества волосяных фолликулов в поле зрения, количества эпителиальных клеток в волосяных фолликулах в зоне радиационного ожога кожи. Также с использованием иммунногистохимического метода выполнено определение количества стволовых (CD34+) клеток в волосяных фолликулах.
Анализ количества волосяных фолликулов в зоне радиационного ожога показал, что локальное облучение кожи в дозе 60 Гр приводило к статистически значимому снижению количества этих придатков: на 7-е сут в зоне ожоговой раны было зарегистрировано 0.71 ± 0.15 фолликулов (при 12.58 ± 0.46 в необлученном контроле), на 21-е сут – 0.2 ± 0.06 (при 7.14 ± 0.76 в необлученном контроле) и на 35-е сут – 0.10 ± 0.05 фолликулов в поле зрения (при 12.17 ± 0.65 в необлученном контроле) (табл. 1).
Таблица 1.
Влияние липосомальных препаратов, содержащих белки рчАФП и рчГКСФ, на количество волосяных фолликулов в поле зрения (1.2 мм2), М ± m
| Экспериментальные группы | Время после облучения, сут | ||
|---|---|---|---|
| 7 | 21 | 35 | |
| количество волосяных фолликулов в поле зрения | |||
| Необлученный контроль | 12.58 ± 0.46 | 7.14 ± 0.76 | 12.17 ± 0.65 |
| Облученный контроль | 0.71 ± 0.15 | 0.20 ± 0.06 | 0.10 ± 0.05 |
| t1 = 24.6; р < 0.0001 | t1 = 9.1; р < 0.0001 | t1 = 18.6; р < 0.0001 | |
| γ-облучение + липосомы c рчАФП и рчГКСФ | 2.63 ± 0.4 | 1.80 ± 0.43 | 0.73 ± 0.20 |
| t2 = 4.5; р = 0.002 | t2 = 3.65; р = 0.006 | t2 = 3.03; р = 0.02 | |
| γ-облучение + липосомы c рчАФП | 1.64 ± 0.33 | 0.40 ± 0.11 | 0.48 ± 0.16 |
| t2 = 2.6; р = 0.03 | t3 = 3.2; р = 0.01 | ||
| γ-облучение + липосомы c рчГКСФ | 1.14 ± 0.25 | 0.65 ± 0.36 | 0.83 ± 0.21 |
| t3 = 3.2; р = 0.01 | t2 = 3.4; р = 0.01 | ||
Примечание. Здесь и далее М ± m – средняя арифметическая величина и ее стандартная ошибка; t1 – значение t-критерия Стьюдента при сравнении с показателем в необлученном контроле; t2 – значение t-критерия Стьюдента при сравнении с показателем в облученном контроле; t3 – значение t-критерия Стьюдента при сравнении с показателем в группе γ-облучение + + липосомы c рчАФП и рчГКСФ; р – уровень значимости.
Во все сроки обследования в экспериментальной группе, где после облучения животным на место радиационного поражения наносили липосомы, содержащие рчАФП и рчГКСФ, количество волосяных фолликулов в поле зрения статистически значимо превышало таковое в облученном контроле (в 3–9 раз). При аппликации липосом, содержащих рчАФП, этот показатель был существенно выше, чем в соответствующем контроле только на 7-е сут после облучения. При аппликации липосом, содержащих рчАФП, количество волосяных фолликулов статистически значимо больше, чем в облученном контроле только на 7-е сут после облучения. У животных, которым наносили липосомы, содержащие рчГКСФ, на 7-е и 21-е сут число волосяных фолликулов в поле зрения не отличалось от показателей в облученном контроле, а на 30-е сут этот показатель был статистически значимо выше, чем в облученном контроле, и имел близкое значение к показателю в группе “γ-облучение + липосомы с рчАФП и рчГКСФ”. Обращает на себя внимание, что в группе “γ-облучение +липосомы с рчАФП и рчГКСФ” регистрировалось более существенное сохранение волосяных фолликулов на 7-е сут и 21-е сут, однако на 35-е сут показатели во всех трех группах были сопоставимы.
В табл. 2 представлены данные о количестве эпителиальных клеток в волосяных фолликулах кожи у мышей экспериментальных групп. У необлученных животных в волосяных фолликулах содержится порядка 400 эпителиальных клеток в поле зрения. Облучение кожи в дозе 60 Гр приводит к снижению численности клеток в фолликулах на 7-е сут после воздействия в 100, а на 35-е сут – в 300 раз. Аппликация на место радиационного поражения кожи липосом с белками приводит к увеличению рассматриваемого показателя (в 3–5 раз по отношению к облученному контролю), регистрируемого в это же время после облучения во всех трех экспериментальных группах. В группе “γ-облучение + липосомы c рчАФП и рчГКСФ” этот эффект сохраняется на 21-е и 35-е сут. В группах “γ-облучение + липосомы c рчАФП” и “γ-облучение + липосомы c рчГКСФ” также показатели выше, чем у облученного контроля, однако статистически значимыми эти различия являются только на 35-е сут в группе “γ-облучение + липосомы c рчГКСФ”.
Таблица 2.
Влияние липосомальных препаратов, содержащих белки рчАФП и рчГКСФ, на количество эпителиальных клеток в волосяных фолликулах в зоне ожоговой раны в поле зрения (1.2 мм2), М ± m
| Экспериментальные группы | Сроки обследования, сут | ||
|---|---|---|---|
| 7 | 21 | 35 | |
| количество эпителиальных клеток в волосяных фолликулах в поле зрения | |||
| Необлученный контроль | 516 ± 67 | 416 ± 112 | 370 ± 73 |
| Облученный контроль | 6 ± 2 | 2 ± 1 | 1 ± 1 |
| t1 = 7.6; р < 0.0001 | t1 = 3.7; р = 0.006 | t1 = 5.1; р = 0.0009 | |
| γ-облучение + липосомы c рчАФП и рчГКСФ | 34 ± 8 | 21 ± 8 | 21 ± 8 |
| t2 = 3.4; р = 0.009 | t2 = 2.4; р = 0.04 | t2 = 3.1; р = 0.02 | |
| γ-облучение + липосомы c рчАФП | 19 ± 5 | 8 ± 3 | 7 ± 3 |
| t2 = 2.43; р = 0.04 | |||
| γ-облучение + липосомы c рчГКСФ | 17 ± 4 | 13 ± 9 | 14 ± 5 |
| t2 = 2.3; р = 0.05 | t2 = 2.3; р = 0.02 | ||
Локальное облучение кожи в дозе 60 Гр приводит к резкому снижению количества стволовых клеток в волосяных фолликулах: на 7-е сут после радиационного воздействия количество CD34+ клеток в зоне поражения составило 3.5 ± 1.0 (при 235 ± 31 в необлученном контроле), на 21-е сут – 0.65 ± 0.43 (при 165 ± 44 в необлученном контроле) и на 35-е сут – 0.3 ± 0.3 клеток в поле зрения (при 165 ± 44 в необлученном контроле) (табл. 3).
Таблица 3.
Влияние липосомальных препаратов, содержащих белки рчАФП и рчГКСФ, на количество стволовых эпителиальных клеток (CD34+) в поле зрения (1.2 мм2) в зоне ожоговой раны, М ± m
| Экспериментальные группы | Сроки обследования, сут | ||
|---|---|---|---|
| 7 | 21 | 35 | |
| количество стволовых эпителиальных клеток (CD34+) в поле зрения | |||
| Необлученный контроль | 235 ± 31 | 165 ± 44 | 165 ± 44 |
| Облученный контроль | 3.5 ± 1.0 | 0.65 ± 0.43 | 0.3 ± 0.3 |
| t1 = 7.6; р < 0.0001 | t1 = 3.7; р = 0.006 | t1 = 5.1; р = 0.0009 | |
| γ-облучение + липосомы c рчАФП и рчГКСФ | 13 ± 3 | 12 ± 4 | 18 ± 6 |
| t2 = 2.98; р = 0.02 | t2 = 2.58; р = 0.03 | t2 = 3.2; р = 0.01 | |
| γ-облучение + липосомы c рчАФП | 14 ± 4 | 5 ± 2 | 4 ± 2 |
| t2 = 3.0; р = 0.03 | t2 = 2.5; р = 0.04 | t3 = 2.2; р = 0.05 | |
| γ-облучение + липосомы c рчГКСФ | 10 ± 3 | 6 ± 4 | 7 ± 2 |
| t2 = 2.3; р = 0.05 | t2 = 3.0; р = 0.02 | ||
Таким образом, количество стволовых клеток в волосяных фолликулах кожи после локального ее облучения в дозе 60 Гр снизилось по отношению к необлученному контролю до 1.5, 0.4 и 0.3% соответственно на 7-е, 21-е и 35-е сут после воздействия радиации.
Аппликация липосом с белками на радиационно пораженные участки кожи у мышей привела к статистически значимому по отношению к облученному контролю повышению количества стволовых клеток в волосяных фолликулах: на 7-е сут во всех экспериментальных группах, где мыши получали лечение, – в 3–4 раза; на 21-е сут в группе “γ-облучение + липосомы c рчАФП и рчГКСФ” – в 20 раз и в группе “γ-облучение + + липосомы c рчАФП” – в 10 раз; на 35-е сут в группе “γ-облучение + липосомы c рчАФП и рчГКСФ” – в 60 раз; в группе “γ-облучение + липосомы c рчГКСФ” – в 20 раз. Следует особенно отметить, что в экспериментальной группе “γ-облучение + липосомы c рчАФП и рчГКСФ” количество стволовых клеток в поле зрения не снижалось в период с 7-х по 35-е сут после облучения, в то время как в группе облученного контроля численность стволовых клеток на 35-е сут по сравнению с 7-х сут после радиационного воздействия снизилась в 10 раз.
Количество стволовых клеток по отношению к необлученному контролю в группах, где животные получали лечение липосомальными препаратами, на 7-е, 21-е и 35-е сут составило: в группе “γ-облучение + липосомы c рчАФП и рчГКСФ” – 6, 7, 11%; в группе “γ-облучение + липосомы c рчАФП” – 6, 3, 2%; “γ-облучение + липосомы c рчГКСФ” – 4, 4, 4% соответственно.
Таким образом, гистологические исследования позволили заключить, что при радиационном воздействии липосомальные препараты с белками рчАФП и рчГКСФ оказывают защитное действие на стволовые клетки кожи, что выражается в повышении их выживаемости и сопровождается увеличением количества сохранившихся волосяных фолликулов, а также количества эпителиальных клеток в них.
Критериями эффективности средств, предназначенных для лечения радиационных поражений кожи, служат сокращение длительности периодов лучевого поражения кожи, например, более быстрое восстановление, или снижение тяжести повреждения, например, формирование более легкой степени ожога, удлинение латентного периода, отсутствие/укорочение периодов влажного эпидермита и струпа в группах облученных мышей, получающих испытываемое вещество по отношению к нелеченым облученным мышам.
По клиническим показателям все три препарата демонстрировали положительный эффект, который выражался, прежде всего, в сокращении общего времени заживления ожоговой раны, главным образом за счет сокращения периода влажного эпидермита и периода струпа по сравнению с таковыми показателями у мышей с локальным ожогом, которые не получали лечения. Наиболее эффективным по клиническим показателям оказалось применение липосом, содержащих рчАФП: в этом случае регистрировались статистически значимое увеличение длительности скрытого периода и укорочение периода эпителизации. Вместе с тем общее время заживления у животных всех трех экспериментальных групп, получавших лечение различными препаратами, не имело статистически значимых отличий друг от друга.
Гистологические исследования показали, что трансдермальное нанесение липосомальных препаратов на зону радиационного поражения кожи привело к повышению выживаемости стволовых клеток в волосяных фолликулах. Это сопровождалось повышением количества как сохранившихся волосяных фолликулов, так и эпителиальных клеток в них. Наиболее выраженный эффект по гистологическим показателям регистрировался при применении липосом, содержащих рчАФП и рчГКСФ.
Поскольку скорость и полнота восстановления кожи после облучения во многом зависят от состояния популяции стволовых клеток, то с учетом того, что все три липосомальных препарата оказывают благоприятный эффект на течение лучевого ожога кожи, по результатам гистологических исследований предпочтительнее использовать липосомы, содержащие два белка – рчАФП и рчГКСФ. Особенно важным полноценное восстановление стволовых клеток кожи является в плане снижения рисков развития отдаленных последствий, прежде всего канцерогенных эффектов, а также формирования трофических язв.
Таким образом, результаты исследования позволяют заключить, что трансдермальное нанесение липосомального препарата белков рчАФП и рчГКСФ при локальном радиационном воздействии является эффективным средством для лечения лучевых ожогов кожи. С учетом собственных результатов, приведенных в данной статье и в публикации [10], а также литературных данных, выявленные эффекты могут быть обусловлены защитным действием на клетки кожи (прежде всего стволовые) фосфолипидов (репарация мембран) [10], антиоксидантным и антиапоптотическим действием АФП [16, 17], антиапоптотическим действием ГКСФ [18, 19]; повышением пролиферативной и миграционной активности стволовых клеток, в том числе стволовых клеток волосяных фолликулов [7–9], а также синергическим положительным взаимодействием компонентов препарата.
ВЫВОДЫ
1. По показателям клинической картины течения лучевого ожога кожи степени IIIA у мышей, трансдермальная аппликация на место радиационного поражения в течение двух недель после облучения липосом, содержащих рекомбинантные белки человека (липосомы с рчАФП, липосомы с рчГКСФ; липосомы с рчАФП и рчГКСФ), приводит к статистически значимому сокращению времени заживления ожоговой раны преимущественно за счет укорочения периода влажного эпидермита и периода струпа. Более эффективными являются препараты, содержащие рчАФП. В этом случае наблюдаются, помимо указанных эффектов, увеличение длительности латентного периода и более быстрая эпителизация ожоговой раны.
2. Гистологические исследования показали, что при локальном облучении кожи у мышей в дозе 60 Гр все испытанные препараты приводят к повышению выживаемости стволовых клеток в волосяных фолликулах, к увеличению количества сохранившихся волосяных фолликулов в коже и количества эпителиальных клеток в них по отношению к таковым показателям у животных с нелеченым лучевым ожогом.
Список литературы
Гребенюк А.Н., Стрелова О.Ю., Легеза В.И. и др. Основы радиобиологии и радиационной медицины: Учебное пособие. СПб.: ООО “Изд-во ФОЛИАНТ”, 2012. 232 с.
Афанасьев Ю.И., Юрина Н.А., Котовский Е.Ф. и др. Кожа и ее производные: Гистология, цитология и эмбриология. 6-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2012. 800 с.
Сосоновский А.Е. Лучевые дерматиты. Минск: Беларусь, 1974. 143 с.
Alonso L., Fuchs E. Stem cells of the skin epithelium // PNAS. 2003. V. 100. Suppl. 1. P. 11830–11835.
Maurice Tubiana, Dutreix J.A. Wambersie Introduction to radiobiology. London; New York: Taylor & Francis, 1990. 371 p.
Стрелин Г.С. Регенерационные процессы в развитии и ликвидации лучевого повреждения. М.: Медицина, 1978. 207 с.
Morrasso V.I., Tomic-Canics V. Epidermal Stem Cells: the cradle of epidermal, determination and wound healing // Biol. Cell. 2005. V. 97. P. 173–183.
Taylor G., Lehrer M.S., Jensen P.J. et al. Involvement of follicular stem cells in forming not only the follicle but also the epidermis // Cell. 2000. V. 102. № 4. P. 451–461.
Tumbar T., Guasch G., Greco V. et al. Defining the epitheliel stem cell niche in skin. Scaiens. 2004. V. 303. № 5646. P. 359–363.
Тряпицына Г.А., Пряхин Е.А., Атаманюк Н.И. и др. Влияние липосомального препарата, содержащего белки альфа-фетопротеин и гранулоцитарный колониестимулирующий фактор, на патогенез лучевого ожога кожи у мышей // Радиац. биология. Радиоэкология. 2018. Т. 58. № 3. С. 251–261.
Директива 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях. СПб.: Rus-LASA “НП объединение специалистов по работе с лабораторными животными”. Рабочая группа по переводам и изданию тематической литературы, 2012. 48 с.
Тряпицына Г.А., Атаманюк Н.И., Обвинцева Н.А. и др. Методика получения местного радиационного поражения кожи у мышей с использованием установки Кибер-Нож // Вопр. радиац. безопасности. 2016. № 1. С. 47–52.
Тряпицына Г.А., Пряхин Е.А., Атаманюк Н.И. и др. Методика определения периодов патогенеза лучевого ожога кожи у мышей по клиническим показателям с использованием фотонаблюдения // Радиац. биология. Радиоэкология. 2017. Т. 57. № 5. С. 495–504.
Пальцев М.А., Коваленко В.Л., Аничков Н.М. Руководство по биопсийно-секционному курсу: Учебное пособие. М.: Медицина, 2002. 256 с.
Sidney L.E., Branch M.J., Dunphy S.E. et al. Concise Review: Evidence for CD34 as a Common Marker for Diverse Progenitors // Stem Cells. 2014. V. 32. № 6. P. 1380–1389.
Молдогазиева Н.Т., Терентьев А.А. Альфа-фетопротеин и факторы роста. Структурно-функциональные взаимоотношения и аналогии // Успехи биол. химии. 2006. Т. 46. С. 90–148.
Черешнев В.А., Родионов С.Ю., Черкасов В.А. и др. Альфа-фетопротеин. Екатеринбург: УрО РАН, 2004. 376 с.
Гольдберг Е.Г., Дыгай А.М., Жданов В.В. Механизмы действия гранулоцитарного колониестимулирующего фактора на гемопоэз // Бюл. эксперим. биол. и мед. 2005. Прил. 1. С. 5–14.
Кетлинский С.А., Симбирцев А.С. Цитокины. СПб.: Фолиант, 2008. 552 с.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


