Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 229-234
РОЛЬ ПРОЦЕССОВ ВОССТАНОВЛЕНИЯ В ПРОЯВЛЕНИИ ГЕНЕТИЧЕСКОЙ НЕСТАБИЛЬНОСТИ КЛЕТОК
Е. С. Евстратова *, В. Г. Петин
Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Национального медицинского исследовательского центра радиологии Минздрава России
Обнинск, Россия
* E-mail: ekevs7240@mail.ru
Поступила в редакцию 30.07.2018
Аннотация
Традиционно предполагалось, что генетическая нестабильность, оцениваемая по задержке формирования колоний облученными дрожжевыми клетками, в большей степени выражена для тех, которые имеют диплоидный набор хромосом. Эти клетки способны восстанавливаться от радиационных повреждений и характеризуются сигмоидной формой кривой зависимости выживаемости от дозы. В противоположность этой точке зрения в данной работе приводятся данные, демонстрирующие явно выраженную генетическую нестабильность для диплоидных клеток не только дикого типа, но и для радиочувствительных мутантных штаммов с экспоненциальными кривыми выживаемости. Проведены эксперименты по воздействию УФ-света, γ-квантов и α-частиц на гаплоидные и диплоидные дрожжевые клетки. Полученные результаты позволяют сделать вывод о том, что эффект позднего появления колоний выжившими после облучения дрожжевыми клетками не связан однозначно с формой кривой выживаемости и способностью клеток восстанавливаться от радиационных повреждений, а детерминируется плоидностью клеток.
Ряд радиобиологических эффектов, регистрируемых с некоторой задержкой после воздействия излучений, например хромосомные аберрации, репродуктивная гибель, злокачественная трансформация, снижение эффективности клонирования и гетерогенность потомства облученных клеток иллюстрируют индуцированную генетическую нестабильность клетки, подвергшейся радиационному воздействию [1–3]. Дрожжевые клетки широко используются в качестве модельной системы для изучения механизмов, связанных с нестабильностью генома [4–6]. Задержанное формирование колоний клетками, выживающими после воздействия различных факторов окружающей среды, можно также рассматривать как пример индуцированной генетической нестабильности клетки [7, 8]. Общим свойством различных отдаленных эффектов ионизирующего излучения является передача отдаленному потомству некоторых субповреждений, проявляющихся в замедлении деления клеток, повышении радио- и термочувствительности, наличии инактивированных клеток внутри образованной макроколонии, а также в повышенном выходе различных мутаций [8, 9]. Таким образом, генетическая нестабильность сохраняется долгое время в отдаленных потомках выживших после облучения клетках.
Большинство результатов по генетической нестабильности были получены с культивируемыми клетками млекопитающих в диплоидном состоянии. Дрожжевые клетки, простейший пример эукариотических клеток, являются удобным объектом для сравнения летального эффекта и генетической нестабильности гаплоидных и диплоидных клеток, что позволяет получать новые фундаментальные данные. В частности, был сделан вывод, что эффект задержанного формирования колоний (эффект дорастания) в большей степени проявляется для диплоидных клеток, способных к пострадиационному восстановлению и характеризующихся сигмоидной кривой доза–эффект [8]. Наше недавнее сравнительное изучение ОБЭ α-частиц для выживаемости и генетической нестабильности гаплоидных и диплоидных дрожжевых клеток не противоречило такому представлению [5], которому также соответствовали обширные данные о роли повреждения ДНК в генетической нестабильности, старении и индукции онкологических заболеваний [7, 10–13]. Однако некоторые результаты, полученные нами, указывали на то, что данная парадигма устарела и должна быть пересмотрена [6, 14–17]. В настоящей работе подводятся итоги этих многоплановых исследований – будет продемонстрирована независимость генетической нестабильности от формы кривых выживаемости и способности клеток к восстановлению после воздействия различных физических факторов окружающей среды на гаплоидные и диплоидные дрожжевые клетки различного генотипа.
МАТЕРИАЛЫ И МЕТОДИКА
В качестве объекта исследования были выбраны гаплоидные и гомозиготные диплоидные дрожжи Saccharomyces cerevisiae, штаммы дикого типа S288C (RAD), XS800 (RAD/RAD), их радиочувствительные мутанты XS774-4d (rad51), XS806 (rad51/rad51), g160/2d (rad52), XS1898 (rad52/rad52), g218/7c (rad54), XS1879 (rad54/rad54) и УФ-чувствительный диплоидный штамм XS1956 (rad6/rad6). Гаплоидный штамм дикого типа и радиочувствительные гаплоидные мутантны были первоначально получены от Dr. Mortimer (США), все диплоидные штаммы – от Dr. S. Nakai (Япония). Простота культивирования дрожжей обеспечивает хорошую воспроизводимость результатов. Кроме того, они обладают и другими преимуществами: быстрым ростом на плотной питательной среде с большим выходом клеток; способностью образовывать гомогенные суспензии, состоящие из одиночных, близких по размеру и возрасту неделящихся клеток; малым количеством почкующихся клеток в популяции, вышедшей на стационарную стадию роста; достаточной изученностью в радиобиологическом и генетическом отношении [18, 19]. В данной работе суспензию клеток облучали в стационарной стадии роста, для этого использовали 4–6-суточные культуры диплоидных клеток и 12–14-суточные культуры гаплоидных клеток, выращенные на стандартной агаризованной питательной среде при 30°С. Протяженность предрадиационного культивирования определяли по прекращению почкования клеток.
Клетки из одной исходной суспензии подвергали воздействию γ-квантов 60Co (ЛПЭ = 0.2 кэВ/мкм, 20 Гр/мин), α-частиц 239Pu (ЛПЭ = 120–130 кэВ/мкм, 25 Гр/мин) и УФ-излучения (254 нм, 1.5 Вт/м2). Отметим, что именно при таком высоком значении ЛПЭ (120–130 кэВ/мкм) наблюдается максимум в зависимости ОБЭ от ЛПЭ для большинства клеток эукариот [20]. Из-за малой проникающей способности α-частиц облучали монослой клеток: 0.02 мл суспензии концентрацией 5 × 107 клеток/мл наносили на поверхность голодного агара и на 20–30 мин помещали в термостат (30°С) для выпаривания воды из капли. Мощность дозы редкоионизирующего излучения измеряли калиброванной ионизационной камерой Siemens. Мощность дозы α-излучения определяли путем измерения интенсивности и энергии частиц с помощью полупроводникового барьерного детектора на расстоянии, соответствующем монослою клеток. Клеточную суспензию (2 мл, 106 клеток/мл) подвергали воздействию УФ-света в открытом кварцевом сосуде. В рамках опытов по воздействию УФ-света, облучение, разведение суспензий и другие процедуры выполняли при красном свете, чтобы избежать фотореактивации. Подсчет количества макроколоний в чашках Петри производили после окончания формирования колоний необлученными клетками (спустя 22–24 ч) и соответственно каждые 2–6 ч до тех пор, пока не прекращалось появление колоний клетками облученной популяции. В качестве теста генетической нестабильности рассчитывали процент колоний, образованных позже контроля выжившими после радиационного воздействия клетками. Каждый опыт повторяли 2–5 раз. Результаты представлены в виде среднего значения и его стандартной ошибки.
РЕЗУЛЬТАТЫ
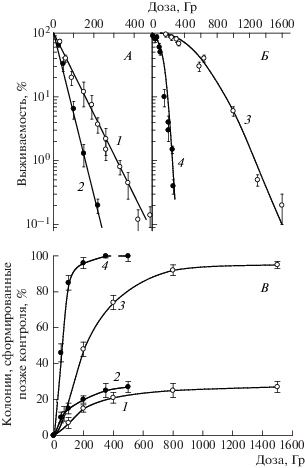
На рис. 1 представлена зависимость выживаемости дрожжевых клеток S. cerevisiae от дозы ионизирующего излучения (далее для удобства просто кривые выживания) гаплоидных (рис. 1, A) и диплоидных (рис. 1, Б) дрожжевых клеток дикого типа, подвергшихся воздействию γ-квантов и α-частиц. Видно, что независимо от вида излучения, т.е. его ЛПЭ, гаплоидные клетки демонстрируют экспоненциальные кривые доза–эффект, тогда как диплоидные клетки характеризуются сигмоидной формой кривых выживаемости. На рис. 1, В представлена зависимость процента колоний, сформированных позже контроля, выжившими гаплоидными (кривые 1, 2) и диплоидными (кривые 3, 4) клетками, подвергшимися воздействию γ-квантов и α-частиц.
Рис. 1.
Радиобиологические реакции гаплоидных (штамм S288C, RAD) и диплоидных (штамм XS800, RAD/RAD) дрожжевых клеток S. cerevisiae дикого типа: кривые выживания гаплоидных (А) и диплоидных (Б) дрожжей и задержанное появление колоний (В) гаплоидными (кривые 1, 2) и диплоидными (кривые 3, 4) дрожжевыми клетками, подвергшимися воздействию γ-квантов 60Co (светлые кружки) и α-частиц 239Pu (темные кружки).
На рис. 2 приведен пример аналогичных данных для гаплоидного (rad52) и гомозиготного диплоидного (rad52/rad52) штаммов дрожжей. Эти радиочувствительные мутанты независимо от плоидности и ЛПЭ излучения показывали экспоненциальные кривые выживаемости. В табл. 1 приведены радиобиологические параметры кривых выживаемости для штаммов, приведенных на рис. 1 и 2, и некоторых других мутантных штаммов, в экспериментах с которыми получены результаты, опубликованные ранее [14, 15].
Рис. 2.
Радиобиологические реакции радиочувствительных мутантов гаплоидных (штамм g160/2d, rad52) и диплоидных (штамм XS1898, rad52/rad52) дрожжевых клеток S. cerevisiae: кривые выживания гаплоидных (А) и диплоидных (Б) дрожжей и задержанное появление колоний (В) гаплоидными (кривые 1, 2) и диплоидными (кривые 3, 4) дрожжевыми клетками, подвергшимися воздействию γ-квантов 60Co (светлые кружки) и α-частиц 239Pu (темные кружки).
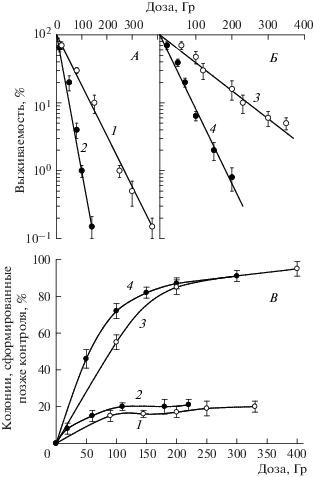
Таблица 1.
Радиобиологические параметры гаплоидных и диплодных дрожжей S. cerevisiae различного генотипа
| Штамм | Генотип | I* | $\frac{{{\text{Л }}{{{\text{Д }}}_{{{\text{90}}}}}\;{\text{(д и к и й )}}}}{{{\text{Л }}{{{\text{Д }}}_{{{\text{90}}}}}\;{\text{(м у т а н т )}}}}$ | ОБЭ для выживаемости клеток | ОБЭ для генетической нестабильности |
|---|---|---|---|---|---|
| S288C | RAD | 30 | – | 2.1 ± 0.3 | 1.8 ± 0.2 |
| XS800 | RAD/RAD | 100 | – | 4.5 ± 0.4 | 4.7 ± 0.3 |
| XS774-4d | rad51 | 20 | 1.07 | 2.1 ± 0.2 | 1.8 ± 0.1 |
| XS806 | rad51/rad51 | 100 | 6.00 | 2.5 ± 0.1 | 2.5 ± 0.3 |
| g160/2d | rad52 | 20 | 1.14 | 2.7 ± 0.3 | 2.0 ± 0.4 |
| XS1898 | rad52/rad52 | 100 | 3.7 | 2.7 ± 0.4 | 1.6 ± 0.2 |
| g218/7c | rad54 | 20 | 1.33 | 2.4 ± 0.1 | 2.0 ± 0.3 |
| XS1879 | rad54/rad54 | 100 | 10.4 | 1.8 ± 0.1 | 2.6 ± 0.3 |
Из таблицы видно, что относительная радиочувствительность мутантных штаммов, оцениваемая отношением ЛД90(дикий)/ЛД90(мутант) для редкоионизирующего излучения, в значительно большей степени повысилась для диплоидных, чем для гаплоидных штаммов при сравнении с радиочувствительностью клеток исходного родительского (дикого) штамма. Здесь ЛД90 – доза, снижающая выживаемость клеток до 10%-ного уровня. Действительно, мутантные гены приводят лишь к небольшому увеличению чувствительности к действию редкоионизирующей радиации гаплоидных клеток по сравнению с родительскими клетками дикого типа. Эти отношения составляют 1.07, 1.14 и 1.33 для клеток с мутациями rad51, rad52 и rad54. Напротив, эти же мутации в гомозиготном состоянии приводили к значительно большему увеличению радиочувствительности диплоидных клеток. Соответствующие отношения равны 6.0, 3.7 и 10.4. Большее увеличение радиочувствительности диплоидных клеток происходило в результате утраты их способности восстанавливаться от двунитевых разрывов ДНК в основном из-за молекулярных дефектов в процессе рекомбинации гомологичных хромосом [21].
ОБЭ α-частиц для выживаемости гаплоидных дрожжевых клеток и радиочувствительных мутантов с экспоненциальными кривыми выживаемости количественно оценивали отношением средних летальных доз ${{D}_{0}}$ для излучений с низкими и высокими ЛПЭ: ОБЭ = ${{D}_{0}}(\gamma ){\text{/}}{{D}_{0}}(\alpha )$, где ${{D}_{0}}$ – среднелетальная доза, снижающая выживаемость клеток в e = 2,71 раза (до 37%) после действия излучения с низкой и высокой ЛПЭ. В отличие от гаплоидных клеток, кривые выживания для диплоидных клеток дикого типа были сигмоидными после воздействия как γ-квантов, так и α-частиц. При такой форме зависимости выживаемости от дозы ОБЭ оценивали отношением соответствующих значений ${{D}_{0}}$ на экспоненциальных участках кривых выживаемости. Большая эффективность плотноионизирующих излучений в отношении индукции генетической нестабильности сообщалась во многих работах исследователями с культивируемыми клетками млекопитающих [22–25]. Однако использованное нами тестирование генетической нестабильности, в отличие от исследованных показателей, изложенных в этих публикациях, позволило нам количественно оценить значения ОБЭ отношением изоэффективных доз после воздействия γ-квантов и α-частиц. Усредняя значения ОБЭ в диапазоне, охватывающем все полученные показатели выраженности генетической нестабильности (от 20 до 70–80%), мы получили значения ОБЭ и для этого отдаленного эффекта облучения.
Приведенные результаты (рис. 1, 2 и табл. 1) показывают, что воздействие излучения с высокими ЛПЭ было более эффективным не только в отношении клеточной выживаемости, но и индукции нестабильности генома. Выявлено, что для всех изученных штаммов дрожжей генетическая нестабильность была более выражена при воздействии излучения с высокой ЛПЭ, чем эффект, наблюдаемый при действии редкоионизирующей радиации. Видно также, что значения ОБЭ были близки друг к другу для обоих использованных тестов, а наибольшие значения ОБЭ (4.5–4.7) отмечены для диплоидных клеток дикого типа, тогда как для гаплоидных дрожжевых клеток дикого типа и всех радиочувствительных мутантов, независимо от их плоидности, значения ОБЭ случайно варьировали в пределах 1.6–2.6 без какой-либо систематической закономерности. В этой же таблице указаны максимальные значения манифестации генетической нестабильности, достигающие 100% с ростом дозы для всех диплоидных дрожжевых клеток независимо от формы кривой выживания и способности клеток к восстановлению, в то время как у гаплоидных клеток этот эффект не превышал 20%.
Итак, мы пришли к выводу, что генетическая нестабильность, определяемая по тесту задержки формирования колоний выжившими после облучения клетками, выражена в значительно большей степени для диплоидных клеток независимо от формы кривой выживаемости и способности клеток к восстановлению. Для того чтобы подтвердить этот вывод, представляло интерес сравнить генетическую нестабильность, индуцированную УФ-излучением в гаплоидных и диплоидных клетках дикого типа и УФ-чувствительного мутанта (rad2/rad2), характеризующихся сигмоидными формами кривых выживаемости.
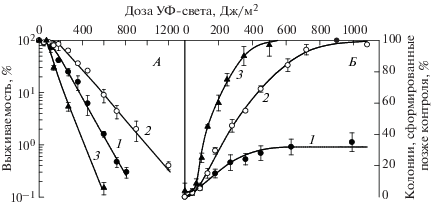
На рис. 3 представлены зависимости от дозы УФ-излучения выживаемости клеток (рис. 3, А) и позднего формирования колоний (рис. 3, Б), образованных выжившими после облучения гаплоидными (кривая 1) и диплоидными (кривая 2) дрожжевыми клетками дикого типа и УФ-чувствительного мутанта (кривая 3). Данные рис. 3, Б показывают, что с возрастанием дозы облучения доля выживших диплоидных клеток, формирующих колонии позже контроля, увеличивается и практически достигает 100% для диплоидных клеток дикого типа и УФ-чувствительного мутанта (кривые 2 и 3) независимо от их способности к восстановлению. Генетическая нестабильность гаплоидных дрожжевых клеток, также характеризующихся сигмоидной кривой выживаемости, значительно менее выражена и составляет около 30% после радиационного воздействия. Эти данные также подтверждают сформулированный выше вывод, что генетическая нестабильность детерминируется главным образом плоидностью клеток, а не формой кривых выживаемости и способностью клеток восстанавливаться от радиационных повреждений.
Рис. 3.
Кривые выживаемости гаплоидных (штамм S288C, RAD, кривая 1) и диплоидных (штамм XS800, RAD/RAD, кривая 2) дрожжевых клеток S. cerevisiae и УФ-чувствительного мутанта (штамм, rad2/rad2, кривая 3), подвергшихся воздействию УФ-света (А), а также задержанное появление колоний (Б) гаплоидными (кривая 1) и диплоидными дрожжевыми клетками, штаммы XS800 (кривая 2) и XS1956 (кривая 3), выжившими после воздействия УФ-света.
ОБСУЖДЕНИЕ
Приведенные данные показывают, что степень генетической нестабильности, определяемая по задержке появления колоний клетками, выжившими после воздействия излучений с различными ЛПЭ и УФ-светом, определяется, главным образом, плоидностью клеток. А именно, как резистентные, так и радиочувствительные диплоидные штаммы, независимо от формы кривых выживания и способности клеток к восстановлению, демонстрируют значительную задержку появления клонов клетками, выжившими после облучения (100%), в отличие от гаплоидных штаммов (20–30%).
Очевидно, что после действия ионизирующего излучения и УФ-света кривые выживаемости диплоидных клеток имеют сигмоидную форму, и они намного более устойчивы к действию ионизирующего излучения, чем гаплоидные клетки, характеризующиеся экспоненциальной кривой выживаемости. Это обусловлено способностью диплоидных клеток дикого типа восстанавливаться от двунитевых разрывов ДНК [19]. Способность гаплоидных клеток восстанавливать двунитевые разрывы в настоящее время также известна благодаря открытию негомологичной репарации [26], эффективность которой ниже, чем восстановление за счет рекомбинации гомологичных хромосом. Однако отсюда нельзя сделать вывод, что именно различная степень восстановления гаплоидных и диплоидных клеток детерминирует различный эффект позднего формирования колоний гаплоидными и диплоидными клетками, поскольку и радио-, и УФ-чувствительные диплоидные штаммы, дефектные по репарации, демонстрировали такую же генетическую нестабильность, как и их исходные клетки дикого типа.
Возможным механизмом проявления задержки формирования колоний могут быть дефекты в хромосомах (делеции, анеуплодия и пр.), которые в большей степени являются летальными для гаплоидных, а не диплоидных клеток, и могут приводить к задержке формирования колоний в большей степени диплоидных клеток. Эти дефекты могут сохраняться у отдаленных потомков выживших после облучения клеток [8] и тем самым вызывать дестабилизацию генома, что и проявляется в задержанном образовании колоний после облучения.
Список литературы
Stirling P.C., Bloom M.S., Solanki-Patil T. et al. The complete spectrum of yeast chromosome instability genes identifies candidate CIN cancer genes and functional roles for ASTRA complex components // PLoS Genet. 2011. V. 7. № 4. e1002057, https://doi.org/https://doi.org/10.1371/journal.pgen.1002057
Kumaran R., Yang S-.Y., Leu J-.Y. Characterization of chromosome stability in diploid, polyploid and hybrid yeast cells // PLoS ONE. 2013. V. 8. № 7. e68094, https://doi.org/https://doi.org/10.1371/journal.pone.0068094
Skoneczna A., Kaniak A., Skoneczny M. Genetic instability in budding and fission yeast – sources and mechanisms // FEMS Microbiol. Rev. 2015. V. 39. № 6. P. 917–967.
Duffy S., Fam H.K., Wang Y.K. et al. Overexpression screens identify conserved dosage chromosome instability genes in yeast and human cancer // PNAS. 2016. V. 113. № 36. P. 9967–9976.
Евстратова Е.С., Переклад О.В., Хрячкова А.В. ОБЭ α-частиц для задержки формирования колоний облученными дрожжевыми клетками // Радиац. биология. Радиоэкология. 2016. Т. 56. № 5. С. 481–486.
Евстратова Е.С., Хрячкова А.В., Жураковская Г.П. и др. УФ-индуцированная задержка формирования колоний дрожжевыми клетками // Радиац. биология. Радиоэкология. 2018. Т. 58. № 3. С. 245–250.
Little J.B., Nagasawa H., Pfenning T. et al. Radiation-induced genomic instability: delayed mutagenic and cytogenetic effects of X rays and alpha particles // Radiat. Res. 1997. V. 148. № 2. P. 299–307.
Korogodin V.I., Bliznik K.M., Kapultcevich Yu.G. et al. Cascade mutagenesis: regularities and mechanisms // Proc. 2nd Int. N.W. Timoffeev-Ressovsky Conf. Dubna. 2007. V. 1. P. 419–447.
Petin V.G., Pereklad O.V., Nili M. et al. Yeast cells retain a memory of their original radiation-induced insult // J. Radiat. Industry. 2008. V. 2. № 1. P. 59–64.
Chang W.P., Little J.B. Evidence that DNA double-strand break initiate the phenotype of delayed reproductive death in Chinese hamster ovary cells // Radiat. Res. 1992. V. 131. № 1. P. 53–59.
Brosh R.M., Bohr V.A. Human premature aging, DNA repair and RecQ helicases // Nucl. Acids Res. 2007. V. 35. № 22. P. 7527–7544.
Shen Z. Genomic instability and cancer: an introduction // J. Mol. Cell Biol. 2011. V. 3. № 1. P. 1–3.
Aggarwal M., Brosh R.M. Functional analysis of human DNA repair proteins important for aging and genomic stability using yeast genetics // DNA Repair (Amst). 2012. V. 11. № 4. P. 335–348.
Евстратова Е.С., Переклад О.В., Петин В.Г. Зависимость радиационно-индуцированной генетической нестабильности от плоидности дрожжевых клеток // Радиация и риск. 2016. Т. 25. № 4. С. 80–89.
Evstratova E.S., Petin V.G. The delayed appearance of haploid and homozygous diploid Saccharomyces cerevisiae yeast cells of wild-type and radiosensitive mutants surviving after exposure to gamma rays and alpha particles // J. Radiat. Res. Appl. Sci. 2018. V. 11. № 1. P. 98–103.
Evstratova E.S., Petin V.G. Genetic instability of haploid and diploid yeast cells surviving after exposure to UV light, gamma-rays and alpha-particles // Ionizing Radiation: Advances in Research and Applications. New York: Nova Sci. Publ., Inc., 2018. P. 111–140.
Evstratova E.S., Mishra K.P., Petin V.G. The comparison of genetic instability in haploid and diploid yeast cells exposed to ionizing radiations of different linear energy transfer and ultraviolet light // J. Radiat. Cancer Res. 2018. V. 9. № 2. P. 79–85.
Корогодин В.И. Проблемы пострадиационного восстановления. М.: Атомиздат, 1966. 391 с.
Frankenberg D., Frankenberg-Schwager M., Blöcher D. et al. Evidence for DNA double-strand breaks as the critical lesions in yeast cells irradiated with sparsely and densely ionizing radiation under oxic or anoxic conditions // Radiat. Res. 1981. V. 88. № 3. P. 524–532.
Ярмоненко С.П., Коноплянников А.Г., Вайнсон А.А. Клиническая радиобиология. М.: Медицина, 1992. 320 с.
Saeki T., Machida I., Nakai S. Genetic control of diploid recovery after gamma-irradiation in the yeast Saccharomyces cerevisiae // Mutat. Res. 1980. V. 73. № 2. P. 251–265.
Kadhim M.A., Lorimore S.A., Hepburn M.D. et al. Alpha-particle-induced chromosomal instability in human bone marrow cells // Lancet. 1994. V. 344. № 8928. P. 987–988.
Little J.B., Nagasawa H., Pfenning T. et al. Radiation-induced genomic instability: delayed mutagenic and cytogenetic effects of X-rays and alpha particles // Radiat. Res. 1997. V. 148. № 4. P. 299–307.
Dugan L.C., Bedford J.S. Are chromosomal instabilities induced by exposure of cultured normal human cells to low- and high-LET radiation // Radiat. Res. 2003. V. 159 № 3. P. 301–311.
Ponnaiya B., Jenkins-Baker G., Bigelow A. et al. Detection of chromosomal instability in α-irradiated and bystander human fibroblasts // Mutat. Res. 2004. V. 568. № 1. P. 41–48.
Lewis L.K., Resnick M.A. Tying up loose ends: nonhomologous end-joining in Saccharomyces cerevisiae // Mutat. Res. 2000. V. 451. № 1–2. P. 71–89.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


