Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 235-242
МЕХАНИЗМЫ РАДИОСЕНСИБИЛИЗИРУЮЩЕГО ДЕЙСТВИЯ НИКЛОЗАМИДА В ОТНОШЕНИИ КУЛЬТУРЫ МАММОСФЕР ЛИНИИ MCF-7, ОБОГАЩЕННЫХ ОПУХОЛЕВЫМИ СТВОЛОВЫМИ КЛЕТКАМИ
В. Г. Шуватова *, А. П. Кувырченкова, Ю. П. Сёмочкина, Е. Ю. Москалёва
НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: shuvatova.vg@gmail.com
Поступила в редакцию 31.07.2018
Аннотация
Небольшая субпопуляция опухолевых стволовых клеток (ОСК) определяет процессы развития и метастазирования опухоли. Цель работы – изучение радиосенсибилизирующего действия никлозамида в отношении ОСК линии MCF-7 и молекулярных механизмов его действия. Клетки, культивируемые в виде маммосфер, облучали в дозе 2 Гр (источник γ-излучения 60Co, мощность дозы 0.54 Гр/мин) через 1 ч после добавления никлозамида. Через 7 сут после радиационного воздействия подсчитывали количество маммосфер. Через 24 ч после облучения исследовали активность сигнального пути Wnt, а также определяли количество двунитевых разрывов (ДР) ДНК по уровню гистона γH2AX. Максимальное снижение количества маммосфер обнаружено при совместном действии никлозамида и γ-излучения. Через 24 ч после облучения количество белков сигнального пути Wnt β-катенина и Dvl-2 увеличилось на 8 и 38% соответственно. Совместное действие никлозамида и γ-излучения по сравнению с действием только γ-радиации приводило к снижению количества β-катенина на 23%, а Dvl-2 – на 30%. Через 24 ч после облучения уровень гистона γH2AX был выше контрольного уровня на 10%, а при совместном действии никлозамида и γ-излучения – на 30%. Радиосенсибилизирующее действие никлозамида на ОСК MCF-7 связано с ингибированием сигнального каскада Wnt и скорости репарации ДР ДНК.
Известно, что, несмотря на несомненные успехи в разработке новых подходов к лечению онкологических заболеваний, в ряде случаев у пациентов формируется резистентность к лучевой и химиотерапии, происходят рецидивы заболевания и/или развиваются метастазы. Эти неудачи терапии связывают с присутствием в опухолях небольшой субпопуляции опухолевых стволовых клеток (ОСК), способных к неограниченному самообновлению и дифференцировке, и обладающих высокой устойчивостью к действию противоопухолевых препаратов и облучения [1]. ОСК обнаружены практически во всех типах опухолей, а также в различных линиях культивируемых опухолевых клеток. Поэтому поиск способов элиминации ОСК является одной из актуальных задач противоопухолевой терапии. Перспективным подходом повышения эффективности лучевой терапии представляется повышение чувствительности ОСК к действию излучения с помощью малотоксичных радиосенсибилизаторов.
M. Al-Hajj и соавт. впервые показали, что ОСК рака молочной железы человека имеют фенотип CD44+CD24–/lowESA+, что позволяет идентифицировать эти клетки и анализировать их количество [2, 3].
Помимо фенотипирования и количественного определения ОСК по антигенам CD44+/CD24–/low, ОСК можно количественно определять с помощью проточной цитометрии как “боковую популяцию” – SP (side population). ОСК формируют популяцию SP благодаря их способности выкачивать некоторые флуоресцентные красители, в том числе Hoehst 33342, которые являются субстратами для AВCG2 транспортера, гиперэкспрессированного в ОСК разных линий [4]. Еще одной особенностью ОСК является высокая активность альдегид-дегидрогеназы (ALDH) – фермента, который участвует в окислении внутриклеточных альдегидов и поддержании низкого уровня активных метаболитов кислорода (АМК) в клетке. Поэтому высокий уровень активности этого фермента также используется в качестве маркера ОСК [5]. Количество ОСК, определяемое при использовании разных маркеров, может существенно различаться [6].
Кластеры, состоящие из ОСК и ранних прогениторных клеток, в эксперименте in vitro могут быть получены при культивировании опухолевых клеток в низкоадгезивных условиях с добавлением ряда факторов роста. Это связано со способностью ОСК сохранять пролиферативную активность при отсутствии взаимодействия с матриксом и формировать в этих условиях сферические колонии. В случае клеток рака молочной железы такие колонии получили название маммосфер [7]. Их количество в культуре соответствует доле ОСК среди тех клеток, которые были внесены в культуру. Этот метод определения количества ОСК основан на их способности к самообновлению, которая, по-видимому, и играет решающую роль в инициации и метастазировании опухоли.
Согласно данным литературы, одним из препаратов, способных повышать чувствительность ОСК к действию излучения, может быть хорошо известный и давно используемый антигельминтный препарат никлозамид (систематическое название: 5-хлор-N-(2-хлор-4-нитрофенил)-2-оксибензамид) [8, 9].
Механизмы его действия можно условно разделить на две группы. К первой относятся механизмы, связанные с повреждением митохондрий, в том числе снижение мембранного потенциала митохондрий, разобщение тканевого дыхания и окислительного фосфорилирования и увеличение образования активных форм кислорода [10]. Повреждение митохондрий может приводить к индукции апоптоза и снижению синтеза АТФ в клетках. В последнем случае можно ожидать ингибирования активности биохимических процессов, идущих с потреблением энергии, в том числе активности системы репарации двунитевых разрывов (ДР) ДНК. Ко второй группе известных механизмов действия никлозамида относится его способность ингибировать различные сигнальные каскады, в том числе сигнальный путь Wnt [11].
Ранее, определяя в культуре маммосфер линии MCF-7 ОСК клетки, характеризующиеся фенотипом CD44+CD24–/low, мы показали, что они радиорезистентны, а никлозамид повышает их чувствительность к действию γ-излучения. Однако механизмы этого явления изучены не были [9].
Цель настоящей работы заключалась в исследовании радиосенсибилизирующего действия никлозамида на ОСК аденокарциномы молочной железы человека (линия MCF-7) путем оценки их количества по числу образуемых маммосфер, а также изучение влияния совместного действия никлозамида и γ-излучения на активность сигнальной системы Wnt и на эффективность репарации ДР ДНК при анализе количества ДР по уровню гистона γН2АХ.
МАТЕРИАЛЫ И МЕТОДИКА
Культивирование клеток. Прикрепляющуюся культуру клеток аденокарциномы молочной железы человека линии MCF-7 культивировали в среде DMEM (“Gibco”, США), с добавлением 10% фетальной бычьей сыворотки (ФБС) (“HyClone”, США) и 50 мкг/мл гентамицина (“HyClone”, США) в СО2-инкубаторе при 37°С в увлажненной атмосфере (95%), содержащей 5% СО2.
Обогащенную ОСК культуру маммосфер линии MCF-7 получали из клеток прикрепляющейся культуры, как описано в работе [12], с модификациями. После достижения прикрепляющимися клетками линии MCF-7 субконфлюэнтного состояния (около 80% от монослоя) их снимали с подложки с помощью 0.05%-ного раствора трипсина в растворе Версена и помещали в низкоадгезивные культуральные чашки Петри в концентрации 20 клеток/мкл в среде DMEM/F12 без фенолового красного (“Gibco”, США), содержащую 20 нг/мл EGF (“Calbiochem”, Германия), 20 нг/мл bFGF (“ПанЭко”, Россия), 2% добавки B27 (“Gibco”, США), 10 мкг/мл инсулина (“Calbiochem”, Германия), 4 мкг/мл гепарина (“Serva”, Германия), 50 мкг/мл гентамицина (“HyClone”, США) (полная культуральная среда). Через 5–7 сут культивирования в культуре образовывались маммосферы диаметром 100–150 нм. Их собирали при центрифугировании (100 × g, 5 мин) и диссоциировали с помощью раствора протеаз Трипле, согласно рекомендациям производителя (“Gibco”, США), на отдельные клетки, которые продолжали культивировать в указанных выше условиях.
Облучение клеток. Маммосферы диссоциировали, как указано выше, и в виде суспензии помещали в круглодонные центрифужные пробирки (“Eppendorf”, Германия) по 100 тыс. клеток в 2 мл среды DMEM/F12 без факторов EGF, FGF и добавки В27. За 1 ч до облучения к части образцов добавляли никлозамид (“Sigma-Aldrich”, США) в концентрации 2 мкмоль/л, и затем все образцы, кроме контрольных без никлозамида и с препаратом, подвергали облучению в дозе 2 Гр на установке “ГУТ-200М” (источник γ-излучения 60Co) при мощности дозы 0.54 Гр/мин. После радиационного воздействия клетки переносили в низкоадгезивные культуральные чашки Петри (“Corning”, США) в плотности 20 клеток/мкл и культивировали в течение 24 ч в полной культуральной среде с сохранением концентрации никлозамида 2 мкмоль/л.
Подсчет маммосфер. Для определения влияния никлозамида и γ-излучения по отдельности и совместно на способность клеток образовывать маммосферы, через 24 ч после облучения клетки собирали с помощью центрифугирования (500 × g, 7 мин), диссоциировали и подсчитывали в камере Горяева. Последующее их высаживание в 24-луночные низкоадгезивные планшеты (“Corning”, США) проводили из расчета 1000 клеток в лунку в 1 мл полной культуральной среды. Время культивирования составляло 6 дней. Для контрольных клеток и клеток, подвергшихся разным воздействиям, использовали не менее 4 параллелей. Через 7 сут после облучения подсчитывали количество маммосфер диаметром не менее 50 мкм. Для этого культуру образовавшихся маммосфер из каждой лунки 24-луночного планшета переносили по 200 мкл в пять лунок 96-луночного планшета. Количество маммосфер в каждой лунке последнего подсчитывали с помощью светового микроскопа и определяли суммарное количество маммосфер, образовавшихся в лунках 24-луночного планшета. Количество маммосфер при разных воздействиях оценивали в процентах от их количества в контрольных пробах.
Определение активности сигнального пути Wnt. Активность сигнального пути Wnt оценивали по уровню белков β-катенин и Disheveled-2 (Dvl-2) с помощью проточной цитофлуориметрии после окрашивания флуоресцентно мечеными антителами к этим белкам. Для этого через 24 ч после облучения с никлозамидом и без него и после действия только никлозамида клетки центрифугировали, однократно промывали фосфатно-солевым буфером (ФСБ) и фиксировали раствором 2%-ного параформальдегида 20 мин при комнатной температуре. После фиксации клетки дважды промывали ФСБ и инкубировали 1 ч при комнатной температуре в растворе для пермеабилизации, состоящем из ФСБ 2% бычьего сывороточного альбумина (“ICN”, США), 0.3% тритона Х-100 (“Panreac”, Испания) и 0.05% натрия азида (“Carl Roth”, Германия). Клетки однократно промывали ФСБ и инкубировали в течение 1 ч при комнатной температуре в блокирующем растворе, содержащем ФСБ, 2% бычьего сывороточного альбумина и 0.05% натрия азида, с первичными мышиными моноклональными антителами к белку Dvl-2 (“Santa Cruz”, США) в разведении 1 : 20 или с мышиными моноклональными антителами к β-катенину, конъюгированными с AlexaFluor 488 (“eBioscience”, США), в разведении 1 : 20. По окончании времени инкубации образцы дважды промывали ФСБ. Клетки, окрашенные антителами к β-катенину, ресуспендировали в ФСБ и оставляли при температуре +4°С до проведения исследования, а клетки, окрашенные первичными антителами к белку Dvl-2, инкубировали в блокирующем растворе со вторичными козьими поли-клональными антителами, меченными Alexa Fluor 488 (“Biolegend”, США), в разведении 1 : 200 при комнатной температуре в течение 1 ч. Затем пробы дважды промывали и готовили суспензию в ФСБ для анализа. Для контроля неспецифического связывания вторичных антител клетки инкубировали в блокирующем буфере со вторичными антителами в разведении 1 : 200 в течение 1 ч при комнатной температуре. Анализ проводили на проточном цитофлуориметре FacsCalibur (“BD Bioscience”, США, ресурсный центр молекулярной и клеточной биологии).
Определение уровня гистона γН2АХ. Через 24 ч после облучения проводили анализ содержания гистона γН2АХ c помощью проточной цитофлуориметрии, как описано в [13] с некоторыми модификациями. Клетки центрифугировали, однократно промывали ФСБ и фиксировали в абсолютном метаноле при +4°С в течение 20 мин, до проведения измерений образцы хранили в метаноле при –20°С. Перед исследованием клетки отмывали от метанола в растворе для блокировки (ФСБ, содержащий 3% ФБС) и инкубировали в этом растворе с мышиными моноклональными антителами к гистону γH2AX, меченными Alexa Fluor 488 (“BD Pharmingen”, США), в разведении 1 : 100. Анализ проводили на проточном цитофлуориметре FacsCalibur.
Статистическая обработка. Данные представляли в виде средних значений и стандартной ошибки среднего. Статистическую обработку результатов по методу Манна–Уитни проводили с помощью программы Statistica 6.0 (“StatSoft”, США). Статистически значимыми считали различия при р < 0.05.
РЕЗУЛЬТАТЫ
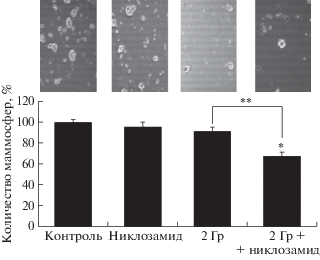
Радиосенсибилизирующее действие никлозамида в отношении ОСК линии MCF-7 оценивали по влиянию этого препарата и γ-излучения по отдельности и совместно на способность клеток формировать маммосферы. Эффекты исследуемых воздействий регистрировали через 7 сут после облучения, так как к этому времени в контрольных культурах завершается процесс образования крупных маммосфер и для дальнейшего культивирования необходим пересев клеток. В контрольных культурах в выбранных условиях получали 55 ± 2 маммосферы на 1000 высаженных в культуру клеток. Таким образом, контрольные культуры содержали около 5.5% ОСК и ранние прогениторные клетки.
Полученные при исследовании изучаемых воздействий результаты представлены на рис. 1. Показано, что количество маммосфер через 7 сут после облучения в дозе 2 Гр составило 90 ± 5%, а после инкубации с никлозамидом и облучения – 67 ± 4% относительно контроля, не подвергавшегося действию облучения и никлозамида. Таким образом, облучение клеток в дозе 2 Гр, принятой для однократного облучения при лучевой терапии, приводило к очень незначительному снижению количества ОСК, что соответствует данным о высокой радиорезистентности ОСК. При этом через 7 сут после совместного действия никлозамида и облучения количество маммосфер статистически значимо уменьшилось на 23% по сравнению с их количеством после облучения без добавления никлозамида. Полученные результаты свидетельствуют о том, что никлозамид в субтоксичной концентрации повышает чувствительность ОСК к действию γ-излучения.
Рис. 1.
Влияние никлозамида и γ-излучения на количество маммосфер линии MCF-7 через 7 сут после радиационного воздействия. Контрольные культуры содержали 55 ± 2 маммосферы диаметром не менее 50 мкм. За 100% принято количество маммосфер в контроле. Данные представлены в виде среднего значения ± стандартная ошибка среднего. * Отличия от контроля статистически значимы, р < 0.05; ** отличия между группами статистически значимы, р < 0.05.
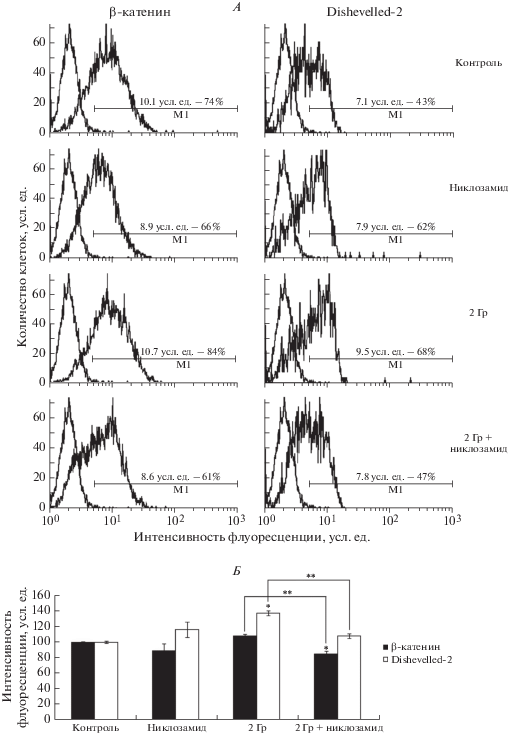
Раздельное и совместное влияние никлозамида и γ-излучения на активность сигнального пути Wnt оценивали по уровню экспрессии двух белков, участвующих на разных стадиях передачи сигнала при связывании Wnt с рецепторным комплексом: β-катенина и Dishevelled-2. Содержание этих протеинов в клетках маммосфер исследовали с помощью проточной цитофлуориметрии с применением иммуноцитохимического окрашивания белков флуоресцентно мечеными антителами через 24 ч после облучения. На рис. 2, А представлены примеры гистограмм, полученных при определении содержания белков системы Wnt в исследуемых клетках, а на рис. 2, Б – данные о влиянии никлозамида и облучения на их количество. Обнаружено, что никлозамид снижал количество β-катенина на 11% и повышал количество Dishevelled-2 на 16% относительно контроля, хотя эти изменения были статистически незначимыми. Облучение в дозе 2 Гр приводило к увеличению количества белков сигнальной системы Wnt: уровень β-катенина возрастал на 8%, а Dishevelled-2 – на 38% относительно контроля. При совместном действии никлозамида и ионизирующей радиации количество белков β-катенин и Dishevelled-2 статистически значимо уменьшалось на 23 и 30% соответственно, по сравнению с действием только облучения, что свидетельствует об ингибировании пути Wnt в клетках маммосфер в этих условиях.
Рис. 2.
Влияние никлозамида и γ-излучения на уровень экспрессии белков β-катенина и Dishevelled-2 в маммосферах MCF-7 через 24 ч после радиационного воздействия. А. Данные одного из трех экспериментов. Левый пик – аутофлуоресценция клеток, правый пик – флуоресценция клеток, окрашенных антителами к β-катенину или Dishevelled-2. Цифрами указаны средняя интенсивность флуоресценции окрашенных клеток в условных единицах (усл. ед.) и доля окрашенных клеток в процентах. Б. За 100% принято значение средней интенсивности флуоресценции для каждого из белков в контроле. Данные представлены в виде среднего значения ± стандартная ошибка среднего. * Отличия от контроля статистически значимы, р < 0.05; ** отличия между группами статистически значимы, р < 0.05.
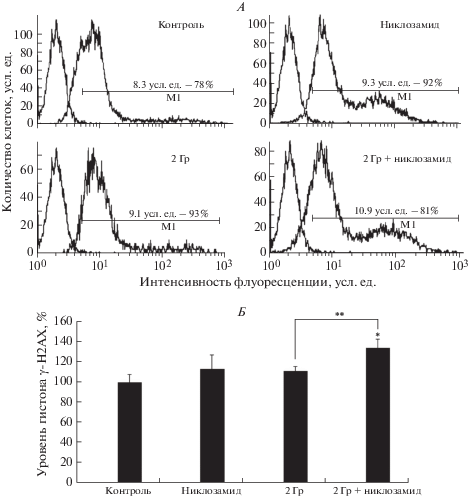
Основным механизмом действия γ-излучения на клетки является повреждение молекулы ДНК. При исследовании механизмов действия никлозамида обнаружено, что он снижает мембранный потенциал митохондрий, переводя клетку в гипоэнергетическое состояние, следствием чего может быть замедление процессов репарации ДНК [10]. Ранее нами было показано, что совместное действие никлозамида и γ-излучения приводит к увеличению уровня ДР ДНК в клетках маммосфер через 1 ч после облучения по сравнению с действием этих факторов по отдельности [9]. В настоящей работе мы исследовали влияние никлозамида и ионизирующей радиации по отдельности и совместно на уровень репарации ДР ДНК в клетках маммосфер, определяемый через 24 ч после облучения в дозе 2 Гр. Количество ДР ДНК оценивали по уровню гистона γH2AX – фосфорилированной формы гистона H2AX в клетках с помощью проточной цитофлуориметрии. На рис. 3, А представлены примеры типичных гистограмм, полученных с помощью этого метода, а на рис. 3, Б – результаты определения уровня гистона γH2AX через 24 ч после облучения. Показано, что уровень гистона γH2AX через 24 ч после радиационного воздействия в дозе 2 Гр превышал таковой в контроле на 10% (р > 0.05), а при совместном действии никлозамида и ионизирующего излучения – на 30% (р < 0.05).
Рис. 3.
Уровень гистона γH2AX (фосфорилированного гистона H2AX) в клетках маммосфер MCF-7 через 24 ч после облучения без и в присутствии никлозамида. А. Данные одного из трех экспериментов. Левый пик – аутофлуоресценция, правый пик – флуоресценция клеток, окрашенных антителами к гистону γH2AX. Цифрами указаны доля окрашенных клеток в процентах и средняя интенсивность флуоресценции окрашенных клеток в условных единицах (усл. ед.). Б. Относительный уровень гистона γH2AX после действия никлозамида и γ-излучения. За 100% принято значение MFI в контроле. Данные представлены в виде среднего значения ± стандартная ошибка среднего. * Отличия от контроля статистически значимы, р < 0.05; ** отличия между группами статистически значимы, р < 0.05.
ОБСУЖДЕНИЕ
Известно, что каждая маммосфера представляет собой колонию, образованную одной ОСК и состоит из ОСК и ранних прогениторных клеток. Чтобы исключить паракринное влияние клеток и оценить воздействие изучаемых повреждающих факторов на клетки, обладающие внутренним потенциалом к самообновлению, т.е. на ОСК, их высаживали в низкой концентрации (1 клетка/мкл). В этих условиях доля ОСК в культуре маммосфер составила 5.5 ± 0.2%. Проведенная нами ранее идентификации ОСК как популяции клеток с фенотипом CD44+/CD24–/low в культуре маммосфер показала, что их доля составляет хотя и близкое, но несколько меньшее значение: 3.2 ± ± 0.6%. Таким образом, в культуре маммосфер доля клеток с фенотипом CD44+/CD24–/low в 1.7 раз меньше, чем клеток, способных формировать маммосферы. Это может быть связано с тем, что очень ранние прогениторные клетки уже теряют фенотип CD44+/CD24–/low, но еще сохраняют способность формировать маммосферы.
Показано (рис. 1), что при действии γ-излучения в дозе 2 Гр большая часть ОСК, а именно 90%, оставалась способной к самообновлению. В то же время сочетанное действие никлозамида и γ-излучения приводило к существенному снижению количества образующихся маммосфер. Последнее свидетельствует о радиосенсибилизирующем действии никлозамида в отношении ОСК линии MCF-7 и подтверждает полученные нами ранее данные при анализе количества ОСК, как клеток с фенотипом CD44+/CD24–/low.
Для ОСК, в отличие от более дифференцированных опухолевых клеток, характерна активация сигнальных путей Hedgehog, STAT3, Notch и Wnt, которые играют важную роль в их самообновлении, пролиферации и повышении выживаемости. Ранее было установлено, что в разных типах опухолевых клеток никлозамид способен ингибировать различные внутриклеточные каскады. Ингибирование сигнального пути Wnt при действии этого препарата показано в клетках трижды негативного рака молочной железы и рака яичника с помощью метода вестерн-блоттинг [14, 15].
В настоящей работе для количественного определения ключевых белков сигнального пути Wnt, таких как β-катенин и Dishevelled-2, использованы иммуноцитохимические методы и проточная цитофлуориметрия.
Показано, что через 24 ч после облучения в дозе 2 Гр в клетках маммосфер линии MCF-7 происходило значительное увеличение количества белков β-катенина и Dishevelled-2, что свидетельствует об активации пути Wnt в этих клетках в результате воздействия радиации (рис. 2, А, Б). При совместном действии никлозамида и γ-излучения обнаружено статистически значимое уменьшение уровня белков β-катенина и Dishevelled-2 по сравнению с действием только γ-излучения. Это свидетельствует о способности никлозамида ингибировать индуцированную радиацией активацию сигнального пути Wnt в клетках маммосфер линии MCF-7 (рис. 3).
При исследовании влияния никлозамида на эффективность репарации ДР ДНК, индуцированных γ-излучением, о количестве ДР ДНК судили по уровню гистона γН2АХ через 24 ч после радиационного воздействия. Показано, что при совместном действии никлозамида и γ-излучения уровень гистона γН2АХ через 24 ч после облучения был существенно выше, по сравнению с таковым в контрольных клетках и клетках, подвергшихся воздействию либо никлозамида, либо γ-радиации (рис. 3). Полученные результаты свидетельствуют о неполном восстановлении уровня ДР ДНК после облучения в присутствии никлозамида и позволяют констатировать способность этого препарата ингибировать репарацию индуцированных при действии γ-излучения ДР ДНК в клетках маммосфер линии MCF-7.
Ранее при исследовании влияния никлозамида и γ-излучения по отдельности и совместно на уровень ДР ДНК, оцениваемых по уровню гистона γН2АХ, через 1 ч после облучения, мы показали, что предварительная обработка клеток маммосфер рассматриваемым препаратом повышала уровень ДР ДНК, индуцируемых радиационным воздействием, до более высоких значений, чем таковые регистрируются при действии каждого из этих факторов по отдельности [15]. Данные, полученные в настоящей работе, хорошо согласуются с результатами, полученными Li J. и соавт., которые показали, что никлозамид совместно с γ-излучением в дозе 6 Гр значительно повышает количество ДР ДНК в клетках назофарингеальной карциномы через 1 и 12 ч после облучения, по сравнению с таковыми показателями, наблюдаемыми при раздельном действии каждого из этих факторов [16]. Выше мы уже отмечали, что известным механизмом действия никлозамида является повреждение митохондрий, что может приводить к снижению уровня АТФ, а ингибирование процессов репарации ДР ДНК может быть следствием недостатка АТФ.
Таким образом, полученные данные позволяют заключить, что радиосенсибилизирующее действие никлозамида в отношении культуры клеток линии MCF-7 в виде маммосфер, обогащенных ОСК, связано с угнетением способности ОСК к самообновлению, ингибированием активированного после облучения пути Wnt и ингибированием активности репарации ДР ДНК, индуцированных γ-излучением.
ЗАКЛЮЧЕНИЕ
Показано, что никлозамид повышает чувствительность ОСК линии MCF-7 к действию γ-излучения, снижая их способность образовывать маммосферы.
Показано, что γ-излучение повышает активность сигнального пути Wnt в клетках линии MCF-7, культивируемых в виде маммосфер, тогда как никлозамид при совместном действии с γ-излучением ингибирует этот сигнальный путь.
Обнаружено, что никлозамид совместно с γ-излучением приводит не только к повышению количества ДР ДНК в клетках маммосфер линии MCF-7 через 1 ч после облучения, но и к снижению скорости репарации ДР ДНК после воздействия радиации.
Полученные результаты позволяют констатировать радиосенсибилизирующее действие никлозамида в отношении ОСК линии MCF-7, и заключить, что механизмы этого явления связаны со способностью рассматриваемого препарата ингибировать индуцированную действием γ-излучения активацию сигнального пути Wnt, а также с угнетением репарации индуцированных γ-радиацией ДР ДНК.
Список литературы
Krause M., Dubrovska A., Linge A. et al. Cancer stem cells: Radioresistance, prediction of radiotherapy outcome and specific targets for combined treatments // Adv. Drug Deliv. Rev. 2017. V. 109. P. 63–73.
Al-Hajj M., Wicha M.S., Benito-Hernandez A. et al. Prospective identification of tumorigenic breast cancer cells // Proc. Natl. Acad. Sci. USA. 2003. V. 100. № 7. P. 3983–3988.
Wang R., Lv Q., Meng W. et al. Comparison of mammosphere formation from breast cancer cell lines and primary breast tumors // J. Thorac. Dis. 2014. V. 6. № 6. P. 829–837.
Hirschmann-Jax C., Foster A.E., Wulf G.G. et al. A distinct “side population” of cells in human tumor cells: implications for tumor biology and therapy // Cell Cycle. 2005. V. 4. P. 203–205.
Lee H.E., Kim J.H., Kim Y.J. et al. An increase in cancer stem cell population after primary systemic therapy is a poor prognostic factor in breast cancer // Br. J. Cancer. 2011. V. 104. P. 1730–1738.
Tanaka H., Nakamura M., Kameda C. et al. The Hedgehog Signaling Pathway Plays an Essential Role in Maintaining the CD44+CD24–/low Subpopulation and the Side Population of Breast Cancer Cells // Anticancer Res. 2009. V. 29. P. 2147–2158.
Ponti D., Costa A., Zaffaroni N. et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties // Cancer Res. 2005. V. 65.P. 5506–5511.
Wang Y.C., Chao T.K., Chang C.C. et al. Drug Scree-ning Identifies Niclosamide as an Inhibitor of Breast Cancer Stem-Like // Cells PLoS One. 2013. V. 8. № 9. e74538.
Шуватова В.Г., Кувырченкова А.П., Сёмочкина Ю.П., Москалёва Е.Ю. Радиосенсибилизация опухолевых стволовых клеток аденокарциномы молочной железы человека линии MCF-7 с помощью никлозамида // Мед. радиология и радиац. безопасность. 2017. Т. 62. № 6. С. 5–11.
Khanim F.L., Merrick B.A., Giles H.V. et al. Redeployment-based drug screening identifies the anti-helminthic niclosamide as anti-myeloma therapy that also reduces free light chain production // Blood Cancer J. 2011. V. 1. № 10, e39.
Chen M., Wang J., Lu J. et al. The anti-helminthic niclosamide inhibits Wnt/Frizzled1 signaling // Biochemistry. 2009. V. 48. P. 10267–10274.
Dontu G., Abdallah W.M., Foley J.M. et al. In vitro pro-pagation and transcriptional profiling of human mammary stem/progenitor cells // Genes Dev. 2003. V. 17. № 10. P. 1253–1270.
Krutzik P., Nolan G. Intracellular phosphoprotein stai-ning techniques for flow cytometry: monitoring single cell signaling events // Cytometry. Part A. 2003. V. 55A. P. 61–70.
Yin L., Gao Y., Zhang X. et al. Niclosamide sensitizes triple-negative breast cancer cells to ionizing radiation in association with the inhibition of Wnt/β-catenin signaling // Oncotarget. 2016. V. 7. № 27. P. 42126–42138.
Arend R.C., Londoño-Joshi A.I., Gangrade A. et al. Niclosamide and its analogs are potent inhibitors of Wnt/β-catenin, mTOR and STAT3 signaling in ovarian cancer // Oncotarget. 2016. V. 7. № 52. P. 86803–86815.
Li J., Li H., Zhan D. et al. Niclosamide sensitizes nasopharyngeal carcinoma to radiation by downregulating Ku70/80 expression // J. Cancer. 2018. V. 9. № 4. P. 736–744.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


