Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 293-299
ВЛИЯНИЕ γ-ИЗЛУЧЕНИЯ НА РАЗВИТИЕ РАСТЕНИЙ ИЗ ОБЛУЧЕННЫХ СЕМЯН И ПРОРОСТКОВ Allium cepa L.
Е. А. Трофимова 1, *, Д. В. Дементьев 1, А. Я. Болсуновский 1
1 Институт биофизики СО РАН, Федеральный исследовательский центр “Красноярский научный центр СО РАН”
Красноярск, Россия
* E-mail: e.trofimova11@yandex.ru
Поступила в редакцию 19.12.2017
Аннотация
Изучена реакция семян и проростков лука (Allium cepa L.) на воздействие γ-излучения в дозах 0.1–10 Гр по таким показателям, как длина корня и ростка, сырая и сухая биомасса. В экспериментах γ-излучение во всех использованных дозах, в том числе в малых дозах, приводило к угнетению параметров роста растений через 6 сут после облучения. Наиболее чувствительным ростовым параметром к γ-излучению является длина корней, которая уменьшалась почти в 3 раза по сравнению с контролем с увеличением поглощенной дозы. Повреждения, полученные проростками и семенами при облучении в дозах 0.1–2.5 Гр, не являлись критическими, и восстановление нормального роста происходило спустя 10 сут после прекращения облучения. При поглощенных дозах 2.0–2.5 Гр выявлено стимулирующее действие γ-излучения на рост растений.
В результате испытаний ядерного оружия, многолетней деятельности предприятий ядерно-топливного цикла, включая аварии на АЭС, в окружающую среду поступило значительное количество техногенных радионуклидов. Пойма р. Енисей загрязнена техногенными радионуклидами, в том числе в виде радиоактивных микрочастиц, в результате многолетней деятельности Горно-химического комбината (ГХК) ГК “Рос-атом” [1–3]. Радиоактивные частицы с высокой активностью 137Cs (до 30 МБк) [2, 3] являются точечными источниками внешнего γ-излучения, создающими дополнительную дозовую нагрузку для водных и наземных организмов. Для моделирования влияния γ-излучения радиоактивных частиц ранее нами были проведены лабораторные эксперименты с различными растительными и бактериальными биотестами [4, 5], которые показали высокую чувствительность биотестов к γ-излучению в малых дозах. В отдельных токсикологических исследованиях нами использовался луковый биотест (Allium-test) [6], который ранее хорошо зарекомендовал себя для оценки химической и радиационной токсичности проб окружающей среды [7, 8]. В наших экспериментах использование лукового биотеста выявило не ингибирование, а стимуляцию параметров роста корней при использованных дозах облучения [6]. Стандартный Allium-test проводится как на луковицах репчатого лука [9, 10], так и на его семенах [10]. Семена являются удобным тест-объектом, поскольку они находятся в состоянии биологического покоя и обладают генетической и физиологической однородностью. Биотесты с использованием семян репчатого лука показали хорошие результаты при оценке цито- и генотоксичности электромагнитного излучения [11] и почв из зоны отчуждения Чернобыльской АЭС [12]. Влияние высоких доз γ-излучения (10–100 крад) на всхожесть семян и развитие проростков лука исследовано в работе M. Amjad и M.A. Anjum [13]. Однако экспериментальных работ по влиянию γ-излучения в малых дозах на рост корней и ростков семян лука нами не найдено.
Цель данной работы – оценить влияние γ-излучения на рост проростков лука после облучения семян в лабораторных экспериментах.
МАТЕРИАЛЫ И МЕТОДИКА
В экспериментах по биотестированию γ-излучения использовали семена репчатого лука (Allium cepa L.) (2n = 16) сорта “Штуттгартер ризен”. Семена хранились при температуре 4°С в коммерческой упаковке до их использования в экспериментах. Было проведено два варианта экспериментов: облучение набухших семян и облучение проростков семян лука. Облучение проростков и семян проводили в Институте ядерной физики им. Г.И. Будкера СО РАН (Новосибирск) от источника γ-излучения 137Cs (активность 1.38 × 1010 Бк), время облучения – 24 ч. Всего было проведено три эксперимента: эксперимент № 1 в октябре 2016 г. – облучение семян и проростков; эксперименты № 2 и № 3 в июле и октябре 2017 г. – облучение проростков. Семена и проростки лука облучали в дозах: эксперимент № 1 – 0.1 и 2.5 Гр; эксперимент № 2 – 0.1, 1, 2, 6 и 10 Гр; эксперимент № 3 – 0.1, 0.4, 1, 2 и 10 Гр. При этом мощности дозы γ-излучения, соответствующие поглощенным дозам, составляли: эксперимент № 1 – 4 и 105 мГр/ч; эксперимент № 2 – 4, 42, 84, 250 и 430 мГр/ч; эксперимент № 3 – 4, 17, 42, 84 и 430 мГр/ч. Значения мощности дозы определялись расстоянием корней проростков от источника и были получены расчетным методом на основании паспортной мощности экспозиционной дозы для источника 137Cs и проверены прямыми измерениями дозиметром ДКС-АТ1123 (НПП “Доза”, Россия). Контролем служили необлученные семена или проростки семян (мощность дозы в контроле 0.002 мГр/ч).
Перед началом экспериментов с проростками лука семена проращивали в полипропиленовых контейнерах на фильтровальной бумаге, смоченной в дистиллированной воде. Всхожесть семян оценивали на 7-й день проращивания по ГОСТ 12038-84 [14], и она составляла 87%. Для облучения использовали проростки с длиной первичного корня 2–3 мм. Семена в эксперименте по облучению семян лука предварительно раскладывали на влажную фильтровальную бумагу для набухания на 11 ч, перед началом облучения влажность семян составляла 44–46%. Облучение проростков и семян проводили в прозрачных полипропиленовых контейнерах на ложе из двух слоев фильтровальной бумаги, смоченной в дистиллированной воде в течение суток, без освещения при температуре 18°С. Для каждого уровня облучения и контроля было использовано от 15 до 40 проростков и по 300 семян. Эксперименты проводили в одной биологической повторности.
После облучения проростки лука подращивали 6 и 10 сут в прозрачных полипропиленовых контейнерах на фильтровальной бумаге, смоченной фильтрованной водопроводной водой, при освещении 2.5–3.0 клк без фотопериода при температуре 24°С. Облученные семена также проращивали в полипропиленовых контейнерах на фильтровальной бумаге, смоченной фильтрованной водопроводной водой. По окончании экспериментов у растений определяли следующие параметры: длина корня, длина ростка, сырая и сухая масса растения, относительная скорость роста корней, рассчитанная по формуле:
где: Xt – длина корней (мм) в конце эксперимента, X0 – длина корней (мм) в начале эксперимента, T – длительность эксперимента (сут).Полученные экспериментальные данные анализировали методами вариационной статистики с использованием пакета STATISTICA 7.0. Статистическую значимость отличий оценивали с помощью критерия Стьюдента. На рисунках и в таблице 1 представлены средние значения и их стандартные отклонения.
Таблица 1.
Результаты эксперимента № 1 по облучению проростков и семян лука
| Доза, Гр | n, шт. | Длина ростков, мм | Длина корней, мм | Масса растений, мг | ||
|---|---|---|---|---|---|---|
| первичный | суммарная | сырая | сухая | |||
| Облученные семена спустя 6 сут | ||||||
| Контроль | 12 | 28.2 ± 4.2 | 15.5 ± 1.8 | ‒ | 13.5 ± 2.3 | 1.8 ± 0.3 |
| 0.1 | 13 | 24.2 ± 3.2* | 14.1 ± 1.7 | ‒ | 10.5 ± 1.3* | 1.1 ± 0.2* |
| 2.5 | 19 | 30.2 ± 3.3 | 15.6 ± 1.7 | ‒ | 13.9 ± 1.9 | 1.6 ± 0.3 |
| Облученные семена спустя 10 сут | ||||||
| Контроль | 20 | 31.3 ± 3.7 | 15.1 ± 1.3 | 18.9 ± 5.8 | 17.5 ± 2.5 | 1.7 ± 0.3 |
| 0.1 | 19 | 30.9 ± 4.5 | 16.6 ± 1.2 | 16.8 ± 1.4 | 15.7 ± 2.2 | 1.5 ± 0.3 |
| 2.5 | 17 | 33.5 ± 5.7 | 18.5 ± 2.2* | 23.6 ± 3.8* | 18.4 ± 3.1 | 1.5 ± 0.3 |
| Облученные проростки спустя 10 сут | ||||||
| Контроль | 14 | 36.1 ± 5.4 | 17.3 ± 3.5 | 18.5 ± 3.9 | 17.3 ± 2.8 | 1.4 ± 0.3 |
| 0.1 | 11 | 40.2 ± 5.8 | 22.9 ± 6.4* | 26.0 ± 7.3* | 22.8 ± 4.4* | 1.9 ± 0.4* |
| 2.5 | 12 | 39.6 ± 6.3 | 21.0 ± 3.2* | 26.3 ± 4.3* | 21.9 ± 4.6* | 1.6 ± 0.4 |
РЕЗУЛЬТАТЫ
Облучение семян и проростков лука (эксперимент № 1)
Всхожесть облученных семян при дозах 0.1 и 2.5 Гр составляла 62 и 63% соответственно и не отличалась от контрольных семян (63%). На 6-е сутки у растений, выросших из семян после γ-облучения в дозе 0.1 Гр, наблюдалось достоверное снижение длины ростков, сырой и сухой массы растений относительно контроля (таблица 1). Однако по длине первичных корней отличий между экспериментом при дозе 0.1 Гр и контролем не было. Облучение семян в дозе 2.5 Гр не привело к снижению какого-либо регистрируемого параметра роста семян по сравнению с контролем. Значения длины ростка и биомассы растений на 10-е сутки после облучения семян были близки к контрольным для всех доз облучения. При этом для дозы γ-излучения 2.5 Гр длина первичных и суммарная длина корней достоверно превышали показатели в контроле (таблица 1).
В эксперименте № 1 параллельно с облучением семян проводили облучение проростков лука, которые потом подращивали в течение 10 сут. Как следует из полученных данных (таблица 1), облучение во всех дозах не повлияло на длину ростков растений по сравнению с контролем. При этом длина первичных и суммарная длина корней достоверно превышали контрольный уровень для облучения в дозах 0.1 и 2.5 Гр (таблица 1). Таким образом, последующее развитие растений в течение 10 сут после облучения семян и проростков семян лука не отличается; наблюдается стимуляция развития первичного корня при облучении в дозе 2.5 Гр по сравнению с контролем.
Облучение проростков лука (эксперименты № 2 и № 3)
В экспериментах № 2 и № 3 облучение проростков лука проводили в диапазоне доз от 0.1 до 10 Гр. Облучение проростков лука показало угнетение роста растений на 6-е сутки относительно контроля по таким параметрам, как длина ростков и первичных корней, сырая и сухая масса растений. В этих экспериментах достоверное снижение длины ростков наблюдалось во всем диапазоне доз от 0.1 до 10 Гр (рис. 1, а). Уменьшение длины первичного корня хотя и начиналось с 0.1 Гр в эксперименте № 3, однако достоверные отличия от контроля по результатам двух экспериментов приходились на диапазон 1–10 Гр. При этом уменьшение длины корня при облучении в максимальных дозах было более значительным (с 20 до 7 мм), по сравнению с уменьшением длины ростков (с 23 до 17 мм) (рис. 1, б). Значения сырой и сухой биомассы достоверно снижались при облучении в дозе 0.1 Гр только в эксперименте № 3, а статистически значимые отличия биомасс от контроля для двух экспериментов были получены при облучении в дозах, начиная с 1 Гр и до 10 Гр.
Рис. 1.
Длина ростков (а) и первичного корня (б) через 6 сут после облучения проростков семян лука в экспериментах № 2 и 3; прямая линия – контроль. *Статистически значимое отличие от контрольного уровня (р < 0.05).

При анализе роста растений на 10-е сутки отмечается отсутствие снижения параметров роста облученных проростков по сравнению с контролем в диапазоне доз от 0.1 до 2 Гр (рис. 2). В экспериментах № 2 и № 3 уменьшение длины ростков достоверно регистрировалось только при облучении в дозе 10 Гр, в то время как при дозе 2 Гр в эксперименте № 2 отмечена стимуляция роста ростков (аналогично данным эксперимента № 1 для корней). Достоверное ингибирование длины первичного корня и суммарной длины корней отмечалось в обоих экспериментах при максимальных дозах 6 и 10 Гр, за исключением дозы 0.1 Гр в эксперименте № 3, где также было отмечено ингибирование (рис. 2, б).
Рис. 2.
Длина ростков (а) и первичного корня (б) через 10 сут после облучения проростков семян лука в экспериментах № 2 и 3; прямая линия – контроль. *Статистически значимое отличие от контрольного уровня (р < 0.05).

Расчет относительных скоростей роста корней для экспериментов № 2 и № 3 показал их уменьшение с достоверными отличиями от контроля при облучении в дозах 6 и 10 Гр, а также в отдельных экспериментах при дозе 0.1 Гр (рис. 3). Рассчитанные скорости роста корней спустя 6 сут после облучения были выше, чем для растений спустя 10 сут после облучения. Значения скоростей роста корней облученных проростков эксперимента № 1 для растений спустя 10 сут не отличались достоверно от данных других экспериментов.
Рис. 3.
Относительная скорость роста корней через 6 (а) и 10 сут (б) после облучения проростков семян лука в экспериментах № 1, 2 и 3; прямая линия – контроль. *Статистически значимое отличие от контрольного уровня (р < 0.05).
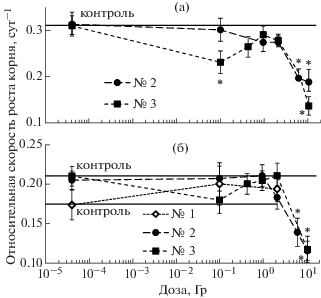
Сопоставление результатов трех экспериментов позволяет выделить общие закономерности: 1) эффекты ингибирования параметров роста наиболее выражены для растений спустя 6 сут после облучения; 2) для растений спустя 10 сут после облучения эффекты ингибирования роста наблюдаются только при поглощенных дозах 6 и 10 Гр; 3) наиболее чувствительным ростовым параметром при облучении является длина корней, которая уменьшалась почти в 3 раза по сравнению с контролем с увеличением дозы облучения; 4) при малой дозе облучения 0.1 Гр во всех трех экспериментах было зарегистрировано ингибирование одного или нескольких ростовых параметров только для растений спустя 6 сут после облучения; 5) при облучении в дозах 2–2.5 Гр в двух из трех экспериментов была зарегистрирована достоверная стимуляция параметров роста растения относительно контроля только спустя 10 сут после облучения.
ОБСУЖДЕНИЕ
Чувствительность растений к облучению зависит от стадии развития организма, и в ряде исследований показано, что культуры тканей и семена более устойчивы к действию ионизирующего излучения, чем проростки [15–17]. Как видно из результатов нашего исследования, у растений лука на 6-е сут после облучения наблюдалось угнетение роста по таким параметрам, как длина ростков и корней, относительная скорость роста корней, а также сырая и сухая масса растений при облучении во всем диапазоне доз. Доза γ-излучения для сухих семян лука, в дальнейшем ингибирующая рост проростков на 50%, составляет 200–300 Гр [18], в наших экспериментах ингибирование роста наступало при облучении в дозах 1–10 Гр. Вероятно, такой биологический отклик набухших семян и проростков лука на воздействие ионизирующего излучения в низких дозах в первую очередь связан с более высоким содержанием воды по сравнению с сухими семенами. С повышением влажности увеличивается чувствительность семян к облучению [18, 19]. Биологический эффект γ-излучения основан на его взаимодействии с атомами или молекулами вещества в клетке, в особенности с водой. В клетке в результате радиолиза воды возникают свободные радикалы, которые могут повредить важные компоненты растительной клетки и, как следствие, повлиять на морфологию, анатомию, биохимию и физиологию растения в зависимости от дозы радиации [20].
При поглощении воды в семени активируются метаболические процессы, которые впоследствии приводят к росту тканей зародыша и проникновению первичного корня (или другого органа) через окружающие ткани во внешнюю среду (прорастание семени) [21]. Активная пролиферация клеток – одна из причин более высокой радиочувствительности проростков по сравнению с сухими семенами, которые, по сути, представляют собой покоящуюся стадию растения с подавленными процессами метаболизма. Радиоустойчивость меристемных клеток ниже, чем дифференцированных клеток и тканей, поэтому при действии ионизирующего излучения на растение в первую очередь поражаются активно делящиеся клетки [18].
В экспериментах по биотестированию с использованием погруженных макрофитов ряд авторов [22–25] отмечают, что корни являются наиболее чувствительной к токсическому воздействию частью растения. В исследовании M. Amjad и M.A. Anjum [13] корни проростков лука, выращенные из семян, облученных в дозах 10, 20, 80 и 100 крад, оказались более чувствительны к действию радиации, чем ростки. В лабораторных экспериментах по оценке влияния ионизирующего излучения на рост элодеи канадской было показано угнетение роста корней этого растения при малых мощностях доз облучения, начиная с 2–3 мкГр/ч [4]. В наших исследованиях корни проростков лука проявили большую чувствительность к действию радиационного фактора, чем ростки. При облучении в самых высоких из исследованных нами дозах 6 и 10 Гр можно было наблюдать сильную опушенность корней в зоне роста и побурение апексов, что свидетельствует об отмирании клеток поверхностных тканей корня.
Повреждения, полученные клетками апикальной меристемы проростков лука, не были критическими, так как после восстановительного периода в 10 сут после воздействия γ-излучения разница значений по параметрам роста между контролем и экспериментом нивелировалась, кроме самой высокой дозы 10 Гр. На самой высокой из исследованных нами доз – 10 Гр рост первичных корней лука сильно замедлился: их длина спустя 10 сут после облучения оставалась близка к значению, которое было спустя 6 сут после облучения. Кроме того, у растений, облученных в высоких дозах, был нарушен процесс формирования новых корней; это хорошо заметно по снижению суммарной длины корней и их относительной скорости роста. Замедленное корнеобразование и ингибирование роста корня у растений, облученных в диапазоне доз 6–10 Гр, может привести к их гибели. Ингибирование роста, индуцированное облучением в высоких дозах, связывают с остановкой клеточного цикла в фазе G2 митоза и прекращением синтеза ауксина [20]. Схожие результаты были получены для гороха, где при облучении в дозах 8–10 Гр наблюдалось угнетение корневой системы, а выше 10 Гр – замедление и остановка роста главного корня [26]. Также у таких растений можно было наблюдать увеличение сухой массы, хотя их сырая масса находилась на уровне значений в контроле. Это можно объяснить тем, что в растениях, облученных пороговыми поглощенными дозами, продолжают синтезироваться и накапливаться не используемые для роста пластические вещества, поскольку процессы фотосинтеза и дыхания не ингибируются даже дозами, подавляющими рост растений [20, 27].
При проведении Allium-теста на луковицах по оценке токсичности ионизирующего излучения в малых дозах [28, 29] были получены немногочисленные и противоречивые данные. Так, в работе С.В. Пятковой и соавт. [28] при исследовании токсичности радиоактивных проб с территории Семипалатинского ядерного полигона и воздействии γ-излучения на луковицы был сделан вывод, что достоверные биологические эффекты (повышение частоты аберрантных клеток в корневой меристеме лука) наблюдались при уровнях облучения, превышающих 1 мГр. Однако в работе С.Ю. Синовец и соавт. [29] для определения радиочувствительности луковицы облучали в дозах от 0.1 до 2 Гр (от источника 60Со) и было показано, что в данном диапазоне доз суммарные частоты аберрантных клеток лука не превышают контрольного значения. Как уже отмечалось, в лабораторных экспериментах по оценке влияния ионизирующего излучения на рост элодеи канадской было показано угнетение роста корней этого растения при облучении в малых дозах, начиная с 1–2 мГр [4]. В наших исследованиях также отмечены эффекты токсичности облучения в малых дозах на рост корней проростков лука, но при более высоких значениях из области малых доз.
В трех проведенных нами экспериментах был зарегистрирован эффект угнетения ростовых параметров лука при минимальной дозе облучения 0.1 Гр, которую принято считать малой дозой облучения. В работе R. Zaka и соавт. [30] при облучении проростков гороха (поглощенные дозы от 0.2 до 10 Гр) показано, что малые дозы могут вызывать стойкие ингибирующие эффекты роста растений, которые регистрируются даже через два поколения. Например, при дозе облучения 0.4 Гр наблюдалось достоверное ингибирование роста растений во втором поколении, что, по мнению авторов, объясняется индуцированной облучением геномной нестабильностью растений [30]. В области малых доз от 0.2 до 0.4 Гр также был отмечен рост индукции хромосомных нарушений и микроядер в апикальных клетках корней облученных проростков гороха [30], в области от 0.05 до 0.5 Гр – для проростков ячменя [31]. Можно предположить, что в наших экспериментах повреждающий эффект (при дозе облучения 0.1 Гр) также связан с тенденцией увеличения цитогенетических нарушений в клетках.
Воздействие на семена γ-излучением в низких дозах приводит к стимуляции на клеточном уровне и может ускорять фотосинтез, дыхание, скорость транспорта электронов [19]. Ранее было показано стимулирующее действие радиации в малых дозах на рост корней луковиц [6]; стимулирующие дозы для развития проростков красного перца при γ-излучении – 2 и 4 Гр [17], для семян ячменя – 20 Гр [32], для набухших семян и проростков риса при облучении тяжелыми ионами – 0.2 и 2 Гр [16]. В данном исследовании у семян и проростков лука выявлен положительный биологический отклик (стимуляция роста ростков, первичных и вторичных корней) на воздействие γ-излучения в низких дозах 2.0–2.5 Гр после восстановительного периода (на 10-е сут после облучения). Известно, что облучение в низких дозах может стимулировать рост за счет изменения сети гормональной сигнализации в растительных клетках, либо путем увеличения антиоксидантной способности клеток [20]. Согласно данным авторов [18, 33], стимулирующее действие малых доз радиации на рост растений регистрируется, как правило, в течение первых 3–6 сут после облучения и в дальнейшем (через 2–3 сут) эффект нивелируется. Но в нашем исследовании стимуляция наблюдается несколько позже установленных в литературе сроков.
Результаты использования Allium-теста показали, что γ-облучение проростков лука в диапазоне доз 0.1–10 Гр приводило к угнетению параметров роста растений через 6 сут после облучения. Наиболее чувствительным ростовым параметром при облучении была длина корней, которая уменьшалась почти в 3 раза по сравнению с контролем при увеличении дозы облучения. При облучении в малой дозе 0.1 Гр во всех проведенных экспериментах было зарегистрировано ингибирование ростовых параметров только для растений спустя 6 сут после облучения. Однако повреждения, полученные проростками и семенами при облучении в дозах 0.1–2.5 Гр, не являлись критическими, и восстановление нормального роста происходило спустя 10 сут после облучения. При облучении в дозах 2–2.5 Гр для набухших семян и проростков лука на 10-е сут после облучения выявлено стимулирующее действие γ-излучения на рост ростков и корней. В то же время экспозиция при поглощенных дозах более 6 Гр привела к ингибированию роста растений.
Список литературы
Bolsunovsky A. Artificial radionuclides in sediment of the Yenisei River // Chem. Ecol. 2010. V. 26. № 6. P. 401–409.
Bolsunovsky A.Ya., Tcherkezian V.O. Hot particles of the Yenisei River flood plain, Russia // J. Environ. Radioact. 2001. V. 57. № 3. P. 167–174.
Bolsunovsky A., Melgunov M., Chuguevskii A. et al. Unique diversity of radioactive particles found in the Yenisei River floodplain // Scientific Reports. 2017. № 7. Article number: 11132. P. 1–10.
Болсуновский А.Я., Дементьев Д.В, Трофимова Е.А., Зотина Т.А. Новые данные о влиянии радиационного излучения на рост водного растения Elodea canadensis в лабораторных экспериментах // ДАН. 2017. Т. 475. № 1. С. 113–119.
Bolsunovsky A., Frolova T., Dementyev D., Sinitsyna O. Low doses of gamma-radiation induce SOS response and increase mutation frequency in Escherichia coli and Salmonella typhimurium cells // Ecotoxicol. Environ. Safety. 2016. V. 134. Part 1. P. 233–238.
Болсуновский А.Я., Трофимова Е.А., Зуева А.В., Дементьев Д.В. Первые данные по использованию Allium-теста для оценки химической и радиационной токсичности донных отложений реки Енисей // ДАН. 2016. Т. 469. № 4. С. 513–517.
Leme D.M., Marin-Morales M.A. Allium cepa test in environmental monitoring: A review on its application // Mutat. Res. 2009. V. 682. № 1. P. 71–81.
Geras’kin S., Oudalova A., Michalik B. et al. Geno-toxi-city assay of sediment and water samples from the Upper Silesia post-mining areas, Poland by means of Allium-test // Chemosphere. 2011. V. 83. P. 1133–1146.
Fiskesjo G. The Allium test as a standard in environmental monitoring // Hereditas. 1985. V. 102. P. 99–112.
Grant W.F. Chromosome aberration assays in Allium. A report of the U.S. Environmental Protection Agency Gene-Tox Program // Mutat. Res. 1982. V. 99. № 3. P. 273–291.
Tkalec M., Malari K., Pavlica M. et al. Effects of radio-frequency electromagnetic fields on seed germination and root meristematic cells of Allium cepa L. // Mutat. Res. 2009. V. 672. P. 76–81.
Kovalchuk O., Kovalchuk I., Arkhipov A. et al. The Allium cepa chromosome aberration test reliably measures genotoxicity of soils of inhabited areas in the Ukraine contaminated by the Chernobyl accident // Mutat. Res. 1998. V. 415. P. 47–57.
Amjad M., Anjum M.A. Effect of gamma radiation on onion seed viability, germination potential, seedling growth and morphology // Pak. J. Agric. Sci. 2002. V. 39. № 3. P. 202–206.
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. Межгосударственный стандарт. Стандарты на методы контроля. М., 2002. 28 с.
Rao P.S., Harada H., Bapat V.A. A comparative study of the differential radiosensitivity of seeds, seedlings and tissue cultures of the Japanese morning glory (Pharbitis nil) // Plant and Cell Physiol. 1976. V. 17. P. 119–125.
Shi J.M., Guo J.G., Li W.J. et al. Cytogenetic effects of low doses of energetic carbon ions on rice after exposures of dry seeds, wet seeds and seedlings // J. Radiat. Res. 2010. № 51. P. 235–242.
Kim J.H., Chung B.Y., Kim J.S., Wi S.G. Effects of in planta gamma-irradiation on growth, photosynthesis, and antioxidative capacity of red pepper (Capsicum annuum L.) plants // J. Plant Biol. 2005. V. 48. № 1. P. 47–56.
Гродзинский Д.М. Радиобиология растений. Киев: Наук. думка, 1989. 384 с.
De Micco V., Arena C., Pignalosa D., Durante M. Effects of sparsely and densely ionizing radiation on plants // Radiat. Environ. Biophys. 2011. V. 50. P. 1–19.
Jan S., Parween T., Siddiqi T.O., Mahmooduzzafar. Effect of gamma radiation on morphological, biochemical, and physiological aspects of plants and plant products // Environ. Rev. 2012. № 20. P. 17–39.
Bewley J.D., Bradford K.J., Hilhorst H.W.M., Nonogaki H. Seeds. Physiology of development, germination and dormancy. Springer Science + Business Media, LLC, 2013. 399 p.
Ferreira R.C.F., Graca M.A.S. A comparative study of the sensitivity of selected aquatic plants to mining effluents // Limnetica. 2002. № 21. P. 129–134.
Sanchez D., Grase M.A.S., Canhoto J. Testing the use of watermilfoil (Myriophyllum spicatum L.) in laboratory toxicity assays // Bull. Environ. Contam. Toxicol. 2007. № 78. P. 421–426.
Arts G.H.P., Belgers J.D.M., Hoekzema C.H., Thissen J.T.N.M. Sensitivity of submerged freshwater macrophytes and endpoints in laboratory toxicity tests // Environ. Pollut. 2008. № 153. P. 199–206.
Zotina T.A., Trofimova E.A., Medvedeva M.Yu. et al. Use of the aquatic plant Elodea canadensis to assess toxi-city and genotoxicity of Yenisei river sediments // Environ. Toxicol. Chem. 2015. V. 34. P. 2310–2321.
Кравец Е.А., Михеев А.Н., Овсянникова Л.Г., Гродзинский Д.М. Критический уровень радиационного повреждения апикальной меристемы корня и механизмы ее восстановления у Pisum sativum L. // Цитология и генетика. 2011. № 1. С. 24–34.
Васильев И.М. Действие ионизирующих излучений на растения. М.: Изд-во АН СССР, 1962. 224 с.
Пяткова С.В., Гераськин С.А., Васильева А.Н., Козьмин Г.В., Лянной Н.Н. Особенности использования Аllium-теста для оценки токсичности образцов воды и почвы с радиоактивно загрязненных территорий // Изв. ВУЗов. Ядерная энергетика. 2009. № 3. С. 50–57.
Синовец С.Ю., Пяткова С.В., Козьмин Г.В. Экспериментальное обоснование использования Аллиум-теста в радиоэкологическом мониторинге // Изв. ВУЗов. Ядерная энергетика. 2009. № 1. С. 32–38.
Zaka R., Chenal C., Misset M.T. Study of external low irradiation dose effects on induction of chromosome aberrations in Pisum sativum root tip meristem // Mutat. Res. 2002. V. 517. P. 87–99.
Geras’kin S.A., Oudalova A.A., Kim J. K. et al. Cytogenetic effect of low dose c-radiation in Hordeum vulgare seedlings: non-linear dose–effect relationship // Radiat. Environ. Biophys. 2007. № 46. P. 31–41.
Гераськин С.А., Чурюкин Р.С., Казакова Е.М. Модификация развития ячменя на ранних этапах онтогенеза при воздействии γ-излучения не семена // Радиац. биология. Радиоэкология. 2015. Т. 55. № 6. С. 607–615.
Гудков И.Н. Основы общей и сельскохозяйственной радиобиологии. Киев: Изд-во УСХА, 1991. 328 с.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


