Радиационная биология. Радиоэкология, 2019, T. 59, № 3, стр. 286-292
ЭКСПРЕССИЯ ГЕНОВ БИОСИНТЕЗА И КАТАБОЛИЗМА ГИББЕРЕЛЛИНОВ В ЗАРОДЫШАХ СЕМЯН ЯЧМЕНЯ, ПОДВЕРГШИХСЯ ВОЗДЕЙСТВИЮ γ-ИЗЛУЧЕНИЯ
С. В. Битаришвили 1, *, В. С. Бондаренко 1, С. А. Гераськин 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
Обнинск, Россия
* E-mail: bitarishvili.s@gmail.com
Поступила в редакцию 01.06.2018
Аннотация
Исследовано изменение экспрессии генов биосинтеза (HvGA3ox2) и катаболизма (HvGA2ox3) гиббереллинов в зародышах семян ячменя, облученных в дозах 4–50 Гр, в течение первых 30 ч прорастания. Показано, что транскрипционная активность гена катаболизма гиббереллинов HvGA2ox3 была увеличена на каждом этапе прорастания, кроме одного – через 12 ч после начала эксперимента. Транскрипционная активность гена биосинтеза гиббереллинов HvGA3ox2 была снижена в ранний период наблюдения (через 6, 12 ч после начала прорастания семян) и увеличена на более поздних этапах (через 24, 30 ч после начала прорастания семян). После 18 ч прорастания наблюдали пик транскрипционной активности исследуемых генов в зародышах как контрольных, так и облученных семян; при воздействии в дозе 20 Гр концентрация транскриптов гена биосинтеза гиббереллинов HvGa3ox2 была максимальна и превышала таковую гена катаболизма гиббереллинов HvGa2ox3 более чем на порядок. Экспрессия генов метаболизма гиббереллинов может указывать на изменение потенциала их синтеза в зависимости от доз γ-излучения и периода прорастания.
Изучение закономерностей формирования ответных реакций растений на действие ионизирующих излучений является актуальной проблемой радиобиологии. Особый интерес исследователей вызывают эффекты в области малых доз, к которым относится радиационный гормезис, подразумевающий стимулирующий эффект низкодозового облучения, в то время как большие дозы приводят к ингибированию биологических процессов [1]. При облучении семян сельскохозяйственных растений в дозах 5–30 Гр наблюдаются ускорение темпов их прорастания, стимуляция роста и развития проростков, увеличение урожая, повышение стрессоустойчивости растений [2]. В большинстве работ, посвященных исследованию этого феномена, основные усилия направлены на изучение фенотипических признаков – морфометрических параметров и структуры урожая. При этом механизмы формирования наблюдаемых эффектов остаются не до конца раскрытыми. В этой связи особую актуальность имеют исследования на молекулярном уровне, направленные на выявление ключевых генов, изменение экспрессии которых через сложные метаболические пути приводят к стимуляции развития растений.
В нашей предыдущей работе [3] было изучено влияние γ-облучения семян ячменя в дозах 4–50 Гр на изменение содержания эндогенных регуляторов роста и развития растений. Было показано, что радиационное воздействие приводит к сдвигам в фитогормональном балансе проростков: увеличивает содержание фитогормонов, стимулирующих рост, и снижает содержание ингибитора прорастания.
Гиббереллины играют ключевую роль на ранних этапах онтогенеза, они инициируют выход семян из состояния покоя и переход к прорастанию [4], вызывая синтез α-амилазы в алейроновом слое, что приводит к гидролизу крахмала эндосперма и обеспечению зародыша питательными веществами [5]. Основные изменения транскрипционной активности генов при переходе к прорастанию происходят в тканях зародыша, но не в эндосперме [6]. Содержание гиббереллинов во время прорастания регулируется семействами генов GA3ox, кодирующих фермент биосинтеза GA3-оксидазу, и генов GA2ox, кодирующих фермент катаболизма GA2-оксидазу [7].
Целью настоящей работы был анализ изменения экспрессии генов биосинтеза и катаболизма гиббереллинов в зародышах семян ячменя в течение первых 30 ч прорастания в зависимости от дозы γ-излучения.
МАТЕРИАЛЫ И МЕТОДИКА
Объект исследования
В качестве объекта исследования был выбран ячмень (Hordeum vulgare L.) сорта Нур первой репродукции. Семена влажностью 13–15% облучали в дозах 4, 10, 16, 20 и 50 Гр (60Со, 60 Гр/ч, установка “ГУР-120”; ВНИИРАЭ, Обнинск). Дозу излучения измеряли с помощью дозиметра ДКС-101 (Политехформ-М, Россия, паспортная относительная погрешность измерений 4%). В качестве контроля использовали необлученные семена. Семена проращивали в рулонах из фильтровальной бумаги согласно ГОСТ 12038-84 [8]. Рулоны помещали в стаканы с дистиллированной водой и ставили в термостат MIR-254 (Sanyo, Япония) при температуре 20 ± 0.5°C.
Экстракция РНК
Для каждого измерения из 20 семян в трех биологических повторностях (60 семян на точку) извлекали зародыши, используя скальпель и препаровальную иглу, и фиксировали в жидком азоте до экстракции. Зародыши гомогенизировали до порошкообразной фракции в жидком азоте. Выделение РНК осуществляли при помощи набора для одновременного выделения ДНК, РНК и белка NucleoSpinTriPrep (Macherey-Nagel, Германия) согласно протоколу производителя. Синтез кДНК на матрице РНК осуществляли при помощи набора реактивов MMLV RT kit (Евроген, Россия). Концентрацию нуклеиновых кислот измеряли на спектрофотометре NanoDrop и флуориметре Qubit 2.0 c использованием наборов реактивов для флуориметрического измерения концентрации ДНК и РНК фирмы Invitrogen согласно протоколу производителя.
ПЦР в реальном времени
В данной работе исследовали экспрессию двух генов, участвующих в метаболизме гиббереллинов HvGA3ox2 (синтез) и HvGA2ox3 (катаболизм). В качестве референтного был выбран ген 18SrRNA, кодирующий 18S-субъединицу рРНК. У ячменя данный ген входит в число наиболее стабильных “генов домашнего хозяйства” в условиях биотических и абиотических стрессов и рекомендуется к использованию в качестве референтного при исследовании транскрипционной активности [9]. В качестве праймеров использовали последовательности, приведенные в табл. 1 [9, 10].
Таблица 1.
Олигонуклеотидные последовательности, используемые для анализа экспрессии генов 18SrRNA, HvGA3ox2 и HvGA2ox3
Уровни транскрипционной активности генов определяли методом ПЦР с обратной транскрипцией в режиме реального времени на амплификаторе ДТ-96 (ДНК-Технология). Реакционные смеси готовили на основе набора реактивов HS TaqDNA Polymerase dNTP mix (Евроген). Для детекции накопления продуктов ПЦР использовали флюоресцирующий краситель SYBR Green I (Lumiprobe, Германия).
Реакции проводили в объеме 20 мкл с первичной денатурацией в течение 10 мин при 95°С, затем 50 циклов с тремя температурными полками: 94°С 20 с, 60°С 20 с, 72°С 20 с. Детекцию накопления продуктов амплификации проводили автоматически на стадии отжига праймеров (60°С) каждого цикла.
Все реакции проводили в трех повторах (триплетах) для каждой матрицы кДНК. В случае, если значения порогового цикла реакции Сt в триплете различались на 0.5 и более, результаты по данному триплету признавали недействительными и реакцию для данной матрицы проводили повторно. Пороговая линия выставлялась автоматически в среде специализированного программного обеспечения фирмы “ДНК-Технология”. После получения для каждой матрицы значений Сt по референтному гену и Сt по исследуемому гену, вычисляли значение ΔСt по формуле:
РЕЗУЛЬТАТЫ
Экспрессия гена фактора биосинтеза гиббереллинов HvGA3ox2
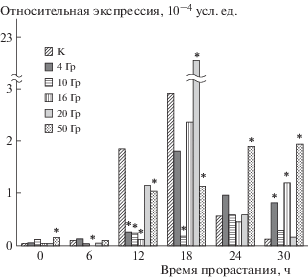
Экспрессия гена фактора биосинтеза гиббереллинов HvGA3ox2 в зародышах сухих семян и после 6 ч их замачивания при температуре 20°C находилась на очень низких уровнях как в контроле, так и после радиационного воздействия. Однако облучение в наибольшей дозе 50 Гр вело к значимому увеличению этого показателя в сухом семени, а облучение в дозе 16 Гр – к снижению после 6 ч прорастания (рис. 1). После 12 ч экспрессия гена HvGA3ox2 в контроле резко возрастала. При этом его транскрипционная активность в облученных семенах хотя и увеличилась по сравнению с показателями, зарегистрированными через 0–6 ч после начала эксперимента, но была при всех дозах воздействия, кроме 16 Гр, статистически значимо меньше, чем в контроле. Увеличение времени прорастания вело к увеличению транскрипционной активности гена HvGA3ox2. Наибольшее значение, превышающее таковое в контроле в 7 раз, зафиксировано через 18 ч прорастания зародышей при дозе 20 Гр, через 24 ч – при 50 Гр и через 30 ч – при дозах 4, 16 и 50 Гр. Через 24 и 30 ч наблюдали положительную корреляцию значений транскрипционной активности с дозой облучения (r = 0.81, p < 0.05; r = 0.75, p < 0.05 соответственно). Интересно, что через 12 ч прорастания транскрипционная активность гена HvGa3ox2 в зародышах семян, облученных в дозах 4, 10 и 16 Гр, статистически значимо снижалась относительно контроля. Такой же эффект наблюдали через 18 ч прорастания в зародышах семян, подвергшихся радиационному воздействию в дозе 10 Гр.
Экспрессия гена фактора катаболизма гиббереллинов HvGA2ox3
Экспрессия гена катаболизма гиббереллинов HvGA2ox3 демонстрировала более низкие уровни транскрипционной активности по сравнению с геном его биосинтеза. На каждом этапе прорастания фиксировали увеличение экспрессии гена HvGA2ox3 в зародышах облученных семян по отношению к контролю, за исключением показателей, зарегистрированных через 12 ч после начала эксперимента, для которых не было обнаружено статистически значимых отличий от контроля (рис. 2).
Рис. 2.
Транскрипционная активность гена катаболизма гиббереллинов HvGa2ox3 в зародышах в зависимости от дозы облучения семян и времени прорастания. * Различия статистически значимы по сравнению с контрольными значениями, p < 0.05, U-тест Манна–Уитни.
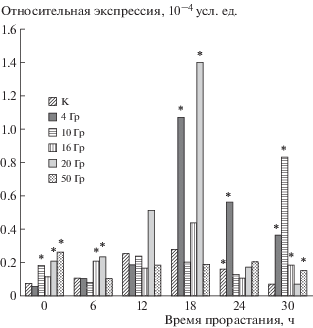
Как и в случае с геном HvGA3ox2, с увеличением времени прорастания возрастала транскрипционная активность гена HvGA2ox3 в облученных семенах, причем в контроле колебания уровней экспрессии в зависимости от времени прорастания были меньше, чем в зародышах облученных семян. В извлеченном из сухого семени зародыше наблюдали положительную корреляцию между транскрипционной активностью исследуемого гена и дозой облучения (r = 0.85; p < 0.05); статистически значимое усиление экспрессии гена происходило при 10, 20 и 50 Гр, в то время как после 6 ч прорастания – лишь при 16 и 20 Гр. Так же как и в случае с геном HvGA3ox2, наибольшая концентрация транскриптов в облученных зародышах была отмечена при 20 Гр через 18 ч прорастания. Интересно, что через 24 и 30 ч значения транскрипционной активности при 20 Гр не отличались от контроля. С увеличением времени прорастания семян наибольшее усиление экспрессии гена наблюдалось при меньших дозах (рис. 2): если в зародышах воздушно-сухих семян максимальное повышение транскрипционной активности гена HvGA2ox3 фиксировалось при использовании наибольшей дозы γ-излучения 50 Гр, через 6 ч прорастания – при 20 Гр, то через 24 и 30 ч – при облучении в наименьших дозах 4 и 10 Гр.
Облучение в дозе 4 Гр вело к увеличению транс-крипционной активности гена HvGA2ox3, причем по прошествии 18 ч и более от начала прорастания это увеличение было статистически значимым. Через 30 ч увеличение концентрации транскриптов наблюдалось при всех исследованных дозах за исключением 20 Гр. Облучение в дозе 20 Гр вело к увеличению исследуемого параметра в зародышах воздушно-сухих семян, так же как и через 6 и 18 ч после начала прорастания.
ОБСУЖДЕНИЕ
Прорастание семян является важнейшим этапом в жизни растений, в ходе которого под действием внешних и внутренних сигналов происходит активация генома и биохимических процессов, обеспечивающих переход к активному росту. К внутренним сигналам прежде всего относятся фитогормоны, которые регулируют все процессы, протекающие в растении, включая адаптивные реакции. Критическая роль в процессе прорастания отводится взаимодействию гиббереллины/абсцизовая кислота (АБК) [12]. В последнее время антагонизм гиббереллинов и АБК является предметом активного изучения, однако сложность организации сигнальных путей фитогормонов затрудняет понимание механизмов их регуляции. Есть данные о том, что АБК может ингибировать прорастание семян путем супрессии синтеза гиббереллинов: так, в мутантных семенах с дефицитом АБК aba2-2 обнаружено усиление экспрессии генов биосинтеза гиббереллинов [13]. То есть усиление прорастания в этих мутантных семенах происходит за счет снятия репрессии биосинтеза гиббереллинов. В условиях стресса АБК негативно регулирует прорастание через ингибирование синтеза гиббереллинов [12]. В ячмене прерывание покоя происходит, вероятно, через активацию синтеза и сигналинга гиббереллинов, нежели через пути, ассоциированные с АБК [14].
Гиббереллины инициируют выход семян из состояния покоя и начало прорастания, активируя гидролитические ферменты алейронового слоя эндосперма [5, 15]. Во время поступления воды в семя гиббереллины активно синтезируются de novo и переходят из связанных форм в активное состояние, вызывая размягчение окружающих зародыш структур [16].
Биохимические изменения на клеточном уровне в результате действия ионизирующего излучения опосредованы индукцией активных форм кислорода (АФК), избыток которых может привести к метаболической дисфункции или гибели клетки [17]. Однако АФК выполняют множество функций в метаболических процессах растений: в качестве сигнальных молекул, участвуют в ответе на биотический и абиотический стресс и передаче сигналов фитогормонов, а также играют важную роль в процессах прерывания покоя семян и их прорастания [18]. В современных представлениях о гормональной регуляции покоя и прорастания семян особое внимание уделяют взаимодействию АФК и фитогормонов. Есть данные, свидетельствующие о том, что гиббереллины способны увеличивать содержание АФК в алейроновом слое зародыша ячменя [19].
Экзогенные АФК стимулируют биосинтез гиббереллинов путем усиления экспрессии генов GA3ox, GA20ox [20]. Повышение уровня АФК влияет на прорастание семян ячменя не столько через репрессию сигнализации АБК, сколько через активацию синтеза и сигналинга гиббереллинов [21].
Нами экспериментально показано (рис. 1, 2), что в зародышах контрольных семян ген биосинтеза гиббереллинов HvGa3ox2 экспрессируется активнее, нежели ген инактивации HvGa2ox3. Это подтверждают и другие исследователи [6, 14, 16]. Наибольшая транскрипционная активность HvGa3ox2 и HvGa2ox3 в контрольных и облученных семенах наблюдалась через 18 ч прорастания. Это соотносится с представленными в работе [22] данными, где в ходе изучения влияния АФК на зародыш и клетки алейронового слоя ячменя самые большие значения экспрессии генов синтеза HvGa20ox1, HvGa3ox1 и катаболизма HvGa2ox4 наблюдали именно в этот срок. Возможно, обнаруженный пик транскрипционной активности генов метаболизма гиббереллинов (через 18 ч прорастания) отражает запуск генных сетей, ответственных за развитие проростков, а соответствующий временной интервал является критическим для прорастания семян ячменя.
Экспрессия гена биосинтеза гиббереллинов HvGa3ox2 в зародышах облученных семян показала отличную от контроля динамику. Более того, при облучении в дозе 50 Гр повышение транс-крипционной активности гена HvGa3ox2 наблюдалось даже в сухом семени. Это противоречит представлениям о том, что в ячмене уровень гиббереллинов не увеличивается до тех пор, пока не произошло набухания [23]. Увеличение транс-крипционной активности в зародышах семян на поздних этапах прорастания (18–30 ч) говорит в пользу повышения уровней гиббереллинов, что в свою очередь приводит к стимуляции прорастания семян. Наибольшее значение было зафиксировано через 18 ч прорастания при 20 Гр. Именно при этой дозе в проростках ячменя было обнаружено увеличение содержания основных классов фитогормонов, стимулирующих рост и развитие растений [3], увеличение активности ферментов антиоксидантных систем [24] и размеров проростков [25].
Увеличение транскрипционной активности HvGa2ox3 (на уровне значимых отличий от контроля или тенденций к увеличению) отмечено на всех этапах прорастания, кроме 12 ч, что косвенно указывает на снижение содержания гиббереллинов за счет их катаболизма и, как следствие, ингибирование прорастания. Это не соотносится с представлениями о том, что гиббереллины играют ведущую роль в стимуляции развития проростков, выполняя функцию триггер-эффектора для синтеза α-амилазы в алейроновом слое семени [26], и результатами, демонстрирующими увеличение содержания данного фитогормона в проростках в ответ на низкодозовое облучение [27]. Возможно, здесь имеет место ситуация, при которой паралогические гены способны изменять экспрессию отлично друг от друга в ответ на одно и то же воздействие. Можно предположить, что транскрипционная активность других генов-паралогов семейства HvGA2ox, не исследованная в данной работе, демонстрировала иную динамику в ответ на действие γ-излучения. Аналогично, при исследовании биосинтеза и сигналинга гиббереллинов в проростках арабидопсиса, гены из одного семейства AtGA3ox1 и AtGA3ox2 демонстрировали разнонаправленную динамику транскрипционной активности в ответ на гипотермию: активность гена AtGA3ox1 увеличивалась, в то время как активность AtGA3ox2 снижалась [28]. При исследовании изменения транскриптома ячменя в ходе прорастания [6] гены HvGA2ox1 и HvGA2ox2 показали противоположную динамику экспрессии через 24 ч после начала прорастания семян. Аналогичные явления наблюдали в работе [22], где ингибитор НАДФН способствовал снижению активности гена HvGA3ox1, в то время как таковая для HvGA3ox2 продолжала увеличиваться. Столь разные паттерны экспрессии генов одного семейства, возможно, связаны с работой дифференциальных регуляторных элементов и каскадов в каждом конкретном случае. Из этого следует, что для оценки экспрессии генов метаболизма гиббереллинов в полной мере необходимо анализировать транскрипционную активность всех представителей таргетных семейств генов.
ЗАКЛЮЧЕНИЕ
Полученные результаты продемонстрировали существенные изменения транскрипционной активности обоих исследуемых генов в зародышах облученных семян. Экспрессия гена катаболизма гиббереллинов HvGa2ox3 была увеличена на всех этапах прорастания, кроме одного – через 12 ч после начала эксперимента. Экспрессия гена биосинтеза гиббереллинов HvGa3ox2 демонстрировала разнонаправленную динамику, в том числе наблюдались и статистически значимые различия: была снижена на ранних этапах прорастания (через 6 и 12 ч после начала эксперимента) и увеличена на более поздних (через 24 и 30 ч после начала эксперимента). С увеличением времени прорастания наблюдалась тенденция к возрастанию разницы транскрипционной активности изученных генов между зародышами контрольных и облученных семян. Следует отметить, что облучение приводило к изменениям рассматриваемых параметров не только в зародышах набухших, но и воздушно-сухих семян (рис. 2). Максимальные значения экспрессии исследованных генов наблюдали при облучении семян в дозе 20 Гр после 18 ч прорастания. В данном случае транскрипционная активность исследованных генов превышала контрольные показатели в 6–7 раз, при этом концентрация транскриптов гена биосинтеза гиббереллинов HvGa3ox2 превышала таковую гена фактора катаболизма гиббереллинов HvGa2ox3 в облученных семенах более чем на порядок. Именно при воздействии излучения в дозе 20 Гр ранее наблюдались стимуляция развития проростков [25], увеличение содержания основных классов фитогормонов [3] и увеличение активности антиоксидантных ферментов [24] в проростках ячменя. Пик транскрипционной активности генов метаболизма гиббереллинов через 18 ч прорастания, возможно, отражает критический этап прорастания семян ячменя и запуск генетических программ развития растения.
В результате воздействия γ-излучения, как, вероятно, и в результате действия других факторов, происходит активация множественных сигнальных путей, имеющих различные временные и пространственные характеристики. Представляется, что первичный стимул воспринимается несколькими сенсорами, причем, в зависимости от природы раздражителя, их набор может отличаться [29]. Это ведет к различию каскадных процессов сигналинга вторичных мессенджеров, таких как фитогормоны, которые осуществляют регуляцию всех важнейших процессов жизнедеятельности растений и, взаимодействуя друг с другом и окружающими молекулами, создают сложную сигнальную сеть. Исследованная в данной работе экспрессия генов метаболизма гиббереллинов, не являясь заключительным звеном сигнального пути, не может являться единственной причиной повышенных уровней гиббереллинов, но может указывать на изменение потенциала их синтеза, в том числе и увеличения. Есть множество других аспектов, включая транскрипционную, посттранскрипционную и посттрансляционную регуляцию, генную избыточность, альтернативный сплайсинг, некодирующие РНК и эпигенетические эффекты, которые регулируют пути передачи сигналов. Эти направления, несомненно, требуют дальнейшего изучения для раскрытия механизмов формирования ответных реакций растений на действие ионизирующих излучений в широком диапазоне доз.
Список литературы
Baldwin J., Grantham V. Radiation Hormesis: Historical and Current Perspectives // J. Nucl. Med. Technol. 2016. V. 43. P. 242–247.
Гудков И.Н. Основы общей и сельскохозяйственной радиобиологии. Киев: Изд-во УСХА, 1991. 328 с.
Битаришвили С.В., Волкова П.Ю., Гераськин С.А. Влияние γ-облучения семян на фитогормональный статус проростков ячменя // Физиология растений. 2018. Т. 65. № 3. С. 223–231.
Shu K., Liu X. D., Xie Q. et al. Two faces of one seed: hormonal regulation of dormancy and germination // Mol. Plant. 2016. V. 9. P. 34–45.
Gubler F., Chandler P.M., White R.G. et al. Gibberellin signaling in barley aleurone cells. Control of SLN1 and GAMYB expression // Plant Physiol. 2002. V. 129. P.191–200.
Sreenivasulu N., Usadel B., Winter A. et al. Barley grain maturation and germination: Metabolic pathway and regulatory network commonalities and differences highlighted by new MapMan/PageMan profiling tools // Plant Physiol. 2008. V.146. P. 1738–1758.
Yamaguchi S. Gibberellin metabolism and its regulation // Annu. Rev. Plant Biol. 2008. V. 59. P. 225–251.
ГОСТ12038_84. Семена сельскохозяйственных культур. Методы определения всхожести. Межгосударственный стандарт. Стандарты на методы контроля. М., 2002. 28 с.
Jarošova J., Kundu J.K. Validation of reference genes as internal control for studying viral infections in cereals by quantitative real-time RT-PCR // BMC Plant Biol. 2010. V. 10. 146.
Gubler F., Hughes T., Waterhouse P. et al. Regulation of dormancy in barley by blue light and after-ripening: effects on abscisic acid and gibberellins metabolism // Plant Physiol. 2008. V. 147. P. 886–896.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method // Methods. 2001. V. 25. P. 402–408.
Toh S., Imamura A., Watanabe A. et al. High temperature induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds // Plant Physiol. 2008. V. 146. P. 1368–1385.
Seo M., Hanada A., Kuwahara A. et al. Regulation of hormone metabolism in Arabidopsis seeds: phytochrome regulation of abscisic acid metabolism and abscisic acid regulation of gibberellin metabolism // Plant J. 2006. V. 48. P. 354–366.
Bahin E., Bailly C., Sotta B. et al. Crosstalk between reactive oxygen species and hormonal signalling pathways regulates grain dormancy in barley // Plant Cell Environ. 2011. V. 34. P. 980–993.
Finch-Savage W. E., Leubner-Metzger G. Seed dormancy and the control of germination // New Phytol. 2006. V. 171. P. 501–523.
Yamaduchi S., Kamiya Yu. Gibberellin Biosynthesis: Its Regulation by Endogenous and Environmental Signals // Plant Cell Physiol. 2000. V. 43. № 3. P. 251–257.
Bailey-Serres J., Mittler R. The roles of reactive oxygen species in plant cells // Plant Physiol. 2006. V. 141. 311.
Gapper C., Dolan L. Control of plant development by reactive oxygen species // Plant Physiol. 2006. V. 141. P. 341–345.
Ishibashi Y., Tawaratsumida T., Kondo K. et al. Reactive oxygen species are involved in gibberellin/abscisic acid signaling in barley aleurone cells // Plant Physiol. 2012. V. 158. P. 1705–1714.
Liu Y., Ye N., Liu R. et al. H2O2 mediates the regulation of ABA catabolism and GA biosynthesis in Arabidopsis seed dormancy and germination // J. Exp. Bot. 2010. V. 61. P. 2979–2990.
Bazin J., Langlade N., Vincourt P. et al. Targeted mRNA oxidation regulates sunflower seed dormancy alleviation during dry after-ripening // Plant Cell. 2011. V. 23. P. 2196–2208.
Ishibashi Y., Tawaratsumida T., Zheng S. et al. A role for reactive oxygen species produced by NADPH oxidases in 564 the embryo and aleurone cells in barley seed germination // Plant Prod. Sci. 2010. V. 13. P. 45–52.
Jacobsen J.V., Pearce D.W., Poole A.T. et al. Abscisic acid, phaseic acid and gibberellin contents associated with dormancy and germination in barley // Physiologia Plantarum. 2002. V. 115. P. 428–441.
Волкова П.Ю., Чурюкин Р.С., Гераськин С.А. Влияние γ-облучения семян на активность ферментов в проростках ячменя // Радиац. биология. Радиоэкология. 2016. Т. 56. № 2. С. 190–196.
Гераськин С.А., Чурюкин Р.С., Казакова Е.А. Модификация развития ячменя на ранних этапах онтогенеза при воздействии γ-облучения на семена // Радиац. биология. Радиоэкология. 2015. Т. 55. № 6. С. 607–615.
Кузин А.М. Стимулирующее действие ионизирующего излучения на биологические процессы (к проблеме биологического действия малых доз). М.: Атомиздат, 1977. 136 с.
Machaiah J.P., Vahil U.K., Sreenivasan A. The effect of gamma-irradiation on biosynthesis of gibberellins in germinating wheat // Environ. Exp. Bot. 1976. V. 6. P. 131–140.
Yamauchi Y., Ogawa M., Kuwahara A. et al. Activation of gibberellin biosynthesis and response pathways by low temperature during imbibition of Arabidopsis thaliana seeds // Plant Cell. 2004. V. 16. P. 367–378.
Sewelam N., Kazan K., Schenk P.M. Global plant stress signaling: reactive oxygen species at the cross-road // Front. Plant Sci. 2016. V. 7. 187.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология