Радиационная биология. Радиоэкология, 2019, T. 59, № 4, стр. 394-409
ФУНДАМЕНТАЛЬНАЯ ХАРАКТЕРИСТИКА РЕАКЦИИ НЕЙРОНОВ ГОЛОВНОГО МОЗГА НА ЭМП НЕТЕПЛОВОЙ ИНТЕНСИВНОСТИ
С. Н. Лукьянова *
Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
* E-mail: lukyanovasn@yandex.ru
Поступила в редакцию 04.12.2018
Аннотация
Данная работа – обобщение и анализ многолетних исследований автором биоэлектрической активности нейронов головного мозга в условиях действия ЭМП СВЧ диапазона (1–10 ГГц) нетепловой интенсивности и короткой экспозиции (ППЭ < 500 мкВт/cм2, 1 мин). Корректный методический подход, разноплановый анализ результатов экспериментов, проведенных в условиях in vivo, в сочетании с большим объемом данных – отличительная особенность этого материала. В результате автор формирует представление об изучаемой реакции: феноменология, механизм формирования, определяющее значение исходного физиологического фона, биологическая значимость, зависимость от параметров ЭМП, изменения в условиях комбинированных воздействий с факторами других модальностей.
В литературе описание реакций отдельных нервных клеток на ЭМП представлено единичными работами [1–6]. Они выполнены или в условиях in vitro, или с анализом реакций только до и после воздействия, или с использованием металлических деталей (электродов, проводов, микроманипулятора) в период облучения.
Самостоятельного внимания заслуживают работы Р.А. Чиженковой, выполненные в корректных условиях, с основным акцентом на изучение импульсных потоков популяций нейронов коры [7–11]. Следует отметить и ряд исследований последних лет, которые косвенно свидетельствуют о реакции нейронов на ЭМП [12–20]. Используя биохимические, морфологические, биофизические и фармакологические методы изучения реакций ЦНС, они описывают влияние ЭМП на кальциевые каналы, на количество и размеры везикул в синаптических образованиях, на белковые структуры, на движение ионов через мембрану клетки, на процессы аутофагии и апоптоза в гиппокампе и стволовых клетках.
Настоящая работа дополняет имеющиеся сведения, доказывая наличие и представляя фундаментальную характеристику изменений в биоэлектрической активности отдельных нервных клеток на ЭМП нетепловой интенсивности и короткой экспозиции.
Задачи последовательно проводимых серий экспериментов сводились к поиску ответов на нижеперечисленные вопросы.
1. Имеет ли место сам факт изменения активности нейрона в условиях эксперимента in vivo под влиянием ЭМП нетепловой интенсивности и короткой экспозиции?
2. Чем отличаются эти ответы от соответствующих реакций нейронов на известные раздражители (свет, звук – интенсивность в пределах пороговых значений)?
3. Какова роль фона в феноменологии реакции нейрона на ЭМП нетепловой интенсивности, учитывая, что это – слабое воздействие?
4. Как зависят наблюдаемые изменения от режима и параметров облучения?
5. Существуют ли нейроны, реагирующие только на ЭМП, одинакова ли их реактивность в различных структурах мозга и что определяет внутрицентральные взаимоотношения?
6. Влияет ли ЭМП на ответ нейрона на другие по модальности раздражители (в частности, на реакцию на вспышку света)?
7. Как изменяются реакции нейронов на ЭМП в условиях сочетанного действия с факторами других модальностей (свет, звук, ПМП)?
МАТЕРИАЛЫ И МЕТОДИКА
Объектом исследования была биоэлектрическая экстраклеточная активность нейронов головного мозга кролика, регистрируемая в условиях in vivo до, в период и непосредственно после облучения ЭМП СВЧ диапазона. Источниками линейно поляризованного ЭМП 1–10 ГГц служили высокочастотные генераторы сигналов Г4-121 и Г4-111 (производство СССР) с соответствующими усилителями мощности и рупорными антеннами. Во время эксперимента голова кролика находилась в дальней зоне поля антенны, т.е. в области сформированной плоской электромагнитной волны. Интенсивность неискаженного ЭМП контролировали каждый раз перед началом экспозиции с помощью миллитесламетра ТП2-2У (Россия) и широкополосного измерителя Narda EMR-300 (ФРГ). ППЭ на уровне головы не превышала 500 мкВт/см2 не только в среднем, но и в импульсе. Схема эксперимента во всех сериях была одинаковой: 1 мин фон, 1 мин воздействие, 1 мин после облучения. В каждом исследовании эта схема повторялась 2–5 раз при обязательном чередовании с контролем (ложное воздействие). Отведение биопотенциалов было монополярным, с расположением индифферентного электрода на ухе кролика. Активным электродом для записи нейронной активности служил стеклянный капилляр (диаметр кончика 1–3 мкм), заполненный 2.5 моль/л раствором NaCl с сопротивлением 5–20 МОм. Эксперименты проводили, соблюдая требования к проведению исследований с ЭМП нетепловой интенсивности, чтобы избежать непредсказуемых артефактов, возникающих в результате отраженной энергии или наведения тока микрополяризации. Это касалось экспериментальной камеры, выложенной внутри поглощающим материалом, и замены металлических деталей, находящихся в зоне облучения, что неоднократно нами было описано [21–28]. Самостоятельного внимания заслуживает микроманипулятор, изготовленный из органического стекла, по аналогии с металлическим [29], и замена металлических отводящих проводников на хлорвиниловые трубки, заполненные физиологическим раствором на основе агар-агара. Совокупность перечисленного никогда не была описана в работах других авторов и по настоящее время составляет уникальность методики данного направления исследований.
Содержание, использование животных в экспериментах осуществлялось в соответствии с принципами Европейского сообщества (86/609/EEC) и с общепринятыми этическими нормами, изложенными в Правилах Европейской Конвенции ETS 123 и Правилах лабораторной практики (GLP) Хельсинкской декларации (2000 г.).
Количественная характеристика экспериментальных серий с облучениями, соответствующими контролями и статистической обработкой приведена ниже. Во всех случаях статистически оценивали возможность проявления реакции на облучение относительно фона и соответствующего контроля с ложным ЭМП воздействием, используя параметрический (критерий Стьюдента) и непараметрический (χ2) методы оценки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ответ на первый вопрос был получен в экспериментах на 13 кроликах-самцах породы шиншилла [21]. Изучали экстраклеточную биоэлектрическую активность 53 нейронов сенсомоторной области коры головного мозга в условиях ЭМП (6 ГГц; меандр 50 Гц, глубина модуляции – 100%, ППЭср. – 200 мкВт/см2). Миниатюрный микроманипулятор с шагом винта 500 мкм крепился на голове кролика и позволял регистрировать импульсную активность, не только до и после, но и в период действия СВЧ-фактора. В результате был получен ответ на первый вопрос – в корректных условиях выполнения экспериментов с ЭМП нетепловой интенсивности можно наблюдать статистически значимые изменения в экстраклеточной импульсной активности нейронов коры головного мозга (табл. 1).
Таблица 1.
Сравнительная характеристика реакции нейронов коры головного мозга кролика на ЭМП, ПМП, свет и звук слабой интенсивности Table 1. Comparative reactions of neurons of the cerebral cortex of rabbit on lowintensity EMF, СMF, light and sound
| Фактор (параметры) | Область коры мозга | Число нейронов | Число 1-минутных воздействий | Процент реакций – статистически значимых изменений фоновой частоты | |
|---|---|---|---|---|---|
| учащение | урежение | ||||
| ЭМП (6 ГГц, меандр 50 Гц, ППЭср 200 мкВт/см2) | Сенсомоторная | 53 | 67 | 6.4 | 49.25** $\blacksquare $ |
| ЭМП (1 ГГц, меандр 100 Гц, ППЭимп – 30 мкВт/см2) | Зрительная | 72 | 109 | 10.4 | 25.0* $\blacksquare $ |
| ПМП (1000 Э) | Сенсомоторная | 40 | 64 | 24.69* | 30.38* |
| Зрительная | 41 | 63 | 23.40* | 36.36** | |
| Звук (50 Гц, на 15 дБ выше порога слышимости человека) | Зрительная | 41 | 108 | 16.41 | 29.82* |
| Свет (50 Гц, τ –1 мс, 0.62 Дж) | Зрительная | 41 | 207 | 60.97** $\blacksquare $ | 25.47* |
| Контроль (ложные воздействия) | Сенсомоторная | 54 | 62 | 13.07 | 8.22 |
| Зрительная | 40 | 71 | 10.88 | 3.8 | |
Развитие этих исследований позволило сравнить полученные данные с соответствующими реакциями на ЭМП других параметров, а также мелькающий свет, звуковые щелчки, постоянное магнитное поле (ПМП). Этот комплекс работ имел непосредственное отношение к ответу на второй вопрос. Данное сопоставление было возможно, так как все эксперименты проводили в идентичных условиях, а факторы имели некоторое сходство в физических характеристиках (частота повторения – 50 Гц; энергетические показатели соответствовали, скорее, слабому раздражителю для ЦНС). Анализ полученных материалов показал, что достоверные (р < 0.01) изменения в частоте фоновой импульсации нейронов сенсомоторной области коры головного мозга на ЭМП (при оценке по группе из 53 клеток, относительно контроля – 54 нейрона) заключались только в уменьшении количества спайков (табл. 1). Эту реакцию отмечали в 49.25% случаев. Изменения противоположного характера наблюдали в 6.4% , что достоверно не отличалось от контроля. Аналогичный результат наблюдали и при ЭМП других параметров (табл. 1). В реакциях на ПМП также преобладали изменения в виде торможения активности нейронов (30.86%).
Следует отметить, что на ЭМП и ПМП изменения реализовались с большими латентными периодами (10–20 с), что можно было наблюдать не только при экспозиции, но и в первую минуту после выключения фактора. Это существенно отличало данные реакции от ответов на свет чуть выше пороговой величины в адекватной области мозга. В этом случае явно преобладала реакция в виде активации, тогда как на звук в неадекватной для него зрительной области достоверным по группе нейронов было только снижение частоты импульсации (табл. 1). Это обстоятельство сходно с основной характеристикой реакции нейронов на ПМП и ЭМП. Однако латентный период ответов нейронов на звук измерялся миллисекундами (среднее значение – 110 ± 10 мс), а не секундами, что, по всей видимости, определялось различием соответствующих первичных механизмов. Сопоставление ответов нейронов одной и той же области на адекватные и неадекватные раздражители впервые было описано Юнгом, в дальнейшем подтверждено большим числом исследователей [31–34] и находит отражение в наших работах. Важно отметить, что особенность реакций мозга по ЭЭГ-показателю, наблюдаемая на ЭМП и ПМП (повышение индекса альфа-диапазона в спектре ЭЭГ), описана в литературе и для известных стимулов (звук, электрический ток), но только подпороговой величины [35–37].
Совокупность представленных данных позволяет сделать вывод, что ЭМП нетепловой интенсивности и короткой экспозиции – полноправный раздражитель для ЦНС. В этом случае реакция нейронов имеет сходство с ответами на известные раздражители подпороговой величины в адекватной области или на слабые (чуть выше порога) стимулы в неадекватной области мозга. Их феноменология характеризуется, преимущественно, уменьшением частоты импульсации, большим латентным периодом (секунды, а не мс), сходством с ответами на ПМП.
Увеличение количества экспериментальных исследований с использованием различных режимов ЭМП и детальной сравнительной оценки активности нейронов в фоне, при экспозиции и после выключения фактора позволили ответить на следующие два вопроса. Как показано в табл. 2, достоверные изменения в контроле с ложным ЭМП-воздействием практически отсутствовали, а реакции на облучение могли проявляться как в виде снижения, так и повышения частоты импульсов. Это обстоятельство тесно связано с режимом облучения и исходным фоном [24, 28]. Анализ конкретных значений частоты разряжения нейронов в процессе эксперимента показывает зависимость феноменологии реакции от исходного фона. Совокупность этих данных приведена на рис. 1 и находит отражение в гистограммах (рис. 2, рис. 3). Эти результаты поддерживают мнение Ю.А. Холодова о коррегирующем влиянии факторов магнитной природы [38]. Из представленных гистограмм следуют некоторые дополнительные выводы: латентный период реакций измеряется секундами (10 ± 3с – для активации, 9 ± 2с – для торможения), характер разряжения нейронов является несколько различным в случае реакций торможения и активации, однако точно охарактеризовать его не представлялось возможным. Чаще всего, при действии ЭМП (как и в фоне) сохранялась регулярная импульсная активность, которая изменялась только по частоте, увеличиваясь в случае активации и уменьшаясь при реакции торможения. Конкретные примеры оригинальных записей с основной реакцией на ЭМП (режим “ИР”, табл. 2) в виде торможения приведены на рис. 4 и 5.
Таблица 2.
Реакции нейронов коры головного мозга кролика на ЭМП различных режимов Table 2. The reaction of the neurons of the cerebral cortex of rabbit on the EMF different modes
| Серия режим параметры | Область коры головного мозга (общее число записанных нейронов) | Характер реакции (% случаев ее проявления) | Средняя частота разряжения нейронов, Гц | ||
|---|---|---|---|---|---|
| в фоне (1 мин) | в период облучения (1 мин) | сразу после облучения (1 мин) | |||
| “HP” непрерывный 1.2 ГГЦ 300 мкВт/см2 | передне- центральная (72) | активация (7.6) | 6.3 ± 0.74 | 8.0 ± 0.9 | 7.2 ± 1.2 |
| торможение(37.4)• | 7.2 ± 0.42 | 6.8 ± 0.38 | 5.6 ± 0.35* | ||
| теменно- затылочная (56) | активация (7.1) | 4.2 ± 0.63 | 5.1 ± 0.4 | 4.9 ± 1.0 | |
| торможение (31)• | 6.4 ± 0.51 | 5.4 ± 0.8 | 5.0 ± 0.2* | ||
| “ИР” импульсный 1.2 ГГц, F – 0.12 Гц τ – 0.4 мс ППЭимп 300 мкВт/см2 | передне- центральная (105) | активация (27.62)• | 6.1 ± 0.89 | 11.2 ± 0.64* | 9.2 ± 0.58* |
| торможение (32.38)• | 8.9 ± 0.88 | 4.32 ± 0.7* | 8.85 ± 0.69 | ||
| теменно- затылочная (84) | активация (25.1)• | 4.9 ± 0.45 | 8.4 ± 0.53* | 6.9 ± 0.48* | |
| торможение (29.76)• | 6.53 ± 0.39 | 4.13 ± 0.57* | 6.89 ± 0.75 | ||
| “П-ИР” пачеч.-имп. 1.2 ГГц Fимп – 1000 Гц Fпач – 0.12Гц Τ – 0.4 мс ППЭ – 300 мкВт/см2 | передне- центральная (76) | активация (24.1)• | 5.5 ± 0.66 | 16.3 ± 0.78** | 6.3 ± 0.64 |
| торможение (31.0)• | 11.8 ± 0.7 | 4.3 ± 0.49** | 6.33 ± 0.61* | ||
| теменно- затылочная (63) | активация (23.23)• | 5.5 ± 0.4 | 11.25 ± 0.76** | 2.83 ± 0.41** | |
| Торможение (30.4)• | 9.67 ± 0.73 | 3.58 ± 0.68** | 4.45 ± 0.61** | ||
| “К” ложное облучение | передне- центральная (62) | активация (13.1) | 5.2 ± 1.32 | 6.94 ± 1.5 | 7.8 ± 1.09 |
| торможение (8.2) | 9.1 ± 0.62 | 6.1 ± 0.83 | 6.3 ± 0.98 | ||
| теменно- затылочная (71) | активация (10.9) | 2.3 ± 1.5 | 4.1 ± 1.6 | 4.4 ± 1.9 | |
| торможение (3.8) | 5.5 ± 0.94 | 3.2 ± 0.92 | 3.9 ± 0.85 | ||
Рис. 1.
Зависимость реакции нейронов от исходного фона.
Fig. 1. Dependence of the reaction of neurons from the original background.
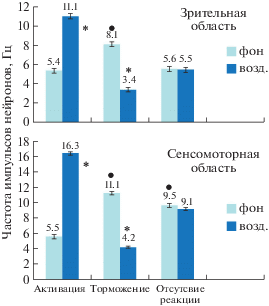
Рис. 2.
Гистограмма распределения частоты импульсации нейронов, возбуждающихся в ответ на одноминутное СВЧ-облучение. Примечание. а – фон, б – период СВЧ-облучения, в – после СВЧ-облучения. По оси абсцисс – время, с; по оси ординат – частота импульсации, Гц. Приведены средние значения за период анализа – 1 мин; шаг построения – 0.1 с.
Fig. 2. Histogram of the distribution of frequencies of the impulses of excited neurons to one-minute microwave irradiation.
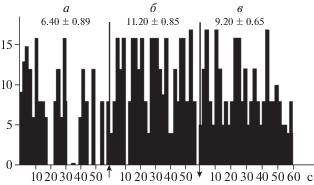
Рис. 4.
Пример реакции торможения импульсной активности нейрона коры на ЭМП. Примечание. 1 – фон; 2 – момент включения (↑); 3 – период действия; 4 – момент выключения (↓); 5 – период последействия, скорость записи 10 см/с. Приведена импульсная и медленная активность, записанная с одного и того же микроэлектрода, калибровка: 0.5 см по вертикали – 250 mkv, 0.5 см по горизонтали – 0.1 s.
Fig. 4. Example reaction inhibition pulse activity cortex neuron on the EMF.
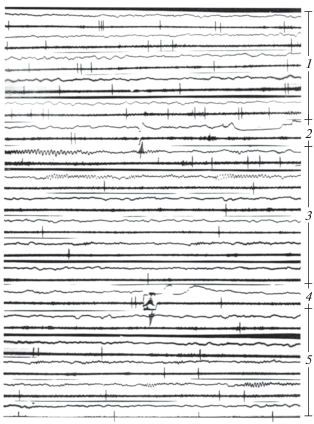
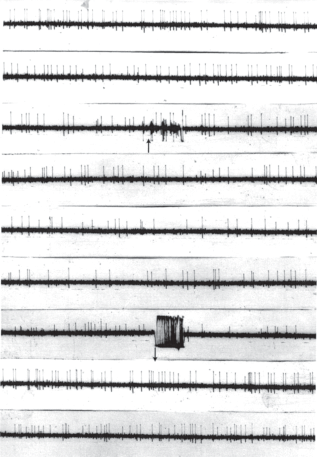
Рис. 5.
Пример реакции торможения импульсной активности нейрона Hippocampus на ЭМП. Примечание. ↑, ↓ – включение и выключение электромагнита; калибровка: 0.5 см по вертикали – 250 mkv, 0.5 по горизонтали – 0.1 s; приведена непрерывная запись со скоростью 10 см/с; глубина погружения электрода в область Hippocampus 4.300 мк.
Fig. 5. Example reaction inhibition pulse activity of Hippocampus neuron on the EMF.
Как показано в табл. 1 и 2, реакции на ЭМП в различных областях коры головного мозга очень похожи, в отличие от ответов на известные адекватные стимулы пороговой величины. Это – одна из особенностей действия проникающих раздражителей (ПМП, ЭМП), для которых нет специализированных областей в мозге.
В работах с ПМП и ЭМП [18, 20, 28, 30] было доказано, что в их нейрофизиологическом механизме преобладает непосредственное действие на ткань мозга, а не рефлекторный путь. Нет и таких специализированных нервных клеток в коре головного мозга, как показали наши исследования. В самостоятельной серии на 70 нейронах зрительной области было показано, что на ЭМП отвечают те же самые клетки, которые реагируют на свет и звук (рис. 6). Каждому нейрону в случайном порядке предъявляли свет, звук или ЭМП. Из 70 записанных нейронов мы не встретили ни одного, который реагировал бы только на ЭМП. Это были клетки, отвечающие на свет, или на свет и звук, т.е. бимодальные и тримодальные нейроны. 23% нейронов изменяли свою активность только на свет (адекватный раздражитель для зрительной области), 10% клеток не реагировали ни на один из раздражителей.
Рис. 6.
Конвергенция импульсов разной модальности на нейронах зрительной области коры головного мозга.
Fig. 6. The convergence of different pulses modality on neurons of Visual areas cortex.

Один из аспектов нейрофизиологического механизма касается внутрицентральных взаимоотношений. Есть ли в мозге структуры наиболее чувствительные и реактивные к действию ЭМП? Известно, что в условиях целостного мозга его отделы реагируют не однозначно, как на ПМП, так и на ЭМП [27, 28, 30, 38]. Естественно, возникает вопрос: как объяснить это различие (чувствительностью, реактивностью или исключительно дозиметрическими характеристиками)? Данные, приведенные в табл. 3, демонстрируют участие разных отделов мозга в реакции на 1-минутное действие ЭМП (1 ГГц или 10 ГГц, непрерывный режим, ППЭ 200 мкВт/см2), которые предъявляли на спонтанном фоне. Следует отметить сходство по феноменологии изменений в разных отделах мозга. Везде преобладали реакции в виде торможения, на этом основании в табл. 3 приводятся результаты оценки только этой (основной) реакции. Говорить о чувствительности структур (в данном случае) не приходится, так как латентные периоды ответов нейронов различных структур мозга достоверно не различались между собой. Следует только отметить, что они значительно больше соответствующих величин для реакций на свет и звук в адекватных областях. Однако реактивность образований была различной, и она не зависела от характеристик дозиметрии. При ЭМП 1 ГГц – 30 см или 10 ГГц – 3 см наибольший процент реакций наблюдали в гипоталамусе. Несколько меньшая прочность реакции отмечена в коре и неспецифических ядрах таламуса, которые между собой статистически достоверно не различались. И, наконец, гиппокамп и ретикулярная формация среднего мозга на ЭМИ практически не реагировали, так как отсутствовали статистически значимые отличия от соответствующего контроля. Как было показано ранее, определяющим в наличии и характере реакции нейронов коры и мозга в целом (по результатам анализа ЭЭГ) на данные воздействия является исходный фон [23, 24, 27]. Оценка средней частоты разряжения нейронов в фоне и на воздействие в различных отделах мозга показала, что (в данном случае) это не является критерием степени их участия в реакции. В качестве примера в табл. 4 приведена сравнительная характеристика средних значений частот активности нейронов в фоне и на воздействие в разных отделах мозга (эксперименты с ЭМП 1 ГГц, непрерывный режим, ППЭ 200 мкВт/см2). Статистически значимые изменения в виде снижения фоновой частоты при действии ЭМП и сразу после его выключения наблюдали в большинстве отделов мозга (кроме гиппокампа и ретикулярной формации), что согласуется с данными табл. 3. Однако возрастание фоновой частоты импульсации при погружении микроэлектрода в глубину мозга (от коры до ретикулярной формации) не соответствует плавному усилению, а затем снижению выраженности реакции, как было описано ранее для нейронов коры. В каждом (отдельно взятом) образовании такая закономерность прослеживается, однако при оценке степени их участия в реакции мозга более правомерно учитывать их функциональное состояние. Роль гипоталамуса как важного интегративного центра, где сходятся нервные, гормональные и гуморальные пути функциональной регуляции организма, позволяет предполагать высокую степень его активности в спонтанных условиях. Это обстоятельство может служить объяснением наибольшей реактивности этой структуры на слабые раздражители различной модальности. Большое разнообразие ЭМП и ПМП, которые в наших исследованиях проявляли себя как слабые раздражители для ЦНС, вызывали в гипоталамусе изменения наиболее интенсивные и в наибольшем проценте случаев [28]. Однако изменение функционального состояния отдельных структур мозга путем введения фармакологических веществ или усложнение режима облучения (при условии увеличения экспозиции) изменяло внутрицентральные отношения. По реактивности структуры распределяются в соответствии со степенью их участия (активности) в формировании нового функционального состояния. При его изменении может измениться реакция на ЭМП и, прежде всего, степень участия разных отделов мозга в ее реализации [27]. Подтверждением сказанному является результат серии экспериментов с ПМП и анализом нейронной активности в условиях измененного функционального состояния ЦНС путем введения кофеина или адреналина [28]. Активирующее действие этих препаратов реализуется по различным механизмам [39–41]. В соответствии с этими механизмами распределилась и степень участия структур в реакции на ПМП с магнитной индукцией 46 мТл [27, 28]. На фоне кофеина, основной точкой приложения которого является кора головного мозга, лидирующее положение по прочности реакции на ПМП занимают именно эти отделы. Усиливаются реакции в гиппокампе и ретикулярной формации, тогда как статистически значимо они не изменяются в таламусе и гипоталамусе, что соответствует данным литературы об изменении возбудимости данных структур на внутримышечное введение кофеина в дозе 50 мг/кг [40]. Аналогичные результаты имели место и в экспериментах с введением адреналина. Наибольшая прочность реакции отмечена в ретикулярной формации среднего мозга (основной точке приложения данного вещества). В меньшей степени реакция возросла в коре и гиппокампе и практически не изменилась в гипоталамусе, что также соответствует данным литературы о механизме действия адреналина при его внутривенном введении в дозе 0.03 мг/кг [40].
Таблица 3.
Сравнительная характеристика прочности реакций нейронов в разных отделах головного мозга кролика на воздействие ЭМП Table 3. Comparative strength of the neuron responses in different departments of rabbit brain on the impact of EMF
| Отделы мозга | Процент нейронов, статистически значимо урежающих частоту импульсации (относительно исходного фона) на воздействие | ||
|---|---|---|---|
| ЭМП, ГГц | Контроль (ложное действие) | ||
| 1 | 10 | ||
| Cort s-m | 42.3** (п = 52) | 39.5* (п = 38) | 8.2 (п = 62) |
| Cort vis. | 48.5* (п = 33) | 48.6* (п = 35) | 9.8 (п = 71) |
| Hippocampus | 23.6 (п = 38) | 27.2 (п = 33) | 10.1 (п = 41) |
| Thalami | 40.5* (п = 42) | 27.7* (п = 54) | 10.0 (п = 60) |
| Hypothalami | 70.2*** (п = 37) | 62.8*** (п = 43) | 10.1 (п = 59) |
| R.F. | 18.6 (п = 43) | 22.6 (n = 31) | 11.7 (п = 61) |
Таблица 4.
Средняя частота импульсации нейронов различных отделов мозга кролика в фоне, при действии и после выключения ЭМП Table 4. The average frequency of the impulses of neurons in different departments of rabbit brain in the background, during the action and after turning off the EMF
| Отделы мозга | Частота импульсации нейронов, Гц | ||
|---|---|---|---|
| фон | воздействие, 1 мин | 1 мин после выключения | |
| Cort s-m (n = 33) | 6.6 ± 0.08 | 5.7 ± 0.13** | 5.4 ± 0.10** |
| Cort vis. (n = 52) | 7.9 ± 0.12 | 6.1 ± 0.11** | 5.0 ± 0.17** |
| Hippocampus (n= 28) | 8.4 + 0.19 | 7.9 ± 0.16 | 8.1 ± 0.14 |
| Thalami (n = 42) | 9.0 ± 0.13 | 8.1 ± 0.09* | 7.6 ± 0.12** |
| Hypothalami (n = 37) | 10.0 ± 0.14 | 8.0 ± 0.12** | 7.9 ± 0.18** |
| R. F. (n = 43) | 12.0 ± 0.70 | 11.0 ± 0.90 | 11.3 ± 0.80 |
Таким образом, в головном мозге нет специализированных нейронов и образований, которые воспринимали бы только ЭМП. Это те же нейроны и те же структуры, которые могут отвечать и на другие по модальности стимулы. Реакция зависит от исходного фона, а внутрицентральные взаимоотношения складываются в соответствии с уровнем активности структур.
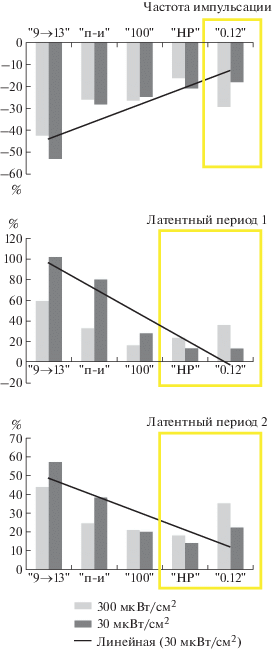
Приведенные данные еще раз подчеркивают, что ЭМП нетепловой интенсивности и короткой экспозиции можно рассматривать как слабый неспецифический раздражитель для ЦНС. На этом основании его присутствие (по законам фундаментальной физиологии) может изменить функциональное состояние ЦНС и ответ организма на другие воздействия. В наших исследованиях на нейронах в условиях эксперимента in vivo изучалось влияние ЭМП нетепловых интенсивностей и короткой экспозиции на ответы нейронов зрительной области на вспышки света [42]. Показана зависимость изменений в реакции на вспышку света от режима, параметров и характера модуляции ЭМП. На десяти кроликах породы Шиншилла (самцы, 2.5–3 кг) изучали влияние различных режимов 1 ГГц ЭМП с ППЭ 300 мкВт/см2 или 30 мкВт/см2 на ответы нейронов зрительной области коры головного мозга на вспышки света (1 Гц, 1 мс, 0.62 Дж). В случайном порядке у одного и того же нейрона (после фона – 1 мин) записывали реакции на вспышки света (экспозиция 20 с) изолированно или в условиях действия СВЧ ЭМП. В последнем случае вспышки предъявляли после 30 с изолированного действия поля, учитывая ранее полученные данные о латентных периодах соответствующих реакций головного мозга [28]. В результате влияние слабого раздражителя (ЭМП) проявлялось более ярко (табл. 5). Феноменология изменений в реакции нейронов на вспышку света под влиянием ЭМП была одинаковой вне зависимости от режима облучения, ППЭ, частоты и характера модуляции в изученных пределах. Всегда в реакции нейронов на вспышку света доминировало усиление процессов торможения в виде снижения частоты импульсации первой фазы активации, увеличения латентных периодов первой и второй активных фаз (табл. 6, 7). Отличия в реакциях на ЭМП различных параметров наблюдали только в количественных характеристиках этих показателей. Как следует из табл. 5–7, достоверные изменения (относительно изолированного действия вспышки) имели место почти при всех режимах и при ППЭ в импульсе, как 300, так и 30 мкВт/см2. В наименьшей степени изменялся латентный период первой фазы активации, а в наибольшей – латентный период второй активной фазы. В последнем случае отмечен и более высокий уровень значимости достоверных изменений. На рис. 7 приведены примеры оригинальных записей реакций на вспышки света, предъявляемые изолированно (А) и на фоне ЭМП (В). Хорошо заметны снижение частоты импульсации активных фаз и увеличение их латентных периодов. Наиболее эффективным оказался режим с плавным изменением частоты модуляции от 13 к 9 Гц за 0.5 мин. При этом режиме все анализируемые показатели реакции на вспышку достоверно изменялись, не только относительно ее изолированного действия, но и при сравнении с непрерывным режимом облучения. Наиболее эффективно влияние данного режима проявляется при ППЭ – 30 мкВт/см2 в импульсе, так как (только в этом случае) все показатели реакции на вспышку изменяются в достоверно большей степени, чем на остальные импульсные ЭМП воздействия. Рис. 8 наглядно демонстрирует степень изменений показателей реакции нейронов. Наибольшая степень изменений всех показателей имела место при режиме “13 → 9”, постепенно снижаясь к показателям при режимах “НР” и “0.12”. Заметен и полипараметрический характер влияния ЭМП. При одних режимах более эффективной является ППЭ в импульсе 30 мкВт/см2, при других – 300 мкВт/см2, при третьих их действие проявляется примерно в равной степени. Эти данные поддерживают представление об отсутствии прямой пропорциональной зависимости ответа от энергетической характеристики ЭМП [43]. Важное значение приобретают режим, ППЭ в импульсе, полипараметрическая зависимость.
Таблица 5.
Сравнительная характеристика процента нейронов, реагирующих торможением на ЭМП различных параметров в условиях спонтанной и вызванной вспышкой света активности Table 5. Comparison of percent of neurons responsive braking on EMF various parameters in the context of spontaneous and induced flash light activity
| Режим (параметры) | Процент нейронов с реакциями в виде торможения при ППЭ | ||||
|---|---|---|---|---|---|
| 30 мкВт/см2 в сериях | 300 мкВт/см2 в сериях | ||||
| ЭМП | ЭМП + всп. | ЭМП | ЭМП + всп. | ||
| “НР” | 19.6 | 32.1 | 32.3 | 50.0* | |
| n = 56 | n = 62 | ||||
| Импульсный | “0.12” (F – 0.12 Гц, τ – 16 мс) | 14.3 | 30.6 * | 53.3.8 | 59.0* |
| n = 49 | n = 51 | ||||
| “100” (меандр – 100 Гц) | 18.8 | 50.9** | 25.0 | 48.5** | |
| n = 53 | n = 72 | ||||
| “13 → 9” (13 → 9 за 0.5 мин, τ – 25) | 39.7$\blacksquare $ | 88.2**$\blacksquare $ | 30.3 | 75.7**$\blacksquare $ | |
| n = 68 | n = 66 | ||||
| “П-И” (Fимп – 1000 Гц, τ – 0.4 мс, fпач – 0.12 Гц, τ – 16 пач – мс) | 35.7$\blacksquare $ | 71.4**$\blacksquare $ | 30.1 | 63.4** | |
| n = 70 | n = 63 | ||||
| Контроль (ложное воздействие) | 3.8 (n = 53) | ||||
Примечание. Приведена активность нейронов зрительной области коры головного мозга кролика; во всех сериях – несущая частота ЭМП – 1 ГГц, однократная экспозиция 3–5 мин. *,** – р < 0.05, р < 0.01 по критерию χ2, относительно только ЭМП; все значения с ЭМП воздействиями достоверно отличаются от контроля; $\blacksquare $ р < 0.05 относительно других режимов в соответствующем столбце по χ2.
Таблица 6.
Показатели реакции нейронов зрительной области коры головного мозга кролика на вспышку света в условиях изолированного действия и на фоне СВЧ ЭМП с ППЭ 300 мкВт/см2Table 6. The reaction rates of neuronal Visual areas cortex rabbit on a Flash light in in conditions of isolated actions and background EMF with EFD 300 mkVt/cm2
| Показатель реакции на вспышку света | Изолированное действие вспышки света (n = 104) | На фоне СВЧ ЭМП различных режимов | ||||
|---|---|---|---|---|---|---|
| непрерывный “НР” (n = 62) | импульсный | пачечно-импульсный “П-И” (n = 90) | ||||
| “0.12” (n = 71) | “100” (n = 108) | “13 → 9” (n = 163) | ||||
| Частота импульсации 1-й фазы активации, Гц | 6.8 ± 0.28 | 5.7 ± 0.20* | 4.8 ± 0.31** | 5.0 ± 0.47* | 3.9 ± 0.32**• | 5.0 ± 0.29* |
| Латентный период 1-й фазы активации, мс | 25.6 ± 2.1 | 32 ± 2.6 | 35 ± 2.48* | 30 ± 2.18 | 41 ± 2.8** | 34 ± 2.0* |
| Латентный период 2-й фазы активации, мс | 151.2 ± 2.5 | 179 ± 4.8** | 206 ± 6.9**• | 183 ± 2.8** | 218 ± 4.** • | 189 ± 2.9** |
Таблица 7.
Показатели реакции нейронов зрительной области коры головного мозга кролика на вспышку света в условиях изолированного действия и на фоне СВЧ ЭМП с ППЭ 30 мкВт/см2Table 7. The reaction rates of neuronal Visual areas cortex of rabbit on a Flash of light in conditions of isolated actions and background EMF with EFD 30 mkVt/cm2
| Показатель реакции на вспышку света | Изолированное действие вспышки света (n = 104) | На фоне СВЧ ЭМП различных режимов | ||||
|---|---|---|---|---|---|---|
| непрерывный “НР” (n = 92) | импульсный | пачечно-импульсный “П-И” (n = 86) | ||||
| “0.12” (n = 111) | “100” (n = 108) | “13 → 9” (n = 99) | ||||
| Частота импульсации 1-й фазы активации, Гц | 6.8 ± 0.28 | 5.4 ± 0.19* | 5.6 ± 0.11* | 5.1 ± 0.25* | 3.2 ± 0.12**•$\blacksquare $ | 4.9 ± 0.34** |
| Латентный период 1-й фазы активации, мс | 25.6 ± 2.1 | 29 ± 3.1 | 29 ± 2.06 | 33 ± 2.47 | 52 ± 3.0**•$\blacksquare $ | 40 ± 3.0** |
| Латентный период 2-й фазы активации, мс | 151.2 ± 2.5 | 178 ± 5.2** | 186 ± 5.9** | 181 ± 1.6** | 238 ± 5.1**•$\blacksquare $ | 209 ± 8.5** |
Примечание. ППЭ соответствует значению в непрерывном режиме и в импульсе импульсного режима. p < 0.05, **p < 0.001, относительно изолированного действия вспышки света, •р < 0.05 относительно непрерывного режима; $\blacksquare $ р < 0.05 относительно других импульсных режимов – по критерию Стьюдента.
Рис. 7.
Примеры оригинальных записей вызванной импульсной и суммарной биоэлектрической активности зрительной области коры головного мозга кролика на вспышки света – изолированно и на фоне ЭМП. Примечание. На каждом из трех примеров приведен отрезок записи (700 мс) импульсной и суммарной активности, записанных с одного и того же микроэлектрода; ↑ – отметка предъявления вспышек: А – изолированно, В – на фоне ЭМП.
Fig. 7. Examples of original records caused by impulse and total of bioelectric activity of Visual areas cortex rabbit on light flashes – in isolation and on the background EMF.
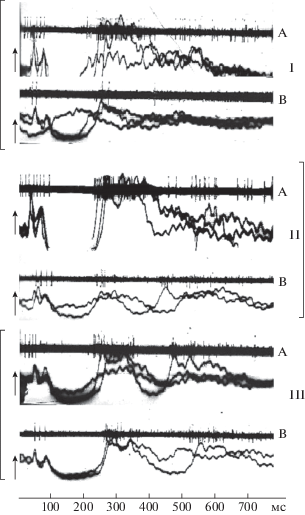
Рис. 8.
Соотношение изменений, вызванных ЭМП в реакции нейронов на вспышку света с режимом и ППЭ облучения. Примечание. По оси ординат – процент изменения показателя относительно его значения в контроле (изолированное действие вспышки), принятого за 0%; по оси абсцисс – режимы облучения. Проведенная линия показывает тенденцию снижения эффектов ЭМП в зависимости от режима. В выделенных прямоугольниках отмечено преобладание ППЭ 300 мкВт/см2 по сравнению с 30 мкВт/см2 в остальных вариантах облучения.
Fig. 8. The ratio changes caused by EMF in reaction to a Flash of light with modes and EFD exposure.
Из приведенных результатов следует, что ЭМП нетепловой интенсивности и короткой экспозиции, способное вызвать реакцию нейронов коры головного мозга, может оказать влияние и на функциональное состояние ЦНС (в частности, зрительного анализатора). Это влияние определяется полипараметрической зависимостью, включая ППЭ в импульсе, режим облучения, характер модуляции.
Дальнейшее развитие это направление работ получило в самостоятельной серии – изучение реакций нейронов зрительной области коры головного мозга на вспышку света в условиях действия ЭМП в комплексе с другими раздражителями [26]. На 27 кроликах изучали влияние различных физических факторов: ПМП (460 Э), СВЧ ЭМП (6 ГГц, непрерывный режим, ППЭ – 200 мкВт/см2), звук (щелчки 50 Гц, на 6 дБ выше порога проявления ЭЭГ отклика) – изолированно и в различных сочетаниях на вызванные ответы нейронов зрительной области коры головного мозга на вспышки света (1 Гц, 1 мс, 0.62 Дж). Результаты представлены в табл. 8 и 9. Влияние факторов магнитной природы было сходно с действием звука (неадекватного раздражителя для данной области). Реакции тормозного характера отмечали чаще (результат достоверный по группе нейронов), и они усиливались при сочетанном действии раздражителей (ПМП и СВЧ ЭМП; ПМП и звук). Основной характер изменений сводился к снижению частоты импульсации первой фазы активации и увеличению латентных периодов первой и второй активных фаз. Остальные показатели реакции на вспышки света практически не изменялись. В наибольшей степени ответ на вспышку света изменялся на фоне сочетанного действия ПМП + СВЧ ЭМП. Интенсивность реакции постепенно снижалась при действии СВЧ ЭМП, далее – ПМП + звук и ПМП. На фоне только звука достоверных изменений в основных показателях реакции на вспышку света (при оценке по группе нейронов) отмечено не было. При индивидуальном анализе реакций отдельных нейронов наблюдали достоверные изменения различного характера. Их процентное выражение приведено в табл. 9.
Таблица 8.
Показатели реакции на вспышку света в условиях ее изолированного действия и на фоне различных физических факторов Table 8. The reaction rates in a Flash of light in conditions of isolated actions and various physical factors
| Показатель реакции на вспышку света | Вспышка света (n = 92) | Вспышки света на фоне действия различных факторов | ||||
|---|---|---|---|---|---|---|
| звук (n = 54) | ПМП (n = 73) | ПМП + звук (n = 58) | СВЧЭМП (n = 67) | ПМП + СВЧ ЭМП (n = 61) | ||
| Частота импульсации 1-й фазы активации, Гц | 7.1 ± 0.34 | 7.0 ± 0.31 | 6.2 ± 0.23 | 5.9 ± 0.45 | 5.8 ± 0.24* | 5.0 ± 0.4* |
| Латентный период 1-й фазы активации, мс | 23.4 ± 2.5 | 27.1 ± 3.27 | 31 ± 4.3 | 30 ± 3.2 | 36 ± 2.42* | 40 ± 2.92*• |
| Латентный период 2-й фазы активации, мс | 148.0 ± 2.31 | 150 ± 2.48 | 165 ± 3.2* | 173 ± 4.3* | 181 ± 3.11* | 201 ± 4.83*• |
Таблица 9.
Характеристика изменений первой фазы активации в реакции на вспышку света под влиянием различных физических факторов Table 9. Characteristic changes of the first phase of activation in response to a Flash of light under the influence of various physical factors
| Характер изменения | % нейронов с достоверными изменениями в реакции на вспышку света под влиянием физических факторов | ||||
|---|---|---|---|---|---|
| ПМП (n = 73) | звук (n = 54) | ПМП + звук (n = 58) | СВЧ ЭМП (n = 67) | ПМП + СВЧ ЭМП (n = 61) | |
| Снижение частоты импульсации | 6.8 | 5.6 | 13.8 | 13.4 | 24.6*• |
| Повышение частоты импульсации | 5.5 | 5.6 | 10.3 | 8.9 | 3.3 |
| Уменьшение латентного периода | 6.8 | 3.7 | 5.2 | 4. | 3.3 |
| Увеличение латентного периода | 9.6 | 1.8 | 5.2 | 10.4* | 14.7* |
| Снижение частоты + + увеличение латентного периода | 10.9 | 3.7 | 15.5 | 16.4* | 34.4*• |
| Повышение частоты + + уменьшение латентного периода | 5.5 | – | 5.2 | 8.9 | 4.9 |
| Общий % реагирующих нейронов | 45.1 | 20.4 | 55.2 | 65.7 | 85.2 |
В итоге, на примере ответов нейронов зрительной области коры головного мозга кролика на вспышки света показана возможность усиления влияния слабого ЭМП в условиях его сочетания с другими факторами. В данном конкретном исследовании, наибольшее усиление реакции нейронов на сочетанное действие ПМП + СВЧ ЭМП, вероятно, объясняется тем, что по своей биологической значимости (силе) и первичному механизму они более близки.
ЗАКЛЮЧЕНИЕ
Совокупность проведенных исследований дополняет соответствующие данные in vitro, доказывая, что и в условиях целостного организма нервные клетки реагируют на ЭМП. Именно эти основные структурные и функциональные единицы мозга дают представление о степени возбуждения (активации) ЦНС. По сравнению с суммарной биоэлектрической активностью и ответом организма реакции нейронов характеризуются меньшими латентными периодами и большей реактивностью. Их реакции можно рассматривать как предвестники изменений на более высоком уровне организации ЦНС. Помимо этого, для таких неспецифических раздражителей как ЭМП, для которых нет специализированных рецепторов, важно изучение реакций нейронов, в плане представления о нейрофизиологическом механизме их влияния на ЦНС. Конкретно представленные исследования демонстрируют возможность достоверных изменений в экстраклеточной биоэлектрический активности нейронов коры головного мозга кролика в ответ на ЭМП различных режимов и параметров при ППЭ в импульсе не более 500 мкВт/см2. Характер реакции определяется исходным фоном, свидетельствуя о коррегирующем влиянии изучаемого воздействия. Различные ППЭ, режимы облучения и характер модуляции позволяют увидеть их сложную взаимосвязь при реализации эффекта. Полученные данные поддерживают существующее в литературе мнение о полипараметрической зависимости эффектов ЭМП нетепловой интенсивности [42–43]. Такая многогранная зависимость ответа характерна, главным образом, для слабых воздействий различных модальностей, тем не менее, она существует. При этом подчеркивается важная роль ЦНС в формировании этих реакций. Анализ биоэлектрической активности мозга позволяет представить нейрофизиологический механизм формирования реакции ЦНС на ЭМП нетепловой интенсивности [5–7, 28, 38]. Важным является доказательство, что данное воздействие можно рассматривать как обычный неспецифический раздражитель для ЦНС, который подчиняется фундаментальным законам физиологии о модификации его биологической значимости. Такой вывод обосновывают и эксперименты с сочетанным действием ЭМП и раздражителей других модальностей. Влияние ЭМП нетепловой интенсивности и короткой экспозиции на функциональное состояние важного звена зрительного анализатора – нейронов зрительной области коры головного мозга и их вызванный ответ на вспышку света предполагает и вероятность изменения в функциональном состоянии данного анализатора. В условиях дополнительной нагрузки (вспышки света) находит свое подтверждение ряд существующих положений о биоэффектах ЭМП нетепловой интенсивности: в пределах нетепловых значений (во всяком случае, до 500 мкВт/см2) нет прямой пропорциональной зависимости эффекта от ППЭ; основная феноменология реакции сводится к усилению процессов торможения в ЦНС; импульсный режим может вызывать большие изменения, чем непрерывный; характер модуляции в виде плавного изменения частот в диапазоне α-ритмов ЭЭГ может провоцировать его усиление; определяющую роль в проявлении эффекта слабого ЭМП играют ППЭ в импульсе и полипараметрическая зависимость.
Список литературы
Файтельберг-Бланк В.Р., Перевалов Г.М. Действие электромагнитных полей сверхвысокой частоты на центральные структуры мозга // Докл. АН СССР. 1978. Т. 239. № 1. С. 242–243. [Fajtelberg-Blank V.P., Perevalov G.M. Effect of electromagnetic field of super-high frequency on Central brain structures // Rep. AS USSR. 1978. V. 239. № 1. P. 242–243. (in Russian)]
Захарова Н.М., Алексеев С.И., Жадин М.Н. Воздействие СВЧ излучения на спонтанную импульсную активность переживающих срезов коры мозга // Биофизика. 1993. Т. 38. Вып. 3. С. 520–522. [Zakharova N.M., Alekseev S.I., Zhadin M.N. Effects of microwave radiation on spontaneous impulse activity experiencing brain slices// Biophysics. 1993. V. 38. Is. 3. P. 520–522 (in Russian)]
Захарова Р.М. Усиление ритмических процессов в срезах коры мозга под воздействием импульсно-модулированного микроволнового излучения // Биофизика. 1995. Т. 40. № 3. С. 695–696. [Zakharova N.M. Strengthening rhythmic processes in brain slices under the influence of pulse-modulated microwave radiation // Biophysics. 1995. V. 40. № 3. P. 695–696 (in Russian)]
Минасян С.М., Григорян Г.Ю., Саакян С.Т., Ахумян А.А., Калантарян В.П. Эффекты действия крайне высокочастотного ЭМП на импульсную активность нейронов супраоптического ядра гипоталамуса крыс // Рос. физиол. журн. им. И.М. Сеченова. 2005. Т. 91. № 12. С. 1398–1406. [Minasyan S.M., Grigoryan G.Yu., Saakyan S.T. at ol. Effects extremely high-frequency EMF on impulse neuronal activity of rat hypothalamus // Russian Fiziol. J. of I.M. Sechenov. 2005. V. 91. № 12. P. 1398–1406. (in Russian)]
Чиженкова Р. А. Фоновая и вызванная активность нейронов интактной коры кроликов после воздействия полем СВЧ // Журн. высш. нервн. деят-ти. 1969. Т. 19. № 3. С. 495–501. [Chizhenkova R.A. Background and сaused neuronal activity of intact cort rabbits after exposure to electromagnetic field of super-high frequency // J. higher nervous activity 1969. V. 19. № 3. P. 495–501. (in Russiab)]
Chizhenkova R.A. Slow potentials and spike unit activity of the cerebral cortex of rabbits expozed EMF // Bioelectromagnetics. 1988. V. 9. № 3. P. 337–345.
Чиженкова Р.А. Влияние СВЧ облучения низкой интенсивности на импульсные потоки нейронов коры больших полушарий // Проблемы электромагнитной нейробиологии / Под ред. Ю.А. Холодова и Н.Н. Лебедевой. М.: Наука, 1988. С. 24–31. [Chizhenkova R.A. Effect microwave irradiation low intensity to impulse flows neurons cortex // Problems of electromagnetic neuroscience/ed. Y.A. Cholodov and N.N. Lebedeva. M.: Nauka, 1988. P. 24-31. (in Russian)]
Чиженкова Р.А. Импульсные потоки популяций корковых нейронов при СВЧ облучении разной интенсивности: межспайковые интервалы и число вспышек пачечной активности // Вестн. новых мед. технологий. 2006. Т. 13. № 4. С. 6–8. [Chizhenkova R.A. Impulse flows of populations of cortical neurons during microwave irradiation of different intensity: mezhspajkov intervals and number of flashes activity // Herald of new medical technologies. 2006. V. 13. № 4. P. 6–8. (in Russsian)]
Чиженкова Р.А. Перестройки в деятельности нейронных популяций коры при СВЧ // Неврол. вестн. им. В.М. Бехтерева. 2007. Т. 39. № 4. С. 43–47. [Chizhenkova R.A. Adjustment activities of neural populations in brain cort on microwave // Nevrol. Herald of V.M. Bekhterev. 2007. V. 39. № 4. С. 43–47. (in Russian)]
Чиженкова Р.А.Импульсные потоки популяций корковых нейронов коры больших полушарий кроликов при сверхвысокочастотном облучении низкой интенсивности: пачечная активность // Нейрофизиология. 2008. Т. 40. № 5–6. С. 417–425. [Chizhenkova R.A. Impulse flows of populations of cortical neurons of rabbits with a super-high-frequency irradiation of low intensity: train activity // Neurophysiology. 2008. V. 40. № 5–6. P. 417–425. (in Russian)]
Чиженкова Р.А. Импульсные потоки популяций корковых нейронов при СВЧ-облучении: число вспышек пачечной активности // Радиац. биология. Радиоэкология. 2010. Т. 50. № 2. С. 201–210. [Chizhenkova R.A. Impulse flows of populations of cortical neurons during microwave irradiation: the number of outbreaks of pachechnoj activity // Radiation biology. Radioecology. 2010. V. 50. № 2. P. 201–210. (in Russian)]
Calabro E. Effects of Electromagnetic Fields on Cells and Proteins’ Structure. Lambert Academic Publishing, 2012. 300 p.
Kim J.H., Sohn U.D., Kim H.G., Kim H.R. Exposure to 835 MHz RF-EMF decreases the expression of calcium channels, inhibits apoptosis, but induces autophagy in the mouse hippocampus // Korean J. Physiol. Pharmacol. 2018. May.V. 22. № 3. P. 277–289.
Kim J.H., Yu D.H., Kim H.J., Huh Y.H., Cho S.W., Lee J.K., Kim H.G., Kim H.R. Exposure to 835 MHz radiofrequency electromagnetic field induces autophagy in hippocampus but not in brain stem of mice // Toxicol. Health. 2018. Jan. V. 34. № 1. P. 23–35.
Kim J.H., Kim H.J., Yu D.H., Kweon H.S., Huh Y.H. Changes in numbers and size of synaptic vesicles of cortical neurons induced by exposure to 835 MHz radio-frequency-electromagnetic field // Anat. Cell Biol. 2017. Oct. 18. V. 50. № 8. P. 246.
Eghlidospour M., Ghanbari A., Azari H. Effects of radiofrequency exposure emitted from a GSM mobile phone on proliferation, differentiation, and apoptosis of neural stem cells // Anat. Cell Biol. 2017. Jun. V. 50. № 2. P. 115–123.
Bernal-Mondragón C., Arriaga-Avila V., Martínez-Abundis E. et al. Effects of repeated 9 and 30-day exposure to extremely low-frequency electromagnetic fields on social recognition behavior and estrogen receptors expression in olfactory bulb of Wistar female rats // Neurol. Res. 2017. Feb. V. 39. № 2. P. 165–175.
Hinrikus H., Bachmann M., Karai D., Lass J. Mechanism of low-level microwave radiation effect on nervous system // Electromagnetic Biol. Med. 2017. V. 36. № 2. P. 202–212.
He G.L., Luo Z., Shen T.T. et al. Inhibition of STAT3- and MAPK-dependent PGE2 synthesis ameliorates phagocytosis of fibrillar β-amyloid peptide (1-42) via EP2 receptor in EMF-stimulated N9 microglial cells // J. Neuroinformation. 2016. Nov. 21. V. 13. № 1. P. 296.
Barthélémy A., Mouchard A., Bouji M. et al. Glial mar-kers and emotional memory in rats following acute cerebral EMF exposures // Environ. Sci. Pollut. Res. Int. 2016. Dec. V. 23. № 24. P. 25343–25355.
Лукьянова С.Н., Рынсков В.В., Макаров В.П. Реакции нейронов сенсомоторной области коры головного мозга кролика на низкоинтенсивное СВЧ-облучение // Радиац. биология. Радиоэкология. 1995. Т. 35. Вып. 1. С. 53–56. [Lukyanova S.N., Rynskov V.V., Makarov V.P. Reaction neurons sensomotor area of the cerebral cortex of rabbit on the influence of microwave-irradiation // Radiation biology. Radioecology. 1995. V. 35. № 1. P. 53–56. (in Russian)]
Лукьянова С.Н., Макаров В.П., Рынсков В.В. Зависимость изменений суммарной биоэлектрической активности головного мозга от ППЭ МКВ-облучения // Радиац. биология. Радиоэкология. 1996. Т. 36. Вып. 5. С. 706–709. [Lukyanova S. N., Makarov V.P., Rynskov V.V. Dependence changes in summary bioelectric activity of brain from EFD microwave-irradiation // Radiation biology. Radioecology. 1996. V. 36. № 5. P. 706–709/ (in Russian)]
Лукьянова С.Н., Моисеева Н.В. К анализу импульсной биоэлектрической активности коры головного мозга кролика в ответ на низкоинтенсивное МКВ-облучение // Радиац. биология. Радиоэкология. 1998. Т. 38. Вып. 5. С. 763–768. [Lukyanova S.N., Moiseeva N.V. To the analysis of impulse response of bioelectric activity of rabbit brain cortex to the influence of the microwave –irradiation // Radiation Biology. Radioecology. 1998. V. 38. № 5. P. 763–768. (in Russian)]
Лукьянова С.Н. Определяющее значение исходного фона в нейроэффектах ЭМИ нетепловой интенсивности // Радиац. биология. Радиоэкология 2003. Т. 43. № 5. С. 519–523. [Lukyanova S.N. Defines the value of the original background in effects of nervous system on EMF non-thermal intensity // Radiation biology. Radioecology. 2003. V. 43. № 5. P. 519–523. (in Russian)]
Лукьянова С.Н., Григорьев Ю.Г., Григорьев О.А., Меркулов А.В. Зависимость биоэффектов электромагнитного поля радиочастотного диапазона нетепловой интенсивности от типологических особенностей электроэнцефалограммы человека // Радиац. биология. Радиоэкология. 2010. Т. 50. № 6. С. 712–722. [Lukyanova S.N., Grigoriev Ju.G., Grigo-riev O.A., Merkulov A.V. Dependence of the effekts non-thermal radio frequency electromagnetic field non-termal intensity from the typological features of the human EEG // Radiation Biology. Radioecology. 2010. V. 50. № 6. P. 712–722. (in Russian)]
Лукьянова С.Н., Алексеева В.А. Изменение в реакции нейронов зрительной области коры головного мозга кролика на вспышку света под влиянием низкоинтенсивных физических факторов неионизирующей природы // Радиац. биология. Радиоэкология. 2011. Т. 51. № 4. С. 471–475. [Lukyanova S.N., Alekseevа V.А. Change in the reaction of neuronal Visual areas cortex of rabbit оn a Flash of light under the influence of low intensity physical factors non-ionizing nature // Radiation Biology. Radioecology. 2011.V. 51. № 4. С. 471–475. (in Russian)]
Лукьянова С.Н., Меркулов А.В. К вопросу о степени участия различных отделов головного мозга в реакциях на магнитное и электромагнитное поля малых уровней // Радиац. биология. Радиоэкология. 2012. Т. 52. № 6. С. 608–615. [Lukyanova S.N., Merkulov A.V. To the question of the degree of involvement of the various divisions of the brain in the reactions of magnetic and electromagnetic fields of small levels // Radiation Biology. Radioecology. 2012. V. 52. № 6. P. 608–615. (in Russian)]
Лукьянова С.Н. ЭМП СВЧ диапазона нетепловой интенсивности как раздражитель для ЦНС. М.: ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна, 2015. 200 с. [Lukyanova S.N. EMF SHF range non-thermal intensity as stimulus for CNS. M.: SRC – FMBC them. A.I. Burnazjan, 2015. 200 p. (in Russian)]
Мелехова А.М., Дьяконов В.А. // Журн. высш. нервн. деят-ти. 1966. Т. 17. № 2. С. 328–335. [Me-lechova A.M., Dyakonov V.A. J. higher nervous activity. 1966. V. 17. № 2. P. 328–335. BurnazjanaMS FMBC STATrabbit I (in Russian)]
Лукьянова С.Н. К анализу реакций ЦНС на ПМП (условно-рефлекторный и электрофизиологический методы исследования): Дис. … канд. биол. наук. М.: Ин-т ВНД и НФ АН СССР, 1970. 182 с. [Lukyanova S.N. To the analysis of the responses of the central nervous system on CMF (shareware-reflex and electrophysiological methods of research): Dis. … Cand. Biol. Sciences. M.: Ins-te HNA and NF Acad. Sci. USSR. 1970. 182 p. (in Russian)]
Jung R. Cerebral Inhibitory Phenomena. Progress in Brain Research. VI. Brain Mechanisms. Amsterdam–London–New York: Acad. Sci., 1963. P. 445–447.
Скребицкий В.Г. // Мат. V Всесоюз. конф. по вопросам электрофизиологии центральной нервной системы. Тбилиси, 1966. С. 227. [Skrebickij V.G. // Mater. Vsesojuz. conf. on electrophysiology of the central nervous system: Tbilisi, 1966. P. 227. (in Russian)]
Скребицкий В.Г., Бомштейн О.3. // Физиол. журн. СССР. 1967. Т. 53. № 2. С. 129–138. [Skrebickij V.G., Bomshtejn O.Z. // Fiziol. Jurn. The USSR. 1967. V. 53. № 2. P. 129–138. (in Russian)]
Кондратьева Я.А. Современные проблемы электрофизиологии центральной нервной системы. М.: Наука, 1967. С. 148–159. [Kondratyeva I.N. Modern problems of the central nervous system electrophysiology. M.: Nauka, 1967. P. 148–159. (in Russian)]
Гершуни Г.В. Изучение деятельности звукового анализатора человека на основе использования разных реакций // Проблемы физиологической акустики. Т. 3. М.: Изд-во АН СССР, 1955. С. 13–25. [Gershuni G.B. Study of sound human Analyzer based on the use of different reactions // The problem of physiological acoustics. V. 3. M.: Acad. Sci. USSR, 1955. P. 13–25.
Костандов Э.А. Нейрофизиологические механизмы неосознаваемых явлений // Успехи физиол. наук. 1981. Т. 12. № 4. С. 3–27. [Kostandov E.A. Neurophysiological mechanisms not realised phenomena // Fiziol. Successes. Sciences. 1981. V. 12. №. 4. P. 3–27. (in Russian)]
Dixon N.F., Henley S.H. Unconscious perception. Possible implications of data from academic research for clinical practice // J. Nervous and Mental Disease. 1991. V. 179. № 5. P. 243–252.
Холодов Ю.А. Реакции нервной системы на электромагнитные поля. М.: Наука, 1975. 284 с. [Cholodov Y.A. Reactions of the nervous system on electromagnetic fields. M.: Nauka, 1975. 284 p. (in Russian)]
Bonvallet V., Dell P., Hiebel G. // EEG Clin. Neuro-physiol. 1954. P. 119–127.
Вальдман А.В. Актуальные проблемы фармакологии ретикулярной формации и синаптической передачи. Л., 1963. С. 111–134. [Waldman A.V. Actual problems of Pharmacology of the reticular formation and synaptic transmission. L., 1963. P. 111–134. (in Russian)]
Kгыpp R., Monnier M., Still G. // Arch. Experim. Pathol. Pharmacol. 1959. № 23. P. 381–394.
Лукьянова С.Н., Григорьев О.А., Дешин И.А., Веселовский И.А., Алексеева В.А. К вопросу о влиянии ЭМП нетепловой интенсивности и короткой экспозиции на функциональное состояние зрительного анализатора // Радиац. биология. Радиоэкология. 2017. Т. 57. № 6. С. 617–624. [Lukyanova S.N., Grigoriev O.A., Dyoshin I.A., Veselovsky I.A., Alekseeva V.A. To the question the impact EMF of non-thermal intensity and short expositions on the functional State of the Visual Analyzer // Radiation Biology. Radioecology. 2017. V. 57. №. 6. P. 617–624. (in Russian)]
Жаворонков Л.П., Дубовик Б.В., Павлова Л.Н. и др. Влияние модулированного ЭМП низкой интенсивности на общую возбудимость ЦНС // Радиация и риск. 2011. Т. 20. № 2. С. 64–74. [Zhavoronkov L.P., Dubovik B.V., Pavlova L.N. et al. Influence of modulated EMF of low intensity for a total nervous anxiety // Radiation risk. 2011. V. 20. № 2. P. 64–74. (in Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология



