Радиационная биология. Радиоэкология, 2019, T. 59, № 5, стр. 465-474
ДЕТАЛИЗАЦИЯ КЛАССИФИКАЦИИ АБЕРРАЦИЙ ХРОМОСОМ С НЕДИФФЕРЕНЦИРОВАННЫМ ОКРАШИВАНИЕМ ДЛЯ УЧЕТА КЛАСТОГЕННОГО ВОЗДЕЙСТВИЯ РАДИОНУКЛИДНЫХ И КОМПЛЕКСНЫХ ЗАГРЯЗНЕНИЙ
В. В. Столбова 1, *, С. В. Мамихин 1, А. Д. Котельникова 1, 2, С. А. Прохорова 1, М. В. Зайцева 1
1 Московский государственный университет им. М.В. Ломоносова, факультет почвоведения
Москва, Россия
2 Почвенный институт им. В.В. Докучаева
Москва, Россия
* E-mail: vstol@bk.ru
Поступила в редакцию 30.05.2018
Аннотация
Рассмотрены примеры использования в качестве диагностических показателей различных видов хромосомных аберраций для решения практических задач радиоэкологии. Проанализированы классификации хромосомных аберраций, используемые для оценки кластогенного воздействия факторов радиационной и химической природы по результатам цитогенетических исследований с равномерным окрашиванием хромосом. Выявлена некоторая терминологическая несогласованность и неоднозначность при обозначении различных видов и категорий хромосомных аберраций, отражающих кластогенный эффект. Показано, что данная несогласованность может затруднять использование таких цитогенетических показателей в радиоэкологической практике. По результатам Allium-теста с использованием системы цифровой визуализации получены оригинальные микроизображения, демонстрирующие конфигурации аберрантных хромосом, используемые в классификациях.
Цитогенетические показатели биодиагностики традиционно используются в радиобиологических и радиоэкологических исследованиях для решения научных и прикладных задач: изучению молекулярных механизмов действия ионизирующей радиации, эффектов адаптации и эволюционных процессов в условиях острого и хронического облучения, оценке уровней радионуклидного и комплексных загрязнений техногенных территорий [1]. Способность ионизирующих излучений и ряда химических мутагенов оказывать кластогенное воздействие на хромосомы, вызывая разрывы молекулы ДНК, может быть обнаружена стандартными методами цитогенетического исследования в форме метафазного или ана-телофазного анализа. Наиболее простой и универсальной процедурой является анализ структурных мутаций хромосом с использованием недифференцированного окрашивания генетического материала без остановки деления на стадии метафазы [2]. Анафазный метод находит широкое применение в радиоэкологии, особенно с использованием растительных тест-организмов и биоиндикаторов-представителей фитоценозов, характеризующихся крупными хромосомами. При этом в качестве тест-функций используются такие интегральные показатели, как общая частота патологий митоза (мейоза) и/или частота хромосомных аберраций. С учетом особенностей механизма радиационного воздействия из общей частоты аберраций информативно выделять ту часть спектра нарушений, которая отражает кластогенный эффект. На стадии анафазы легко выявляются фрагменты и мосты, которые и представляют реализованные в разрывы хромосом воздействия на генетический материал. В зависимости от фазы возникновения разрыва выделяют хроматидные или хромосомные фрагменты и мосты [3], которые относят к аберрациям хроматидного или хромосомного типа соответственно. Эти же структурные нарушения хромосом по другому признаку – морфологии анафазной конфигурации, упоминаются как одиночные фрагменты и мосты, в противопоставление парным конфигурациям [4].
Поскольку в работах по изучению цитогенетических эффектов факторов радиационной и химической природы выявлены различия в спектрах хромосомных аберраций, отражающих кластогенное воздействие на хромосомы [5], то закономерно использование в радиоэкологических исследованиях соотношения хромосомных аберраций разного типа в качестве индикатора природы мутагена. Так, преобладание аберраций хромосомного типа в общем спектре структурных мутаций хромосом отражает приоритетную роль фактора радиационной природы в генотоксическом эффекте сочетанного воздействия мутагенов. Однако существуют определенные противоречия и терминологические разночтения при обозначении аберраций в различных классификациях, что отмечено еще в работах по изучению особенностей химического и радиационного мутагенеза. “В литературе при обозначении структурных мутаций хромосом имеет место некоторая терминологическая неточность. Часто термином хромосомные перестройки обозначают все типы изменений. Более правильно в этом случае использовать термин перестройки хромосом, тогда как выражения хромосомные перестройки и хроматидные перестройки будут иметь самостоятельное значение” (цит. по [6]). В некоторой степени это связано с различием в спектрах хромосомных нарушений, выявляемых при разных формах цитогенетического исследования. Спектр нарушений структуры хромосом, выявляемый при метафазном анализе и положенный в основу основных классификаций, значительно шире и отличается от видов аберраций, доступных к учету при цитогенетическом исследовании без остановки митоза на стадии метафазы [7]. Отсутствие унифицированного общепринятого подхода к обозначению видов хромосомных аберраций, выявляемых на стадии анафазы, и определенная субъективность при выборе классификаций значительно затрудняют сравнение результатов исследователей и обобщение полученных данных.
Целью работы являлось сравнение классификаций хромосомных аберраций, выявляемых в цитогенетических исследованиях с недифференцированным окрашиванием хромосом и отражающих эффекты кластогенного воздействия, а также анализ использования спектра хромосомных нарушений в качестве биоиндикационного и тестовых показателей в практике радиоэкологических исследований.
МЕТОДИКА ПОЛУЧЕНИЯ ЦИФРОВЫХ ИЗОБРАЖЕНИЙ АБЕРРАНТНЫХ ХРОМОСОМ
Процедура получения микрофотографий, документально фиксирующих соответствующие классификациям конфигурации аберрантных хромосом, выполнялась на основе результатов серии Allium-тестов без остановки митоза на стадии метафазы. Фитотестером служили луковицы и семена лука репчатого Allium cepa L. сорт Штуттгартен Ризен. Для проведения цитогенетического анализа участок корня с апикальной меристемой размером около 1.5 см помещали в фиксатор Кларка на срок от 2 до 14 дней. При необходимости долгосрочного хранения биоматериал переводили в 70%-ный (v/v) этиловый спирт с предварительной отмывкой от фиксатора раствором спирта такой же концентрации. Подготовку к микроскопированию проводили по стандартной методике приготовления препаратов из корневой меристемы [8], отмывая материал от спирта в дистиллированной воде в небольших емкостях. Препараты окрашивали 2%-ным ацетоорсеином (Sigma-Aldrich, США) в течение 30 мин, по истечении которых корни отмывались в течение 15 мин от красителя в 45%-ной уксусной кислоте. Для приготовления стандартных давленых препаратов брали от окрашенного корня апикальный участок не менее 2 мм длиной. Анализ клеток производится с помощью светопольной микроскопии в проходящем свете при увеличении 10 × 40 с использованием синего светофильтра. Цифровые микроизображения хромосомных аберраций получены с помощью системы визуализации на основе микроскопа Микмед-6 с тринокулярной насадкой (ОАО “ЛОМО”, Россия), оптико-механического адаптера (“НПК “Зенит”, Россия), цифрового фотоаппарата Canon EOS 1100 D (“Canon Inc.”, Япония) и программного обеспечения, поставляемого в пакете с комплексом визуализации EOS Utility версии 2.10.00 (“Canon Inc.”) [9]. Преобразование цифровых изображений проводилось в блоке компьютера с использованием фоторедактора Microsoft Office Picture Manager.
ХРОМОСОМНЫЕ АБЕРРАЦИИ КАК ДИАГНОСТИЧЕСКИЕ ПОКАЗАТЕЛИ КЛАСТОГЕННОГО ЭФФЕКТА РАДИОНУКЛИДНЫХ И КОМПЛЕКСНЫХ ЗАГРЯЗНЕНИЙ
В радиоэкологических исследованиях общая частота хромосомных нарушений в соматических и генеративных клетках растений служила дозозависимым индикатором уровня радиационного воздействия как в острый, так и в отдаленные периоды Чернобыльской радиационной аварии [10, 11]. Частота хромосомных аберраций использовалась в ходе цитогенетического биомониторинга техногенных территорий с радионуклидным и химическим загрязнением [12, 13] как показатель уровня комплексного загрязнения.
Однако в работах последних лет все чаще предпринимаются попытки дифференцированного использования цитогенетических показателей. Из общей частоты хромосомных аберраций с диагностическими целями выделяют те части спектра, которые связываются с представлениями о разных механизмах реализации кластогенного эффекта, выявляя таким образом ведущую роль в генотоксичности либо химических мутагенов, либо факторов радиационной природы. При этом классификация хромосомных аберраций может опираться на морфологию анафазной конфигурации хромосом – одиночные или двойные мосты и фрагменты. Или же в основу кладется фаза клеточного цикла, на которой произошел разрыв хромосомы с последующей реализацией его в аберрацию в цикле “разрыв – слияние – структурная мутация” с выделением подгрупп аберраций хроматидного или хромосомного типа.
Например, спектр цитогенетических нарушений с выделением подгрупп аберраций хромосомного и хроматидного типа у растений лука Allium schoenoprasum, в течение года произрастающих на техногенно загрязненной почве, использовался в работе [14] как индикатор природы мутагена, приоритетного для генотоксичности почв нескольких пробных площадок с различным содержанием ТЕРН, тяжелых металлов и мышьяка. Преобладание в спектре цитогенетических эффектов нарушений хроматидного типа (одиночных хроматидных фрагментов и мостов) позволило высказать предположение о ведущей роли химического мутагенеза, связанного с высокими концентрациями металлов в почве. При этом, как признак радиационного воздействия ионизирующих излучений от ТЕРН, рассматривалось увеличение частоты парных мостов и фрагментов, относящихся к хромосомному типу повреждений хромосом.
Сходным образом анализировали результаты оценки генотоксичности подземных вод с промплощадки центра по обращению с радиоактивными отходами в условиях комбинированного загрязнения. По результатам биотестирования с Allium cepa выявлен незначительный вклад аберраций хромосомного типа (двойные мосты и фрагменты), что позволило авторам выделить ведущую роль в генотоксичности образцов химического фактора загрязнения (вещества 3-го класса опасности) на фоне загрязнения 137Cs и 90Sr [15].
Часть спектра хромосомных аберраций в виде двойных мостов рекомендована авторами как биологический индикатор, диагностирующий уровень воздействия радиации на природные растительные популяции в условиях радиоактивного загрязнения Семипалатинского полигона. При изучении цитогенетических показателей доминантного вида тонконога Koeleria gracilis детальный анализ спектра выявил разную интенсивность роста частоты для аберраций разного вида. Рост числа одиночных мостов и фрагментов и двойных фрагментов не зависел от величины удельной активности Sr90 в биоматериале. Напротив, изменение частоты двойных мостов показывало линейную дозовую зависимость до величины 10 МБк/кг [16].
Несколько иной способ использования показателя частоты хромосомных аберраций применяли исследователи [17], анализируя характер распределения аберраций хромосом по клеткам индикаторов-гидробионтов в экспериментальных условиях мутагенеза. Воздействие только ионизирующей радиации или ее ведущей ролью в условиях сочетанного воздействия с химическими мутагенами характеризовалось распределением хромосомных аберраций по клетках согласно закономерностям Пуассона, тогда как при химическом мутагенезе или его ведущей роли в сочетанном воздействии – распределением, близким к геометрическому. Выявив различия типа поклеточного распределения хромосомных аберраций в зависимости от роли в повреждениях химических мутагенов или ионизирующей радиации, авторы проанализировали природные популяции гидробионтов для оценки эффективности реальных действующих факторов загрязнения и учета их вклада в повреждения хромосом при комплексном загрязнении. Были подтверждены выявленные в модельном эксперименте закономерности и сделан вывод о том, что тип распределения хромосомных аберраций может использоваться для индикации цитогенетического действия ионизирующего излучения и химических мутагенов при сочетанном действии.
В целом видно, что при попытке выявить природу мутагена, оказывающего ведущее воздействие в условиях комплексного загрязнения мутагенами химической и радиационной природы, информативно использовать как анализ вида поклеточного распределения хромосомных аберраций, так и соотношение аберраций хромосом разного типа в спектре. По мнению авторов, эти особенности могут указывать на ведущую роль факторов либо радиационной, либо химической природы в генотоксичности природных сред [14–17].
АНАФАЗНЫЕ КОНФИГУРАЦИИ АБЕРРАНТНЫХ ХРОМОСОМ, ИСПОЛЬЗУЕМЫЕ ДЛЯ КЛАССИФИКАЦИИ
Сравнивая вклад в кластогенный потенциал химических мутагенов или факторов радиационной природы, исследователи предпочитают использовать классификации, основанные на морфологии метафазных/анафазных хромосом или опираться на представления о стадии возникновения разрыва и различных молекулярно-генетических событиях, приводящих к реализации его в структурные мутации хромосом. Как известно, в зависимости от фазы клеточного цикла возникновения разрыва нити ДНК выделяют аберрации хромосомного типа, возникшие на предсинтетической стадии G1, и хроматидного типа, образование которых возможно как во время, так и после репликации в фазе S и G2 соответственно. В фазе G1 хромосома представлена однонитевой структурой, поэтому, возникнув на этой стадии, после фазы S синтеза ДНК хромосомные нарушения удваиваются и морфологически в метафазе и анафазе представлены двойными структурами. Аберрации хроматидного типа возникают после репликации и затрагивают изменением одну из хроматид, что на стадии метафазы и анафазы морфологически проявляется одиночными аберрациями как конечной формой нарушений только одной из двух сестринских хроматид [4, 5, 18–20].
В табл. 1 обобщены данные о видах аберрантных хромосом, используемых для классификации по результатам анафазного исследования и подразделяемых на основании:
Таблица 1.
Виды хромосомных аберраций, используемые для оценки кластогенного действия факторов радиационной и химической природы по данным простого цитогенетического исследования с недифференцированным окрашиванием хромосом Table 1. Types of chromosomal aberrations used to assess the clastogenic effect for factors of radiation and chemical nature according to a simple cytogenetic study with solid chromosome staining
| № | Схема анафазной конфигу-рации | Механизм структурной перестройки | Тип аберрации | |
|---|---|---|---|---|
| Морфология анафазной хромосомы | Стадия появления разрыва | |||
| 1 | [ | Изохроматидная терминальная делеция на основе изолокусного разрыва при слиянии проксимальных фрагментов сестринских хроматид | Одиночный мост (равноплечий) | G2 Хроматидного типа |
| 2 | L | Асимметричный межхромосомный обмен (хроматидная транслокация) в результате слияния проксимальных фрагментов после разрыва хроматид двух различных хромосом | Одиночный мост (часто неравноплечий) | То же |
| 3 | [ | Терминальная делеция с последующей репликацией и слиянием проксимальных фрагментов сестринских хроматид | Одиночный мост (равноплечий) | G1 Хромосомного типа |
| 4 | Х | Асимметричный межхромосомный обмен (хромосомная транслокация) в результате слиянии проксимальных фрагментов разных хромосом до их репликации | Двойной перекрестный мост – анафазная конфигурация метафазной дицентрической хромосомы | G1 Хромосомного типа |
| 5 | ][ | То же | Двойной параллельный мост – анафазная конфигурация дицентрической метафазной хромосомы (дицентрика) | То же |
| 6 | 8 | Асимметричный внутрихромосомный обмен на базе межплечевой делеции | Двойной мост в виде сцепленных кольцеобразных хроматид – анафазная конфигурация кольцевой центрической метафазной хромосомы (центрического кольца) | То же |
| 7 | О | То же | Двойной мост в виде дицентрического кольца, образованный из кольцевой центрической метафазной хромосомы (центрического кольца) | То же |
| 8 | — | Изохроматидная терминальная делеция на основе изолокусного разрыва при слиянии дистальных фрагментов сестринских хроматид | Одиночный ацентрический фрагмент | G2 Хроматидного типа |
| 9 | — | Терминальная делеция с последующей репликацией и слиянием дистальных фрагментов | То же | G1 Хромосомного типа |
| 10 |  |
Асимметричный межхромосомный обмен (хроматидная транслокация) в результате неслияния дистальных фрагментов после разрыва хроматид двух различных хромосом | Два непарных фрагмента | G2 Хроматидного типа |
| 11 | $ = $ | Изохроматидная терминальная делеция на основе изолокусного разрыва при неслиянии дистальных фрагментов сестринских хроматид | Парный фрагмент | То же |
| 12 | $ = $ | Терминальная делеция с последующей репликацией и неслиянием дистальных фрагментов | То же | G1 Хромосомного типа |
– стадии (S-синтетическая, G1 и G2 – пред- и постсинтетическая соответственно) клеточного цикла возникновения разрыва хромосомы;
– морфологии анафазной конфигурации хромосом в митозе. На рис. 1 представлены микрофотографии, демонстрирующие конфигурации аберрантных хромосом, используемые в классификациях и полученные по результатам Allium-теста с недифференцированным окрашиванием.
Рис. 1.
Цифровые микроизображения (увеличение 10 × 40) патологий митоза в клетках апикальной меристемы корней лука репчатого Allium cepa, связанные с кластогенным воздействием на хромосомы при биотестировании: 1) почв с максимальной активностью 137Cs 7.1 ± 5.9; Ra226 – 44.3 ± 15.2; Th232 – 27.6 ± 16.0; K40 – 420 ± 151 Бк/кг и содержанием суммы полициклических ароматических углеводородов 91–297, в том числе 3,4-бензпирена – 1–15 мкг/кг (а, в, г, д, и); 2) γ-излучения от загрязненных 137Cs почв мощностью эквивалентной дозы 0.3–1.53 мкЗв/ч (б, е, з, к, л, н); 3) излучения мобильного телефона интенсивностью 1.5–2.5 мкВт/см2 (ж, м, о, п); (а, б) – одиночный мост в анафазе; (в) – пара одиночных мостов в анафазе одной клетки; (г) – двойной параллельный мост в анафазе; (д) – конфигурация одиночного и двойного перекрещенного моста с парой длинных фрагментов в анафазе одной клетки; (е, ж, з) – двойной перекрещенный мост в анафазе; (и, к) – двойной мост в виде двух сцепленных по типу звеньев в цепи хроматид; (л) – двойной мост в виде большого дицентрического анафазного кольца; (м, н) – множественная фрагментация хромосом в аберрантную метафазу с неявной двойной природой фрагментов; (о, п) – множественная фрагментация хромосом в анафазу с неявной одиночной природой фрагментов; (р) – микрошкала (цена деления 10 мкм).
Fig. 1. Digital microimages (magnification 10 × 40) of pathological mitosis in Allium cepa root apical meristem cells, associated with clastogenic effect on chromosomes under biotesting: 1) soils with a maximum activity of 137Cs 7.1 ± 5.9; Ra226 – 44.3 ± 15.2; Th232 – 27.6 ± 16.0; K40 – 420 ± 151 Bq/kg and the amount of polycyclic aromatic hydrocarbons 91–297, including 3,4-benzpyrene – 1–15 μg/kg (a, c, d, e, i); 2) γ-radiation from 137Cs contaminated soils with an equivalent dose rate of 0.3–1.53 μSv/h (b, f, h, j, k, m); 3) mobile phone radiation intensity of 1.5–2.5 μW/cm2 (g, l, n, o); (a, b) – single bridge in anaphase; (c) – a pair of single bridges in anaphase of a cell; (d) – double parallel bridge in anaphase; (e) – configuration of a single and double crossed bridge with a pair of long fragments in anaphase of a single cell; (f, g, h) – double cross bridge in anaphase; (i, j) – double bridge in the form of two linked chromatid rings; (k) – double bridge in the form of a large dicentric anaphase ring; (l, m) – multiple fragmentation of chromosomes into an aberrant metaphase with an implicit dual nature of fragments; (n, o) – multiple fragmentation of chromosomes into anaphase with an implicit single nature of fragments; (p) – microscale (scale division 10 μm).
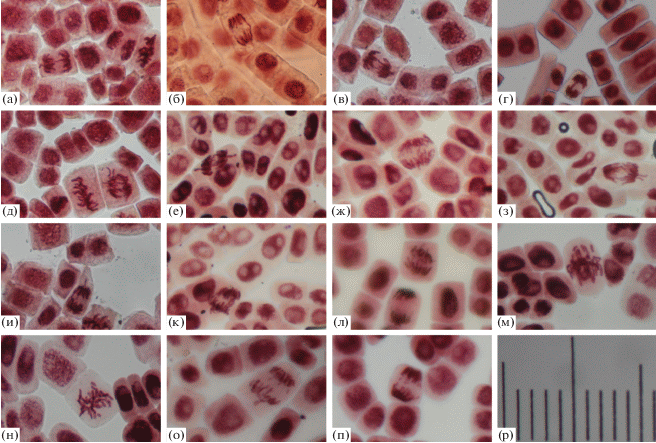
Достаточно часто цитируется описание анафазных мостов по классификации [18], с разделением их по морфологии на хромосомные (обычно двойные) и хроматидные (обычно одиночные) мосты. Хромосомный двойной мост рассматривается как результат воссоединения двух разорванных хромосом, а хроматидный одиночный мост (табл. 1, № 1; рис. 1, а, 1, б) образуется при сестринском соединении хроматид изолокусного разрыва одной хромосомы и часто обозначается как дицентрическая хроматида или равноплечий анафазный мост. Второй возможный механизм образования одиночного (неравноплечего) моста хроматидного типа – асимметричный межхромосомный обмен (хроматидная транслокация) в результате слияния проксимальных концов после разрыва хроматид двух разных хромосом (табл. 1, № 2).
Признается не всеми исследователями [4] возможность в анафазе конфигурации “одиночный мост” как аберрации хромосомного типа при возникновении разрыва в не реплицированной хромосоме фазы G1 клеточного цикла с последующим удвоением и последующим слиянием проксимальных фрагментов [19] (табл. 1, № 3).
Двойные анафазные мосты (табл. 1, № 4 и 5) относятся всеми исследователями к аберрациям хромосомного типа, формирующимся на основе асимметричного межхромосомного обмена [7] после разрывов в двух нерасщепленных хромосомах с последующей репликацией. В метафазной конфигурации это дицентрические хромосомы – маркеры радиационного воздействия, в анафазе же хроматиды могут идти к разным полюсам, образуя перекрещивающийся двойной мост или конфигурацию параллельных мостов, обозначаемую как “двойной мост” [4, 19], без указания конкретной формы (рис. 1, в–з). Хотя в классификациях чаще упоминается только перекрестный мост как возможная анафазная судьба дицентрика [20, 21].
При анализе двойных мостов необходимо упомянуть также анафазную судьбу кольцевых центрических хромосом метафаз – маркеров радиационного воздействия. Известно, что кольцеобразные хромосомные анафазные мосты образуются в цикле “разрыв – слияние (ошибки репарации) – структурное нарушение” и предваряются существованием кольцевых хромосом [7, 22]. Разделяясь в анафазе, центрические кольца могут распрямиться по типу ленты Мёбиуса, образуя большую дицентрическую петлю (табл. 1, № 7; рис. 1, л) или переплестись двумя кольцами меньшего размера и сцепиться по типу звеньев цепи, что напоминает форму “восьмерки” [20] (табл. 1, № 6; рис. 1, и, 1, к). Механизмом этой перестройки хромосомного типа является асимметричный внутрихромосомный обмен на базе межплечевой делеции на стадии G1 клеточного цикла с последующим удвоением при репликации.
Хроматидные перестройки на основе изолокусного разрыва (изохроматидной делеции) двух хроматид и различных вариантов слияния фрагментов проявляются в анафазе одиночным мостом или дицентрической хроматидой (сестринское слияние проксимальных фрагментов (табл. 1, № 1), а также одиночным или двойным фрагментом (табл. 1, № 8 и 10; рис. 1, о, 1, п) при слиянии/не слиянии дистальных концов, соответственно.
При этом описан другой механизм образования одиночного фрагмента (табл. 1, № 9), позволяющий отнести его к аберрациям хромосомного типа, признаваемый, однако, не всеми исследователями [4]. Это хромосомный разрыв или терминальная делеция на стадии G1 (по терминологии автора “концевая нехватка в нерасщепленной” хромосоме) с последующей репликацией и слиянием дистальных фрагментов после репликации [19]. Аналогично морфологически двойная конфигурация “два непарных фрагмента” по механизму возникновения относится к аберрациям хроматидного типа, поскольку представляет собой асимметричный межхромосомный обмен (хроматидная транслокация) в результате неслияния дистальных фрагментов после разрыва хроматид двух разных реплицированных хромосом (табл. 1, № 10).
АНАЛИЗ КЛАССИФИКАЦИИ ХРОМОСОМНЫХ АБЕРРАЦИЙ ДЛЯ УЧЕТА ОСОБЕННОСТЕЙ КЛАСТОГЕННОГО ДЕЙСТВИЯ ФАКТОРОВ
По современным представлениям о механизме радиационного воздействия непосредственно двунитевые разрывы ДНК (и/или суперпозиция однонитевых) являются базовыми событиями радиационно-индуцированных повреждений хромосом, которые реализуются в аберрации в цикле “разрыв – сшивка (ошибки репарации) – структурная мутация” и могут быть выявлены обычными методами цитогенетики. Аналогичное кластогенное действие на хромосомы способны оказывать некоторые мутагены химической природы, имитируя эффекты ионизирующей радиации. При этом описана более сложная последовательность молекулярно-генетических событий, связанная с формированием “первичных, начальных” повреждений одной нити, реализуемых при определенных условиях и фазах клеточного цикла в истинные повреждения (двунитевые разрывы) хромосом [23, 24].
Подходы к классификации хромосомных аберраций для учета кластогенного действия факторов могут базироваться на различной типологической основе. В зависимости от используемой классификации и целей цитогенетического исследования выделяют стабильные и нестабильные типы хромосомных аберраций, симметричные и асимметричные структурные перестройки, аберрации хромосомного или хроматидного типа, на основе меж- и внутрихромосомных обменов и т.п. При этом спектр хромосомных аберраций может включать различные формы, выявляемые соответственно технике цитогенетического исследования и представлениям о задействованных механизмах реализации двойного разрыва в микроскопируемую структурную перестройку [25, 26].
При метафазном анализе доступны к учету центрические кольца (внутрихромосомные обмены, когда интерстициальный фрагмент замкнут в кольцо после двух разрывов по различным сторонам от центромеры и слиянии липких концов центрического фрагмента между собой) и ацентрические кольца (результат внутрихромосомных обменов при слиянии в кольцо ацентрических участков одного плеча хромосомы); дицентрические хромосомы (результат асимметричных транслокаций при межхромосомном обмене, образующихся после разрывов в разных хромосомах и последующим объединением их центромерных фрагментов); а также парные терминальные или интерстициальные фрагменты, образованные в результате одного или двух разрывов соответственно в не реплицированной хромосоме [2, 4, 18, 19]. С диагностическими целями предложено использовать, например, соотношение аберраций хромосомного типа на основе меж- и внутрихромосомных обменов для характеристики качества (по величине линейной передачи энергии) излучения [27]. При этом техника простого равномерного окрашивания хромосом не позволяет различать симметричные внутрихромосомные обмены (пара- и перицентрические инверсии) при анализе метафазного спектра [25, 27].
При анафазном методе недоучитывается около 40% метафазных нарушений. При этом судьба метафазных хромосомных изменений в анафазе проявляется другим набором аберраций, фиксируемых с использованием недифференцированного окрашивания хроматина [7, 19, 20]. При использовании анафазного метода в радиоэкологических исследованиях к аберрациям хроматидного типа традиционно относят одиночные мосты и одиночные фрагменты (m′–f ′), к аберрациям хромосомного типа – двойные мосты и двойные фрагменты (m′′–f ′′) [14–16]. Хотя некоторая неоднозначность распределения анафазных аберраций по этим подтипам отмечалась еще в работе [6], когда при анализе анафаз выделили семь типов нарушений: хроматидные: 1) одинарный фрагмент (−); 2) парные фрагменты (= как частично хромосомные перестройки); 3) мосты с одним фрагментом ([−); 4) мосты с парой фрагментов ([=); 5) мосты без фрагментов ([ как результат ухода одного или пары фрагментов с массой хромосом к полюсу клетки), а также хромосомные: 1) транслокации с парой фрагментов (Х=); 2) транслокации без фрагментов (Х как результат ухода фрагментов к полюсу клетки). Как видно, хроматидные двойные фрагменты (символ =) частично относили к хромосомным перестройкам и отмечали возможность их недоучета при уходе к полюсам клетки.
При этом аберрации хроматидного типа возможны на основе изолокусного разрыва, который возникает в реплицированной хромосоме в фазе S или G2. По этому признаку одиночный мост и сопутствующие одиночные фрагменты относятся к аберрациям хроматидного типа. Однако в классификации [19] выделяется одиночный мост как анафазная фигура, проявляющая аберрации хромосомного типа на основе хромосомного разрыва (концевая нехватка) в “нерасщепленной” хромосоме с последующим удвоением без слияния разорванных концов. После репликации на ряде объектов показана возможность слияния уже сестринских хроматид (аналогично слиянию проксимальных концов после изолокусного разрыва), с образованием дицентрической хроматиды, образующей в анафазе мостик. В этом случае, исходя из морфологии анафазной фигуры, данный вид следует отнести к хроматидному типу аберраций как “одиночный мост”. Однако по стадии возникновения разрыва в фазу G1 – к хромосомному. Также допускается механизм образования анафазного одиночного фрагмента как аберрации хромосомного типа [19], возникшего в результате терминальной делеции (концевая нехватка в “нерасщепленной” хромосоме) с последующей репликацией и слиянием дистальных фрагментов (табл. 1, № 9). Хотя ряд авторов считают маловероятным слияние дистальных фрагментов хроматид с образованием одиночного фрагмента: “…маловероятно предположение, что одиночный фрагмент может происходить из-за слияния сестринских хроматид парного фрагмента и развертывания их по длине” (цит. по [2]).
На основе изохроматидных разрывов, когда изменение произошло после репликации и затрагивает сестринские хроматиды, возможны аберрации хромосом в виде парных терминальных или интерстициальных фрагментов, морфологически идентичных аберрациям хромосомного типа (двойные), но возникших в реплицированной хромосоме, следовательно – хроматидного типа. Так, по морфологии двойной фрагмент (результат не слияния дистальных фрагментов) относят к аберрациям хромосомного типа, хотя разрыв возник на стадии S или G2 (табл. 1, № 11). Поэтому парные фрагменты могут быть как изохроматидного, так и хромосомного происхождения (табл. 1, № 11 и 12).
Таким образом, при использовании методики обычной светопольной микроскопии морфологическими маркерами кластогенного действия и последующих транслокаций являются характерные конфигурации хромосом метафазных пластинок и анафаз митоза. При этом аберрации хромосомного типа чаще описываются как двойные, сходным образом затрагивающие обе хроматиды реплицированной хромосомы, а аберрации хроматидного типа – как одиночные фигуры, хотя при использовании техники недифференцированного окрашивания ядерного хроматина признается трудно различимой по ширине фрагмента его одиночная или парная природа (рис. 1м–1п). Аналогичные инструментальные ограничения недифференцированное (равномерное) окрашивание анафазных хромосом накладывает на процесс распознавания природы мостов и соответственно механизма образования предшествующих им метафазных дицентриков [25]. На схемах хроматидный мост или дицентрическая хроматида обозначается как одиночный, однако при микроскопировании препаратов “…по толщине моста нельзя судить о его хромосомном или хроматидном характере…, не всегда можно дифференцировать характер моста и поэтому вряд ли целесообразно проводить такое разделение при использовании тотального метода окрашивания хромосом, не позволяющего идентифицировать отдельные хроматиды” (цит. по [2]).
ВЫВОДЫ
1. Для ряда аберраций выявлены терминологические противоречия и неоднозначное соотнесение анафазного морфологического вида с хроматидным или хромосомным типом, отражающим особенности кластогенного действия факторов радиационной или химической природы и использующимся в качестве биоиндикационного или тестового показателя.
2. Используя анафазный спектр хромосомных аберраций с диагностическим целями, информативно представлять результаты не только с разделением нарушений на типы хромосомной или хроматидной природы, но и давать более дифференцированную морфологическую характеристику анафазной конфигурации как для мостов, так и для фрагментов.
3. Техника тотального окрашивания хромосом при простом варианте цитогенетического исследования без остановки деления на стадии метафазы неоднозначно диагностирует одиночную или парную природу фрагментов, что затрудняет отнесение их к хромосомному или хроматидному типу.
4. Для анафазных мостов желательно представлять не только описание их двойной или одиночной природы, но и характеризовать способ пересечения нитей, включая описание кольцеобразных структур. Это дает информацию о механизме возникновения и предшествующей метафазной морфологии хромосомы, которая используется как маркер радиационного воздействия.
Список литературы
Esnault M.-A., Legue F., Chenal Ch. Ionizing radiation: Advances in plant response // Environ. Experim. Botany. 2010. V. 68. P. 231–237.
Калаев В.Н., Карпова С.С. Цитогенетический мониторинг: методы оценки загрязнений окружающей среды и состояния генетического аппарата организма. Воронеж: Изд-во ВГУ, 2004. 80 с. [Kalaev V.N., Karpova S.S. Citogeneticheskij monitoring: metody ocenki zagryaznenij okruzhayushchej sredy i sostoyaniya geneticheskogo apparata organizma. Voronezh: Izdatel'stvo VGU, 2004. 80 s. (in Russian)]
McClintock B. The stability of broken ends of chromosomes in Zea mays. // Genetics. 1940. V. 26. P. 234–282.
Паушева З.П. Практикум по цитологии растений. М.: Колос, 1988. 304 с. [Pausheva Z.P. Praktikum po citologii rastenij. M.: Kolos, 1988. 304 s. (in Russian]
Дубинин Н.П. Радиационный и химический мутагенез. М.: Наука, 2000. 465 с. [Dubinin N.P. Radiacionnyj i himicheskij mutagenez. M.: Nauka, 2000. 465 s. (in Russian)]
Дубинин Н.П., Дубинина Л.Г., Нестерова Н.И. Доза облучения и ядерные изменения в клетках человека в культуре ткани по разным фазам клеточного цикла // Радиобиология. 1964. Т. 4. Вып. 5. С. 713–725. [Dubinin N.P., Dubinina L.G., Nesterova N.I. Doza oblucheniya i yadernye izmeneniya v kletkah cheloveka v kul'ture tkani po raznym fazam kletochnogo cikla // Radiobiologiya. 1964. T. 4. Vyp. 5. S. 713-725. (in Russian)]
Nicoloff H., Gecheff K. Methods of scoring induced chromosome structural changes in barley // Mutat. Res.1976. V. 34. P. 233–244.
Барыкина Р.П. и др. Справочник по ботанической микротехнике. Основы и методы. М., 2004. [Barykina R.P. i dr. Spravochnik po botanicheskoj mikrotekhnike. Osnovy i metody. M., 2004. (in Russian)]
Столбова В.В., Манахов Д.В., Щеглов А.И. Регистрация результатов Allium-теста с помощью комплекса визуализации на основе микроскопа Микмед-6 для оценки генотоксичности почв // Вестн. Моск. Ун-та. Сер. 17. Почвоведение. 2016. № 2. С. 40–44. [Stolbova V.V., Manahov D.V., Shcheglov A.I. Registraciya rezul'tatov Allium-testa s pomoshch'yu kompleksa vizualizacii na osnove mikroskopa Mikmed-6 dlya ocenki genotoksichnosti pochv // Vestn. Mosk. Un-ta. Ser. 17. Pochvovedenie. 2016. № 2. S. 40-44. (in Russian)]
Kal’chenko V.A., Fedotov I.S. Genetic effects of acute and chronic ionizing irradiation on Pinus sylvestris L. inhabiting the Chernobyl Meltdown Area // Russ. J. Genet. 2001. V. 37. № 4. P. 341–350.
Geraskin S.A., Dikarev V.G., Zyablitskaya Y.Y., Oudalova A.A., Spirin Y.V., Alexakhin R.M. Genetic consequences of radioactive contamination by the Chernobyl fallout to agricultural crops // J. Environ. Radiat. 2003. V. 66. P. 155–169.
Geraskin S.A., Kim J.K., Oudalova A.A., Vasiliyev D.V., Dikareva N.S., Zimin V.L., Dikarev V.G. Bio-monitoring the genotoxicity of populations of Scotspine in the vicinity of a radioactive waste storage facility // Mutat. Res. 2005. V. 583. P. 55–66.
Geras’kin S.A., Oudalova A.A., Michalik B., Dikareva N.S., Dikarev V.G. Geno-toxicity assay of sediment and water samples from the Upper Silesia post-mining areas, Poland by means of Allium-test // Chemosphere. 2011. V. 83. № 8. P. 1133–1146.
Белых Е.С., Майстренко Т.А. Цитогенетические эффекты у растений Allium schoenoprasum, произрастающих на техногенно загрязненной почве // Радиац. биология. Радиоэкология. 2015. Т. 55. № 1. С. 5–15. [Belyh E.S., Majstrenko T.A. Citogeneticheskie effekty u rastenij Allium schoenoprasum, proizrastayushchih na tekhnogenno zagryaznennoj pochve // Radiatcionnaya Biologiya. Radioekologiya. 2015. V. 55. № 1. S. 5–15. (in Russian)]
Удалова А.А., Пяткова С.В., Гераськин С.А., Киселёв С.М., Ахромеев С.В. Оценка цито- и генотоксичности поземных вод, отобранных на промплощадке Дальневосточного центра по обращению с радиоактивными отходами // Радиационная биология. Радиоэкология. 2016. Т. 56. № 2. С. 208–219. [Udalova A.A., Pyatkova S.V., Geras'kin S.A., Kiselyov S.M., Ahromeev S.V. Ocenka cito- i genotoksichnosti pozemnyh vod, otobrannyh na promploshchadke Dal'nevostochnogo centra po obrashcheniyu s radioaktivnymi othodami // Radiatcionnaya Biologiya. Radioekologiya. 2016. V. 56. № 2. S. 208–219. (in Russian)]
Минкенова К.С., Байгазинов Ж.А., Лукашенко С.Н., Мамырбаева А.Н., Каримбаева К.С. Цитогенетические изменения тонконога (Koeleria gracilis Pers), произрастающего в местах испытания боевых радиоактивных веществ на Семипалатинском испытательном полигоне // Тез. докл. VII Междунар. науч.-практ. конф. Павлодар: Дом печати, 2016. С. 69–70. [Minkenova K.S., Bajgazinov Zh.A., Lukashenko S.N., Mamyrbaeva A.N., Karimbaeva K.S. Citogeneticheskie izmeneniya tonkonoga (Koeleria gracilis Pers), proizrastayushchego v mestah ispytaniya boevyh radioaktivnyh veshchestv na Semipalatinskom ispytatel'nom poligone //Tezisy dokladov VII Mezhdunarodnoj nauchno-prakticheskoj konferencii. Pavlodar: Dom pechati, 2016. S. 69–70. (in Russian)]
Поликарпов Г.Г., Цыцугина В.Г. Закономерности распределения аберраций хромосом по клеткам гидробионтов при действии ионизирующего излучения и химических мутагенов среды // Радиац. биология. Радиоэкология. 1993. Т. 33. № 2. С. 205–213. [Polikarpov G.G., Cycugina V.G. Zakonomernosti raspredeleniya aberracij hromosom po kletkam gidrobiontov pri dejstvii ioniziruyushchego izlucheniya i himicheskih mutagenov sredy // Radiatcionnaya Biologiya. Radioekologiya. 1993. V. 33. № 2. S. 205–213. (in Russian)]
Алов И.А. Цитофизиология и патология митоза. М.: Медицина, 1972. 264 с. [Alov I.A. Citofiziologiya i patologiya mitoza. M.: Medicina, 1972. 264 s. (In Russian)]
Ли Д.Е. Действие радиации на живые клетки / Пер. с англ. М.: ГосАтомИздат, 1963. 288 с. [Li D.E. Dejstvie radiacii na zhivye kletki: Perevod s angl. M.: GosAtomIzdat, 1963. 288 s. (in Russian)]
Коггл Дж. Биологические эффекты радиации / Пер. с анг. под ред. А.Н. Деденкова. М.: Энергоатомиздат, 1986. 184 с. [Koggl Dzh. Biologicheskie effekty radiacii: Per. s ang. / Pod red. A.N. Dedenkova. M.: Energoatomizdat, 1986. 184 s. (in Russian)]
Gisselson D. Classification of chromosome segregation errors in cancer // Chromosoma. 2008. V. 117. Issue 6. P. 511–519.
McClintock B. The production of homozygous deficient tissues with mutant characteristics by means of the aberrant behavior of ring-shaped chromosomes // Genetics. 1938. V. 23. P. 215–237.
Ковалева О.А. Цитогенетические аномалии в соматических клетках млекопитающих // Цитология и генетика. 2008. Т. 42. № 1. С. 58–72. [Kovaleva O.A. Citogeneticheskie anomalii v somaticheskih kletkah mlekopitayushchih // Citologiya i genetika. 2008. V. 42. № 1. S. 58–72. (in Russian)]
Дубинин Н.П. Потенциальные изменения в ДНК и мутации. Молекулярная цитогенетика. М.: Наука, 1978. 236 с. [Dubinin N.P. Potencial'nye izmeneniya v DNK i mutacii. Molekulyarnaya citogenetika. M.: Nauka, 1978. 236 s. (in Russian)]
Obe G., Pfeiffer P., Savage J.R.K. et al. Chromosomal aberrations: formation, identification and distribution // Mutat. Res. 2002. V. 504. P. 17–36.
Durante M., Bedford J.S., Chen D.J. et al. From DNA damage to chromosome aberrations: Joining the break // Mutat. Res. 2013. V. 756. P. 5–13.
Cornforth M.N., Durante M. Radiation quality and intra-chromosomal aberrations: Size matters // Mutat. Res. Gen. Tox. En. 2018. V. 836. P. 28–35.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


