Радиационная биология. Радиоэкология, 2019, T. 59, № 5, стр. 453-464
РАДИАЦИОННАЯ БИОЛОГИЯ СТРУКТУРНО РАЗНЫХ ГЕНОВ Drosophila melanogaster. СООБЩЕНИЕ 8. ГЕН white: ОБЩАЯ ХАРАКТЕРИСТИКА РАДИОМУТАБИЛЬНОСТИ И ПЦР-АНАЛИЗ “ТОЧКОВЫХ” МУТАЦИЙ
Е. В. Кравченко 1, А. Н. Русакович 1, *, Ф. Эльноамани 2, С. В. Дубовик 1, С. Е. Хассаб Ель-Наби 2, М. В. Александрова 1, И. Д. Александров 1
1 Объединенный институт ядерных исследований
Дубна, Россия
2 Университет Минуфии
Минуфия, Египет
* E-mail: artemrusakovich@yandex.ru
Поступила в редакцию 09.01.2019
Аннотация
Представлены результаты генетического, цитогенетического и молекулярного (ПЦР) анализа γ- (5–60 Гр) и нейтрон-индуцированных (2.5–20 Гр) мутаций сцепленного с полом гена white (w) Drosophila melanogaster. Полный спектр мутаций w, индуцированных в результате действия ионизирующих излучений разных видов в широком диапазоне доз, оказался одинаковым и включал три класса мутаций: 1) стерильные F1w мутации, 2) наследуемые “точковые” мутации и 3) наследуемые хромосомные мутации. Установлено, что зависимость доза–эффект для обоих наследуемых классов мутаций является линейной как для γ-квантов, так и для нейтронов. Важно отметить, что многие нейтрон-индуцированные мутации w, ассоциированные с инверсионным или транслокационным разрывом, являются “точковыми”, но комплексной природы, и имеют независимые изменения ДНК внутри гена. Принимая во внимание эти результаты, ОГЭ нейтронов в индукции “точковых” и хромосомных мутаций w составляет 2,5 и 4.0 соответственно. Согласно результатам ПЦР-анализа γ- и нейтрон-индуцированные “точковые” мутации могут быть обусловлены изменениями ДНК четырех разных типов: 1) микроизменениями, не выявляемыми методом ПЦР; 2) мутациями с потерей одного ПЦР-фрагмента; 3) мутациями с потерей нескольких смежных ПЦР-фрагментов и 4) мутации с кластером потерь второго и/или третьего типа одновременно. Обсуждаются особенности радиомутабильности гена w в сравнении с таковыми у другого сцепленного с полом гена yellow.
Настоящая работа, описывающая сравнительное действие γ-излучения и нейтронов на ген white (w) Drosophila melanogaster, завершает цикл наших публикаций по ключевым аспектам радиационной биологии индивидуальных генов в генеративных клетках, а именно, установление общих для разных генов закономерностей радиационного мутагенеза и выявление зависимости спектра мутаций от таких варьирующих генетических и биологических факторов, как величина гена, его экзон-интронная организация с элементами контроля экспрессии типа энхансеров, положение на хромосоме и его эу- или гетеро-хроматиновое окружение, а также от дозы и качества радиации. Среди изученных нами пяти локусов ген w хорошо изучен на цитологическом, генетическом и молекулярно-генетическом уровнях, что предопределило его широкое использование в качестве гена-репортера при изучении широкого круга острых вопросов общей, молекулярной и, в том числе, радиационной генетики. В последнем случае уже на раннем этапе ее развития ген w становится первым и главным тест-объектом в изучении проблемы прямого и обратного мутирования его аллелей под действием рентгеновского излучения [1, 2], а вскоре и в изучении характера зависимости частоты рентген-индуцированных мутаций этого локуса от дозы радиации [3] и положения на Х-хромосоме [4]. Позже, в 80-е годы прошлого столетия локус w становится одним из основных генов-репортеров в изучении сравнительного генетического действия нейтронов и γ-излучения [5] или рентгеновских лучей [6]. Как показали близкие для обеих работ результаты, в спектре индуцированных редкоионизирующим излучением и нейтронами наследуемых мутаций гена преобладают крупные аберрации хромосом в виде мультилокусных делеций (потеря изучаемого гена и смежных с ним других локусов), инверсий или транслокаций с аберрационным разрывом в области гена. Доля мутаций w с внутригенными изменениями (так называемые “точковые” мутации) оказалась весьма незначительной после действия обоих видов радиации. Некоторые из них, как показал молекулярный анализ с использованием метода блот-гибридизации по Саузерну [6], представляли собой частичные делеции ДНК гена размером 100–400 пар нуклеотид (п.н.), и лишь одна среди рентген-индуцированных мутаций имела мутационные изменения, не выявляемые этим методом. Учитывая различия в степени зрелости облучаемых гамет в выше перечисленных исследованиях, а также тот факт, что в работах отсутствует анализ зависимости доза–эффект для хромосомных и “точковых” мутаций, доля которых среди изученных методом блот-гибридизации была весьма незначительной, эти первые результаты по радиомутабильности гена w можно рассматривать как сугубо предварительные и далеко недостаточные, особенно в отношении молекулярной природы и частоты “точковых” мутаций. Вопрос об эффективности ионизирующих излучений в индукции наследуемых “точковых” мутаций гена и о молекулярной природе таких мутаций в настоящее время приобретает особую остроту в свете независимо накапливающихся данных о весомом вкладе именно таких мутаций с микроизменениями ДНК в картину спонтанных изменений генов наследственных заболеваний и аномалий развития человека [7–10]. Экспериментально обоснованный ответ на этот важный и актуальный вопрос закладывает научную основу современного подхода к оценке генетического риска (опасности) радиации на молекулярном уровне в отношении индукции “точковых” мутаций.
Учитывая сказанное, нами проведен комплексный цитологический, генетический (гибридологический) и молекулярный (метод полимеразной цепной реакции, ПЦР) анализ мутаций гена w, индуцированных при воздействии γ-излучения и нейтронов (разные дозы) в зрелых спермиях самцов дикой лабораторной линии Д-32 Drosophila melanogaster. Таким образом, исследование посвящено анализу мутаций данного гена, полученных в тех же экспериментах, что и таковые четырех других изучаемых нами локусов, особенности радиомутабильности которых уже опубликованы.
МАТЕРИАЛЫ И МЕТОДИКА
Структурная часть гена w (цитология: 3B6 политенной Х хромосомы; генетическая локализация 1.5) размером 5868 п.н. состоит из шести экзонов и пяти интронов (35.0 и 65.0% ДНК гена соответственно) [FlyBase ID FBgn0003996] (рис. 1).
Рис. 1.
а – схема локализации гена w на цитогенетической карте Х-хромосомы со смежными генами-маркерами; б – схема регуляторной и кодирующей частей гена w (En – энхансер гена w) и положение перекрывающихся фрагментов – ампликонов (1–7) на карте гена. Темные блоки – экзоны, ломаные линии – интроны.
Fig. 1. a – scheme of w gene localization on citogenetical map of X-chromosome with adjacent marker genes; b – scheme of regulatory and coding parts of w gene (En – enhancer of w gene) and of position of overlapping amplicon fragments (1–7) on gene map. Black blocks – exons, broken lines – introns.
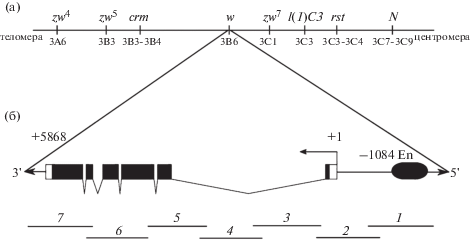
В 5’-геномной ДНК идентифицирована область регуляции активности гена (координаты от –1856 до –1084) [11]. Продукт гена участвует в распределении оммохромных (коричневых) и птеридиновых (красных) пигментов, находящихся в составных глазах и глазках взрослых мух. Точная функция белка, который кодирует ген w, до сих пор неизвестна, но считается, что это мембранный АТФ-связывающий транспортный белок [12, 13]. Мутационная инактивация гена w ведет к изменению окраски глаз имаго. Все мутации в данном локусе являются рецессивными и приводят к изменению нормальной кирпично-красной окраске глаз к более светлым оттенкам вплоть до полного отсутствия пигментации (белые глаза). Среди описанных в литературе мутантных аллелей гена наиболее широко известна и используется в различных лабораторных линиях в качестве маркера рецессивная мутация wa, вызванная инсерцией мобильного элемента copia во второй интрон [14]. Именно мутацией wa маркирован генотип самок тестер-линии KL (In (1) scS1Lsc8R + dl-49, y31dscS1sc8wa; b1cn1vg1), с которыми скрещивались интактные и облученные самцы дикой лабораторной линии Д-32 в наших экспериментах для получения в F1 мутантных самок по этому гену.
Изученные в работе мутации w получены в тех же контрольных и радиационных генетических экспериментах, что и мутации генов black (b) [15], cinnabar (cn) [16], vestigial (vg) [17] и yellow (y) [18]. Физические условия воздействия γ-квантов 60Co и реакторных нейтронов с Еср = 0.85 МэВ, комбинированного действия этих излучений, включая детали классического цито- и генетического анализа с их классификацией на три основных класса: 1) ненаследуемые мутации F1 с доминантной стерильностью; 2) наследуемые мутации аберрационной природы и 3) наследуемые мутации “точковой” природы, детально были описаны ранее [5, 17, 19].
Молекулярная природа спонтанных, γ- и нейтрон-индуцированных мутаций изучалась нами, как первый этап анализа, с использованием метода полимеразной цепной реакции (ПЦР), для чего область гена w была подразделена на семь перекрывающихся фрагментов (рис. 1), к которым были подобраны уникальные пары праймеров (табл. 1).
Таблица 1.
Праймеры, используемые для молекулярного анализа гена white D. melanogaster Table 1. List of primers used for molecular analysis of w gene of D. melanogaster (5' → 3') and their localization relative to the transcription start point (+1)
| № фрагментa гена | Нуклеотидная последовательность праймеров 5' → 3' | Локализация концов фрагментов относительно точки начала транскрипции | Размеры фрагментов, п.н. |
|---|---|---|---|
| 1 | ACCGCACTTCCTGTGACAAT | –1836 | 1223 |
| CCTATCCGCACCCGTACTTC | –613 | ||
| 2 | GGCAACTGCAACTGCTAACC | –841 | 1485 |
| GCCACCACTGGTTATGCGTC | +644 | ||
| 3 | GAGATCATATCATGATCAAGAC | +414 | 1298 |
| AGCGAGATGGCCATATGGCTG | +1712 | ||
| 4 | TGCACAGCGCCATCTAGCG | +1373 | 1324 |
| CTCAATCTCTTGTAGATAAGTGC | +2697 | ||
| 5 | CCGCAAACGTCTTCGGTTAC | +2448 | 1289 |
| CGGAACTGCCCATCACGGC | +3737 | ||
| 6 | CTGCAACGAGCGACACATAC | +3563 | 1339 |
| TCGCATCTCATTAATATTCGCG | +4902 | ||
| 7 | AGACAACGGTGAGTGGTTCC | +4711 | 1348 |
| GTGGTGTGGTGGAGGTGAAT | +6059 |
Геномную ДНК геми- или гомозиготных мутантов для ПЦР-анализа выделяли с помощью стандартного фенольного метода. Амплификацию проводили с помощью реагентов GenPak (Isogen). В качестве контроля использовали геномную ДНК из дикой близкородственной лабораторной линии Д-18 (w+18). Расчеты зависимостей доза–эффект (выживаемость, генные мутации) и выживаемость–эффект для отдельных классов мутаций проводили с помощью программы Microsoft Excel. Характер распределения на структурно-функциональной карте гена ПЦР-выявляемых мутационных изменений в виде отсутствия того или иного фрагмента у радиационных мутантов оценивали с помощью критерия χ2.
РЕЗУЛЬТАТЫ
В контрольных опытах по анализу зависимости частоты мутаций гена w от дозы -излучения и нейтронов (конец 80-х годов прошлого века) среди около 270 тыс. регулярных (по фенотипу дикого типа) самок F1 выявлены три мутантных по изучаемому гену. Таким образом, частота возникновения последних составляет 1.1 × 10–5/локус/поколение. Их дальнейший генетический и цитологический (на политенных хромосомах) анализ показал, что они являются ”точковыми”, но разными по фенотипу у гомо- (♀♀) или гемизиготных (♂♂) особей. Первая по времени выявления мутация (w87h) оказалась по фенотипу белоглазой. Ее последующий молекулярный анализ показал отсутствие ПЦР-продукта, соответствующего 3’-концу гена (см. ниже табл. 2). Две другие по окраске глаз были близки к классическим аллелям гена wh (w-honey, желтовато-коричневатые глаза) (мутация w88c45) и к we (w-eosin, желтовато-розовые) (мутация w88d46). Обе, по результатам ПЦР-анализа, не имеют изменений гена, выявляемых этим методом (табл. 2).
Таблица 2.
Результаты ПЦР-анализа спонтанных и радиационно-идуцированных мутаций гена white Drosophila melanogaster Table 2. Results of PCR analisis of spontaneous and radiation-induced w gene mutations of D. melanogaster
| п/п | Код мутации | Фенотип | Происхождение | Цитологияа | Изученные фрагменты гена whiteб | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||||
| 1 | y sc w– spl | w | spont | + | – | – | – | – | – | + | + |
| 2 | y wa (M5) | wa | '' | '' | + | + | + | + | – | + | + |
| 3 | w87h | w | '' | '' | + | + | + | + | + | + | – |
| 4 | w88c45 | wh | '' | '' | + | + | + | + | + | + | + |
| 5 | w88d46 | we | '' | '' | + | + | + | + | + | + | + |
| 6 | w2010f24b | w | '' | '' | + | + | + | + | + | – | + |
| 7 | w2010f24c | w | '' | '' | + | + | + | + | + | + | + |
| 8 | w87g75 | w | γ – 5 Гр | '' | + | + | + | + | + | + | + |
| 9 | w81k2 | w | γ – 10 Гр | '' | + | – | + | + | + | + | + |
| 10 | w81k3 | w | '' | '' | + | + | + | + | + | + | + |
| 11 | w81k4 | w | '' | '' | + | + | + | + | + | + | – |
| 12 | w81k5 | w | '' | '' | + | + | + | + | + | + | + |
| 13 | w81k6 | w | '' | '' | + | + | + | + | + | + | + |
| 14 | w87g14 | w | '' | '' | + | + | + | + | + | + | + |
| 15 | w81k7 | w | γ – 20 Гр | '' | + | + | + | + | + | + | + |
| 16 | w81k12 | w | '' | '' | – | – | + | + | + | + | + |
| 17 | w87e36 | w | '' | '' | + | + | + | + | + | + | + |
| 18 | w87g67 | w | '' | '' | + | + | + | + | + | + | + |
| 19 | w017l55 | w | '' | '' | + | + | + | + | + | + | + |
| 20 | w017l68 | wbx | '' | '' | + | + | + | + | + | + | + |
| 21 | w017l1 | w | '' | '' | + | – | + | + | + | + | + |
| 22 | w67a | w | Γ – 40 Гр | '' | + | + | + | + | + | + | + |
| 23 | w67b | w | '' | '' | + | + | + | + | + | + | + |
| 24 | w67g | w | '' | '' | + | + | + | + | + | – | + |
| 25 | w71k | w | '' | '' | + | + | + | + | + | + | + |
| 26 | w72a29 | wa | '' | '' | + | + | + | + | + | + | + |
| 27 | w72b | w | '' | Ин. | + | + | + | – | + | + | + |
| 28 | w74b29 | w | '' | + | + | + | + | + | + | + | + |
| 29 | w74c157 | w | '' | '' | + | + | + | + | + | + | + |
| 30 | w74d145 | w | '' | '' | + | + | + | + | + | + | + |
| 31 | w74d50 | w | '' | '' | + | + | + | + | + | + | + |
| 32 | w74j | w | '' | '' | + | + | + | + | + | + | + |
| 33 | w76b129 | wh | '' | '' | + | + | + | + | + | + | + |
| 34 | w76b98 | w | '' | '' | + | + | + | + | + | + | + |
| 35 | w76l2 | w | '' | '' | + | + | + | + | + | + | + |
| 36 | w77a112 | w | '' | '' | + | + | + | + | + | + | + |
| 37 | w77a63 | w | '' | '' | + | + | + | + | + | + | + |
| 38 | w81c44 | w | '' | '' | + | + | + | + | + | + | + |
| 39 | w83b32 | wBx | '' | '' | + | + | + | + | + | + | + |
| 40 | w83b49 | wBx | '' | '' | + | + | + | + | + | + | + |
| 41 | w83c20 | wco | '' | '' | + | + | + | + | + | + | + |
| 42 | w83f42 | wh | '' | '' | – | + | – | – | – | + | + |
| 43 | w87h83 | w | '' | '' | + | + | + | + | + | + | + |
| 44 | w88d32 | wch | '' | '' | + | + | + | + | + | + | + |
| 45 | w88d54 | w | γ – 60 Гр | '' | + | + | + | + | + | + | + |
| 46 | w88d80 | wm | '' | Тр. | + | + | + | + | + | + | + |
| 47 | w88c34a | w | n– – 2.5 Гр | '' | + | – | + | + | + | + | + |
| 48 | w88c87 | w | '' | Ин. | + | + | + | + | + | + | + |
| 49 | w88b10 | w | n– – 5 Гр | + | + | + | + | + | + | + | + |
| 50 | w88c34b | w | '' | Тр. | + | + | + | + | + | – | + |
| 51 | w88b64 | w | '' | Ин. | + | + | + | + | + | – | + |
| 52 | w79b3 | w | n– – 10 Гр | '' | + | + | + | + | – | + | + |
| 53 | w79b4 | wm | '' | + | – | – | – | – | + | + | + |
| 54 | w79b5 | w | '' | Ин. | + | + | + | + | + | + | + |
| 55 | w79b7 | w | '' | '' | + | + | + | + | + | + | + |
| 56 | w79d5 | w | '' | '' | + | + | + | + | + | + | + |
| 57 | w79d6 | w | '' | + | + | + | – | – | + | + | + |
| 58 | w88f18 | w | n– + γ – 15 Гр | '' | – | – | + | + | + | + | + |
| 59 | w88g20 | w | '' | '' | – | + | – | – | – | + | + |
| 60 | w88g97 | w | '' | '' | + | + | + | + | + | + | – |
| 61 | w88h75 | wh | n– + γ – 20 Гр | '' | – | – | – | – | – | + | + |
Результаты экспериментов по индукции отдельных классов мутаций w γ-излучением 60Со в разных дозах представлены в табл. 3, а нейтронами – в табл. 4. После воздействия γ-излучения среди 207 983 проанализированных регулярных самок F1 суммарно по всем дозам обнаружено 62 мутации с фенотипом w, а в опытах с нейтронами среди 138 170 самок F1 – 37 таких мутаций.
Таблица 3.
Количество и частота (%) мутаций гена white, индуцированных разными дозами γ-излучения 60Co в зрелых спермиях самцов дикой лабораторной линии Д-32 D. melanogaster Table 3. Number and frequency (%) of mutations of w gene induced by γ-radiation of 60Co in different doses in mature sperms of wild laboratory line D-32 D. melanogaster
| Объект исследования | Доза, Гр | |||||
|---|---|---|---|---|---|---|
| 5 | 10 | 20 | 40 | 60 | все | |
| Число облученных самцов | 491 | 645 | 757 | 1500 | 855 | 4248 |
| Число изученных F1 самок (w+ аллелей) | 69 375 | 60 954 | 37 955 | 33 705 | 5994 | 207 983 |
| Среднее количество самок F1 одного самца (% от контроля#) | 141.3 | 94.5 | 50.1 | 22.5 | 7.0 | |
| (80.5) | (53.9) | (28.5) | (12.8) | (3.9) | ||
| Всего мутантов F1 | (7)* 0.0101 | (10) 0.0164 | (16) 0.0421 | (23) 0.0682 | (6) 0.1 | (62) 100% |
| Стерильные мутанты F1 | (2) 0.0028 | (2) 0.0033 | (3) 0.0079 | (3) 0.0079 | (4)0.012 | (14) 22.6% |
| Все изученные наследуемые мутации | (5) | (8) | (13) | (20) | (2) | (48) 77.4% |
| Аберрационные мутанты: | ||||||
| мультилокусные делеции | (2) | (1) | (2) | (7) | (0) | (12) 19.3% |
| инверсии | (2) 3.2% | |||||
| транслокации | (0) | (0) | (1) | (1) | (1) | (3) 4.8% |
| Все аберрационные | (2)0.0028 | (1) 0.0016 | (3) 0.0079 | (10) 0.0296 | (1) 0.016 | (17) 27.4% |
| “Точковые” мутанты: | ||||||
| простые | (1) + (2)** | (5) + (2)** | (7) + (2)** | (8) | (1) | (28) |
| комплексные | (0) | (0) | (1)** | (2) | (0) | (3) |
| Все “точковые” | (3) 0.0044 | (7) 0.0115 | (10) 0.0263 | (10) 0.0296 | (1)0.016 | (31) 50.0% |
Таблица 4.
Количество и частота (%) мутаций в гене white индуцированных разными дозами реакторных нейтронов (Еср = 0.85 МэВ) в зрелых спермиях самцов дикой лабораторной линии Д- 32 D. melanogaster Table 4. The number and frequency (%) of mutations of w gene induced by reactor neutrons (Eavg = 0.85 MeV) in different doses in mature sperms of wild laboratory line D-32 D. melanogaster
| Объект исследования | Доза, Гр | ||||
|---|---|---|---|---|---|
| 2.5 | 5 | 10 | 20 | Все | |
| Число облученных самцов | 559 | 479 | 1103 | 572 | 2713 |
| Число изученных F1 самок (w+ аллелей) | 67369 | 33952 | 33906 | 2943 | 138170 |
| Среднее количество самок F1 от одного самца (% от контроля#) | 120.5 (68.7) | 70.9 (40.4) | 30.7 (17.5) | 5.1 (2.9) | |
| Всего мутантов F1 | (3)* 0.0044 | (12) 0.0353 | (18) 0.050 | (4) 0.136 | (37) 100% |
| Стерильные мутанты F1 | (1) 0.0014 | (5) 0.0147 | (8) 0.025 | (1) 0.034 | (15) 40.5% |
| Все изученные наследуемые мутации | (2) | (7) | (10) | (3) | (22) 59.5% |
| Число/частота мутаций white разного типа | |||||
| Аберрационные мутации: | |||||
| мультилокусные делеции | (0) | (2) | (3) | (2) | (7) 18.9% |
| инверсии | (1) | (2) | (4) | (0) | (7) 18.9% |
| транслокации | (1) | (1) | (0) | (1) | (3) 8.1% |
| Все аберрационные | (2) 0.0029 | (5) 0.0147 | (7) 0.021 | (3) 0.12 | (17) 45.9% |
| “Точковые” мутации: | |||||
| простые | (0) | (2) | (2) | (0) | (4) |
| комплексные | (0) | (0) | (1) | (0) | (1) |
| Все “точковые” | (0) | (2) 0.0059 | (3) 0.0059 | (0) | (5) 13.5% |
Примечание. #, * см. табл.2.
Как показали результаты генетического анализа, среди 62 индуцированных γ-излучениеми 14 мутантов (22.6%) оказались стерильными, а среди 37 индуцированных нейтронами выявлено 15 (40.5%) таких мутантов, т.е. в индукции генетических изменений, определяющих стерильность мутантных самок, нейтроны оказываются в 1.8 раза эффективней γ-излучения. Цитологический анализ всех оставшихся мутаций показал, что 12 из 48 (19.3%) γ- и 17 из 22 (45.9%) нейтрон-индуцированных наследуемых мутаций w ассоциированы с хромосомными изменениями того или иного типа. Среди них доли мультилокусных делеций для γ-квантов и нейтронов близки и составляют 19.3 и 18.9% соответственно. Обращает на себя внимание тот факт, что в индукции обменных аберраций (инверсии, транслокации), точки разрыва которых локализуются в районе гена w, нейтроны в 3.4 раза эффективнее γ-излучения.
За вычетом стерильных и аберрационных мутаций w, остальные 28 γ- и четыре нейтрон-индуцированных по данным генетики и цитологии являются наследуемыми “точковыми” мутациями. Их доля среди всех проанализированных составляет таким образом 50.0 и 13.5% для γ-квантов и нейтронов соответственно. Следовательно, в индукции этого класса мутаций γ-излучение в 3.7 раза эффективнее, чем нейтроны. При этом среди всех “точковых” мутаций w доля комплексных, т.е. имеющих дополнительно к мутации w другие независимые изменения в геноме, после нейтронного облучения составляет 20%, а после γ-облучения – 10.3%, т.е. почти в 2 раза меньше.
Учитывая количество мутаций w, полученных в опытах по изучению зависимости доза–эффект, нами был проведен ее анализ для всех мутаций в целом (в этом тесте для нейтронов преобладают аберрационные мутации) и только для “точковых” мутаций (по этому тесту для γ-излучения преобладают “точковые” мутации).
Анализ зависимостей доза–эффект для хромосомных и “точковых“ мутаций гена w после действия γ-квантов и нейтронов показывает, что характер этих зависимостей для двух видов радиации принципиально отличается (рис. 3, в, г). Анализ дозовых зависимостей для всех мутаций в целом (рис. 3, б) показывает, что ОГЭ нейтронов приблизительно равна 4. Если в индукции хромосомных мутаций нейтроны существенно более эффективны, чем γ-кванты (ОГЭ = 3.3 при одинаковой частоте индукции хромосомных мутаций 0.029), то в индукции “точковых“ γ-кванты намного эффективнее нейтронов, для которых нами в проведенных экспериментах не было получено дозовой зависимости вследствие малой частоты индукции мутаций такого рода.
Выборка мутантов для ПЦР-анализа была увеличена для дозы γ-квантов 40 Гр за счет полученных в независимых экспериментах, проведенных в тех же условиях облучения и цитогенетического анализа. Для анализа нейтрон-индуцированных мутаций гена выборка была увеличена за счет мутантов аберрационной природы, учитывая тот факт, что целый ряд таких мутантов по результатам генетического анализа можно было рассматривать как “точковой” комплексной природы, поскольку во всех этих случаях появлялись жизнеспособные гемизиготные самцы w с признаками стерильности или слабой плодовитостью. В этой связи можно было предположить, что “точковой” мутации w сопутствуют независимо индуцированная инверсия или транслокация с аберрационным разрывом вблизи гена. Таким образом, общая выборка изученных методом ПЦР- мутаций гена w включала семь спонтанных (из которых два являлись классическими аллелями этого гена и маркировали две разные лабораторные линии, а пять получены нами в контрольных экспериментах), и 39 γ-, 11 нейтрон- и четыре нейтрон + γ-индуцированных мутаций.
Анализ представленных в табл. 2 данных показывает, что в лабораторной линии y sc w- spl мутация w, описанная в литературе как полная делеция гена по нашим данным ПЦР-анализа, обусловлена потерей первых пяти из семи изученных фрагментов локуса. Другой классический аллель wa линии М5, которым маркирован генотип самок (см. Материалы и методика), является мутацией гена, меняющей дикую темно-красную окраску глаз на светло-абрикосовую, которая вызвана (по данным литературы) вставкой мобильного элемента copia во второй интрон гена. По данным ПЦР-анализа, у этого аллеля отсутствует только 5-й фрагмент, как раз включающий этот интрон. Значительный размер мобильного элемента copia (более 5 тыс. п.н.) не позволяет получить ампликон этого фрагмента в условиях стандартной ПЦР, рассчитанной на амплификацию не более 3–4 тыс. п.н. Этот результат показывает, что отсутствие того или иного фрагмента изучаемого гена может быть обусловлено среди других причин крупной инсерцией геномной ДНК.
Из трех мутантов, изолированных нами в контрольных экспериментах, двое со слабоокрашенными глазами (w88c45, w88d46) не содержат изменений в нуклеотидной последовательности гена, которые могли бы обусловить отсутствие того или иного фрагмента (так называемые ПЦР+ мутанты). В то же время третий мутант с крайним проявлением мутационного признака (белые глаза) имеет изменения, определившие отсутствие у него 7-го фрагмента. Кроме того, в дополнительных контрольных экспериментах были получены еще две мутации (w2010f24b, w2010f24c), в одной из них не удалось выявить изменений методом ПЦР, а во второй отсутствует 6-й фрагмент.
Дальнейший анализ табл. 2 показывает, что среди 39 изученных γ-индуцированных мутаций 32 имеют ПЦР-нормальную картину, т.е. содержат все фрагменты, идентичные контролю. Среди остальных пять мутаций характеризуются изменениями, определяющими отсутствие того или иного фрагмента гена, одна мутация – потерей двух смежных фрагментов (w81k12) и одна мутация – кластером изменений в виде потери одного фрагмента и смежных трех-пяти фрагментов (w83f42). Таким образом, эти результаты позволяют выделить четыре основных класса изменений ДНК гена, выявляемые ПЦР-анализом: 1) мутации с микроизменениями ДНК, не выявляемые методом ПЦР (ПЦР + мутанты); 2) мутации с потерей только 1-го фрагмента; 3) мутации с потерей нескольких смежных фрагментов; 4) мутации с несколькими независимыми делециями отдельных фрагментов, частота возникновения которых в изученной нами выборке составляет 82.1, 12.8, 2.6 и 2.6% соответственно.
Близкий спектр изменений, выявляемых ПЦР, характеризующих мутации, индуцированные нейтронами, и мутации, индуцированные комбинированным воздействием нейтроны + γ, позволяет объединить их в одну группу. Как видно из данных табл. 2, в спектре нейтрон-индуцированных мутаций можно различить те же четыре основных класса, которые описаны выше для γ-квантов 60Со, однако частота наблюдаемых мутационных изменений совершенно иная. В частности, среди 15 таких изученных мутаций пять (33.3%) являются ПЦР+ мутантами, пять (33.3%) – с потерей одного фрагмента, четыре (26.6%) – с делециями двух и более смежных фрагментов и одна (6.6%) с кластером в виде потери одного и трех-пяти фрагментов. В целом доля нейтрон-индуцированных мутантов с внутригенными делециями той или иной величины (66.7%) почти в 4 раза больше, чем после действия γ-излучения (17.9%).
Важно также отметить, что восемь аберрационных мутаций, индуцированных нейтронами и две аналогичных, индуцированных γ-излучением, ранее, на основании генетического анализа, рассматривались как “точковые”, но комплексной природы. Последнее полностью подтверждают результаты ПЦР-анализа, поскольку картина внутригенных изменений идентична таковой для всех изученных простых “точковых” мутаций, индуцированных обоими видами радиации. Это позволяет по-новому оценить частоту индукции нейтронами как аберрационных, так и “точковых” мутаций гена w, относительно выживаемости (рис. 3). Как видно из рисунка, частота рассматриваемых мутаций незначительно меняется в широком диапазоне доз γ-излучения в отличие от нейтронов, где уровень мутационных изменений неуклонно растет с падением выживаемости.
Анализ отсутствующих фрагментов с использованием критерия χ2 показал, что их распределение на карте гена носит случайный характер.
ОБСУЖДЕНИЕ
В настоящей работе впервые получена исчерпывающая картина радиомутабильности сцепленного с полом гена w Drosophila melanogaster в широком диапазоне доз γ-излучения 60Co (5–60 Гр) и моноэнергетических нейтронов деления 0.85 МэВ (2.5–20 Гр). Используя системный подход к изучению природы мутаций гена, основанный на генетическом, цитологическом и молекулярном анализе, установлены зависимости спектра и частоты индукции отдельных классов мутаций от дозы γ-излучения и нейтронов.
В первую очередь важно отметить, что спектр мутаций гена w после действия обоих видов радиации качественно идентичен таковому для других ранее изученных нами генов – b [15], cn [16], vg [17], y [18]. Так, для всех нами изученных локусов, спектр γ- и нейтрон-индуцированных изменений включает три основных класса мутаций: 1) ненаследуемые мутации F1 с доминантной стерильностью; 2) наследуемые аберрационные мутации в виде мультилокусных делеций, инверсий или транслокаций с разрывом в районе локализации гена; 3) наследуемые “точковые” мутации простого типа (без сопутствующих геномных изменений) и комплексные (с сопутствующими геномными изменениями в виде рецессивных леталей, инверсий и т.д.) (табл. 3, 4). Это позволяет полагать, что независимо от величины, организации и локализации генов в геноме зрелых гамет дрозофилы их качественная картина реакции на воздействие ионизирующих излучений с разной ЛПЭ аналогична.
Как видно из таблиц, относительная частота аберрационных мутаций и мутаций с доминантной стерильностью после действия нейтронов существенно выше, чем после действия γ-излучения (45.9, 40.5 и 27.4%, 22.6% суммарно по всем дозам соответственно), тогда как в индукции “точковых”, наоборот, γ-кванты эффективнее нейтронов (50 и 13.5% суммарно по всем дозам соответственно). Этот вывод подтверждают и результаты анализа зависимости доза–эффект (рис. 2), свидетельствующие о том, что в индукции аберрационных мутаций w нейтроны существенно эффективнее, чем γ-излучение (ОГЭ = 3.3 при одинаковой частоте индукции хромосомных мутаций 2.9 × 10–2%). Однако это не относится к “точковым” мутациям, частота которых после действия нейтронов не менялась с увеличением дозы от 5 до 10 Гр (0.6 × 10–2%), оставаясь на уровне, близком к таковому для γ-излучения в дозе 5 Гр (0.44 × 10–2%).
Рис. 2.
Графики зависимостей доза–эффект для: а – выживания F1 от яйца до имаго; б – всех обнаруженных w мутаций в F1; в – аберрационных мутаций; г – “точковых” мутаций.
Fig. 2. Dependence of dose-effect for: а – survival of F1 from egg to imago; b – all found w mutations in F1; c – aberration gene mutations; d – “point” gene mutations.
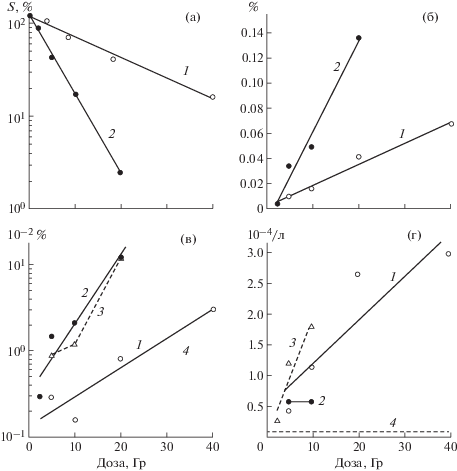
Рис. 3.
Графики зависимостей выживаемость–эффект для: а – всех обнаруженных аберрационных мутаций; б – всех обнаруженных "точковых" мутаций.
Fig 3. Survival-effect dependence due to molecular data analysis for: a – all found aberration mutations; b – all found “point” mutations.
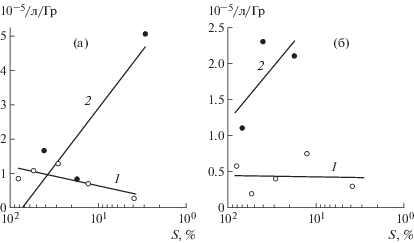
Следует отметить, что среди всех “точковых” мутаций как для γ-излучения, так и для нейтронов, доля простых мутаций значительно больше комплексных (варьируя в пределах 80–90% для обоих видов радиации). Рассматривая аберрационные мутации, можно отметить, что частота индукции мультилокусных делеций близка для γ-квантов и нейтронов (5.7 и 5.0 × 10–5/локус соответственно), тогда как в индукции инверсий и транслокаций нейтроны существенно эффективней γ-излучения (5.0 и 2.1 × 10–5/локус и 0.9 и 1.4 × 10–5/локус соответственно). При этом важно отметить, что многие инверсионные мутанты, индуцированные нейтронами, оказались жизнеспособными у гемизигот, что позволяло предполагать их “точковую” природу, но с сопутствующими независимо индуцированными изменениями генома. Тем самым подобного рода мутации w можно рассматривать как “точковые” мутации, но комплексной природы. Это предположение, как показал ПЦР анализ инверсионных и транслокационных мутаций (табл. 2), полностью подтвердилось, поскольку все изученные нами шесть инверсий и две транслокации имели ПЦР-картину изменений гена, характерную для простых точковых мутаций, а именно изменения, не определяемые ПЦР (4) или отсутствие какого-либо одного фрагмента (4). С учетом этих молекулярных данных, частота индукции нейтронами всех “точковых” мутаций гена существенно растет не только с дозой (рис. 2, г, пунктирная линия), но и со снижением выживаемости (рис. 3, б).
Сопоставляя наши и литературные данные [6] по радиомутабильности гена w после действия редкоионизирующего излучения и нейтронов, можно отметить, что спектр мутаций качественно совпадает, хотя относительные частоты отдельных классов существенно отличаются. Об этом свидетельствуют и результаты настоящей работы. В частности, в работе [6] получена одинаково высокая частота как мультилокусных, так и внутригенных делеций после действия рентгеновского излучения и нейтронов. В то же время в наших экспериментах доля мультилокусных делеций не превышает 20% для γ-квантов и нейтронов. Эти различия можно объяснить, во-первых, разной природой диких аллелей гена w и его ближайшего окружения в наших экспериментах и в работе [6] и, во-вторых, тем фактом, что в цитируемой работе облучались постмейотические генеративные клетки на разных стадиях развития, которые, как известно, отличаются своей радиочувствительностью. В наших же экспериментах облучались только гомогенные популяции зрелых гамет.
Представляет также интерес сравнить картину радиомутабильности гена w с таковой для другого, сцепленного с полом гена yellow (y) [18], изученную нами в тех же самых физических и генетических условиях эксперимента. Такой анализ показывает, что после действия γ-излучения общая частота всех мутаций гена w суммарно по всем дозам (62 мутации среди 207 983 или 2.98 × × 10–4/локус) почти в 3 раза выше, чем для гена y (24 мутации среди 207 983 или 1.15 × 10–4/локус). При этом наибольший вклад в радиомутабильность w дают “точковые” мутации (частота 1.5 × × 10–4/локус), в то время как в случае гена y частота индукции “точковых” мутаций в 2 раза ниже (0.7 × 10–4/локус), чем для гена w. Сопоставляя спектр аберрационных мутаций для этих двух генов, важно отметить, что в случае гена y в изученной выборке мутаций вовсе не обнаружены мультилокусные делеции и транслокации в отличие от гена w, где частота мультилокусных делеций достигает величины 0.5 × 10–4/локус. В то же время оба гена с близкой частотой (0.09–0.1 × 10–4/локус) вовлекаются в инверсионные обмены. Т.е. ген y менее радиомутабилен при действии γ-излучения.
Согласно результатам наших опытов с нейтронами, ген w оказывается также почти в 3 раза более радиомутабилен (37 мутаций среди 138 170 регулярных F1 или 2.6 × 10–4/локус), чем ген y (12 мутаций среди тех же регулярных самок F1 или 0.8 × 10–4/локус). Таким образом, в случае этих двух генов различия в их радиочувствительности практически не изменяются в зависимости от качества радиации. После действия нейтронов частота индукции “точковых” мутаций для обоих генов существенно ниже, чем в случае γ-излучения, составляя для гена w 0.36 × 10–4/локус и 0.21 × 10–4/локус для y. Это показывает, что при действии нейтронов также сохраняется более высокая радиочувствительность гена w по сравнению с y по тесту “точковые” мутации, хотя эти различия между локусами не столь выражены, как после действия γ-излучения.
Обращаясь к результатам ПЦР-анализа, следует отметить, что, несмотря на разницу в общем количестве между γ- и нейтрон-индуцированными мутантами по гену w (39 и 15 соответственно), в обоих случаях были обнаружены все типы изменений, выявляемые этим методом. Среди γ-индуцированных мутаций методом ПЦР были обнаружены пять потерь одного фрагмента (12.8%), одна потеря смежных фрагментов (2.6%) и одна кластерная мутация (2.6%), все остальные 32 мутации (86.4%) показали себя как ПЦР+. В свою очередь среди нейтрон-индуцированных мутаций пять (33.3%) обусловлены потерей одного фрагмента, четыре (26.6%) – потерей смежных фрагментов и одной (6.6%) кластерной мутацией, как ПЦР+ себя показали пять (33.3%) мутаций. Таким образом, γ-излучение индуцирует микроизменения ДНК, не выявляемые ПЦР в 2.6 раза чаще, чем нейтроны, в то время как нейтроны в 2.6 раза эффективнее γ в индукции делеций одиночных фрагментов. Более того, поскольку нейтроны в 10 раз чаще индуцируют потери двух и более смежных фрагментов гена, чем γ-излучение, можно отметить тенденцию к увеличению доли кластерных мутаций после действия нейтронов, чем после действия γ-квантов 60Co.
Обращает на себя внимание, что для пяти из шести инверсий картина ПЦР нормальная. Это свидетельствует о том, что инверсионные разрывы находятся вне гена, по-видимому, в непосредственной близости от него в районе 3С, где располагается интеркалярный гетерохроматин, который, как известно, характеризуется повышенной чувствительностью к хромосомным разрывам [20]. В этой связи мутантный фенотип при таких мутациях можно объяснить либо микроизменениями ДНК самого гена, которые не выявляет ПЦР, либо “эффектом положения” гена, учитывая локализацию инверсионных разрывов вблизи гена. Решение этого вопроса требует дополнительных и независимых исследований.
Сравнение γ-индуцированных молекулярных изменений, выявляемых ПЦР в генах w и y, при одинаковом для них спектре изменений показывает, что относительная частота мутаций с микроизменениями ДНК (ПЦР+ мутанты) выше в гене w, чем в y (86.4 и 64% соответственно), тогда как относительная частота индукции делеционных изменений для этих генов (сумма мутаций с потерей одного фрагмента, смежных фрагментов и одновременно нескольких фрагментов) у гена y (36%) в 2.6 раза выше, чем у гена w (13.6%).
Небольшая выборка точковых нейтрон-индуцированных мутаций w и y не позволяет провести детальный сравнительный анализ чувствительности двух генов по этому тесту, и для решения этого вопроса необходимы дополнительные исследования.
В заключение необходимо отметить, что представленные результаты ПЦР-анализа γ- и нейтрон-индуцированных наследуемых точковых мутаций гена w являются лишь первым шагом в изучении природы таких мутаций на молекулярном уровне. Дальнейшие исследования с использованием метода секвенирования должны дать представление о природе микроизменений ДНК, которые лежат в основе так называемых ПЦР+ мутантов, а также о природе изменений ДНК, определяющих отсутствие одиночных и нескольких смежных фрагментов. Такие исследования нами начаты и в настоящее время продолжаются.
Список литературы
Timofeeff-Ressovsky N.W. Mutation of the gene in different direction // Proc. of the sixth Intern. Congress of Genetics. 1932. V. 1. P. 308–330.
Глембоцкий Я.Л. Сравнительная скорость прямого и обратного мутационного процесса в локусах yellow, achaete-scute, white и forked у Drosophila melanogaster // Биол. журнал. 1936. Т. V. Вып. 5. С. 813–832. [Glembockij YA.L. Sravnitel’naya skorost' pryamogo i obratnogo mutacionnogo processa v lokusah yellow, achaete-scute, white i forked u Drosophila melanogaster (Compa-rative speed of the direct and reverse mutation process in the yellow, achaete-scute, white and forked loci in Drosophila melanogaster) // Biologicheskij zhurnal. 1936. T. V. № 5. P. 813–832. (In Russian)]
Гептнер М.А., Демидова З.А. Зависимость между дозами рентгеновских лучей и мутациями отдельных генов у Drosophila melanogaster // Биол. журн. 1936. Т. V. № 3. С. 541–550. [Geptner M.A., Demidova Z.A. Zavisimost’ mezhdu dozami rentgenovskih luchej i mutaciyami otdel’nyh genov u Drosophila melanogaster (The relationship between doses of X-rays and mutations of individual genes in Drosophila melanogaster) // Biologicheskij zhurnal. 1936. T. V. № 3. P. 541–550. (In Russian)]
Гептнер М.А. Зависимость мутирования определенных генов от их положения в хромосоме // Биол. журн. 1938. Т.VII. № 5–6. С. 1121–1136. [Geptner M.A. Zavisimost’ mutirovaniya opredelennyh genov ot ih polozheniya v hromosome (The dependence of the mutation of certain genes on their position in the chromosome) // Biologicheskij zhurnal. 1938. T. VII. № 5–6. P. 1121–1136. (In Russian)]
Alexandrov I.D. Quality and frequency patterns of γ- and neutron-induced visible mutations in Drosophila melanogaster // Mutat. Res. 1984. V. 127. P. 123–127.
Pastink A., Schalet A.P., Vreeken C. et al. The nature of radiation-induced mutations at the white locus of Drosophila melanogaster // Mutat. Res. 1987. V. 177. P. 101–115.
Sankaranarayanan K. Ionizing radiation and genetic risks. I. Epidemiological, population genetic, bioche-mical and molecular aspects of Mendelian diseases // Mutat. Res. 1991. V. 258. P. 3–49.
Cardon L.R., Clayton D.G., Deloukas P. et al. Genome-wide association study of 14,000 cases of seven common disease and 3,000 shared controls // Nature. 2007. V. 447. P. 661–678.
OMIM. 2017. https://www.omim.org
HGMD. 2018. https://www.hgmd.cf.ac.uk/ac.index.php
Qian S., Varjavand B., Pirrotta V. Molecular analysis of the zeste-white interaction reveals a promoter-proximal element essential for distant enhancer-promoter communication // Genetics. 1992. V. 131. P. 79–90.
Dreesen T.D., Johnson D.H., Henikoff S. The brown protein of Drosophila melanogaster is similar to the white protein and to components of active transport complexes // Mol. Cell. Biol. 1988. V. 8. P. 5206–5215.
Кравченко Е.В., Паршиков А.Ф., Георгиев П.Г. Взаимодействие между Su(Hw) инсуляторами регулирует cis- и trans активность энхансеров гена mini-white // ДАН. 2004. Т 399. С. 392–395. [Kravchenko E.V., Parshikov A.F., Georgiev P.G. Interaction between Su(Hw) insulators regulates cis- and trans activity of the mini-white gene enhancer // Doklady Biochemistry and Biophysics. 2004. V. 399. P. 392–395 (In Russian)]
Levis R.W., O’Hare K., Rubin G.M. Effects of transpo-sable element insertions on RNA encoded by the white gene of Drosophila // Cell. 1984. V. 38. P. 471–481.
Александров И.Д., Намолован Л.Н., Александрова М.В. Радиационная биология структурно разных генов Drosophila melanogaster. Сообщение 3. Ген black. Общая и молекулярная характеристика его радиомутабильности // Радиац. биология. Радиоэкология. 2012. Т. 52. № 5. С. 1–14. [Aleksandrov I.D., Namolovan L.N., Aleksandrova M.V. Radiacionnaya biologiya strukturno raznyh genov Drosophila melanogaster. Soobshchenie 3. Gen black. Obshchaya i moleku-lyarnaya harakteristika ego radiomutabil’nosti (Radiation biology of structurally different genes of Droso-phila melanogaster. Report 3. Gene black. General and molecular characteristics of its radio mutability) // Radiacionnaya biologiya. Radioehkologiya. 2012. V. 52. № 5. P. 1–14. (In Russian)]
Давкова Л.Н., Александров И.Д., Александрова М.В. Радиационная биология структурно разных генов Drosophila melanogaster. Сообщение 5. Ген cinnabar: общая и молекулярная характеристика его радиомутабильности // Радиац. биология. Радиоэкология. 2014. Т. 54. № 1. С. 5–20 [Davkova L.N., Aleksandrov I.D., Aleksandrova M.V. Radiacionnaya biologiya strukturno raznyh genov Drosophila melanogaster. Soobshchenie 5. Gen cinnabar: obshchaya i molekulyarnaya harakteristika ego radiomutabil’nosti (Radiation biology of structurally different genes of Drosophila melanogaster. Report 5. Gene cinnabar: General and molecular characteristics of its radio mutability) // Radiacionnaya biologiya. Radioehkologiya. 2014. V.54. № 1. P. 5–20. (In Russian)]
Александров И.Д., Александрова М.В., Лапидус И.Л., Кораблинова С.В. ОГЭ нейтронов деления при индукции рецессивных мутаций разного типа у Drosophila melanogaster // Радиационная биология. Радиоэкология. 2001. Т. 41. № 3. С. 245–258 [Aleksandrov I.D., Aleksandrova M.V., Lapidus I.L., Korablinova S.V. OGE nejtronov deleniya pri indukcii recessivnyh mutacij raznogo tipa u Drosophila melanogaster (RGE of fission neutrons in the induction of recessive mutations of various types in Drosophila melanogaster) // Radiacionnaya biologiya. Radioehkologiya. 2001. V. 41. № 3. P. 245–258. (In Russian)]
Кравченко Е.В., Дубовик С.В., Александрова М.В., Александров И.Д. Радиационная биология структурно разных генов Drosophila melanogaster. Сообщение 7. Ген yellow: общая характеристика радиомутабильности и ПЦР-анализ “точковых” мутаций // Радиац. биология. Радиоэкология. 2018. Т. 58. № 4. С. 341–351. [Kravchenko E.V., Dubovik S.V., Aleksandrova M.V., Aleksandrov I.D. Radiacionnaya biologiya strukturno raznyh genov Drosophila melanogaster. Soobshchenie 7. Gen yellow: obshchaya harakteristika radiomutabil’nosti i PCR-analiz “tochkovyh” mutacij (Radiation biology of structurally different genes of Drosophila melanogaster. Report 7. Gene yellow: general characteristic of radio mutability and PCR analysis of “point” mutations) // Radiacionnaya biologiya. Radioehkologiya. 2018. V. 58. № 4. P. 341–351. (In Russian]
Александров И.Д., Александрова М.В. Спектр и частота наследуемых мутаций при комбинированном действии нейтронов и γ-излучения // Нейтроны и тяжелые заряженные частицы в биологии и медицине / Под ред. А.Ф. Цыб. Обнинск: НИИ медицинской радиологии АМН СССР, 1989. С. 6–17. [Aleksandrov I.D., Aleksandrova M.V. Spektr i chastota nasleduemyh mutacij pri kombinirovannom dejstvii nejtronov i γ-izlucheniya (Spectrum and frequency of inherited mutations under the combined action of neutrons and γ-radiation) // Nejtrony i tyazhelye zaryazhennye chasticy v biologii i medicine / Pod red. A.F. Cyb. Obninsk: NII medicinskoj radiologii AMN SSSR, 1989. P. 6–17. (In Russian)]
Жимулёв И.Ф. Гетерохроматин и эффект положения гена. M.: Наука, 1993. 491 с. [Zhimulyov I.F. Geterohromatin i ehffekt polozheniya gena (Heterochromatin and gene position effect). M.: Nauka, 1993. 491 p. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


