Радиационная биология. Радиоэкология, 2019, T. 59, № 5, стр. 538-545
ОСОБЕННОСТИ ДЕЙСТВИЯ γ-ИЗЛУЧЕНИЯ НА СЕМЕНА ЛУКА ВЕТВИСТОГО (Allium odorum L.)
Э. В. Филиппов 1, Г. В. Филиппова 1, *
1 Институт биологических проблем криолитозоны СО РАН
Якутск, Россия
* E-mail: nureeva@yandex.ru
Поступила в редакцию 22.04.2018
Аннотация
В экспериментах на семенах дикорастущего вида Allium odorum (L.) были исследованы особенности действия острого γ-излучения на характер прорастания семян, ростовые процессы проростков, уровень перекисного окисления липидов и содержание низкомолекулярных антиоксидантов в тканях листьев и корешков, а также с использованием метода ДНК-комет был оценен уровень повреждений ядерной ДНК проростков. Показано, что воздействие в диапазоне доз 1–500 Гр на семена A. оdorum оказывало значительный стимулирующий эффект на начальные процессы прорастания семян. Максимальная доза облучения, используемая в эксперименте, вызывала повышение энергии прорастания, несвойственное данному виду. К сроку, соответствующему окончанию прорастания, стимулирующий эффект был отмечен только в варианте 1 Гр, что выражалось в увеличении в 1.5 раза числа проросших семян по сравнению с контролем. Облучение семян в этой дозе не вызывало повреждений ядерной ДНК и оказывало положительный эффект на рост листьев и корней, выше в 1.3 раза, чем в контроле. С повышением дозы облучения от 10 до 500 Гр отмечалось дозозависимое увеличение степени повреждений ядерной ДНК как в листьях, так и в корнях проростков. Незначительное ингибирующее действие на рост корней наблюдалось у проростков, выросших из семян, облученных 10 Гр, и значительно усугублялось при более высоких дозах, что также отражалось в низком содержании низкомолекулярных антиоксидантов в клетках корней (100 Гр.). Отставание в росте листьев отмечалось в варианте 500 Гр и сопровождалось низким уровнем перекисного окисления липидов в клетках относительно контроля.
В зависимости от дозы, мощности и продолжительности воздействия ионизирующей радиации в растительных организмах могут проявляться стимулирующие или ингибирующие эффекты. Известно, что воздействие низкими дозами способно ускорять деление клеток, прорастание семян, стимулировать рост и развитие растений, а также повышать продуктивность различных растений [1–3].
Покоящиеся семена растений, вследствие низкого содержания влаги и незначительной метаболической активности, более устойчивы к действию ионизирующих излучений, чем взрослые растения [4]. При прорастании, в период набухания семян, с увеличением содержания влаги и дыхательной активности генерируются свободно-радикальные продукты реакций, выступающие в качестве сигнальных молекул [5], что наряду с повреждениями, вызванными прямым действием радиации, может значительно усиливать негативное воздействие [6].
Значительный вклад в изучение радиочувствительности семян растений внесен Е.И. Преображенской. На основании изучения (по выживаемости к концу вегетационного сезона) около 700 видов культурных и дикорастущих растений из разных таксономических групп Е.И. Преображенской была предложена классификация радиочувствительности растений [7]. Вместе с тем при определении порога радиоустойчивости семян дикорастущих видов встречаются случаи изменения их радиочувствительности. Так, в работе [8] показано, что лабораторная выживаемость проростков одного вида может отличаться в разные годы сбора. Причем изменения могут быть таковы, что исследуемый вид из ранее установленной группы радиочувствительных растений “перемещается” в другую – средне-радиочувствительных. Изменчивость радиочувствительности связывают с температурно-влажностными условиями вегетации и созревания семян в год сбора [9]. Кроме того, возможны трудности при оценке лабораторной выживаемости проростков у дикорастущих видов с замедленным характером прорастания семян, обусловленные частыми сдвигами в сроках начала и длительности прорастания. В этой связи оправданным является использование комплексного подхода, включающего изучение морфологических (длина корешка и побега) и биохимических параметров. Достаточно информативным может быть применение в исследованиях чувствительных методов, позволяющих количественно регистрировать генотоксические эффекты.
Цель данного исследования – определение особенностей действия острого γ-излучения на характер прорастания семян Allium odorum (L.), ростовые процессы проростков, уровень перекисного окисления липидов (ПОЛ) и содержание низкомолекулярных антиоксидантов (НМАО) в тканях листьев и корней, а также уровень повреждений ядерной ДНК.
МАТЕРИАЛЫ И МЕТОДИКА
Материалом для исследований служили семена дикорастущего вида Allium odorum, собранные в природе на разнотравно-злаковом лугу долины Туймаада Центральной Якутии. Семена были просушены в сухом и проветриваемом темном помещении. Выбор вида в качестве объекта исследования был обусловлен компактностью произрастания с достаточным количеством особей на ограниченной территории и большим количеством семян с достаточно крупным размером проростков, позволяющим получить достаточную для проведения исследований вегетативную массу.
Семена подвергали воздействию γ-излучения (60Со) на установке “ГУР-120” (ВНИИСХРАЭ, г. Обнинск, Россия). Мощность дозы источника составляла 60 Гр/ч, облучение проводили в дозах: 1, 10, 100, 500 Гр. В качестве образцов сравнения (контроль) использовали необлученные семена. Облученные и контрольные семена проращивали в чашках Петри на увлажненных фильтрах, в четырех повторностях по 50 штук в каждой. Проращивание проводили в климатической камере KBWF 240 (“Binder”, Германия) при стандартных условиях: температуре 24 ± 0.1°С, фотопериодичности 16 ч свет/8 ч темнота, 70%-ной влажности. Интенсивность света 8 тыс. люкс, представлена холодно-белым светом люминесцентных ламп.
Семена A. odorum характеризуются медленным прорастанием, максимальное количество проросших семян приходится на середину периода прорастания. В этой связи определяли энергию прорастания (7-й день) и количество проростков на 30-й день от момента посева семян. Также оценивали длину главного зародышевого корешка и самый длинный лист 30-дневных проростков.
Материалом для биохимических и молекулярных исследований служили листья и корешки 30-дневных проростков. Все спектрофотометрические измерения были проведены на приборе UV-2600 (“Shimadzu”, Япония). Определение суммарного содержания низкомолекулярных антиоксидантов (НМАО) проводили по методике [10], основанной на окислении антиоксидантов хлоридом железа (III). При этом хлорид железа (III) восстанавливался до хлорида железа (II), количество которого измеряли по изменению интенсивности окраски при добавлении о-фенантролина (ε = = 52.8/(мМ см)) при длине волны 510 нм. Интенсивность процессов ПОЛ определяли по накоплению окрашенного комплекса малонового диальдегида (МДА) с тиобарбитуровой кислотой (ε = 155/(мМ см)) при длине волны 532 нм [11].
Степень фрагментации ДНК в листьях и корнях проростков определяли с помощью щелочной версии метода ДНК-комет (одноклеточный гель-электрофорез) с некоторыми модификациями [12], позволяющего количественно измерить повреждения ДНК, включая однонитевые, двунитевые разрывы, щелочелабильные сайты (пуриновые и пиримидиновые) и др. [13]. Все операции по выделению изолированных ядер клеток проводили под тусклым желтым светом. Листья и корешки разделяли и помещали в чашке Петри (60 мм) на льду. С помощью острого лезвия бритвы листья и корешки были аккуратно нарезаны. Кончики корешков с апикальной меристемой отсекали. На срезы автоматической пипеткой капельно наносили 250 мкл холодного натрий-фосфатного буфера pH 7.5. Чашки держали наклоненными во льду, таким образом, чтобы высвобождающиеся из клеток ядра концентрировались в буфере. Суспензию (60 мкл) сразу вносили в пробирки с 240 мкл 1%-ного раствора легкоплавкой агарозы и наносили на предварительно покрытые тугоплавкой агарозой предметные стекла. После затвердевания агарозы микропрепараты помещали в щелочной буфер для электрофореза (300 ммоль/л NaOH, 1 ммоль/л ЭДТА, pH > 13) на 20 мин для денатурации ДНК и реализации щелочелабильных сайтов в однонитевые разрывы. Электрофорез проводили в течение 20 мин при напряженности поля 1 В/см и силе тока ~300 мА, после чего препараты промывали натрий-фосфатным буфером (рН 7.5), фиксировали в 70%-ном растворе этанола и высушивали. Непосредственно перед микроскопированием препараты окрашивали флуоресцирующим красителем SYBR Green I (20 мкг/мл) в течение 30 мин. Анализ проводили на флуоресцентном микроскопе (“ЛабМед-2Л”, Россия), при увеличении ×250, используя возбуждающий и отсекающий светофильтры на 490, 530 нм соответственно. Полученные с микропрепаратов изображения “ДНК-комет” анализировали с использованием программного обеспечения “CASP 1.2.2”. В качестве показателя поврежденности ДНК использовали процентное содержание ДНК в хвосте “комет” (% ДНК в хвосте от общего количества ДНК в “комете”). Атипичные ДНК-кометы, характеризующиеся отсутствующей или практически отсутствующей головой и широким диффузным хвостом, выделяли в отдельную категорию и подсчитывали (%) на каждые 100 шт. “ДНК- комет” [14].
Все измерения были выполнены в четырех повторностях. Результаты экспериментов представлены в виде средней арифметической величины и ее стандартной ошибки. Сравнение выборок проводили методом однофакторного дисперсного анализа (ANOVA), значимость отличия от контроля определяли с использованием критерия Даннета для множественного сравнения при уровне значимости p ≤ 0.05. Расчет проводился с помощью пакета AnalystSoft, StatPlus – программа статистического анализа, v.2007.
РЕЗУЛЬТАТЫ
Всхожесть семян. Изучение радиочувствительности дикорастущих растений сопряжено с некоторыми трудностями, вызванными, главным образом, особенностями биологии прорастания их семян. К важным показателям всхожести дикорастущих растений относят начало, длительность и характер прорастания [15]. Семена A. оdorum по типу прорастания значительно схожи с семенами A. mongolicum. Последние относят к семенам с медленным появлением всходов и их максимальным количеством в середине периода прорастания, с длительностью от 15–20 (до 44) дней, всхожестью 50–70% (начало приходится на 4–7-й (до 20) день) [16]. В этой связи оценивали энергию прорастания, а также число проростков на 30-й день от момента посева семян, в срок, наиболее полно соответствующий биологии прорастания семян A. оdorum.
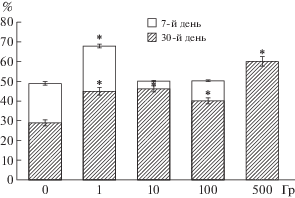
Анализ полученных данных по энергии прорастания семян A. оdorum показал, что все тестируемые дозы облучения привели к статистически достоверному увеличению этого показателя относительно контроля (p ≤ 0.05), т.е. наблюдался стимулирующий эффект облучения (рис. 1). Минимальная доза (1 Гр) вызывала увеличение в 1.5 раза числа проросших семян, максимальная (500 Гр) приводила к повышению в 2.0 раза данного показателя относительно контроля (p ≤ 0.05). К 30 дням стимуляционный характер воздействия γ-излучения сохранялся только в варианте 1 Гр, тогда как варианты 10 и 100 Гр статистически достоверно не отличались от контроля. В варианте 500 Гр не было отмечено дополнительно проросших семян A. оdorum.
Рис. 1.
Энергия прорастания и всхожесть семян Allium odorum в зависимости от воздействия дозы облучения. * Cтатистически значимые отличия от контроля при р ≤ 0.05 (ANOVA, t-тест Даннета).
Fig. 1. Germination energy and germination of Allium odorum seeds, depending on the exposure to radiation dose.
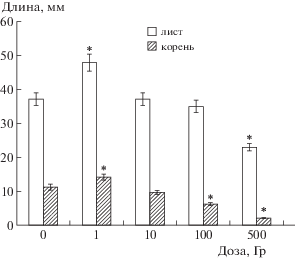
Длина листьев и корня. К числу важных критериев оценки воздействия стрессирующих факторов на растения, наряду с физиологическими реакциями, также относят анализ ростовых процессов как чувствительный параметр индивидуальной ответной реакции растительных организмов [17]. Длина листьев 30-дневных проростков в контроле составляла 37 ± 3 мм (рис. 2). Облучение семян 1 Гр вызывало статистически значимое увеличение этого показателя в 1.3 раза (p ≤ 0.05). Дозы 10 и 100 Гр не оказывали такого эффекта, длина листьев не отличалась от необлученного варианта. Облучение семян в дозе 500 Гр приводило к достоверному снижению длины листьев в 1.6 раза относительно контроля (p ≤ 0.05) и составляло 23 ± 2 мм. Изменение длины корня проростков в зависимости от дозы облучения имело несколько иной характер. С увеличением дозы облучения семян A. оdorum, длина корней 30-дневных проростков снижалась. Угнетение корня было отмечено в варианте 10 Гр, а при 100 Гр длина корня была в 2.0 раза меньше относительно контроля (p ≤ 0.05). Более высокая доза 500 Гр оказывала сильнейшее ингибирующее воздействие, длина корня составляла 2 ± 0.5 мм против 11 ± 1 мм в контроле.
Рис. 2.
Длина листа и корня у проростков Allium odorum, сформировавшихся из облученных семян. * Cтатистически значимые отличия от контроля при р ≤ 0.05 (ANOVA, t-тест Даннета).
Fig. 2. The length of the leaf and root of Allium odorum seedlings formed from irradiated seeds.
Перекисное окисление липидов (ПОЛ) и низкомолекулярные антиоксиданты (НМАО). Исследовано накопление МДА как конечного продукта деградации жирных кислот биологических мембран, образующегося в результате воздействия АФК. МДА является маркером ПОЛ и оксидативного стресса. К числу низкомолекулярных антиоксидантов относят различные по структуре соединения, способные инактивировать свободнорадикальные процессы [5]. В тканях листьев с увеличением дозы облучения наблюдалось снижение уровня МДА на 19–31% по сравнению с контролем (p ≤ 0.05; таблица 1). Процессы ПОЛ в тканях корней также не превышали контрольного уровня. В вариантах с облучением 1 и 100 Гр было отмечено снижение накопления МДА на 33% относительно контроля (p ≤ 0.05). Ввиду незначительной длины корня в варианте 500 Гр измерение данного параметра не представлялось возможным.
Таблица 1.
Биохимические характеристики тканей проростков, сформировавшихся из облученных семян Table 1. Biochemical characteristics of seedling tissues formed from irradiated seeds
| Доза, Гр | НМАО мг-эквкверцетин/гткани | МДА мкмоль/гткани | ||
|---|---|---|---|---|
| лист | корень | лист | корень | |
| 0 | 2.4 ± 0.2 | 2.1 ± 0.2 | 1.6 ± 0.2 | 0.6 ± 0.05 |
| 1 | 1.9 ± 0.2 | 2.2 ± 0.2 | 1.3 ± 0.1 | 0.4 ± 0.03* |
| 10 | 2.3 ± 0.2 | 2.0 ± 0.2 | 1.2 ± 0.1* | 0.6 ± 0.05 |
| 100 | 2.4 ± 0.2 | 1.3 ± 0.1* | 1.2 ± 0.1* | 0.4 ± 0.03* |
| 500 | 1.9 ± 0.1* | – | 1.1 ± 0.1* | – |
Содержание НМАО в тканях проростков в зависимости от дозы облучения достоверно не превышало контрольных значений. В вариантах воздействия 1 и 500 Гр в тканях листьев содержание НМАО уменьшалось в 1.3 раза (p ≤ 0.05), в остальных случаях было сопоставимо с уровнем контроля. В тканях корней проростков снижение в 1.6 раза (p ≤ 0.05) содержания НМАО было отмечено только в варианте 100 Гр.
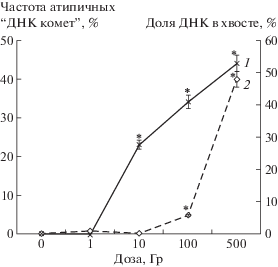
Комет-анализ ДНК. В настоящее время метод ДНК-комет нашел широкое применение в научных исследованиях, связанных с детекцией и оценкой степени повреждений ДНК клеток организмов, включая растения, вызванных различными факторами [18]. Использование в исследовании щелочной версии метода ДНК-комет позволило оценить степень фрагментации (однонитевые, двунитевые разрывы, щелочелабильные сайты и др.) ядерной ДНК в клетках проростках A. оdorum в зависимости от дозы облучения семян. Показано, что однократное острое облучение семян приводило к дозозависимому увеличению степени повреждения ДНК, как в листьях (рис. 3), так и в корешках 30-дневных проростков (рис. 4). В контрольных образцах значение % ДНК в хвосте “кометы” листьев и корешков составляло 0.1%. Доза 1 Гр не вызывала генотоксического эффекта, тогда как воздействие 10 Гр приводило к увеличению % ДНК в хвосте (листья) и появлению значительного числа атипичных ДНК “комет” в листьях (42.9%) и корнях (22.7%) проростков. Зарегистрированные атипичные ДНК “кометы” имели две морфологические формы. Одна из них характеризовалась отсутствующей, или практически отсутствующей головой и широким диффузным хвостом, другая была представлена диффузной головой со свободным пространством в центральной части головы. Воздействие более высоких доз на семена вызывало увеличение ДНК в хвосте кометы в листьях проростков до 20% при 100 Гр, 21.5% при 500 Гр и корнях 6% (100 Гр), 47.9% (500 Гр). Также было отмечено увеличение числа атипичных ДНК “комет” в листьях – 79.3% в варианте 100 Гр и 83.3% при 500 Гр, в корешках – 34.3 и 43.7% соответственно.
Рис. 3.
Уровень повреждений ядерной ДНК в клетках листьев 30-дневных проростков Allium odorum в зависимости от дозы облучения семян. 1 – частота атипичных “ДНК комет”; 2 – доля ДНК в хвосте кометы. * Cтатистически значимые отличия от контроля при р ≤ 0.05 (ANOVA, t-тест Даннета).
Fig. 3. The level of nuclear DNA damage in the leaf cells of 30-day-old Allium odorum seedlings, depending on the seed irradiation dose.]
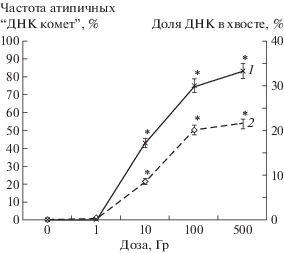
Рис. 4.
Уровень повреждений ядерной ДНК в клетках корней 30-дневных проростков Allium odorum в зависимости от дозы облучения семян. 1 – частота атипичных “ДНК комет”; 2 – доля ДНК в хвосте кометы. * Cтатистически значимые отличия от контроля при р ≤ 0.05 (ANOVA, t-тест Даннета).
Fig. 4. The level of damage to nuclear DNA in the cells of the roots of 30-day-old Allium odorum seedlings, depending on the seed dose.
ОБСУЖДЕНИЕ
Известно, что в ходе набухания семян поступление воды происходит путем диффузии, через мембраны. По достижении 60%-ной влажности в семенах функционирует основной метаболизм: активируются ферменты, повышается интенсивность дыхания, осуществляется мобилизация питательных веществ и др. [5, 19]. Проклевывание семян осуществляется при растяжении клеток зародыша за счет дальнейшей интенсификации поступления воды через аквапорины в осевые органы. Процесс ускорения прорастания семян при воздействии ионизирующего излучения связывают, в том числе, с увеличением скорости поступления воды, способствующей снижению концентрации ингибиторов, изменениями гормональной сети сигнализации в клетках растений, вызывающих перевод зародыша в активное состояние [5, 17]. Так, авторами [20] показано, что у облученных в диапазоне 25–200 Гр семян риса во время набухания (в период 0–8 ч) увеличивалось поступление воды в семена, а при 100 и 200 Гр было выше контрольного до 36 ч. Также отмечено усиление прорастания семян при этих тестируемых дозах по сравнению с необлученными семенами. Это согласуется с полученными нами данными по энергии прорастания семян A. оdorum, облученных в диапазоне 1–500 Гр. Особенно важно отметить стимулирующий эффект 500 Гр, который может быть обусловлен высокой скоростью поступления воды в семена и осевые органы зародышей, что вызывало быстрые темпы проклевывания семян и соответственно повышение энергии прорастания, несвойственное для этого вида.
К числу основных критериев оценки стимулирующих эффектов также относят темпы роста растений, обусловленные ускорением развития корня и побега в первые дни с момента прорастания семян и характеризующиеся относительным приростом этих показателей [17]. Полученные нами данные свидетельствуют о том, что рост корня и листьев стимулировался лишь при воздействии на семена дозой 1 Гр, при более высоких дозах наблюдается ингибирование ростовых процессов. Вместе с тем длина корешка являлась более радиочувствительным параметром. Дозозависимое снижение длины корешка наблюдалось в диапазоне 10–500 Гр, а достоверное снижение длины листа лишь при 500 Гр. В работе [21] на семенах ячменя было показано, что при облучении в стимулирующих дозах увеличение размеров корня и ростка происходит за счет увеличения темпов развития, а не более раннего прорастания.
К эффектам, часто наблюдаемым в ответ на воздействие облучения в низких или высоких дозах, наряду с усилением или ингибированием прорастания семян и роста проростков, также относят антиоксидантные реакции и накопление повреждений ДНК [22–24].
Определение уровня перекисного окисления липидов (полиненасыщенных жирных кислот) является одним из важных критериев оценки пост-радиационных эффектов. Дозозависимое накопление продукта ПОЛ в проростках сои было показано при воздействии облучения на семена в дозах 100, 120, 140 и 200 Гр [25]. Наибольшее увеличение содержания МДА в тканях растений регистрировалось при высоких дозах ионизирующей радиации, используемых в экспериментах [25, 26]. Вместе с тем имеются сведения о более низком содержании H2O2 и МДА в тканях облученных растений, чем в необлученном контроле [27, 28]. Схожие результаты были получены в нашем исследовании – показан относительно низкий, по сравнению с контролем, уровень ПОЛ в листьях 30-дневных проростков A. оdorum, сформировавшихся из семян, облученных при 10, 100, 500 Гр и в корешках при 100 Гр, что не исключает возможности интенсификации процессов ПОЛ на более ранних сроках. Вероятно, низкие значения МДА могут быть обусловлены повышенной активностью ферментативных (не исследовались в данной работе) антиоксидантных систем. Значительное снижение содержания НМАО нами отмечено в корнях при 100 Гр, а в листьях при 500 Гр.
Ингибирование роста, индуцированное высокими дозами облучения, связывают с нарушениями клеточного цикла при соматическом делении клеток и/или различными повреждениями во всем геноме [29]. Анализ ДНК комет показал увеличение повреждений ДНК в листьях и корнях проростков в зависимости от дозы облучения семян A. оdorum, за исключением варианта воздействия 1 Гр, которое не оказывало генотоксического эффекта. Схожие результаты были получены в исследованиях на 4-недельных проростках Zoysia japonica [26], при облучении семян в дозах 100, 200 и 400 Гр. Авторы этого исследования прослеживали генотоксические эффекты в корешках проростков, начиная со 100 Гр, а в варианте 400 Гр % ДНК в хвосте был в 5.5 раз выше, чем в контроле. При этом достоверное увеличение МДА в образце 400 Гр не превышало 50% от необлученного варианта. Полученные результаты в нашем исследовании и в работе [26] позволяют предположить, что радиоиндуцируемые высокие уровни генотоксического эффекта при низком уровне ПОЛ (зафиксированные на 4–5-й неделе от начала прорастания) являлись результатом прямого и косвенного действия ионизирующей радиации на молекулы ДНК и, по-видимому, на фоне подавления репарационных процессов, приводили к накоплению повреждений.
Следует отметить, что в листьях проростков показатели уровня повреждений ДНК были значительно выше, чем в корешках. Поскольку в эксперименте для оценки уровня повреждений ДНК использовалась щелочная версия “комет”, которая позволяет суммарно регистрировать одно- и двухцепочечные разрывы, а также щелочелабильные сайты, уточнение характера повреждений в ДНК клеток листьев требует дальнейших исследований.
Полученные результаты по воздействию на семена A. оdorum максимальной дозы, используемой в эксперименте (500 Гр), согласуются с представлениями о том, что если дозы слишком высоки и реализация регенерационных процессов подавляется, а в клетках и тканях растений способны протекать метаболические процессы и многие физиологические функции, то проявляется эффект метаболической выживаемости [4].
Таким образом, воздействие острого γ-излучения в диапазоне доз 1–500 Гр на семена A. оdorum оказало значительный стимулирующий эффект на начальном сроке прорастания семян. Причем облучение высокой дозой (500 Гр) вызвало повышение энергии прорастания, несвойственное данному виду. К 30 дням стимулирующий эффект всхожести был отмечен только у семян, облученных в дозе 1 Гр. Облучение семян в этой дозе не вызывало повреждений ядерной ДНК в тканях листьев и корней проростков и оказывало положительный эффект на их рост. С увеличением дозы облучения в диапазоне 10–500 Гр отмечалось дозозависимое увеличение степени повреждений ядерной ДНК, как в листьях, так и в корнях проростков, относительно контроля. По-видимому, более высокое количество атипичных ДНК комет, отмеченное в клетках листьев, обусловлено различным характером повреждений ДНК в листьях и корнях проростков A. оdorum. Незначительное ингибирующее действие на рост корней наблюдалось у проростков, выросших из семян, облученных в дозе 10 Гр и значительно усугублялось при более высоких дозах, что также отражалось в низком содержании низкомолекулярных антиоксидантов в клетках корней (100 Гр). Отставание в росте листьев отмечалось при 500 Гр и сопровождалось низким уровнем ПОЛ в клетках относительно контроля. Полученные результаты свидетельствуют о том, что при определении радиочувствительности дикорастущих растений необходимо учитывать биологию прорастания семян исследуемых видов. Наряду с ростовыми процессами, достаточно информативными для прогнозирования радиочувствительности, могут также являться показатели стабильности структуры ядерной ДНК, изучение специфики и характера повреждений которой, несомненно, требует дальнейших исследований.
Список литературы
Гродзинский Д.Н., Коломиец К.Д., Гудков И.Н. и др. Формирование радиобиологической реакции растений. Киев: Наука, 1984. 216 с. [Grodzinskij D.N., Kolomiec K.D., Gudkov I.N. i dr. Formirovanie radiobiologicheskoj reakcii rastenij. Kiev: Nauka, 1984. 216 s. (In Russian)
Kim J.-S., Lee E.-K., Back M.-H., Kim D.-H., Lee Y.-B. Influence of low dose g radiation on the physiology of germinative seed of vegetable crops // Korean J. Environ. Agric. 2000. V. 19. P. 58–61.
Wi S.G., Chung B.Y., Kim J.-H. et al. Ultrastructural changes of cell organelles in Arabidopsis stem after gamma irradiation // J. Plant Biol. 2005. V. 48. №2. P. 195–200.
Храмченкова О.М. Основы радиобиологии. Гомель: УО “ГГУ им. Ф. Скорины”, 2003. 238 с. [Hramchenkova O.M. Osnovy radiobiologii. Gomel’: UO “GGU im. F. Skoriny”, 2003. 238 s. (In Russian)]
Bailly C. Active oxygen species and antioxidants in seed biology // Seed Sci. Res. 2004. V. 14. P. 93–107.
Корогодин В.И. Восстановление клеток от повреждений. М.: Знание, 1976. [Korogodin V.I. Vosstanovlenie kletok ot povrezhdenij. M.: Znanie, 1976. (In Russian)]
Преображенская Е.И. Радиоустойчивость семян растений. М., 1971. 232 с. [Preobrazhenskaja E.I. Radioustojchivost’ semjan rastenij. M., 1971. 232 s. (In Russian)]
Филиппов Э.В., Троева Е.И. Радиочувствительность семян растений Центральной Якутии к острому гамма-облучению // Растительный мир Азиатской России. 2016. № 3 (23). С. 75–80. [Filippov E.V., Troeva E.I. Radiochuvstvitel’nost’ semjan rastenij Central’noj Jaku-tii k ostromu gamma-oblucheniju // Rastitel’nyj mir Aziatskoj Rossii. 2016. № 3 (23). S. 75–80. (In Russian)]
Антонова Е.В., Каримуллина Э.М., Позолотина В.Н. Внутривидовая изменчивость дремы белой в градиенте радионуклидного загрязнения ВУРСа // Экология. 2013. № 1. С. 20–29. [Antonova E.V., Karimullina Je.M., Pozolotina V.N. Vnutrividovaja izmenchivost' dremy beloj v gradiente radionuklidnogo zagrjaznenija VURSa // Jekologija. 2013. № 1. S. 20–29. (In Russian)]
Ермаков А.И. Методы биохимического исследования растений. Л.: Агропромиздат, 1987. 430 с. [Ermakov A.I. Metody biohimicheskogo issledovanija rastenij. Leningrad: Agropromizdat, 1987. 430 s. (In Russian)]
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. 252 с. [Vladimirov Ju.A., Archakov A.I. Perekisnoe okislenie lipidov v biologicheskih membranah. M.: Nauka, 1972. 252 s. (In Russian)]
Gichner T., Patkova Z., Szakova J., Demnerova K. Cadmium induces DNA damage in tobacco roots, but no DNA damage, somatic mutations or homologous recombination in tobacco leaves // Mutat. Res. 2004. V. 559. P. 49–57.
Tice R.R., Agurell E., Anderson D. et al. Single cell gel/Comet assay: guidelines for in vitro and in vivo genetic toxicology testing // Environ. Mol. Mutag. 2000. V. 35. P. 206–221.
Жанатаев А.К., Никитина В.А., Воронина Е.С., Дурнев А. Д. Методические аспекты оценки ДНК-повреждений методом ДНК-комет // Прикл. токсикология. 2011. Т. 2. № 4. С. 28–37. [Zhanataev A.K., Nikitina V.A., Voronina E.S., Durnev A. D. Metodicheskie aspekty ocenki DNK-povrezhdenij metodom DNK-komet // Prikladnaja toksikologija. 2011. Т. 2. № 4. S. 28–37. (In Russian)]
Вихирева-Василькова В.В. О прорастании семян некоторых арктических растений // Ботан. журн. 1958. Т. 43. № 7. С. 1024–1029. [Vihireva-Vasil’kova V.V. O prorastanii semjan nekotoryh arkticheskih rastenij // Botanicheskij zhurnal. 1958. Т. 43. № 7. S. 1024–1029. (In Russian)]
Борисова И.В. Типы прорастания семян степных и пустынных растений // Ботан. журн. 1996. Т. 81. № 12. С. 9–22. [Borisova I.V. Tipy prorastanija semjan stepnyh i pustynnyh rastenij // Botanicheskij zhurnal. 1996. Т. 81. № 12. S. 9–22. (In Russian)]
Чурюкин Р.С., Гераськин С.А. Влияние облучения (60Co) семян ячменя на развитие растений на ранних этапах онтогенеза // Радиация и риск. 2013. Т. 22. №3. С. 80–92. [Churjukin R.S., Geras’kin S.A. Vlijanie obluchenija (60Co) semjan jachmenja na razvitie rastenij na rannih jetapah ontogeneza // Radiacija i risk. 2013. Т. 22. №3. S. 80–92. (In Russian)]
Филиппов Э.В. Использование метода “ДНК-комет” для детекции и оценки степени повреждений ДНК клеток организмов растений, животных и человека, вызванных факторами окружающей среды (обзор) // Наука и образование. 2014. № 2 (74). С. 72–78. [Filippov E.V. Ispol’zovanie metoda “DNK-komet” dlja detekcii i ocenki stepeni povrezhdenij DNK kletok organizmov rastenij, zhivotnyh i cheloveka, vyzvannyh fakto-rami okruzhajushhej sredy (obzor) // Nauka i obrazovanie. 2014. № 2 (74). S. 72–78. (In Russian)]
Обручева Н.В., Синькевич И.А., Литягина С.В., Новикова Г.В. Особенности водного режима при прорастании семян // Физиол. растений. 2017. Т. 64. № 4. С. 311–320. [Obrucheva N.V., Sin’kevich I.A., Litjagina S.V., Novikova G.V. Osobennosti vodnogo rezhima pri prorastanii semjan // Fiziologija rastenij. 2017. Т. 64. №4. S. 311–320. (In Russian)]
Macovei, A., Garg, B., Raikwar, S. et al. Synergistic exposure of rice seeds to different doses of γ-ray and salinity stress resulted in increased antioxidant enzyme activities and genespecific modulation of TC-NER pathway // Biomed. Res. 2014. Int. 2014:676934.
Гераськин С.А., Чурюкин Р.С., Казакова Е.А. Модификация развития ячменя на ранних этапах онтогенеза при воздействии γ-излучения на семена // Радиац. биология. Радиоэкология. 2015. Т. 55. № 6. С. 607–615. [Geras’kin S.A., Churjukin R.S., Kazakova E.A. Modifikacija razvitija jachmenja na rannih jetapah ontogeneza pri vozdejstvii γ-izluchenija na semena // Radiacionnaja biologija. Radiojekologija. 2015. Т. 55. № 6. S. 607–615. (In Russian)]
Song J. Y., Kim D.S., Lee M-C et al. Physiological cha-racterization of gamma-ray induced salt tolerant rice mutants // Austral. J. Crop. Sci. 2012. V. 6. № 3. P. 421–429.
Wi S.G., Chung B.Y., Kim J. et al. Effects of gamma irradiation on morphological changes and biological responses in plants // Micron. 2007. V. 38. №6. P. 553–564.
Kovacs E., Keresztes A. Effect of gamma and UV-B/C radiation on plant cells// Micron. 2002. V. 33. №2. P. 199–210.
Stajner D., Popovic B. M., Taski K. Effects of γ-irradiation on antioxidant activity in soybean seeds // Central Eur. J. Biol. 2009. V. 4. №3. P. 381–386.
Lee H.-J., Kim Y.-S., Jo Y. D. et al. Oxidative stress and DNA damage induced by gamma irradiation in Korean lawngrass (Zoysia japonica Steud.) // Eur. J. Horticultural Sci. 2016. V. 81. №6. P. 303–309.
Seung Gon Wi, Byung Yeoup Chung, Jae-Sung Kim et al. Effects of gamma irradiation on morphological changes and biological responses in plants // Micron. 2007. V. 38. P. 553–564.
Hammed A., Shah T.M., Atta B.M. et al.Gamma irradiation effects on seed germination and growth, protein content, peroxidase and protease activity, lipid peroxidation in Desi and Kabuli chickpea // Pakistan J. Bo-tany. 2008. V. 40. P. 1033–1041.
Preussa S.B., Britta A.B. A DNA-damage-induced cell cycle checkpoing in Arabidopsis // Genetics. 2003. V. 164. P. 323–334.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


