Радиационная биология. Радиоэкология, 2019, T. 59, № 5, стр. 503-515
Разработка рекомбинантных плазмидных днк, кодирующих кроветворные ростовые факторы SCF, G-CSF и FLT-3L и исследование их влияния на гематологические показатели мышей
О. А. Власова 1, *, И. С. Кравцов 1, И. В. Багнаев 1, Э. А. Ковшарь 1, А. А. Круглова 1, А. С. Никифоров 2, А. М. Свентицкая 2
1 Научный центр “Сигнал”
Москва, Россия
2 Государственный научно-исследовательский испытательный институт военной медицины МО РФ
Санкт-Петербург, Россия
* E-mail: chuvashenok@yandex.ru
Поступила в редакцию 20.02.2019
Аннотация
Поиск лекарственных средств, эффективных при костномозговой форме острой лучевой болезни, а также для профилактики осложнений химиолучевой терапии онкобольных, является одной из важных проблем радиационной биологии и медицины. В данной работе исследована перспективность генно-терапевтического подхода для стимуляции созревания и выхода лейкоцитарных клеток в кровоток. Получены три рекомбинантные плазмидные ДНК (пДНК), кодирующие кроветворные ростовые факторы мыши – SCF, G-CSF и FLT-3L. В экспериментах in vitro показана их экспрессия на уровне 5.2, 2.2 и 8.2 мкг с эффективностью секреции – 75.6, 99.1 и 88.7% соответственно. Однократное введение аутбредным белым мышам комбинации из трех пДНК в сочетании с электропорацией обеспечило статистически достоверное по отношению к значениям контрольной группы увеличение, с максимумом на 7-е сутки, общего количества лейкоцитов в 2.6 раза (до 22.2 × 109/л), гранулоцитов в 4.5 раза (до 16.5 × 109/л) и моноцитов в 2.8 раза (до 2.3 × 109/л). Исследована кинетика экспрессии генов трех цитокинов in vivo. Статистически значимый подъем уровня цитокинов в крови мышей отмечался в интервале от 6 ч до 3 сут после однократного введения пДНК и сохранялся в течение 14 дней. Полученные результаты подтверждают перспективность генно-терапевтического подхода для стимуляции системы кроветворения, что может быть востребовано для лечения острой лучевой болезни и мобилизации гемопоэтических стволовых клеток для пациентов, которым назначена высокодозная химиолучевая терапия с трансплантацией аутологичных гемопоэтических клеток.
Известно, что гемопоэтические стволовые клетки (ГСК) и клетки-предшественники являются основной мишенью при радиационном поражении. В результате радиационного воздействия в костном мозге убывает число как низкодифференцированных, так и более зрелых клеток, снижается функциональный резерв и жизнеспособность зрелых элементов крови, что клинически проявляется в виде цитопении (чаще – гранулоцитопении). Возникает иммунодефицит, на фоне которого стремительно развиваются инфекционные процессы, нередко приводящие к летальному исходу [1].
Поиск лекарственных средств, эффективных при лечении радиационных поражений, а также при профилактике осложнений химиолучевой терапии, остается одной из важных проблем радиационной биологии и медицины.
Терапевтические мероприятия, начатые в ранние сроки после облучения, могут обеспечить благоприятный исход радиационного поражения [2]. В настоящее время в качестве средств ранней терапии радиационных поражений наиболее интенсивно изучаются цитокины, посредством которых осуществляется скоординированное взаимодействие различных клеток гемопоэтической системы [3–5]. В отечественной радиобиологии реализацией направления по экстренной терапии лучевых поражений стал рекомбинантный интерлейкин-1 бета (препарат “Беталейкин”), обладающий лечебно-профилактическим действием [6–8]. На сегодняшний день в России “Беталейкин” является единственным цитокином, рекомендованным к применению после острого радиационного воздействия.
Западные исследователи отдают предпочтение гемопоэтическим ростовым факторам, в частности, колониестимулирующим (colony-stimulating factor, CSF) – гранулоцитарному (granulocyte-colony stimulating factor, G-CSF) и гранулоцитарно-макрафагальному (granulocyte-macrophage colony-stimulating factor, GM-CSF). В настоящее время CSF официально включены в рекомендации по лечению пациентов, подвергшихся высоким дозам радиационного облучения [9]. Применение CSF также предусмотрено для первичной и вторичной профилактики фебрильной нейтропении после миелотоксичной химиолучевой терапии, мобилизации ГСК и в ряде других особых клинических ситуаций с целью коррекции миелосупрессии и гранулоцитопоэза [10, 11]. В ряде работ на экспериментальных моделях продемонстрировано, что цитокиновая терапия позволяет значительно повысить выживаемость животных при летальных дозах облучения. Подкожное курсовое введение рекомбинантного G-CSF макакам-резусам в дозе 10 мкг/кг в течение 7–10 дней с первого дня после облучения в дозах 10 и 11 Гр повышает выживаемость животных и в 2–3 раза сокращает период острой нейтропении [12–14]. В работе A.M. Farese и соавт. показано повышение выживаемости макаков-резусов на 38% после тотального облучения в дозе 7.5 Гр на фоне ежедневных инъекций G-CSF в дозе 10 мкг/кг в течение 16 дней начиная через 24 ч после облучения [15]. Аналогичные эффекты были продемонстрированы на мышах, собаках и обезьянах, которым фактор стволовых клеток (stem cell factor, SCF) вводили в дозах по 200 мкг/кг курсом 11–14 дней [16–19]. Упоминаются также и другие цитокины, перспективные для восстановления гемопоэтической функции костного мозга при острых лучевых поражениях и химио- и/или радиотерапии. Это различные интерлейкины: IL-3, -7, -12 и -6, fms-подобный лиганд тирозинкиназы-3 (fms-like tyrosine kinase-3 ligand, FLT-3L), эритропоэтин (EPO) и др. [4, 20–24].
Во многих исследованиях показано, что сочетанное применение нескольких ростовых факторов способствует развитию более выраженного эффекта, позволяет снизить дозировки и уменьшить побочные эффекты каждого, а также сократить количество введений [4]. Например, 5-дневное введение приматам смеси цитокинов SCF и G-CSF либо FLT-3L и G-CSF столь же эффективно для мобилизации ГСК, как и более длительные режимы назначения этих цитокинов отдельно [25]. В ряде работ на разных экспериментальных моделях показано, что использование одного SCF оказывает выраженный стимулирующий эффект на мобилизацию костномозговых прогениторных клеток, тогда как применительно к человеку этот эффект не наблюдается. Однако комбинированное применение SCF с линиеспецифичными факторами (G-CSF, GM-CSF, M-CSF, IL-3, EPO или тромбопоэтин) дает эффект, превышающий эффективность монотерапии [26]. Например, применение G-CSF совместно с SCF позволяет снизить действующую дозу фактора стволовых клеток в 4 раза, улучшить его переносимость и в 2 раза повысить эффект в сравнении с вариантами монотерапии [27, 28]. Аналогичного результата можно добиться и при других сочетаниях цитокинов, например, GM-CSF/IL-3, FLT-3L/SCF, SCF/FLT-3L/IL11 или SCF/FLT-3L/THPO, EPO/SCF или EPO/IL-3, что указывает на плейо-тропность и синергизм действия многих ростовых факторов [30–33].
Тем не менее при всех своих достоинствах рекомбинантные цитокины имеют ряд недостатков, связанных, в первую очередь, с высокой стоимостью их препаратов, необходимостью курсового приема, наличием серьезных побочных эффектов от введения больших доз, риском развития аутоиммунных осложнений, а также нестабильностью при хранении и транспортировке. Одним из вариантов решения обозначенных проблем может стать создание генно-терапевтических препаратов, кодирующих клинически значимые цитокины. Важнейшим преимуществом препаратов генной терапии по сравнению с рекомбинантными белками является физиологичность действия, заключающаяся в быстром достижении стационарного уровня циркулирующего белка, который поддерживается относительно длительное время (недели, иногда месяцы и годы), тогда как введение рекомбинантных белков приводит сначала к резкому росту концентрации и достижению максимального значения, которое может вызывать выраженные осложнения, а затем быстрому снижению до субтерапевтических уровней [34, 35]. Кроме того, структура эндогенно экспрессируемых белков максимально соответствует их нативной конформации, что повышает их иммунологическую безопасность. Препараты генной инженерии характеризует также меньшая стоимость в пересчете на курс лечения и отсутствие необходимости ежедневных введений за счет длительной экспрессии терапевтических генов [36].
На основании анализа данных литературы в рамках изложенного подхода для клонирования в экспрессионный вектор были выбраны гены клинически значимых цитокинов, обладающих взаимно усиливающим действием – SCF, G-CSF и FLT-3L [37–40]. У всех этих трех цитокинов есть одна общая точка приложения – стимуляция пролиферации стволовых клеток костного мозга и образование полипотентных гемопоэтических колоний. При этом SCF отвечает за самообновление и экспансию пула полипотентных клеток, FLT-3L, в дополнение к этому, стимулирует их дифференцировку в лимфоидный предшественник, а G-CSF обеспечивает дифференциацию всего миеломоноцитарного звена до стадии зрелых нейтрофильных гранулоцитов [4]. Таким образом, рассматриваемая комбинация цитокинов способствует самообновлению пула ГСК, поддержанию звеньев врожденного и адаптивного иммунитета.
Цель настоящей работы – конструирование рекомбинантных плазмидных ДНК, содержащих гены scf, gcsf и flt3l, оценка их экспрессионных свойств in vitro и in vivo, а также исследование влияния разработанных пДНК на показатели периферической крови здоровых животных in vivo.
МАТЕРИАЛЫ И МЕТОДИКА
С помощью ПЦР на матрице кДНК соответствующих библиотек тканей мыши (“Clontech”, США) были синтезированы генетические эквиваленты мышиных ростовых факторов SCF, G-CSF и FLT-3L. Генетические эквиваленты клонировали рестрикционным методом в экспрессионный коммерческий вектор pC1neo (“Promega”, США) по сайтам рестрикции NheI и NotI, с получением, соответственно, плазмид pC1neo-mSCF, pC1neo-mGCSF и pC1neo-mFLT3L. Соответстсвующие сайты рестрикции вводили на этапе амплификации генов с помощью специфических праймеров (табл. 1).
Таблица 1.
Последовательность праймеров, использованных для получения генетических эквивалентов scf, gcsf и flt3l Table 1. The sequence of primers used to obtain the genetic equivalents of scf, gcsf and flt3l
| Название праймера | Нуклеотидная последовательность, 5'-3' | Температура отжига, °С |
|---|---|---|
| mSCF-NheI-F | CCTACGT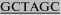 CGCCACCATGAAGAAGACACA CGCCACCATGAAGAAGACACAAACTTGGATTAT |
61 |
| mSCF-NotI-R | GAGATCG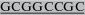 TCATTAGGCTGCAACAGGG TCATTAGGCTGCAACAGGGGGTAACATAA |
61 |
| mGCSF-NheI-F | AGCATTA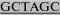 CGCCACCATGGCCCAGCTGAG CGCCACCATGGCCCAGCTGAGCGCCCAGAGGA |
69 |
| mGCSF-NotI-R | TATGTGCT TTATCATGCGAGGTGGTG TTATCATGCGAGGTGGTGAAGTGCCAGTCGGGCGGTCTCAAG |
69 |
| mFLT3L-NheI-F | CCTACGT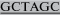 CGCCACCATGACAGTGCTGGC CGCCACCATGACAGTGCTGGCGCCAGCCTGGAGCCCAAATT |
70 |
| mFLT3L-NotI-R | GAGATCG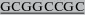 TCATTACTGCCTGGGCCGA TCATTACTGCCTGGGCCGAGGCTCTGGGAGCTCCGTGGCTTCTA |
70 |
Далее полученными пДНК проводили хлоркальциевую трансформацию компетентных клеток E. coli штамма JM109. Селекцию трансформантов вели на среде, содержащей ампициллин в концентрации 100 мкг/мл. Выделение и очистку пДНК выполняли в соответствии с протоколом “Maxi-Prep” с использованием реагентов производства “Qiagen” (Германия).
Проверку чистоты и размеров пДНК проводили методом электрофореза в 0,8%-агарозном геле с последующей оценкой результатов в УФ-трансиллюминаторе, используя размерный стандарт суперспирализованной плазмидной ДНК (“NEB”, Великобритания). Правильность нуклеотидной последовательности клонированных генов проверяли методом секвенирования по Сэнгеру на автоматическом анализаторе AB3500 (“Applied Biosystems”, США) с использованием BrightDye Terminator Cycle Sequencing kit (“Applied Biosystems”, США) и последующей очисткой продуктов сиквенсовой ПЦР с помощью набора DyeEx Spin Kit (“Qiagen”, Германия).
Оценку экспрессионных свойств полученных пДНК in vitro проводили путем трансфекции клеток HEK293T/17. Для этого клетки были засеяны в 6-луночный планшет в количестве 2 × 105 клеток на лунку. Трансфекцию проводили с использованием линейного полиэтиленимина с молекулярной массой 25 кДа (L-PEI25, “Alfa Aesar”, США) согласно протоколу производителя при массовом соотношении пДНК к L-PEI25 – 1 к 3.
РНК для проведения количественного анализа экспрессии целевых генов выделяли из клеток с использованием реагента ExtractRNA (“Евроген”, Россия). Затем ее обрабатывали ДНКазой, свободной от РНКазной активности (“Qiagen”, Германия) и использовали для постановки ОТ-ПЦР по протоколу High Capacity cDNA Reverse Transcription Kit (“Applied Biosystems”, США). Уровень экспрессии определяли методом относительной количественной ПЦР-РВ (∆∆Ct) с использованием специфических праймеров, флуоресцентного красителя SYBR Green I и реакционной смеси qPERmix-HS (“Евроген”, Россия). Нормировку осуществляли по гену глицеральдегидфосфатдегидрогеназы (gapdh) [41, 42]. Последовательность праймеров приведена в табл. 2.
Таблица 2.
Последовательность праймеров, использованных для количественной ПЦР-РВ Table 2. The sequence of primers used for quantitative RT-PCR
| Название праймера | Нуклеотидная последовательность, 5'-3' | Температура отжига, °С |
|---|---|---|
| mSCF-Fq | GAATCTCCGAAGAGGCCAGAA | 53 |
| mSCF-Rq | GCTGCAACAGGGGGTAACAT | 53 |
| mGCSF-Fq | CTGAGCGCCCAGAGGAGGATGA | 59 |
| mGCSF-Rq | AAGAAGCTCCTTGGCAAGGGAA | 59 |
| mFLT3L-Fq | TGTGGCAGGGTCTAAGATGC | 57 |
| mFLT3L-Rq | CTTCTAGGGCTATGGGACTCC | 57 |
| GAPDH-Fq | TGCCTCCTGCACCACCAACTG | 58 |
| GAPDH-Rq | AGGTCCACCACCCTGTTGCTGTA | 58 |
Определение количественного содержания цитокинов SCF, G-CSF и FLT-3L в образцах культуральной среды и лизатов клеток проводили методом ELISA (enzyme-linked immunosorbent assay) согласно протоколам производителя соответствующих коммерческих наборов (“Sigma-Aldrich”, США) через 3 дня после трансфекции.
Для оценки экспрессионных свойств in vivo и исследования фармакологической активности разработанных пДНК использовали белых аутбредных мышей-самцов массой 20–22 г. Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище. Исследования проводили в соответствии с принципами биоэтики и согласно требованиям нормативно-правовых документов о порядке проведения исследовательских работ с применением животных [43, 44].
Эффективность экспрессии репортерного гена luc после в/м введения плазмиды pGL4.51[luc2/CMV/Neo] (“Promega”, США) с электропорацией и без электропорации, а также ее введения методом гидродинамического удара оценивали методом прижизненной визуализации на приборе IVIS SpectrumCT (“PerkinElmer”, США). Наркотизацию мышей проводили изофлураном. Измерение люминесценции проводили через 10 мин после внутрибрюшинного введения субстрата D-люциферина в дозе 150 мг/кг. Эффективность экспрессии оценивали по среднему значению интенсивности люминесценции (ф/с) в области, охватывающей сигнал с интенсивностью от 85% до 100% от максимального в этой области (ROI 25%). Доза пДНК при всех способах введения составляла 25 мкг на инъекцию.
При исследовании влияния пДНК на гематологические показатели периферической крови мышей было сформировано пять групп, которым вводили pC1neo-mSCF (S), pC1neo-mGCSF (G), pC1neo-mFLT3L (F), смесь трех пДНК (SGF) в соотношении 1:1:1 по массе или плазмиду pC1neo, лишенной вставки терапевтического гена (контрольная группа).
Плазмидную ДНК вводили однократно в/м в оба бедра в суммарной дозе 2.5 мг/кг, объеме не более 100 мкл на инъекцию. Использовали комплекс пДНК с 0.05%-ным раствором Pluronic PE6400 в фосфатно-солевом буферном растворе. Электропорацию проводили сразу после инъекции плазмидного препарата в режиме: 150 В/см, 20 мс, 8 имп, 1 Гц (“BTX ECM830”).
Основные показатели периферической крови оценивали при помощи автоматического гематологического анализатора Exigo (“Boule Medical”, Швеция).
Кинетику экспрессии цитокинов исследовали в отдельном эксперименте, в котором животным вводили смесь SGF. Контрольной группе животных вводили плазмиду pC1neo, лишенную вставки терапевтического гена. Концентрацию ростовых факторов SCF, G-CSF и FLT-3L в сыворотке крови определяли методом ELISA согласно протоколам производителя соответствующих коммерческих наборов (“Sigma-Aldrich”, США) через 6, 17 и 24 ч, а также на 3-е, 5-е, 7-е, 9-е, 14-е и 21-е сут после введения пДНК. Определяли такие кинетические параметры, как максимальная концентрация в крови (Сmax), время достижения максимальной концентрации (Tmax), площадь под кривой концентрация–время (AUC0–504, AUC0–∞), период полувыведения (T1/2). Полученные данные анализировали в программе Pharsight® Phoenix® 1.3. Нормировку концентрации соответствующего ростового фактора у мышей опытной группы (SGF) проводили вычитанием фоновых показателей мышей контрольной группы.
Статистические расчеты проводили с помощью программного обеспечения Statistica 12 для Windows. Для каждого анализируемого показателя рассчитывали среднее арифметическое и ошибку среднего [23]. Оценку достоверности отклонений полученных результатов от контрольного уровня проводили с использованием U-критерия Манна–Уитни. Статистически значимыми считали отличия при p < 0.05.
РЕЗУЛЬТАТЫ
В структурном отношении только G-CSF является секретируемым белком с присущим ему лидерным пептидом, отщепление которого обеспечивает секрецию. SCF и FLT-3L являются мембранными белками, в структуре которых, помимо внеклеточного участка, есть трансмембранный и цитоплазматический домены (рис. 1).
Рис. 1.
Структура ростовых факторов и электрофореграмма продуктов амплификации соответствующих генов. LP – leader peptide, лидерный пептид; ТМ – transmembrane domain, трансмембранный домен; С – cytoplasmic domain, цитоплазматический домен
Fig. 1. Structure of growth factors and electrophoregram of amplification products of the corresponding genes.

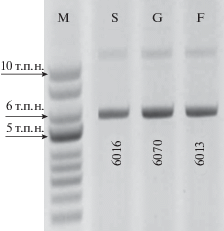
Таким образом, при получении генетических эквивалентов секреторных форм указанных цитокинов праймеры были подобраны так, чтобы амплифицировать исключительно район лидерного пептида и внеклеточной части (табл. 1, рис. 1). Клонированием соответствующих амплификатов были получены все три рекомбинантные пДНК, размеры которых соответствовали расчетным данным (рис. 2). Секвенированием подтверждена идентичность структуры клонированных генов данным GenBank: NM_013598, NM_009971 и NM_01352 для мышиных scf, gcsf и flt3l соответственно.
Рис. 2.
Электрофореграмма плазмидных ДНК, кодирующих секреторные формы гемопоэтических факторов. т.п.н. – тысяч пар нуклеотидов; М – маркер суперспирализованной ДНК (NEB); S – плазмида pC1neo-mSCF, 6016 п.н.; G – pC1neo-mGCSF, 6070 п.н; F – pC1neo-mFLT3L, 6013 п.н.
Fig. 2. Electrophoregram of plasmid DNAs encoding secretory forms of hematopoietic factors. kbp – kilo base pairs, M – marker of supercoiled DNA (NEB); S – plasmid pC1neo-mSCF, 6016 bp; G – pC1neo-mGCSF, 6070 bp; F – pC1neo-mFLT3L, 6013 bp.
Функциональная активность полученных плазмид была проверена при трансфекции клеток линии HEK293T/17. Оценивали количество синтезируемой в клетках мРНК соответствующих генов, количество ростовых факторов, секретируемых в культуральную жидкость трансфицированных клеток и эффективность секреции. Результаты представлены на рис. 3 и 4.
Рис. 3.
Относительный уровень экспрессии генов scf, gcsf, flt3l в клетках, трансфицированных соответствующими плазмидами, по отношению к контролю.
Fig. 3. The relative level of expression of the scf, gcsf, flt3l genes in cells transfected with the corresponding plasmids, relative to the control.
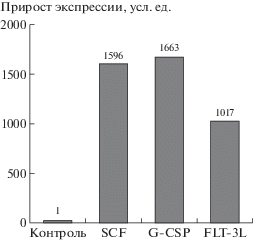
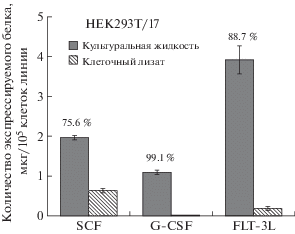
Рис. 4.
Количество рекомбинантных гемопоэтических факторов в образцах культуральной жидкости и лизата трансфицированных клеток.
Fig. 4. The levels of recombinant hematopoietic factors in the culture fluid and lysate samples of transfected cells.
Было показано, что прирост уровня экспрессии генов scf, gcsf, flt3l в клетках, трансфицированных плазмидами, составил соответственно 1596, 1663 и 1017 раз по отношению к клеткам, трансфицированным плазмидой pC1neo, лишенной вставки терапевтического гена (контроль).
Эффективность экспрессии разработанных пДНК подтверждена также наличием в культуральной жидкости белков мышиного происхождения SCF, G-CSF и FLT-3L на уровне 1.96 ± 0.97, 1.09 ± 0.16 и 3.91 ± 0.72 мкг на 100 тыс. трансфицированных клеток соответственно, при этом эффективность их секреции составила 75.6%, 99.1% и 88.7% (рис. 4).
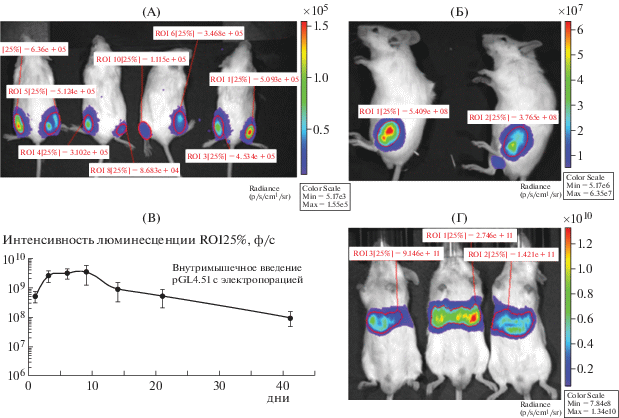
Анализ эффективности электропорационного в/м введения пДНК был проведен при сравнительном исследовании с гидродинамической трансфекцией и в/м введением раствора пДНК pGL4.51[luc2/CMV/Neo]. Используемый протокол электротрансфекции позволил добиться высокой эффективности экспресии репортерного гена luc в мышцах. Через сутки после электротрансфекции экспрессия люциферазы составила (5.0 ± 2.1) × 108 ф/с, что почти в 1000 раз выше, чем при в/м введении без электропорации ((4.6 ± ± 1.2) × 105 ф/с), но при этом в 240 раз ниже, чем при гидродинамической трансфекции печени ((1.2 ± 0.9) × 1011 ф/с), рис. 5, А, Б, Г). Пик экспрессии при применении электропорации приходился на первые 14 сут от момента введения и достигал максимума (3.5 × 109 ф/с) к 9-м сут. К 41-м сут от начала введения экспрессия люциферазы значительно (в 36 раз) снижалась, но при этом полностью не затухала (рис. 5, В).
Рис. 5.
Оценка эффективности внутримышечной электропорации пДНК с помощью прижизненной визуализации экспрессии репортерного гена luc в IVIS SpectrumCT. А – внутримышечное введение 25 мкг плазмиды pGL4.51 в PBS без электропорации; Б – внутримышечное введение 25 мкг плазмиды pGL4.51 в 0.05% PE6400 на PBS c электропорацией; В – кинетика экспрессии репортерного гена luc после электропорационного введения ДНК; Г – гидродинамическое введение 25 мкг плазмиды pGL4.51 в PBS через латеральную хвостовую вену, n = 8.
Fig. 5. Evaluation of the effectiveness of intramuscular electroporation with pDNA using in vivo imaging of luc reporter gene expression in IVIS SpectrumCT. А – intramuscular injection of the plasmid pGL4.51 (25 μg) in PBS without electroporation; Б – intramuscular injection of the plasmid pGL4.51 (25 μg) with 0.05% PE6400 in PBS with electroporation; В – kinetics of luc reporter gene expression after electroporation DNA injection; Г – hydrodynamic introduction of the plasmid pGL4.51 (25 μg) in PBS into the tail vein, n = 8.
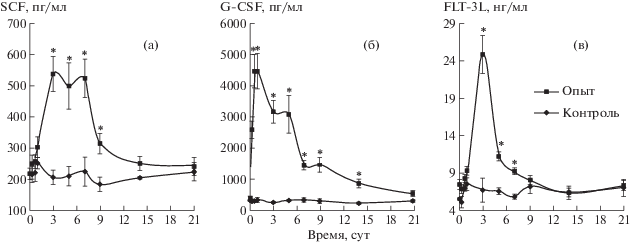
При в/м введении мышам смеси пДНК SGF наблюдали значимый подъем концентрации каждого цитокина в крови. При этом статистически достоверное увеличение концентрации G-CSF наблюдали уже через 6 ч после введения. В этой временной точке регистрировали семикратный прирост концентрации G-CSF по отношению к показателям группы контроля (1035.0 ± 298.8 и 323.2 ± 31.6 пг/мл соответственно). Максимум концентрации G-CSF отмечали через 17 ч после введения, среднее значение которой составляло 4467.0 ± 531.8 пг/мл по сравнению с 291.8 ± ± 42.7 пг/мл в контрольной группе. Статистически значимые отличия от показателей контрольной группы сохранялись до 14-х сут включительно. Снижение концентрации фактора до показателей контрольной группы (513.9 ± 71.1 пг/мл против 299.4 ± 23.3 пг/мл соответственно) отмечали к 21-м сут (рис. 6, Б). Для SCF (рис. 5, А) и FLT-3L (рис. 5, В) достоверное увеличение концентрации было показано начиная с 3-х сут (537.5 ± 56.3 пг/мл против 205.8 ± 21.2 пг/мл и 24.84 ± 2.6 нг/мл против 6.72 ± 1.5 нг/мл соответственно). Статистически значимые отличия сохранялись в течение 9 сут от начала введения комбинации пДНК.
Рис. 6.
Концентрация ростовых факторов в образцах сыворотки крови мышей в различные сроки после электропорационного введения комбинации пДНК SGF. * Различия достоверны при p < 0.05.
Fig. 6. The concentration of growth factors in the serum of mice at various times after electroporation administration of the SGF pDNA combination. * The differences are significant at p < 0.05.
Фармакокинетические (ФК) параметры для каждого из трех цитокинов, рассчитанные без учета фоновых концентраций и с учетом поправки на показатели контрольной группы, представлены в табл. 3.
Таблица 3.
Фармакокинетический анализ сывороточных SCF, G-CSF и FLT-3L после введения соответствующих пДНК в мыщцы (n = 15) Table 3. Pharmacokinetic analysis of serum SCF, G-CSF and FLT-3L after intramuscular injection of the corresponding pDNA (n = 15)
| Параметр | Значение ФК параметра для ростового фактора | ||
|---|---|---|---|
| SCF | G-CSF | FLT-3L | |
| Cmax, пг/мл | $\frac{{{\text{537}}{\text{.5}}}}{{{\text{331}}{\text{.7}}}}$ | $\frac{{{\text{24842}}{\text{.5}}}}{{{\text{18125}}{\text{.0}}}}$ | |
| Tmax, ч | 72.0 | 17.0 | 72.0 |
| AUC0–504, ч нг/мл | $\frac{{{\text{171}}{\text{.4}}}}{{{\text{65}}{\text{.0}}}}$ | $\frac{{{\text{842}}{\text{.8}}}}{{{\text{700}}{\text{.4}}}}$ | |
| AUC0–∞, ч нг/мл | $\frac{{{\text{171}}{\text{.4}}}}{{{\text{65}}{\text{.0}}}}$ | $\frac{{{\text{842}}{\text{.8}}}}{{{\text{700}}{\text{.4}}}}$ | |
| T1/2, ч | $\frac{{{\text{338}}{\text{.6}}}}{{{\text{92}}{\text{.4}}}}$ | $\frac{{{\text{194}}{\text{.3}}}}{{{\text{118}}{\text{.3}}}}$ | $\frac{{{\text{652}}{\text{.8}}}}{{{\text{81}}{\text{.1}}}}$ |
Примечания. В числителе приведены значения ФК параметра без учета фоновых данных, в знаменателе – с учетом поправки на показатели контрольной группы. Параметр T1/2 следует интерпретировать не по отношению к циркулирующему цитокину, а ко времени функционирования плазмидной ДНК, трансфицированной в клетки скелетной мускулатуры.
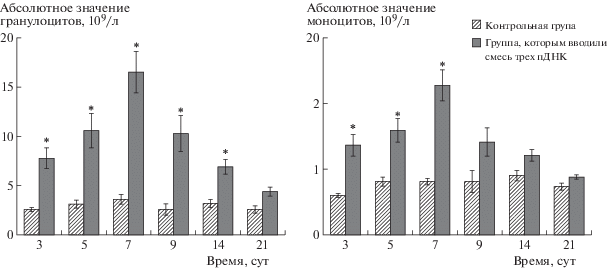
Исследование гематологических показателей показало, что введение пДНК, кодирующих гены scf, gcsf или flt3l, по отдельности не приводит к достоверным количественным изменениям клеточности периферической крови. Хотя при изолированном введении пДНК, кодирющей ген flt3l, наблюдается устойчивое повышение лейкоцитов на 7-е и последующие сутки, результаты статистически не достоверны (табл. 4). При этом однократное введение мышам комбинации трех пДНК обеспечило статистически значимое увеличение общего количества лейкоцитов в период с 3-х по 14-е сут исследования (табл. 4), в том числе гранулоцитов – с 3-х по 14-е сут, и моноцитов – с 3-х по 7-е сут, с максимумом на 7-е сут. К 21-м сут опыта все показатели снижались до уровня контрольной группы (рис. 7).
Таблица 4.
Количество лейкоцитов (109/л) в периферической крови мышей в различные сроки после введения пДНК (X ± mx, n = 15) Table 4. The number of leukocytes (109/l) in the peripheral blood of mice at various times after pDNA administration (X ± mx, n = 15)
| Группа | Количество лейкоцитов, X ± mx, 109/л сутки эксперимента | |||||
|---|---|---|---|---|---|---|
| 3 | 5 | 7 | 9 | 14 | 21 | |
| Контроль | 7.6 ± 0.7 | 9.3 ± 0.5 | 8.5 ± 0.9 | 8.5 ± 0.7 | 8.8 ± 0.8 | 8.7 ± 0.7 |
| SCF | 7.5 ± 0.5 | 7.8 ± 0.7 | 10.5 ± 1.1 | 7.7 ± 0.4 | 8.4 ± 0.7 | 8.0 ± 0.3 |
| GCSF | 7.0 ± 0.2 | 9.5 ± 0.3 | 8.7 ± 0.2 | 6.8 ± 0.2 | 8.2 ± 0.5 | 9.0 ± 0.9 |
| FLT3L | 7.9 ± 0.9 | 9.5 ± 1.0 | 11.9 ± 0.7 | 11.1 ± 0.9 | 11.4 ± 1.1 | 10.9 ± 1.1 |
| Смесь пДНК SGF | 15.8 ± 1.8* | 20.2 ± 2.7* | 22.2 ± 2.2* | 17.7 ± 2.7* | 15.3 ± 0.9* | 10.7 ± 0.5 |
Рис. 7.
Влияние смеси пДНК SGF на динамику гранулоцитов и моноцитов в периферической крови мышей в различные сроки после введения (X ± mx, n = 15).
Fig. 7. The effect of the combination of SGF pDNA on the dynamics of granulocytes and monocytes in the peripheral blood of mice at various times after administration (X ± mx, n = 15).
Следует отметить, что введение смеси пДНК не оказало достоверного стимулирующего влияния на изменение количества лимфоцитов, эритроцитов и тромбоцитов в крови животных.
ОБСУЖДЕНИЕ
Исследования в области генной терапии развиваются по разным направлениям: злокачественные новообразования, сердечно-сосудистые, инфекционные и моногенные наследственные заболевания, метаболические расстройства, глазные, нейрологические болезни и др. Долгое время генная терапия была лишь многообещающей отраслью медицинских исследований, однако в последние годы наметился существенный прогресс, связанный, в первую очередь, с успехами в области масштабного получения эффективных и безопасных векторов доставки, клиническим успехом и регистрацией сразу нескольких генно-терапевтических препаратов: Glybera®, Imlygic®, Strimvelis®, Oncorine®, Luxturna®, Gendicine®, Неоваскулген® и др. Эти обстоятельства вызывают интерес к генной терапии со стороны многих исследовательских групп и фарминдустрии.
Одной из основных проблем генной терапии является эффективность доставки трансгенов в клетки организма. Особенно это касается невирусных систем доставки в виде плазмидных ДНК. Электропорация – один из хорошо зарекомендовавших себя методов невирусного генного переноса. Он позволяет в десятки и сотни раз повысить эффективность доставки и экспрессии генов с плазмидных ДНК [45–47]. Более того, эффективность электропорации можно повысить, например, добавлением к раствору ДНК неионогенных полимеров – поливинилпирролидона, полоксамеров и полоксаминов [48–51]. В ходе предварительных исследований была проведена оптимизация процедуры доставки генов и выявлено, что использование комплекса ДНК с 0.05% полоксамером PE6400 дает 3–4-кратный прирост экспрессии при электропорации (данные не приведены), что хорошо согласуется с данными других исследований [51–53]. Оптимизированные параметры электропорации (двухигольчатый электрод, 150 В/см, 8 имп., 20 мс/имп., 1 Гц) в совокупности с 0.05% PE6400 позволили добиться 1000-кратного прироста экспрессии репортерного гена luc по сравнению с простым внутримышечным введением пДНК (рис. 5). Доза 2.5 мг/кг пДНК была выбрана, исходя из опубликованных данных других авторов по электропорационной доставке пДНК [54, 55].
Генная терапия посредством введения векторов, кодирующих ген цитокина FLT-3L, находит широкое применение в терапии онкологических заболеваний, поскольку способствует пролиферации и активации дендритных клеток (ДК) миелоидного и лимфоидного происхождения, тем самым позволяя им эффективно представлять раковые антигены Т-лимфоцитам. Уровень экспрессии того же FLT-3L в случае электропорации в ряде исследований находился в диапазоне 2–6 нг/мл с максимумом на 4-е сут и длительностью не более 10 дней после однократного введения в мышцу [56, 57]. Этого уровня экспрессии было достаточно, чтобы в 3–4 раза повысить количество дендритных клеток в костном мозге и селезенке и значительно повысить экспрессию костимулирующих молекул на их поверхности [56]. Генная терапия комбинацией плазмид FLT-3L и GM-CSF позволяет повысить количество ДК в селезенке мышей в 6 раз относительно фонового уровня при достигнутых концентрациях соответствующих цитокинов в 2.5 ± 1.0 нг/мл и 66.0 ± ± 26.0 пг/мл сыворотки [58]. В случае гидродинамической инъекции в некоторых работах показана возможность достижения концентраций в 40 мкг/мл крови, что приводит к выраженной спленомегалии и повышению количества функционально активных ДК в 50–100 раз [59]. Поскольку гидродинамическую доставку генов нельзя перенести в область клинического применения, то этот метод скорее следует рассматривать как лабораторный инструмент для невирусного генного переноса.
Исследование препаратов генной терапии на основе G-CSF и SCF находит значительно меньшее отражение в научной литературе. Отмечается перспективность их использования для восстановления ишемических повреждений скелетной мускулатуры и сердца, регенерации нервных тканей [60, 61].
В настоящем исследовании с помощью в/м электропорации смеси пДНК, обеспечивающих эндогенную секрецию трех ростовых факторов, был достигнут высокий уровень их продукции: 4467.0 ± 531.8 пг/мл для G-CSF, 537.5 ± 56.3 пг/мл для SCF и 24.84 ± 2.6 нг/мл для FLT-3L (рис. 6). Экспрессия данной комбинации цитокинов привела к эффективной стимуляции гемопоэза. Максимум мобилизации клеток в кровь был отмечен на 7-е сут, при этом количество лейкоцитов повысилось в 2.6 раза (до 22.2 × 109/л), моноцитов в 2.8 раза (до 2.3 × 109/л) и гранулоцитов в 4.5 раз (до 16.5 × 109/л) по отношению к значениям контрольной группы (табл. 4, рис. 7).
В силу малого количества работ, посвященных проблеме генной терапии нарушений кроветворения, и в особенности его восстановления после курса химиотерапии или облучения, представлялось интересным сопоставить результаты, полученные в данном исследовании, с результатами применения рекомбинантных цитокинов. Так, общепринятая схема мобилизации гемопоэтических стволовых клеток требует курсового введения рекомбинантных ростовых факторов: 10–14 дней для FLT3-L, 4–6 дней для G-CSF и 7–14 дней для SCF [25, 64, 65]. При этом основные фармакокинетические показатели Сmax, Tmax, AUC0-Tfinal, AUC0-T∞ и T1/2 при трехдневном курсовом в/м введении FLT3-L в дозе 5 мкг составляют – 569.0 нг/мл, 1.5 ч, 1869.0 нг ч/мл, 3262.0 нг ч/мл и 5.2 ч соответственно [31]. Для G-CSF при однократном введении 7 мкг подкожно – 1199.0 нг/мл, 2 ч, 6427.0 нг ч/мл, 6618.0 нг ч/мл и 2.3 ч соответственно [64]. Однократная подкожная инъекция G-CSF в дозе 5 мкг на 4-е сут приводит к повышению уровня лейкоцитов в крови мышей с 8.0 до 24.0 × 109/л и гранулоцитов с 3.0 до 14.0 × 109/л [64].
Таким образом, при сравнительном анализе фармакокинетических данных показано, что максимальные концентрации в крови для FLT-3L и G-CSF отличаются от данных литературы в 31 и 287 раз соответственно. Тогда как AUC0–T∞ различается всего в 2.3 и 9.5 раз. (табл. 3). Это свидетельствует о постоянной и длительной экспрессии этих цитокинов с пДНК.
Несмотря на высокие значения параметра Тmax (от 17 до 72 ч), было зафиксировано достаточно раннее появление в крови экспрессируемых цитокинов. Для G-CSF достоверный прирост концентрации в крови наблюдали уже к 6-му часу после введения пДНК. Наработка цитокинов в крови в первые часы после введения пДНК является преимуществом данных препаратов, поскольку время начала лечения радиационных поражений во многом определяет эффективность терапии [2]. Кроме того, сохранение экспрессии соответствующих генов в течение полутора-двух недель после однократного введения смеси пДНК позволяет поддерживать стимуляцию кроветворной системы на протяжении относительно длительного времени. В случае использования рекомбинантных белков такой эффект достижим лишь при многократном курсовом приеме.
В то же время было установлено, что введение пДНК по отдельности не приводит к достоверным изменениям гематологических показателей, что может свидетельствовать о недостаточном уровне экспрессии генов для проявления фармакологических эффектов и указывает на необходимость их использования в комбинации друг с другом. Это обстоятельство подтверждает общее правило, согласно которому синергизм в действии ранне- и позднедействующих цитокинов позволяет их комбинировать и получать существенно больший терапевтический эффект, чем от их индивидуального действия. Известно, что в сочетании с другими цитокинами SCF и FLT-3L (раннедействующие) существенно усиливают пролиферацию и дифференцировку клеток различных ростков кроветворения, а также колониеобразование, подготавливая коммитированные клетки к действию линиеспецифичных ростовых факторов. Например, комбинация SCF с G-CSF стимулирует пролиферацию и дифференцировку коммитированных на гранулоцитопоэз стволовых клеток кроветворной системы, значительно повышая содержание лейкоцитов, главным образом, нейтрофилов [65–67].
Таким образом, результаты проведенных исследований свидетельствуют о перспективности стимуляции кроветворения с использованием генно-терапевтических средств и необходимости дальнейшего экспериментального изучения разработанных пДНК для профилактики осложнений химиолучевой терапии, а также лечения радиационных поражений.
Список литературы
Бутомо Н.В., Гребенюк А.Н., Легеза В.И. и др. Основы медицинской радиобиологии / Под ред. И.Б. Ушакова. СПб.: Фолиант, 2004. 384 с. [Butomo N.V., Grebenyuk A.N., Legeza V.I. i dr. Osnovy medicinskoj radiobiologii [Basics of medical radiobiology] / Ed. I.B. Ushakov. St. Petersburg: Foliant, 2004. 384 p. (In Russian)]
Ильин Л.А. Радиационная медицина: в 4 т. Т. 1. Теоретические основы радиационной медицины. М.: Изд. АТ, 2004. 992 с. [Il’in L.A. Radiacionnaya medicina: v 4 t. Т. 1. Teoreticheskie osnovy radiacionnoj mediciny. [Radiation medicine: In 4 vol. V. 1. Theore-tical foundations of radiation medicine]. Moscow: Publ. AT, 2004. 992 p. (In Russian)]
Власенко Т.Н., Назаров В.Б., Гребенюк А.Н. Современные подходы к фармакологической профилактике радиационных поражений // Биомедицинский журнал “Medline.Ru”. 2010. Т. 11. С. 230–253. [Vlasenko T.N., Nazarov V.B., Grebenyuk A.N. Sovremennye podhody k farmakologicheskoj profilaktike radiacionnyh porazhenij [Current approaches to the pharmacological prophylaxis of radiation injuries]. Biomedical Journal “Medline.Ru”, 2010. V. 11. P. 230–253. (In Russian)]
Кетлинский С.А., Симбирцев А.С. Цитокины. СПб.: Фолиант, 2008. 552 с. [Ketlinskij S.A., Simbircev A.S. Citokiny [Cytokines]. St. Petersburg: Foliant, 2008. 552 p. (In Russian)]
Johnke R.M., Sattler J.A., Allison R.R. Radioprotective agents for radiation therapy: future trends // Future Oncol. 2014. V. 10. № 15. P. 2345–2357.
Neta R. Cytokines in radioprotection and therapy of radiation injury // Biotherapy. 1988. V. 1. № 1. P. 41–45.
Легеза В.И., Чигарева Н.Г., Абдуль Ю.А., Галеев И.Ш. Цитокины как средства ранней патогенетической терапии радиационных поражений. Эффективность и механизм действия // Радиац. биология. Радиоэкология. 2000. Т. 40. № 4. С. 420–424. [Legeza V.I., Chigareva N.G., Abdul’ Yu.A., Galeev I.Sh. Citokiny kak sredstva rannej patogeneticheskoj terapii radiacionnyh porazhenij. Effektivnost’ i mekhanizm dejstviya [Cytokines as a means of early pathogenetic treatment of radiation injuries. Efficiency and mechanism of action] // Radiats. biology. Radioecology. 2000. V. 40. № 4. P. 420–424. (In Russian)]
Рождественский Л.М., Дешевой Ю.Б., Лебедев В.Г., Нестерова Т.А. Зависимость лечебной эффективности интерлейкина-1β от срока введения препарата после облучения мышей // Радиац. биология. Радиоэкология. 2002. Т. 42. № 1. С. 65–69. [Rozhdestvenskij L.M., Deshevoj Yu.B., Lebedev V.G., Nesterova T.A. Zavisimost’ lechebnoj ehffektivnosti interlejkina-1β ot sroka vvedeniya preparata posle oblucheniya myshej [Dependence of the interleukin-1β therapeutic efficacy of mice on the period of drug administration after irradiation] // Radiats. biology. Radioecology. 2002. V. 42. № 1. P. 65–69. (In Russian)]
Smith T.J., Bohlke K., Lyman G.H. et al. Recommendations for the use of white blood cell growth factors: American Society of Clinical Oncology Clinical Practice Guideline Update // J. Clin. Oncol. 2015. V. 33. № 28. P 3199–3212.
Baden L.R., Swaminathan S., Angarone M. et al. Prevention and treatment of cancer-related infections, Version 2. 2016, NCCN Clinical Practice Guidelines in Oncology // J. Natl. Compr. Canc. Netw. 2016. V. 14. № 7. P. 882–913.
Crawford J., Becker P.S., Armitage J.O. et al. Myeloid growth factors, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology // J. Natl. Compr. Canc. Netw. 2017. V. 15. № 12. P. 1520–1541.
MacVittie T.J., Bennett A.W., Farese A.M., Taylor-Howell C. The effect of radiation dose and variation in neupogen® initiation schedule on the mitigation of myelosuppression during the concomitant GI-ARS and H-ARS in a nonhuman primate model of high-dose exposure with marrow sparing // Health Physics. 2015. V. 109. № 5. P. 427–439.
Drouet M., Mourcin F., Grenier N. et al. Single administration of stem cell factor, FLT-3 ligand, megakaryocyte growth and development factor, and interleukin-3 in combination soon after irradiation prevents nonhuman primates from myelosuppression: long-term follow-up of hematopoiesis // Blood. 2004. V. 103. № 3. P. 878–885.
Farese A. M., Brown C. R., Smith C. P. et al. The ability of filgrastim to mitigate mortality following LD50/60 total-body irradiation is administration time-dependent // Health Physics. 2014. V. 106. № 1. P. 39–47.
Farese A.M., Cohen M.V., Katz B.P. et al. Filgrastim improves survival in lethally irradiated nonhuman primates // Radiat. Res. 2013. V. 179. № 1. P. 89–100.
Leigh B.R., Khan W., Hancock S.L., Knox S.J. Stem cell factor enhances the survival of murine intestinal stem cells after photon irradiation // Radiat. Res. 1995. V. 142. № 1. P. 12–15.
Patchen M.L., Fischer R., Schmauder-Chock E.A., Williams D.E. Mast cell growth factor enhances multili-neage hematopoietic recovery in vivo following radiation-induced aplasia // Exp. Hematol. 1994. V. 22. P. 31–39.
Schuening F.G., Appelbaum F.R., Deeg H.J. et al. Effects of recombinant canine stem cell factor, a c-kit ligand, and recombinant granulocyte colony-stimulating factor on hematopoietic recovery after otherwise lethal total body irradiation // Blood. 1993. V. 81. P. 20–26.
Andrews R.G., Bensinger W.I., Knitter G.H. et al. The ligand for c-kit, stem cell factor, stimulates the circulation of cells that engraft lethally irradiated baboons // Blood. 1992. V. 80. P. 2715–2720.
Abdul-Hai A., Weiss L., Ben-Yehuda A. et al. Interleukin-7 induced facilitation of immunological reconstitution of sublethally irradiated mice following treatment with alloreactive spleen cells in a murine model of B-cell leukemia/lymphoma (BCL1) // Bone Marrow Transplant. 2007. V. 40. № 9. P. 881–889.
Chen T., Burke K., Zhan Y. et al. IL-12 facilitates both the recovery of endogenous hematopoiesis and the engraftment of stem cells after ionizing radiation // Exp. Hematol. 2007. V. 35. № 2. P. 203–213.
Selig C., Kreja L., Müller H. et al. Hematologic effects of recombinant human interleukin-6 in dogs exposed to a total-body radiation dose of 2.4 Gy // Exp. Hematol. 1994. V. 22. № 7. P. 551–558.
Zsebo K.M., Wypych J., McNiece I.K. et al. Identification, purification and biological characterization of hematopoietic stem cell factor from buffalo rat liver-conditioned medium // Cell. 1990. № 63. P. 195–201.
Симбирцев А.С. Достижения и перспективы использования рекомбинантных цитокинов в клинической практике // Мед. академ. журн. 2013. Т. 13. № 1. С. 7–22. [Simbircev A.S. Dostizheniya i perspektivy ispol’zovaniya rekombinantnyh citokinov v klinicheskoj praktike [Achievements and prospects for the use of recombinant cytokines in clinical practice] // Med. Acad. J. 2013. V. 13. № 1. pp. 7–22. (In Russian)]
Robin J.A. Cytokines in haemopoietic progenitor mobilisation for peripheral stem cell transplantation // Current Pharmaceutical Design. 2002. V. 8. № 5. P. 379–394.
Case J., Rice A., Wood J. et al. Characterization of cytokine interactions by flow cytometry and factorial ana-lysis // Cytometry. 2001. V. 43. P. 69–81.
Hess D.A. Functional analysis of human hematopoietic repopulating cells mobilized with granulocyte colony-stimulating factor alone versus granulocyte colony-stimulating factor in combination with stem cell factor // Blood. 2002. V. 100. № 3. P. 869–878.
Begley C.G., Basser R., Mansfield R. et al. Enhanced levels and enhanced clonogenic capacity of blood progenitor cells following administration of stem cell factor plus granulocyte colony-stimulating factor to humans // Blood. 1997. V. 90. № 9. P. 3378–3389.
Heyworth C.M., Whetton A.D., Nicholls S. et al. Stem cell factor directly stimulates the development of enriched granulocyte-macrophage colony-forming cells and promotes the effects of other colony-stimulating factors // Blood. 1992. V. 80. P. 2230–2236.
Du Z., Jin H., Cai H. et al. Hematopoietic repopulating ability of CD34+ progenitor cells ex vivo expanded with different cytokine combinations // Artificial Cells, Nanomedicine, and Biotechnology. 2014. V. 43. № 6. P. 398–402.
Ballestreroa A., Ferrando F., Garuti A. et al. Effects of three cytokine regimens on hematologic recovery and progenitor cell mobilization after high-dose cyclophosphamide, etoposide, and cisplatin // Oncology. 2000. Vol. 59. № 1. P. 7–13.
Sauvageau G., Iscove N.N., Humphries R.K. In vitro and in vivo expansion of hematopoietic stem cells // Oncogene. 2004. V. 23. № 43. P. 7223–7232.
Lui W.C., Chan Y.F., Chan L.C., Ng R.K. Cytokine combinations on the potential for ex vivo expansion of murine hematopoietic stem cells // Cytokine. 2014. V. 68. № 2. P. 127–132.
Bloque C., Fabre E., Bureau M.F., Scherman D. Plasmid DNA electrotransfer for intracellular and secreted proteins expression: new methodological developments and applications // J. Gene Med. 2004. V. 6 (S1). P. S11–S23.
Van Gaal E.V.B., Hennink W.E., Crommelin D.J.A., Mastrobattista E. Plasmid engineering for controlled and sustained gene expression for nonviral gene therapy // Pharmaceutical Res. 2006. V. 3. № 6. P. 1053–1074.
Morrison C. $1-million price tag set for Glybera gene therapy // Nature Biotechnol. 2015. V. 33. № 3. P. 217–218.
Briddell R.A., Hartley C.A., Smit K.A., McNiec I.K. Recombinant rat stem cell factor synergizes with recombinant human granulocyte colony-stimulating factor in vivo in mice to mobilize peripheral blood progenitor cells that have enhanced repopulating potential // Blood. 1993. № 82. P. 1720–1723.
Moritz T., Dutt P., Xiao X. et al. Fibronectin improves transduction of reconstituting hematopoietic stem cells by retroviral vectors: evidence of direct viral binding to chymotryptic carboxy-terminal fragments // Blood. 1996. V. 88. № 3. P. 855–862.
Facon T., Harousseau J., Maloisel F. Stem cell factor in combination with figrastim after chemotherapy improves peripheral blood progenitor cell yield and reduces aphaeresis requirements in multiple myeloma patients a randomized controlled trial // Blood. 1999. V. 94. P. 1218 – 1225.
Koller M., Oxeuder M., Brott D. Fit-3-ligand is more potent than -c-kit for the synergistic stimulation of ex vivo hematopoietic cell expansion // J. Hematother. 1996. V. 5. P. 449 – 459.
Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю. ПЦР в реальном времени. М.: БИНОМ, 2015. 226 с. [Rebrikov D.V., Samatov G.A., Trofimov D.Yu. PCR v real’nom vremeni [Real-Time PCR]. Moscow: Publ. BINOM, 2015. 226 p. (In Russian)]
Schmittgen T.D., Livak K.J. Analyzing real-time PCR data a by the comparative CT method // Nature Protocols. 2008. V. 3. № 6. P. 1101–1108.
Приказ МЗ РФ от 01.04.2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики”. [Prikaz MZ RF ot 01.04.2016 g. № 199n “Ob utverzhdenii Pravil nadlezhashchej laboratornoj praktiki” [Order of the Ministry of Health of the Russian Federation 01.04.2016, № 199n “On approval of the rules of good laboratory practice”]. (In Russian)]
Директива 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях. СПб.: Rus-LASA “НП объединение специалистов по работе с лабораторными животными”, рабочая группа по переводам и изданию тематической литературы, 2012. 48 с. [Direktiva 2010/63/EU Evropejskogo parlamenta i soveta evropejskogo soyuza po ohrane zhivotnyh, ispol’zuemyh v nauchnyh celyah. [Directive 2010/63 / EU of the European Parliament and of the Council for the Protection of Animals used for scientific purposes]. St. Petersburg: Rus-LASA. 2012. 48 p. (In Russian)]
Mir L.M., Bureau M.F., Gehl J. et al. High-efficiency gene transfer into skeletal muscle mediated by electric pulses // Proc. Natl. Acad. Sci. 1999. V. 96. P. 4262–4267.
Heller L.C., Heller R. In Vivo Electroporation for Gene Therapy // Human Gene Therapy. 2006. V. 17. P. 890–897.
Trollet C., Bloquel C., Scherman D., Bigey P. Electrotransfer into Skeletal Muscle for Protein Expression // Current Gene Therapy. 2006. V. 6. P. 561–578.
Mumper R.J., Wang J., Klakamp S.L. et al. Protective interactive noncondensing (PINC) polymers for enhanced plasmid distribution and expression in rat skeletal muscle // J. Control. Release. 1998. V. 52. P. 191–203.
Pitard B., Pollard H., Agbulut O. et al. A nonionic amphiphile agent promotes gene delivery in vivo to skeletal and cardiac muscles // Human Gene Therapy. 2002. V. 13. P. 1767–1775.
Prokop A., Kozlov E., Moore W., Davidson J.M. Maximizing the in vivo efficiency of gene transfer by means of nonviral polymeric gene delivery vehicles // J. Pharmaceutic. Sci. 2002. V. 91. P. 67–76.
Riera M., Chillon M., Aran J.M. et al. Intramuscular SP1017-formulated DNA electrotransfer enhances transgene expression and distributes hHGF to different rat tissues // J. Gene Med. 2004. V. 6: P. 111–118.
Hartikka J., Sukhu L., Buchner C. et al. Electroporation-facilitated delivery of plasmid DNA in skeletal muscle: plasmid dependence of muscle damage and effect of poloxamer 188 // Mol. Therapy. 2001. V. 4. № 5. P. 407–415.
Richard P., Pollard H., Lanctin C. et al. Inducible production of erythropoietin using intramuscular injection of block copolymer/DNA formulation // J. Gene Med. 2005. V. 7. № 1. P. 80–86.
Bloquel C., Fabre E., Bureau M.F., Scherman D. Plasmid DNA electrotransfer for intracellular and secreted proteins expression: new methodological developments and applications // J. Gene Med. 2004. V. 6. P. S11–S23.
Trollet C., Bloquel C., Scherman D., Bigey P. Electrotransfer into skeletal muscle for protein expression // Current Gene Therapy. 2006. V. 6. P. 561–578.
Takayama A., Enomoto K., Saito T. et al. Cancer gene therapy using in vivo electroporation of Flt3-ligand // Int. J. Oncology. 2005. V. 27. P. 457–463.
Saito T., Takayama T., Osaki T. et al. Combined mobilization and stimulation of tumor-infiltrating dendritic cells and natural killer cells with Flt3 ligand and IL-18 in vivo induces systemic antitumor immunity // Cancer Sci. 2008. V. 99. № 10. P. 2028–2036.
Peretz Y., Zhou Z.F., Halwani F., Prud’homme G.J. In vivo generation of dendritic cells by intramuscular codelivery of FLT3 ligand and GM-CSF plasmids // Mol. Ther. 2002. V. 6. № 3. P. 407–414.
Tu H., Burke T.M., Oderup C. et al. Robust expansion of dendritic cells in vivo by hydrodynamic FLT3L-FC gene transfer // J. Immunol. Methods. 2014. V. 413. P. 69–73.
Sacramento C.B., da Silva F.H., Nardi N.B. et al. Synergistic effect of vascular endothelial growth factor and granulocyte colony-stimulating factor double gene therapy in mouse limb ischemia // J. Gene Med. 2010. V. 12. P. 310–319.
Pereira Lopes F.R., Martin P.K.M., Frattini F. et al. Double gene therapy with granulocyte colony-stimulating factor and vascular endothelial growth factor acts sy-nergistically to improve nerve regeneration and functional outcome after sciatic nerve injury in mice // Neuroscience. 2013. V. 230. P. 184–197.
Hoffman R., Tong J., Brandt J. et al. The in vitro and in vivo effects of stem cell factor on human hemato-poiesis // Stem Cells. 1993. V.11. № 2. P. 76–78.
Reddy R.L. Mobilization and collection of peripheral blood progenitor cells for transplantation // Transfusion and Apheresis Science. 2005. V. 32. № 1. P. 63–72.
Robinson S.N., Chavez J.M., Blonder J.M. et al. Hematopoietic progenitor cell mobilization in mice by sustained delivery of granulocyte colony-stimulating factor // J. Interferon & Cytokine Res. 2005. V. 25. P. 490–500.
Ulich T.R., del Castillio J., McNiece I.K. et al. Acute and subacute hematologic effect of multi-colony stimula-ting factor in combination with granulocyte colony-stimulating factor in vivo // Blood. 1990. V. 75. № 1. P. 48–53.
Schuening F., Appelbaum F.R., Deeg H.J. et al. Effects of recombinant canine stem cell factor, a c-kit ligand, and recombinant granulocyte colony-stimulating factor on hematopoetic recovery after otherwise lethal total body irradiation // Blood. 1993. V. 81. № 1. P. 20–26.
Herbet K., Prince H., Ritchie D., Seymour J. The role of ancestim (recombinant human stem-cell factor, rhSCF) in hematopoietic stem cell mobilization and hematopoietic reconstitution. Expert Opin // Biol. Ther. 2010. V. 10. P. 113–125.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


