Радиационная биология. Радиоэкология, 2019, T. 59, № 5, стр. 516-526
ФРАКЦИОНИРОВАННОЕ ВОЗДЕЙСТВИЕ РЕДКОИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ НА ПОПУЛЯЦИЮ СТВОЛОВЫХ КЛЕТОК РАКА ШЕЙКИ МАТКИ В ЭКСПЕРИМЕНТАЛЬНЫХ И КЛИНИЧЕСКИХ УСЛОВИЯХ
О. Н. Матчук 1, *, И. А. Замулаева 1, Е. И. Селиванова 1, Л. С. Мкртчян 1, Л. И. Крикунова 1, В. О. Сабуров 1, А. А. Лычагин 1, Г. З. Кулиева 1, А. О. Якимова 1, А. В. Хохлова 1, С. А. Иванов 1, А. Д. Каприн 1
1 Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Федерального государственного
бюджетного учреждения “Национальный медицинский исследовательский центр радиологии”
Министерства здравоохранения РФ
Обнинск, Россия
* E-mail: matchyk@mail.ru
Поступила в редакцию 27.01.2019
Аннотация
Многочисленные исследования доказывают высокую резистентность опухолевых стволовых клеток (ОСК) к однократному воздействию редкоионизирующего излучения in vitro. Эти данные лежат в основе предположения о важной роли ОСК в рецидивировании опухолевого процесса после лучевой терапии по стандартным схемам. Однако при фракционированном облучении закономерности и механизмы действия радиации на эту популяцию клеток изучены недостаточно, а в отношении рака шейки матки (РШМ) имеются лишь единичные публикации. Поэтому целью данной работы являлось выяснение количественных изменений популяции ОСК после воздействия редкоионизирующих излучений в режиме стандартного фракционирования дозы in vitro (в культурах РШМ линии HeLa и SiHa) и in vivo (в соскобах с шейки матки больных плоскоклеточным РШМ в ходе лучевой терапии). С помощью проточной цитометрии оценивали относительное количество (долю) ОСК в указанных клеточных культурах после каждой фракции до достижения суммарной дозы 10 Гр, а в клинических образцах 26 больных – до лечения и после облучения в суммарной очаговой дозе (СОД) 10 Гр. ОСК в клеточных культурах идентифицировали по способности этих клеток откачивать флуоресцентный краситель Хёхст33342 и формировать т.н. боковую популяцию (side population – SP), в соскобах с шейки матки – по иммунофенотипу CD44+CD24low. Установлено статистически значимое увеличение доли ОСК после фракционированного облучения клеточных культур РШМ указанных линий в диапазоне суммарных доз 2–10 Гр по сравнению с необлученным контролем. Высокая индивидуальная вариабельность доли CD44+CD24low ОСК была обнаружена в соскобах РШМ до лечения и после радиационного воздействия. Повышение этого показателя в результате облучения отмечалось у 38% больных; у остальных пациентов наблюдалось уменьшение этого показателя после радиационного воздействия в СОД 10 Гр или его сохранение на исходном уровне. Высокая обратная корреляция была найдена между долей ОСК до лечения и ее изменением после облучения (R = –0.71; p < 0.0001). Полученные результаты свидетельствуют о наличии существенных индивидуальных различий в ответе ОСК РШМ на радиационное воздействие, а также обосновывают принципиальную возможность дальнейшего исследования прогностической значимости количественных изменений ОСК после первых сеансов лучевой терапии в отношении ближайших и отдаленных результатов лечения.
Как свидетельствуют многочисленные данные литературы и результаты собственных исследований, опухолевые стволовые клетки (ОСК), обнаруженные в злокачественных новообразованиях различных локализаций, первичных и стабильных культурах опухолевых клеток, обладают более высокой резистентностью к редкоионизирующему излучению и многим противоопухолевым препаратам по сравнению с остальной массой клеток [1–6]. Поэтому в последние годы высказывается предположение, что именно эта фракция клеток может определять неблагоприятные результаты лучевого и комбинированного лечения онкологических больных, включая возникновение рецидивов заболевания и метастазирование. В настоящее время выясняются молекулярные механизмы резистентности ОСК к различным факторам физической или химической природы, и на этой основе разрабатываются новые способы/cредства элиминации ОСК или повышения чувствительности этих клеток к известным противоопухолевым воздействиям, включая облучение [7–10]. Однако в подавляющем большинстве таких исследований выяснялись эффекты и механизмы ответа ОСК на однократное радиационное воздействие in vitro. В литературе представлено значительно меньше данных о влиянии фракционированного радиационного воздействия на ОСК в культурах опухолевых клеток различного происхождения, а в отношении ОСК шейки матки имеются лишь единичные публикации [11]. Вместе с тем исследование закономерностей ответа ОСК шейки матки на фракционированное облучение представляется весьма актуальным, учитывая рост заболеваемости раком этой локализации в РФ [12] и использование радиотерапии в качестве одного из основных методов лечения инвазивного рака шейки матки (РШМ) [13]. Поэтому целью данной работы стало выяснение количественных изменений популяции ОСК после воздействия редкоионизирующих излучений в режиме стандартного фракционирования дозы in vitro (в культурах рака шейки матки линий HeLa и SiHa) и in vivo (в соскобах с шейки матки больных РШМ в ходе лучевой терапии). В экспериментальных условиях оценивали относительное количество (долю) ОСК в указанных клеточных культурах без облучения и после каждой фракции дозы до достижения суммарной дозы 10 Гр, а в клинических условиях – в образцах РШМ до лечения и после облучения в суммарной очаговой дозе (СОД) 10 Гр.
МАТЕРИАЛЫ И МЕТОДИКА
В работе использовали два основных метода идентификации ОСК, известные в литературе: иммунофенотипирование по поверхностным маркерам и оценка эффективности исключения из клеток флуоресцентного красителя Хёхст 33342. Как известно, ОСК (в отличие от остальных клеток) обладают способностью исключать указанный краситель вследствие высокой экспрессии на плазматической мембране различных АТФ-связывающих транспортёров. Благодаря этой способности ОСК могут быть выявлены с помощью проточной цитометрии как так называемая боковая популяция (side population – SP) в ряде стабильных линий опухолевых клеток, включая использованные в данной работе [14–17]. Метод выявления SP был использован нами при исследовании клеточных культур, метод иммунофенотипирования – при анализе соскобов с шейки матки больных РШМ.
Идентификация клеток SP и определение их относительного количества с помощью проточной цитометрии в контрольных и облученных культурах опухолевых клеток in vitro
Объектом исследования являлись клетки РШМ двух линий: HeLa и SiHa, культивируемые в стандартных условиях. Известно, что эти клеточные культуры инфицированы вирусами папилломы человека (ВПЧ) 18 и 16 типов соответственно, т.е. содержат ВПЧ тех типов, которые наиболее часто встречаются при РШМ. Обе линии культивировали в полной питательной среде DMEM (“ПанЭко”, РФ), содержащей 10% эмбриональной сыворотки крупного рогатого скота (“BioSera”, Франция), пенициллин (50 ед/мл), стрептомицин (50 мкг/мл) и глютамин (292 мкг/мл), в CO2 инкубаторе (“Shellab”, США) в увлажненной атмосфере с 5%-ным содержанием CO2 при температуре +37°С. Для опыта клетки рассевали в пластиковые флаконы (“Corning”, США, площадь поверхности 25 см2). По достижении 30–40% конфлюэнтности клетки подвергали воздействию γ-излучения 60Со на установке “Рокус” (Россия) в разовой дозе 2 Гр ежедневно до достижения суммарной дозы 10 Гр (мощность дозы 0.8 Гр/мин). Относительное количество клеток SP оценивали через 24 ч после облучения в суммарных дозах 2, 4, 6, 8 и 10 Гр; одновременно этот же показатель анализировали в контрольных (необлученных) образцах. Определяли общее количество клеток в каждом флаконе с помощью камеры Горяева и проводили стандартное окрашивание с применением флуоресцентного красителя Хёхст33342 (“Sigma”, США) для определения доли клеток SP в изучаемых культурах, как подробно описано в работе [6]. Концентрация Хёхста составляла 5 мкг/мл, время инкубации – 90 мин при +37°С и периодическом перемешивании. Для исключения из анализа мертвых и погибающих клеток в образцы добавляли раствор йодистого пропидия до конечной концентрации 2 мкг/мл за 10–15 мин до анализа. Окрашенные образцы анализировали с помощью проточного цитофлуориметра “FACS Vantage” (“Becton Dickinson Immunocytometry Systems, BDIS”, США), оборудованного двумя лазерами с длинами волн 364 и 488 нм. Флуоресценцию Хёхста измеряли в синей (424 ± 20 нм) и красной (675 ± 20 нм) областях спектра (при λвозб = = 364 нм), а также регистрировали флуоресценцию йодистого пропидия при длине волны 585 ± ± 20 нм (λвозб = 488 нм). Для контроля окрашивания использовали параллельные образцы клеток, инкубированных с Хёхстом 33342 в присутствии верапамила – блокатора кальциевых каналов I класса, препятствующего выведению Хёхста 33 342 из клеток. Данные собирали в файл, который затем обрабатывали с помощью программы CellQuestPro (“BDIS”, США). Регион SP выделяли графически таким образом, чтобы в образцах с верапамилом в этот регион попадало минимальное количество клеток. Вычисляли относительное количество (процент) клеток SP. С каждой линией опухолевых клеток проведено по три независимых эксперимента, результаты которых были объединены. В каждом эксперименте использовано по 3–5 флаконов на каждую суммарную дозу облучения и соответствующий необлученный контроль.
Выявление и количественная оценка ОСК в соскобах с шейки матки больных РШМ
Группу исследования составили 26 пациенток с гистологически подтвержденным диагнозом плоскоклеточный РШМ IB-IVA стадий по классификации Международной федерации акушеров-гинекологов (FIGO). Средний возраст (±SE) больных составил 47.5 ± 2.2 лет (от 28 до 70 лет). Всем пациенткам проводились радикальные курсы специализированного лечения в отделении лучевых и комбинированных методов лечения гинекологических заболеваний МРНЦ им. А.Ф. Цыба – филиал ФГБУ “НМИЦ радиологии” Минздрава России: сочетанная лучевая терапия (СЛТ) проводилась шести больным; химиолучевая терапия (ХЛТ) – 20 больным. Лечение в обеих группах пациентов начинали с дистанционного облучения первичного очага и зон регионарного метастазирования на линейном ускорителе электронов SL-75-5 (“Philips”, Англия) в режиме фракционирования фотонного излучения (6 МэВ) в разовой очаговой дозе 2.0 Гр ежедневно до СОД 30.0 Гр. В случае ХЛТ дополнительно проводились еженедельные внутривенные инфузии препарата цисплатин из расчета 40 мг/м2.
Соскобы с шейки матки получали до лечения и через 24 ч после облучения в СОД 10 Гр. Полученный материал помещали в пробирки с полной питательной средой DMEM и транспортировали в лабораторию в течение 1 ч при комнатной температуре. Далее получали суспензию клеток, определяли концентрацию ядросодержащих клеток с помощью камеры Горяева и отбирали аликвоты по 200–300 тыс. клеток.
ОСК идентифицировали методом иммунофенотипирования с помощью четырехцветной проточной цитофлуориметрии на приборе “FACS Vantage” (“BDIS”, США). Полученную суспензию клеток окрашивали с помощью ДНК-связывающего красителя Хёхст 33342 и моноклональных антител, меченных разными флуорохромами, к следующим поверхностным маркерам: CD44 (клон L178, связывающий различные изоформы этого белка), CD24, CD45 по стандартной методике, рекомендованной фирмой-производителем (“BD Biosciences”, США). Для контроля неспецифического связывания использовали моноклональные антитела соответствующего изотипа к гемоцианину улитки, конъюгированные с теми же флуорохромами, что и антитела к указанным поверхностным маркерам (“BD Biosciences”, США). Выбор маркеров для идентификации ОСК РШМ был сделан на основе данных литературы о высокой экспрессии CD44 [18–20] и низкой экспрессии CD24 [21–23] на поверхности ОСК шейки матки. Окрашивание антителами к CD45 использовали для отрицательной селекции лимфоидных клеток, связывание с ДНК-связывающим красителем – для положительной селекции ядросодержащих клеток и отрицательной селекции дебриса и эритроцитов. Вычисляли долю CD44+CD24low ОСК среди CD45-Хёхст 33342+ ядросодержащих клеток.
Статистическую обработку результатов проводили с использованием программ “Origin 6.0” (Microcal Software, Inc.) и “Statistica 6.0” (StatSoft., Inc.). Приведены средние значения доли ОСК ± SE в сравниваемых группах.
Данное исследование было одобрено Этическим комитетом МРНЦ им. А.Ф. Цыба, от пациенток получено информированное согласие на исследование.
РЕЗУЛЬТАТЫ
Доля клеток SP в интактных культурах линий HeLa и SiHa существенно различалась, составляя в среднем (±SE) 5.40 ± 0.60 и 0.25 ± 0.02% соответственно. Интересно, что при этом скорость удвоения общего числа клеток в использованных культурах практически не отличалась.
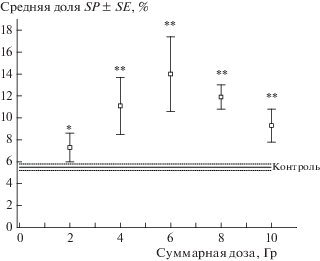
Общее количество клеток уменьшалось с накоплением дозы радиационного воздействия в клеточных культурах обеих линий, притом эффекты фракционированного облучения были выражены сильнее в случае линии SiHa (рис. 1, p < < 0.01 при сравнении коэффициентов В наклона линейных регрессий). Средняя доля клеток SP в обеих клеточных культурах статистически значимо превышала контрольный уровень уже после первой фракции дозы (рис. 2, 3). При этом форма дозовой зависимости этого показателя отличалась для разных линий: в культуре SiHa доля клеток SP возрастала с увеличением накопленной дозы во всем изученном диапазоне (до 10 Гр), в то время как в культуре HeLa доля клеток SP увеличивалась после каждой фракции до суммарной дозы 6 Гр, после чего происходило уменьшение этого показателя. Однако в обоих случаях доля клеток SP после облучения в суммарной дозе 10 Гр была выше, чем в необлученном контроле. Максимальная величина этого показателя после облучения составила 14% для линии HeLa и 7% для линии SiHa, что соответствует увеличению в 2.6 и 28.0 раз по сравнению с соответствующим контролем.
Рис. 1.
Влияние фракционированного γ-облучения на общее количество опухолевых клеток линий HeLa и SiHa через 24 ч после воздействия в сравнении с необлученным контролем, принятым за 100%.
Fig. 1. The effects of fractionated γ-radiation exposure on the total number of cancer cells of the HeLa and SiHa lines 24 hours after exposure in comparison with the unirradiated control, taken as 100%.
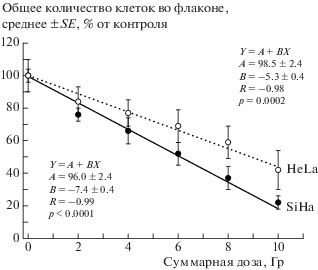
Рис. 2.
Изменение доли клеток SP линии SiHa после фракционированного облучения в суммарных дозах до 10 Гр. * p < 0.01 по сравнению с контролем; ** p < 0.001 по сравнению с контролем.
Fig. 2. Proportion of SiHa SP cells after fractionated radiation exposure at cumulative doses up to 10 Gy. * p < 0.01 in comparison with control; ** p < 0.001 in comparison with control.
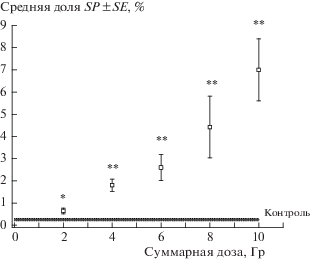
Рис. 3.
Изменение доли клеток SP линии HeLa после фракционированного облучения в суммарных дозах до 10 Гр. *p < 0.05 по сравнению с контролем; ** p < 0.01 по сравнению с контролем.
Fig. 3. Proportion of HeLa SP cells after fractionated radiation exposure at cumulative doses up to 10 Gy. * p < 0.05 in comparison with control; ** p < 0.01 in comparison with control.
Доля CD44+CD24low ОСК изучалась в соскобах с шейки матки больных РШМ до лечения и после воздействия редкоионизирующего излучения (фотонного пучка с энергией 6 МэВ, генерируемого линейным ускорителем электронов) в СОД 10 Гр. В исследование были включены две группы больных: к моменту повторного исследования и в той, и в другой группе было проведено дистанционное облучение первичного опухолевого очага в режиме стандартного фракционирования дозы, но в группе СЛТ дополнительные воздействия не применялись, а в группе ХЛТ перед первым сеансом облучения было выполнено однократное введение противоопухолевого химиопрепарата цисплатин. Исходная доля CD44+CD24low клеток составила в среднем 6.2 ± 2.3% в группе СЛТ и 4.9 ± ± 0.9% в группе ХЛТ (р = 0.52); после облучения в дозе 10 Гр – 3.6 ± 1.2% и 4.5 ± 1.1% соответственно (р = 0.67). Поскольку значимых различий между сравниваемыми группами обнаружено не было, в дальнейшем анализе эти группы были объединены. В объединенной группе средняя доля CD44+CD24low клеток составила 5.2 ± 0.9% до лечения и 4.3 ± 0.9% после облучения в СОД 10 Гр (р = 0.46). Отмечалась высокая индивидуальная вариабельность изучаемого показателя в диапазоне 0.4–16.7% до лечения и 0.6–19.3% после облучения в указанной дозе. Повышение доли CD44+CD24low клеток наблюдалось у 10 больных, снижение этого показателя – у 14 больных, и у остальных двух больных изменений этого показателя не было выявлено.
Исходная доля CD44+CD24low клеток статистически значимо не коррелировала с клинико-морфологическими показателями опухолевого процесса, но отмечена некоторая тенденция к повышению доли изучаемых клеток на поздних стадиях заболевания, при вовлечении в процесс регионарных лимфатических узлов и в случае ороговевающего РШМ (по сравнению с неороговевающим) (табл. 1). Из-за небольшого количества больных в сравниваемых подгруппах (особенно при неороговевающем РШМ) полученные результаты являются предварительными. Требуются дальнейшие исследования для выяснения возможной ассоциации исходной доли ОСК РШМ с клинико-морфологическими показателями.
Таблица 1.
Сравнение средней доли CD44+CD24low клеток в соскобах с шейки матки больных РШМ до лечения в подгруппах с различными клинико-морфологическими показателями опухолевого процесса Table 1. Comparison of the average proportion of CD44+CD24low cells in cervical scrapings from patients with cervical cancer before treatment in subgroups with different clinical and morphological parameters
| Клинико-морфологические показатели | Число больных | Доля CD44+CD24low клеток, % среднее значение ± SE | p | |
|---|---|---|---|---|
| Стадия FIGO | I + II | 13 | 4.4 ± 0.9 | 0.32 |
| III + IV | 13 | 6.1 ± 1.5 | ||
| Наличие опухолевых клеток в регионарных лимфатических узлах | N0 | 18 | 4.4 ± 0.7 | 0.13 |
| N+ | 8 | 7.2 ± 2.0 | ||
| Гистологический тип плоскоклеточного РШМ (данные получены для 23 больных) | Ороговевающий РШМ | 17 | 7.7 ± 1.8 | 0.11 |
| Неороговевающий РШМ | 6 | 4.5 ± 0.9 | ||
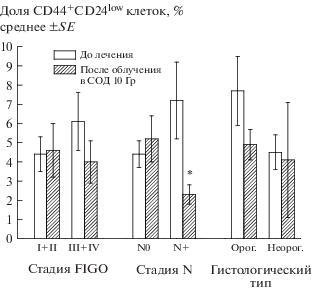
Как и в общей группе больных, доля CD44+CD24low клеток в подгруппах с разными стадиями заболевания или гистологическими типами РШМ не изменялась статистически значимо после первых сеансов облучения в СОД 10 Гр (рис. 4). Однако доля таких клеток статистически значимо уменьшалась в первичном очаге больных, у которых опухолевые клетки были обнаружены в регионарных лимфатических узлах (стадия N+).
Рис. 4.
Средняя доля CD44+CD24low клеток в соскобах с шейки матки до лечения и после облучения в СОД 10 Гр в подгруппах больных РШМ с различными клинико-морфологическими показателями опухолевого процесса. *р = 0.048 по сравнению с исходной долей CD44+CD24low клеток у больных со стадией N+ до лечения.
Fig. 4. The average proportion of CD44+CD24low cells in cervical scrapings before the treatment and after irradiation at a cumulative dose of 10 Gy in subgroups of cervical cancer patients with different clinical and morphological parameters. *p = 0.048 in comparison with the initial proportion of CD44+CD24low cells in patients with stage N+ before the treatment.
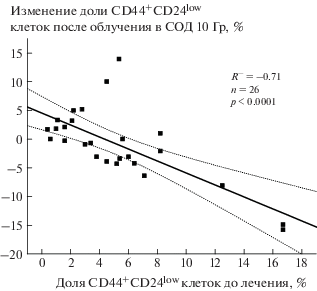
Величина изменений, наблюдаемых на индивидуальном уровне, была обратно пропорциональна исходной доле ОСК до лечения (R = –0.71; p < 0.0001; рис. 5).
Рис. 5.
Корреляция доли CD44+CD24low клеток в соскобах с шейки матки больных РШМ до лечения с изменением этого показателя после облучения в суммарной дозе 10 Гр. По оси ординат показан результат вычитания доли ОСК до лечения из доли ОСК после облучения в указанной дозе. Пунктирные линии показывают границы 95%-ного доверительного интервала для линейной регрессии.
Fig. 5. Correlation of the proportion of CD44+CD24low CSCs in cervical scrapings from patients with cervical cancer before the treatment with a change in this indicator after irradiation at a cumulative dose of 10 Gy. The ordinate axis shows the residual after subtraction of the pretreatment CSC proportion from the proportion of the CSCs after the radiation exposure. Dotted lines indicate the boundaries of the 95% confidence interval for linear regression.
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о наличии существенных различий в относительном количестве ОСК в интактных культурах РШМ известных линий, а также в соскобах с шейки матки больных плоскоклеточным РШМ до лечения. В условиях in vitro поддерживается динамическое равновесие между популяциями стволовых и не стволовых клеток как за счет регуляции асимметричного деления и дифференцировки ОСК, так и за счет перехода части не стволовых опухолевых клеток в пул стволовых [24, 25]. Причем доля ОСК является стабильной величиной в каждой клеточной культуре, поскольку возвращается к своему гомеостатическому уровню в течение 2–3 нед после сортировки на стволовые и не стволовые клетки или после увеличения доли ОСК в ответ на радиационное воздействие [26]. Среди механизмов регуляции пула ОСК в злокачественных опухолях/линиях опухолевых клеток эпителиального происхождения, включая РШМ, важное место занимает эпителиально-мезенхимальная трансзиция (ЭМТ). Как показано для различных локализаций, формирование, по крайней мере, части ОСК зависит от этого процесса [17, 27–30], при этом ЭМТ сопровождается повышением пролиферативной активности клеток [31–33]. Поэтому можно предположить, что многократные различия в доле ОСК, выявленные нами методом SP в культурах HeLa и SiHa (5.40 и 0.25% соответственно), могут объясняться разным уровнем ЭМТ в этих культурах, причем пролиферативная активность ОСК может быть выше в линии HeLa, чем в SiHa. Действительно, уровень экспрессии одного из основных маркеров ЭМТ – виментина – на уровне мРНК выше в первой из них [34].
После радиационного воздействия доля ОСК увеличивалась в культурах обеих линий, но этот эффект был выражен лучше в культуре SiHa, в которой доля ОСК максимально увеличивалась в 28 раз по сравнению с контролем (в то время как максимальное увеличение этого показателя в культуре HeLa составляло лишь 2.6 раза по сравнению с контролем). Эти результаты свидетельствуют, с одной стороны, о более высокой радиорезистентности популяции ОСК по сравнению с остальными клетками в обеих клеточных культурах, а с другой стороны, о том, что это различие в радиорезистентности между ОСК и остальными клетками выражено сильнее в культуре SiHa, возможно, из-за низкой пролиферативной активности ОСК именно в этой культуре. В целом механизмы радиорезистентности ОСК весьма разнообразны и, конечно, не исчерпываются относительно низкой пролиферативной активностью этих клеток по сравнению с основной массой опухолевых клеток, как показано нами и другими авторами [1, 35, 36]. Такие особенности ОСК как относительно небольшое количество радиационно-индуцированных первичных повреждений ДНК, высокая эффективность репарации повреждений ДНК, особое состояние системы окислительно-восстановительного гомеостаза, низкий уровень апоптотической гибели и др. приводят к преимущественному выживанию именно этих клеток после радиационного воздействия, что регистрируется по увеличению доли ОСК после облучения. Вместе с тем пострадиационное повышение доли ОСК может являться следствием не только сохранения жизнеспособности этих клеток после облучения, но также их пролиферации и, как стало понятно в последние годы, следствием дедифференцировки не стволовых клеток под влиянием ЭМТ, которая усиливается под воздействием ионизирующих излучений [37–39].
Резистентность ОСК к однократному острому воздействию редкоионизирующего излучения является широкоизвестным фактом, обнаруженным в культурах опухолевых клеток различного происхождения in vitro, опухолях экспериментальных животных и ксенографтах опухолевой ткани человека в организме иммунодефицитных мышей. Культура РШМ линий HeLa и SiHa не является исключением: резистентность ОСК к однократному облучению была продемонстрирована по многим критериям, включая увеличение доли ОСК, экспрессии генов, вовлеченных в формирование и поддержание стволовых свойств, количества сфероидов после такого воздействия, а также более высокую клоногенную выживаемость облученных ОСК по сравнению с остальными клетками [15–17, 40]. Значительно меньше данных представлено в литературе о влиянии фракционированного облучения на ОСК, причем они касаются, в основном, рака молочной железы, рака предстательной железы и глиомы [41–46], в то время как для РШМ данных крайне мало [11]. В последнем исследовании продемонстрировано более чем 20-кратное повышение доли ОСК в культуре SiHa после фракционированного облучения в суммарной дозе 30 Гр. На примере рака предстательной железы, головы и шеи показано, что длительное фракционированное облучение в суммарных дозах, соответствующих клиническому диапазону (50–70 Гр) и выше него (90 Гр), с успехом может быть использовано для получения радиорезистентных клеточных линий, обогащенных ОСК [47, 48]. Вместе взятые, данные литературы и результаты наших исследований свидетельствуют о резистентности ОСК разных локализаций не только к однократному, но и фракционированному воздействию редкоионизирующего излучения.
Интересно, что в ряде исследований проводилось сопоставление эффектов острого однократного и фракционированного облучения in vitro по критерию изменения доли ОСК, выявляемых по иммунофенотипу в клеточных культурах глиомы [43, 44], или по критерию количества маммосфер, образующихся после облучения стабильных культур рака молочной железы [41]. В этих исследованиях показаны более выраженные эффекты фракционированного облучения по сравнению с однократным. Так, например, в работе Kim et al., 2011 [44] установлено, что доля CD133+ ОСК глиомы повышается по сравнению с контролем примерно в 3 раза при однократном облучении в дозе 6 Гр, и в 6 раз при фракционированном облучении в режиме 3 × 2 Гр. Кроме того, именно после фракционированного облучения авторы показали наибольшее увеличение экспрессии генов Sox2, Notch2, β-катенина и др., связанных со стволовым состоянием клеток. К числу возможных причин более выраженного повышения количества ОСК при фракционированном облучении по сравнению с однократным можно отнести дополнительную индукцию радиорезистентности ОСК между фракциями дозы, многократный пострадиационный отбор наиболее резистентных клеток, многократную индукцию дедифференцировки не стволовых клеток после каждой фракции дозы.
Несомненно, регуляция пула ОСК в условиях in vivo до использования противоопухолевых воздействий и, особенно, после их применения – значительно более сложный процесс, чем в клеточных культурах in vitro, поскольку включает влияние множества сигнальных молекул (например, TGF-b1, FGF, IL-6, HIF, Wnt лиганды и т.д.), секретируемых не только опухолевыми, но и различными стромальными клетками, в том числе эндотелиальные, иммунные клетки, опухоль-ассоциированные макрофаги, фибробласты, нормальные стволовые клетки [48, 49]. Кроме клеточных и гуморальных факторов, в формировании пула и биологических свойств ОСК участвуют такие физические факторы как концентрация кислорода и рН внеклеточной среды, влияющие на радиочувствительность. Поэтому выяснение закономерностей радиационного ответа ОСК в злокачественных новообразованиях in vivo представляет отдельный интерес. В данной работе впервые исследовано изменение доли ОСК после первых сеансов дистанционной лучевой терапии РШМ. Доля ОСК была определена в соскобах с шейки матки среди всех ядросодержащих клеток (за исключением лимфоидных) с помощью проточной цитометрии, которая не позволяет проводить одновременный морфологический анализ и идентифицировать опухолевые клетки, поэтому изменение доли ОСК в исследуемом материале после радиационного воздействия может отражать изменение соотношения опухолевые/нормальные клетки и соотношения ОСК/общая масса опухолевых клеток. Тем не менее, хотя относительное количество опухолевых клеток в исследованных соскобах могло уменьшиться после облучения в СОД 10 Гр по сравнению с исходным уровнем, у части (38%) больных зарегистрировано возрастание доли ОСК в ходе лучевой терапии. Причем такое повышение было выражено в наибольшей степени у больных с исходно низким количеством ОСК и, напротив, при высокой доле ОСК до лечения отмечалось снижение этого показателя после облучения (рис. 5). Аналогичная закономерность была продемонстрирована нами ранее в группе больных раком верхних дыхательных путей, у которых сравнивали долю ОСК в биопсийном материале до лечения и после облучения в СОД 10 Гр [50]. В целом такая закономерность согласуется с результатами, полученными in vitro на культурах HeLa и SiHa, свидетельствующими о более выраженном повышении доли ОСК после облучения именно в культуре с исходно низким уровнем ОСК, возможно, из-за относительно низкой пролиферативной активности этих клеток, определяющей их высокую радиорезистентность. В дальнейшем несомненно важной задачей является выяснение прогностического значения количественных изменений ОСК РШМ после первых сеансов лучевой терапии в отношении ближайших и отдаленных результатов лечения. О перспективности работы в этом направлении свидетельствуют результаты, полученные недавно индийскими авторами. В этом исследовании рассматривается значимость маркеров ОСК РШМ (их экспрессия изучалась в биопсийном материале больных после проведения дистанционной лучевой терапии в СОД 46–50 Гр на фоне еженедельного введения цисплатина) для прогноза эффективности полного курса лечения, включающего после дистанционной лучевой терапии проведение внутриполостной брахитерапии до СОД 83 Гр [51, 52].
Таким образом, установлено статистически значимое увеличение доли ОСК (SP) после фракционированного воздействия γ-излучения на клеточные культуры РШМ линий HeLa SiHa в диапазоне суммарных доз 2–10 Гр по сравнению с контролем. Проточноцитометрический анализ доли CD44+CD24low ОСК в соскобах с шейки матки 26 больных плоскоклеточным РШМ до лечения и после воздействия высокоэнергетического фотонного излучения в СОД 10 Гр (в режиме стандартного фракционирования дозы по 2 Гр) продемонстрировал повышение изучаемого показателя у 38% больных после облучения; у остальных больных наблюдалось уменьшение этого показателя или его сохранение на исходном уровне. При сравнении доли ОСК после облучения в подгруппах больных, у которых лучевая терапия проводилось одновременно с еженедельным введением препарата цисплатин (n = 20) или без него (n = 6), различий не обнаружено. Однако из-за относительно небольшого количества больных сравнительные данные о динамике ОСК при СЛТ и ХЛТ следует считать предварительными. В целом полученные результаты свидетельствуют о наличии существенных индивидуальных различий в ответе ОСК РШМ на радиационное воздействие, а также обосновывают принципиальную возможность дальнейшего исследования прогностической значимости количественных изменений ОСК после первых сеансов лучевой терапии в отношении ближайших и отдаленных результатов лечения.
Список литературы
Dubrovska A. Report on the International Workshop “Cancer stem cells: The mechanisms of radioresistance and biomarker discovery” // Int. J. Radiat. Biol. 2014. V. 90. № 8. P. 607–614.
Rycaj K., Tang D.G. Cancer stem cells and radioresistance // Int. J. Radiat. Biol. 2014. V. 90. № 8. P. 615–621.
Pavlopoulou A., Oktay Y., Vougas K. et al. Determinants of resistance to chemotherapy and ionizing radiation in breast cancer stem cells // Cancer Lett. 2016. V. 380. № 2. P. 485–493.
Yang F., Xu J., Tang L., Guan X. Breast cancer stem cell: the roles and therapeutic implications // Cell. Mol. Life Sci. 2017. V. 74. № 6. P. 951–966.
Матчук О.Н., Саенко А.С. Влияние редкоионизирующего излучения и химиопрепаратов на опухолевые стволовые клетки (SP) меланомы B16 и аденокарциномы молочной железы MCF-7 // Радиация и риск. 2013. Т. 22. № 2. С. 67–76. [Matchuk O.N., Saenko A.S. Vlijanie redkoionizirujushhego izluchenija i himiopreparatov na opuholevye stvolovye kletki (SP) melanomy B16 i adenokarcinomy molochnoj zhelezy MCF-7 [Irradiation and chemotherapy drug effects on cancer stem cells (SP) of melanoma B16 and breast adenocarcinoma MCF-7] // Radiatsija i risk. Bjulleten’ Nacional’nogo radiacionno-jepidemiologicheskogo registra – Radiation and Risk. 2013. V. 22. № 2. P. 67–76 (In Russian)]
Матчук О.Н., Замулаева И.А., Селиванова Е.И. и др. Чувствительность клеток SP линии меланомы В16 к действию редко- и плотноионизирующего излучений // Радиац. биология. Радиоэкология. 2012. Т. 52. № 3. P. 261–267. [Matchuk O.N., Zamulaeva I.A., Selivanova E.I., Lipunov N.M., Pronjushkina K.A, Ul’janenko S.E., Lychagin A.A., Smirnova S.G., Orlova N.V., Saenko A.S. Chuvstvitel’nost’ kletok SP linii melanomy B16 k dejstviju redko- i plotnoionizirujushhego izluchenij [Sensitivity of Melanoma B16 Side Population to Low- and High-LET Radiation]. Radiatsionnaja biologija. Radiojekologija – Radiats. Biol. Radioecol. 2012. V. 52. № 3. P. 261-267 (In Russian) ]
Takebe N., Miele L., Harris P.J. et al. Targeting Notch, Hedgehog, and Wnt pathways in cancer stem cells: clinical update // Rev. Clin. Oncol. 2015. V. 12. № 8. P. 445–464.
Ahmed M., Chaudhari K., Babaei-Jadidi R. et al. Concise Review: Emerging Drugs Targeting Epithelial Cancer Stem-Like Cells // Stem Cells. 2017. V. 35. № 4. P. 839–850.
Kuhlmann J.D., Hein L., Kurth I. et al. Targeting Cancer Stem Cells: Promises and Challenges // Anticancer Agents Med. Chem. 2016. V. 16. № 1. P. 38–58.
Shen S., Xia J.X., Wang J. Nanomedicine-mediated cancer stem cell therapy // Biomaterials. 2016. V. 74. P. 1–18.
Liu H., Wang Y.J., Bian L. et al. CD44+/CD24+ cervical cancer cells resist radiotherapy and exhibit properties of cancer stem cells // Eur. Rev. Med. Pharmacol. Sci. 2016. V. 20. № 9. P. 1745–1754.
Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) / Под ред. А.Д. Каприна, В.В. Cтаринского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ “НМИРЦ” Минздрава России, 2017. 250 с. [Zlo-kachestvenny`e novoobrazovaniya v Rossii v 2015 godu zabolevaemost` i smertnost`) [Malignant neoplasms in Russia in 2015 (morbidity and mortality)] / Pod red. A.D. Kaprina, V.V. Ctarinskogo, G.V. Petrovoj. M.: MNIOI im. P.A. Gercena – filial FGBU “NMIRCz” Minzdrava Rossii, 2017. 250 s. (In Russian)]
Крикунова Л.И., Сыченкова Н.И., Шентерева Н.И., Мкртчян Л.С. Лучевая терапия в онкогинекологии // Терапевтическая радиология: Руководство для врачей / Под ред. А.Ф. Цыба, Ю.С. Мардынского. М.: Мед. книга, 2010. С. 347–383. [Krikunova L.I., Sy`chenkova N.I., Shentereva N.I., Mkrtchyan L.S. Luchevaya terapiya v onkoginekologii [Radiotherapy in oncogynecology]. Glava v knige “Terapevticheskaya radiologiya”. Rukovodstvo dlya vrachej / Pod red. A.F. Cyba, Yu.S. Mardy`nskogo. M.: Medicinskaya kniga, 2010. S. 347–383 (In Russian)]
Kumazawa S., Kajiyama H., Umezu T. et al. Possible association between stem-like hallmark and radioresistance in human cervical carcinoma cells // J. Obstet. Gynaecol. Res. 2014. V. 40. № 5. P. 1389–1398.
Wang K., Zeng J., Luo L. et al. Identification of a cancer stem cell-like side population in the HeLa human cervical carcinoma cell line // Oncol. Lett. 2013. V. 6. № 6. P. 1673–1680.
Qi W., Zhao C., Zhao L. et al. Sorting and identification of side population cells in the human cervical cancer cell line HeLa // Cancer Cell Int. 2014. V. 14. № 1. Article 3.
López J., Poitevin A., Mendoza-Martínez V. et al. Cancer-initiating cells derived from established cervical cell lines exhibit stem-cell markers and increased radioresistance // BMC Cancer. 2012. V. 12. № 48. P. 1–1.
Feng D., Peng C., Li C. et al. Identification and characterization of cancer stem-like cells from primary carcinoma of the cervix uteri // Oncol. Reports. 2009. V. 22. P. 1129–1134.
Wu H., Zhang J., Shi H. Expression of cancer stem markers could be influenced by silencing of p16 gene in HeLa cervical carcinoma cells // Eur. J. Gynaecol. Oncol. 2016. V. 37. № 2. P. 221–225.
Leone J., Perez J.E., Dominguez M.E. et al. Role of difucosylated Lewis Y antigen in outcome of locally advanced cervical squamous cell carcinoma treated with cisplatin regimen // Int. J. Biol. Markers. 2016. V. 31. № 3. P. 300–308.
Gu W., Yeo E., McMillan N., Yu C. Silencing oncogene expression in cervical cancer stem-like cells inhibits their cell growth and self-renewal ability // Cancer Gene Therapy. 2011. V. 18. P. 897–905.
Li J., Zhou B.P. Activation of b-catenin and Akt pathways by Twist are critical for the maintenance of EMT associated cancer stem cell-like characters // BMC Cancer. 2011. V.11. Article 49.
Liu H., Wang Y.J., Bian L. et al. CD44+/CD24+ cervical cancer cells resist radiotherapy and exhibit properties of cancer stem cells // Eur. Rev. Med. Pharmacol. Sci. 2016. V.20. № 9. P. 1745–1754.
Chaffer C.L., Brueckmann I., Scheel C. et al. Normal and neoplastic nonstem cells can spontaneously convert to a stem-like state // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 19. P. 7950 –7955.
Iliopoulos D., Hirsch H.A., Wang G., Struhl K. Inducible formation of breast cancer stem cells and their dynamic equilibrium with non-stem cancer cells via IL6 secretion // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 4. P. 1397–1402.
Yang G., Quan Y., Wang W. et al. Dynamic equilibrium between cancer stem cells and non-stem cancer cells in human SW620 and MCF-7 cancer cell populations // Brit. J. Cancer. 2012. V. 106. P. 1512–1519.
Garg M. Epithelial plasticity and cancer stem cells: Major mechanisms of cancer pathogenesis and therapy resistance // World J. Stem. Cells. 2017. August 26. V. 9. № 8. P. 118–126.
Chen C., Wei Y., Hummel M. et al. Evidence for epithelial-mesenchymal transition in cancer stem cells of head and neck squamous cell carcinoma // PLoS One. 2011. V. 6. № 1. e16466.
Aguilar E., Marin de Mas I., Zodda E. et al. // Metabolic Reprogramming and Dependencies Associated with Epithelial Cancer Stem Cells Independent of the Epithelial-Mesenchymal Transition Program. // Stem. Cells. 2016. V. 34. № 5. P. 1163–1176.
Biddle A., Liang X., Gammon L. et al. Cancer stem cells in squamous cell carcinoma switch between two distinct phenotypes that are preferentially migratory or proliferative // Cancer Res. 2011. V. 71. № 15. P. 5317–5326.
Jiang Y.G., Luo Y., He D.L. et al. Role of Wnt/beta-catenin signaling pathway in epithelial-mesenchymal transition of human prostate cancer induced by hypo-xia-inducible factor-1alpha // Int. J. Urol. 2007. V. 14. № 11. P. 1034–1039.
Geng S., Guo Y., Wang Q. et al. Cancer stem-like cells enriched with CD29 and CD44 markers exhibit mole-cular characteristics with epithelial-mesenchymal transition in squamous cell carcinoma // Arch. Dermatol. Res. 2013. V. 305. № 1. P. 35–47.
Xu G., Qi F., Zhang J. et al. Overexpression of OCT4 contributes to progression of hepatocellular carcinoma // Tumour Biol. 2016. V. 37. № 4. P. 4649–4654.
Human Protein Atlas (Project of The Knut and Alice Wallenberg Foundation, Sweden) available from https://www.proteinatlas.org/ENSG00000026025-VIM/cell
Krause M., Dubrovska A., Linge A., Baumann M. Cancer stem cells: Radioresistance, prediction of radiothe-rapy outcome and specific targets for combined treatments // Adv. Drug. Deliv. Rev. 2017. V. 109. P. 63–73.
Матчук О.Н., Замулаева И.А., Ковалев О.А., Саенко А.С. Механизмы радиорезистентности клеток SP культуры мышиной меланомы В16 // Цитология. 2013. Т. 55. № 8. С. 553–559. [Matchuk O.N., Zamulaeva I.A., Kovalev O.A., Saenko A.S. Mekhanizmy padiorezistentnosti kletok SP kul’tury myshinoy melanomy B16 [Radioresistance mechanisms of side population cells in mouse melanoma cell line B16] // Citologija. 2013. V.55. № 8. P. 553–559. (In Russian)]
Li F., Zhou K., Gao L. et al. Radiation induces the ge-neration of cancer stem cells: A novel mechanism for cancer radioresistance // Oncol. Lett. 2016. V. 12. № 5. P. 3059–3065.
Gao X., Sishc B.J., Nelson C.B. et al. Radiation-Induced Reprogramming of Pre-Senescent Mammary Epithelial Cells Enriches Putative CD44(+)/CD24(-/low) Stem Cell Phenotype // Front. Oncol. 2016. № 6. Article 138.
Lee S.Y., Jeong E.K., Ju M.K. et al. Induction of meta-stasis, cancer stem cell phenotype, and oncogenic metabolism in cancer cells by ionizing radiation // Mol. Cancer. 2017. V.16. № 1. Article 10.
Chhabra R. Cervical cancer stem cells: opportunities and challenges // J. Cancer Res. Clin. Oncol. 2015. V. 141. № 11. P. 1889–1897.
Phillips T.M., McBride W.H., Pajonk F. The response of CD24-/low/CD44+ breast cancer-initiating cells to radiation // J. Natl. Cancer Inst. 2006. V. 98. P. 1777–1785.
Lagadec C., Vlashi E., Della Donna L. et al. Survival and self-renewing capacity of breast cancer initiating cells during fractionated radiation treatment // Breast Cancer Res. 2010. V. 12. № 1. Article R13.
Gao X., McDonald J.T., Hlatky L., Enderling H. Acute and fractionated irradiation differentially modulate glioma stem cell division kinetics // Cancer Res. 2013. V.73. № 5. P. 1481–1490.
Kim M.J., Kim R.K., Yoon C.H. et al. Importance of PKCδ signaling in fractionated-radiation-induced expansion of glioma-initiating cells and resistance to cancer treatment // J. Cell Sci. 2011. V. 124. P. 3084–3094.
Kim R.K., Suh Y., Cui Y.H. et al. Fractionated radiation-induced nitric oxide promotes expansion of glioma stem-like cells // Cancer Sci. 2013. V. 104. № 9. P. 1172–1177.
Cojoc M., Peitzsch C., Kurth I. et al. Aldehyde Dehydrogenase Is Regulated by β-Catenin / TCF and Promotes Radioresistance in Prostate Cancer Progenitor Cells // Cancer Res. 2015. V. 75. № 7. P.1482–1494.
Cho K.J., Park E.J., Kim M.S., Joo Y.H. Characterization of FaDu-R, a radioresistant head and neck cancer cell line, and cancer stem cells // Auris Nasus Larynx. 2018. V. 45. № 3. P. 566–573.
Skvortsov S., Skvortsova I.I., Tang D.G., Dubrovska A. Prostate Cancer Stem Cells: Current Understanding // Stem Cells. 2018. V. 36. № 10. P. 1457–1474.
Batlle E., Clevers H. Cancer stem cells revisited // Nature Medicine. 2017. V. 23. № 10. P. 1124–1132.
Замулаева И.А., Матчук О.Н., Селиванова Е.И. и др. Увеличение количества опухолевых стволовых клеток под воздействием редкоионизирующего излучения // Радиац. биология. Радиоэкология. 2014. Т. 54. № 3. С. 256–264. [Zamulaeva I.A., Matchuk O.N., Selivanova E.I. i dr. Uvelichenie kolichestva opukholevykh stvolovykh kletok pod vozdeystviem redkoioniziruyuschego izluchenija [Increase in the Number of Cancer Stem Cells after Exposure to Low-LET Radiation] // Radiatsionnaja biologija. Radiojekologija – Radiats. Biol. Radioecol. 2014. V. 54. № 3. P. 256–264 (In Russian)]
Chopra S., Deodhar K., Pai V. et al. Cancer Stem cells, CD44 and outcomes following chemoradiation in locally advanced cervical cancer: Results from a prospective study // Int. J. Radiat. Oncol. Biol. Phys. 2019. V. 103. № 1. P. 161–168.
Javed S., Sharma B.K., Sood S. et al. Significance of CD133 positive cells in four novel HPV-16 positive cervical cancer-derived cell lines and biopsies of invasive cervical cancer // BMC Cancer. 2018. V. 18. № 1. P. 357.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


