Радиационная биология. Радиоэкология, 2019, T. 59, № 6, стр. 565-574
ОСОБЕННОСТИ ЭКСПРЕССИИ ГЕНОВ СИГНАЛЬНОГО ПУТИ NF-kB В ТКАНЯХ ОБЛУЧЕННЫХ МЫШЕЙ И У СТАРЫХ ЖИВОТНЫХ
А. Е. Бигильдеев 1, *, Ю. Ф. Чепурных 1, Н. А. Петинати 1, Н. И. Дризе 1
1 НМИЦ гематологии Минздрава России
Москва, Россия
* E-mail: bigildeev.ae@gmail.com
Поступила в редакцию 07.02.2018
Аннотация
Факторы транскрипции семейства NF-kB сопрягают внешний сигнал от провоспалительных цитокинов и транскрипцию их генов-мишеней. Ранее было показано, что в периферической крови облученных молодых и интактных старых мышей поддерживается повышенный уровень интерлейкина-1β, который представляет собой одновременно активатор и мишень сигнального пути NF-kB. Мы предположили, что при индуцированном радиационном и естественном старении в различных тканях организма могут проходить схожие процессы, сопровождающиеся активацией NF-kB. Для проверки этой гипотезы и установления особенностей индуцированного и естественного старения в работе на уровне транскрипции исследовали экспрессию генов семейства NF-kB, его регуляторного комплекса IKK и генов-мишеней NF-kB в костном мозге, селезенке, тимусе, печени и мышцах облученных мышей через 3 мес. после экспозиции и в тех же тканях старых мышей. Из тканей выделяли РНК, проводили обратную транскрипцию с последующей ПЦР в режиме реального времени. Показано, что в целом характер изменений экспрессии NF-kB отличается у облученных и старых животных и, к тому же, зависит от типа ткани. Биохимические процессы, протекающие при естественном и ускоренном радиационном старении, затрагивают сигнальный путь NF-kB, но детали его активации отличаются при этих состояниях. Однако были выявлены общие тенденции. В костном мозге общим для облучения и старения является снижение экспрессии гена Nemo, кодирующего субъединицу регуляторного IKK-комплекса NF-kB, а в тимусе – снижение экспрессии гена Ikkb, кодирующего другую субъединицу того же IKK-комплекса, что указывает на важную роль этих генов в поддержании нормального функционирования кроветворной ткани. У старых мышей экспрессия гена, кодирующего ИЛ-1β, была увеличена в тимусе, селезенке и печени. Продукция этими тканями ИЛ-1β может вносить вклад в повышение его концентрации в периферической крови.
Семейство факторов транскрипции NF-kB играет важную роль в индукции воспаления [1]. В клетках млекопитающих можно обнаружить пять различных представителей этого семейства: p65 (RelA), RelB, c-Rel (Rel), p50/p105 (NF-kB1) и p52/p100 (NF-kB2). Они образуют друг с другом гомо- и гетеродимеры [2]. В неактивном состоянии они находятся в цитоплазме и связаны с ингибиторными белками семейства IKB, которые препятствуют перемещению NF-kB в ядро (рис. 1).
Существуют классический и альтернативный пути активации NF-kB. В классическом пути активация происходит при участии провоспалительных цитокинов, например, при связывании ИЛ-1β с рецептором I-го типа (ИЛ-1Р1). В результате последовательных фосфорилирований и убиквитинирований, происходит активация β-субъединицы киназного комплекса (IKKβ) фосфорилирующего IKB по двум остаткам серина. Это приводит к последующему убиквитинированию IKB убиквитин лигазой SCF-βTrCP и далее к его протеасомному расщеплению. Расщепление IKB открывает сигнальную последовательность, что ведет к транслокации белков NF-kB в ядро. Кристаллографический анализ показал, что субъединицы IKB комплекса связывают димеры p65/p50 или p65/cRel таким образом, что IKB закрывает сигнальную последовательность, расположенную на p65, необходимую для транслокации факторов транскрипции в ядро [1].
Альтернативный путь запускается цитокинами семейства фактора некроза опухолей (ФНО). При этом IKKα активируется и фосфорилирует р100, связанный с RelB, которые существуют в виде гетеродимера, не связанного с IKB комплексом. Гетеродимер p100/RelB не может перемещаться в ядро, так как p100 закрывает сигнальную последовательность, расположенную на RelB. Далее р100 узнается и убиквитинируется убиквитин лигазой SCF-βTrCP и подвергается протеасомному процессингу или деградации. В результате процессинга часть p100 отщепляется, и образуется p52. В результате деградации p100 расщепляется, а с RelB связывается другой член семейства NF-kB. Таким образом, открывается сигнальная последовательность, расположенная на RelB, и факторы перемещаются в ядро, активируя транскрипцию своих генов-мишеней. Число генов-мишеней NF-kB велико, в их список входят члены ИЛ-1 семейства цитокинов, в том числе ИЛ-1β, циклооксигеназа 2, NF-kB1 [3], NF-kB2 [4], белки семейства IKB [5]. Таким образом, ген, кодирующий ИЛ-1β, представляет собой одновременно и ключевой активатор и мишень сигнального пути NF-kB.
Ранее было показано, что облучение мышей в высоких дозах приводит к пролонгированному повышенному содержанию ИЛ-1β в периферической крови облученных животных [6]. Обнаружено, что облучение индуцирует экспрессию ИЛ-1β в клетках костей, однако причины этой активации не были установлены. Последующие эксперименты выявили корреляцию между экспрессией ИЛ-1β и генов семейства NF-kB в стромальных клетках-предшественницах костного мозга [7]. В крови старых мышей также наблюдается стабильно повышенный уровень ИЛ-1β [6]. Мы предположили, что при старении и после облучения в высоких дозах в организме происходят схожие процессы, связанные с активацией сигнального пути NF-kB в тканях, что проявляется в виде повышенной секреции ИЛ-1β в периферическую кровь. Эта гипотеза легла в основу данной работы. У молодых мышей через 3 мес. после облучения в сублетальной дозе (6 Гр) и у старых необлученных мышей измеряли относительный уровень экспрессии генов, кодирующих факторы транскрипции NF-kB (Nfkb1, Nfkb2, Rel, Rela, Relb) и их мишеней (Il1b, Ikba), а также генов, кодирующих регуляторный комплекс IKK (Ikka, Ikkb, Nemo) в костном мозге, тимусе, селезенке, печени и мышцах. Референс контролем был уровень экспрессии указанных генов в соответствующих тканях необлученных молодых мышей той же линии. Обнаруженные изменения в экспрессии генов сравнивали у облученных и старых мышей, анализировали взаимосвязь экспрессии генов семейства NF-kB и ИЛ-1β.
МАТЕРИАЛЫ И МЕТОДИКА
Животные
В работе использовали мышей-самок гибридов линии (CBA×C57Black/J6)F1 в возрасте от 5 мес. до 2 лет, полученных из питомника “Столбовая”. Животных содержали в пластиковых клетках с металлической сетчатой крышкой при 12-часовом световом дне, они получали еду и питье без ограничений. Эксперименты были одобрены комиссией по биомедицинской этике при Институте медико-биологических проблем РАН, протокол № 257.
Схема эксперимента
В эксперименте было три группы животных: молодые облученные (n = 3, возраст 5–8 мес.), молодые необлученные (n = 3, возраст 5–8 мес.) и старые необлученные животные (n = 2, возраст 27 мес.). Через 3 мес. из контрольных, облученных и старых животных выделяли кроветворные органы (костный мозг и селезенку), лимфоидные ткани (тимус и селезенка) и органы, не участвующие в кроветворении (печень и мышцы). Из указанных тканей выделяли тотальную РНК. Проводили обратную транскрипцию. Методом ПЦР в реальном времени исследовали относительный уровень экспрессии генов сигнального пути NF-kB, его регуляторного комплекса IKK и генов-мишеней – Ikba и Il1b. Экспрессию генов интереса нормировали на наиболее стабильные гены “домашнего хозяйства”, подобранные индивидуально для каждой ткани (табл. 1).
Таблица 1.
Гены “домашнего хозяйства” для нормализации результатов экспрессии Table 1. Housekeeping genes for normalization of expression data
| Орган/Ткань | Гены, выбранные для нормализации результатов | ||
|---|---|---|---|
| Костный мозг | Tbp | Rpl13a | Sdha |
| Тимус | Tbp | Hmbs | Sdha |
| Селезенка | B2m | Ubs | Sdha |
| Печень | B2m | Rpl13a | Sdha |
| Мышцы | Tbp | Hmbs | Sdha |
Облучение
Мышей подвергали воздействию γ-излучения 60Со на установке “Луч-1” (Россия) в дозе 6 Гр при мощности дозы 417 мГр/мин, фокусное расстояние 100 см.
Выделение РНК
Для выделения РНК были использованы селезенка, печень, тимус, костный мозг и мышцы. Фрагменты тканей селезенки, печени и тимуса были измельчены в стеклянном ручном гомогенизаторе Поттера с 1 мл фосфатно-солевого буфера (ФСБ). Размер измельчавшихся фрагментов варьировал в зависимости от ткани, но в среднем составлял 0,125 см3 (для печени, селезенки, тимуса). Костный мозг вымывали 1 мл ФСБ в пробирку 1.5 мл из полостей двух бедер и двух голеней и превращали в одноклеточную суспензию с помощью шприца с иглами 21G или 23G. Клеточные суспензии центрифугировали при 1500 об/мин в течение 5 мин, надосадочную жидкость сливали, ресуспендировали осадок в 1 мл ФСБ и центрифугировали повторно в тех же условиях. Супернатант сливали, осадок, содержащий клетки, лизировали 600 мкл денатурирующего раствора ДР (25 ммоль/л цитрат натрия (“Sigma”, США), 0.5% N-лаурил саркозин (“ICN Biomedicals”, США), 4 моль/л гуанидина изотиоцианат (“MP Biomedicals”, США), 0.1 моль/л меркаптоэтанол (“MP Biomedicals”, США)). Фрагменты мышц (примерно 0.250 см3) помещали в керамическую ступку, предварительно охлажденную жидким азотом. Добавляли небольшое количество жидкого азота и растирали фрагменты тканей в порошок пестиком, также предварительно охлажденным жидким азотом. В ступку по каплям добавляли 600 мкл раствора ДР, и перемешивали с порошком ткани. РНК выделяли по методу Хомчинского [8], с изменениями, как описано [7].
Обратная транскрипция и ПЦР в реальном времени
Определение уровня экспрессии генов проводили методом обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени (модификация TaqMan) на приборе ABI Prism 7500 (“Applied Biosystems”, США). Для построения первых цепей ДНК после гибридизации мРНК со смесью поли-Т праймеров и случайных гексамеров использовали обратную транскриптазу M-MLV (“Promega”, США) в соответствии с рекомендациями производителя. ПЦР проводили в следующих условиях: предварительный нагрев до 95°С в течение 10 мин, 40 циклов периодических изменений температуры 95°С – 15 с (плавление), 60°С – 45 с (гибридизация праймеров и элонгация). Детекцию флуоресценции проводили в конце каждого этапа элонгации. Последовательности использованных праймеров и зондов приведены в приложении. Данные, полученные в ходе ПЦР, обрабатывали при помощи модифицированного метода ΔΔCt в программе Excel (“Microsoft”, США) [25]. Для каждой мыши находили уровень экспрессии гена интереса по отношению к каждому из выбранных генов домашнего хозяйства, вычисляя значение $\Delta {{C}_{{{{t}_{i}}}}} = {{2}^{{ - (C_{t}^{{GOI}} - C_{t}^{{H{{K}_{i}}}})}}}$, где $C_{t}^{{GOI}}$ – пороговый цикл гена интереса, $C_{t}^{{H{{K}_{i}}}}$ – пороговый цикл для i-го гена домашнего хозяйства. Пороговый цикл для каждого исследованного гена определяли в трех технических повторах. Из этих повторов вычисляли среднее арифметическое и использовали для дальнейших расчетов. Далее усредняли полученный относительный уровень экспрессии по всем мышам экспериментальной группы (контроль, облучение, старые животные). Находили изменение уровня экспрессии гена интереса в экспериментальной группе (облучение, старые животные) к контролю, вычисляя отношение. Таким способом получали значения для каждого i-го гена домашнего хозяйства. После этого вычисляли среднее арифметическое значение $\left\langle {{{R}_{i}}} \right\rangle $ по всем i генам домашнего хозяйства, находя нормализованное по нескольким генам домашнего хозяйства изменение относительного уровня экспрессии гена интереса в опытной группе по отношению к контрольной.
РЕЗУЛЬТАТЫ
В работе исследовали относительный уровень экспрессии генов, кодирующих факторы транскрипции NF-kB, генов регуляторного комплекса IKK и генов-мишеней сигнального каскада NF-kB – IkBa и Il1b, – в различных тканях и органах облученных мышей и старых необлученных животных той же линии. Исследование было проведено на уровне сравнения транскрипции указанных генов в опытных и соответствующих контрольных группах. Основные результаты исследования приведены на рис. 2.
Рис. 2.
Сравнение экспрессии генов в тканях облученных и старых животных. Представлены данные для костного мозга (а, б), селезенки (в, г), тимуса (д, е), печени (ж, з) и мышц (и, к) облученных и старых необлученных мышей той же линии. За 1 принят уровень экспрессии у молодых необлученных мышей (обозначен пунктирными линиями). Приведены средние значения и стандартные ошибки среднего. * Статистически значимые (p < 0.05) отличия от контроля согласно критерию Манна–Уитни.
Fig. 2. Comparison of gene expression level in tissues of irradiated and intact old animals.
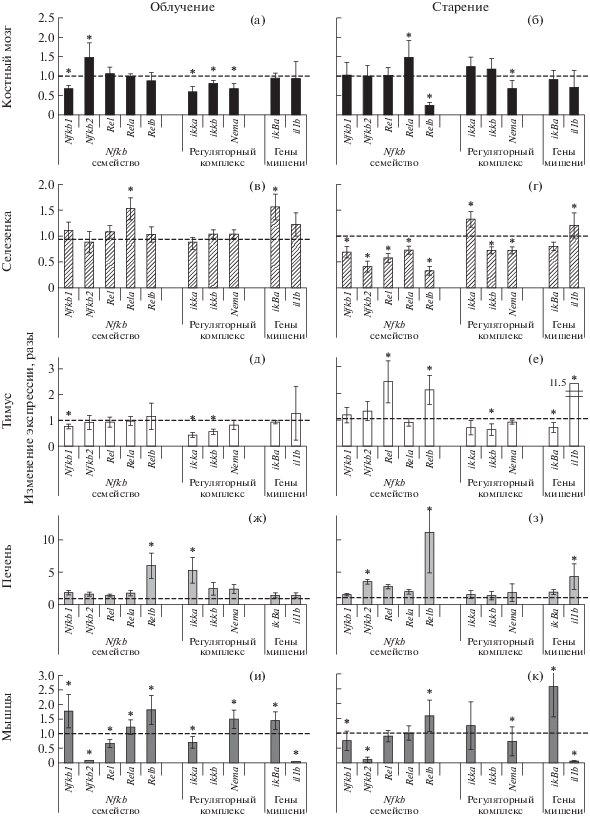
В целом профили относительного уровня экспрессии исследуемых генов в облученных и старых мышах существенно различаются, т.е. процессы, происходящие с участием сигнального пути NF-kB при индуцированном и естественном старении, не сходны в исследуемых тканях. В большинстве случаев изменение экспрессии происходило не более чем в 2–3 раза.
В костном мозге молодых мышей через 3 мес. после облучения снижена экспрессия Nfkb1, и увеличена транскрипция Nfkb2 (рис. 2, а). Экспрессия всех генов, кодирующих регуляторный комплекс IKK, была снижена через 3 мес. после радиационного воздействия. В костном мозге старых мышей наблюдали изменения в экспрессии других генов семейства NF-kB: уровень Relb был снижен, а Rela – повышен (рис. 2, б). У старых мышей также наблюдали сниженный уровень Nemo, в то время как экспрессия двух других генов IKK не отличалась от контроля. Вероятно, Nemo участвует в процессах как индуцированного, так и естественного старения в костном мозге.
В селезенке облученных мышей из всех из-ученных генов NF-kB и IKK была увеличена экспрессия только Rela (рис. 2, в). Одновременно с этим наблюдались изменения в уровне экспрессии генов-мишеней NF-kB: повышение экспрессии IkBa было статистически значимым, а для Il1b была отмечена тенденция к повышению. Это указывает на активацию классического сигнального пути NF-kB в селезенке облученных мышей за счет Rela. У старых животных экспрессия всех исследованных генов сигнального пути NF-kB, за исключением Ikka, была снижена (рис. 2, г). Продукт Ikka задействован в альтернативном пути активации NF-kB. Не было обнаружено статистически значимых изменений в уровне представленности транскриптов гена-мишени NF-kB IkBa, а Il1b был повышен, но несущественно.
Экспрессия генов семейства NF-kB не отличалась от контроля в тимусе мышей через 3 мес. после облучения. Исключение составлял Nfkb1, экспрессия которого была снижена (рис. 2, д). Транскрипционная активность генов IKK-комплекса Ikka и Ikkb также уменьшалась. Уровень генов-мишеней не изменен. В тимусе старых мышей детектировали повышенный уровень экспрессии генов Rel и Relb и сниженный уровень транскрипции Ikkb (рис. 2, е). Наиболее выраженным было увеличение экспрессии Il1b (более чем в 10 раз). Экспрессия IkBa была незначительно снижена.
В печени после облучения повышалась экспрессия всех изученных генов. Статистически значимые отличия от контроля наблюдались для генов Relb и Ikka (рис. 2, ж), участвующих в альтернативном пути активации NF-kB, что указывает на превалирование этого пути над классическим. Повышение экспрессии Relb сопровождалось повышением экспрессии Il1b (рис. 2, з).
Несмотря на то что поперечно-полосатые мышцы не имеют отношения к регуляции иммунитета, в этой ткани обнаружена экспрессия практически всех генов семейства NF-kB и его регуляторного комплекса IKK (исключение составлял только Ikkb, который не экспрессировался ни в одной из исследованных групп животных, что было отличительной особенностью именно этой ткани). Через 3 мес. после облучения, как и у старых животных, наблюдались выраженные изменения экспрессии генов NF-kB, IKK и их мишеней – IkBa и Il1b (рис. 2, и, к). Характер этих изменений был во многом схож между экспериментальными группами. И у облученных, и у старых животных уровень экспрессии IkBa, Relb был повышен, а Nfkb2 и Il1b – существенно снижен.
Обобщенные результаты по исследованию изменения уровня экспрессии генов семейства NF-kB и его регуляторного комплекса IKK через 3 мес. после облучения приведены в табл. 2.
Таблица 2.
Сравнение отдаленных эффектов облучения в различных тканях Table 2. Comparison of long-term effects of irradiation in different tissues
| Путь активации | Ген/Ткань | Костный мозг | Тимус | Селезенка | Печень | Мышцы |
|---|---|---|---|---|---|---|
| Классический | Nfkb1 | ↓ | ↓ | – | – | ↑ |
| Rel | – | – | – | – | ↓ | |
| Rela | – | – | ↑ | – | ↑ | |
| Ikkb | ↓ | ↓ | – | – | ||
| Альтернативный | Nfkb2 | ↑ | – | – | – | ↓ |
| Ikka | ↓ | ↓ | – | ↑ | ↓ | |
| Relb | – | – | – | ↑ | ↑ | |
| Оба пути | Nemo | ↓ | – | – | – | ↑ |
В табл. 3 представлены обобщенные результаты по изменению экспрессии генов NF-kB в тканях старых мышей.
Таблица 3.
Сравнение эффектов старения в различных тканях Table 3. Comparison of ageing effects in different tissues
| Путь активации | Ген/Ткань | Костный мозг | Тимус | Селезенка | Печень | Мышцы |
|---|---|---|---|---|---|---|
| Классический | Nfkb1 | – | – | ↓ | ↑ | ↓ |
| Rel | – | ↑ | ↓ | – | – | |
| Rela | ↑ | – | ↓ | – | – | |
| Ikkb | – | ↓ | ↓ | – | ||
| Альтернативный | Nfkb2 | – | – | ↓ | – | ↓ |
| Relb | ↓ | ↑ | ↓ | ↑ | ↑ | |
| Ikka | – | – | ↑ | – | – | |
| Оба пути | Nemo | ↓ | – | ↓ | – | ↓ |
ОБСУЖДЕНИЕ
Экспрессия факторов транскрипции семейства NF-kB у облученных мышей спустя 3 мес. после воздействия отличалась от таковых показателей у контрольных молодых животных во всех исследованных тканях. Аналогичные различия с молодым контролем наблюдались и у старых интактных мышей. В большинстве случаев экспрессия генов изменялась не более чем в 2–3 раза. Обнаруженные отклонения стоит принимать во внимание, поскольку известно, что в случае факторов транскрипции даже небольшие флуктуации в уровне их экспрессии могут приводить к драматическим последствиям в клетках. Снижение концентрации факторов транскрипции в 2 раза, связанное с гаплонедостаточностью, в ряде случаев приводит к развитию тяжелых заболеваний [10].
В костном мозге снижение экспрессии Nfkb1 и повышение Nfkb2 после облучения указывают на пролонгированную активацию альтернативного сигнального пути NF-kB, так как эти гены не только кодируют факторы транскрипции NF-kB, но одновременно являются генами-мишенями NF-kB. Изменения в экспрессии Rela и Relb у старых мышей свидетельствуют о доминировании классического пути активации NF-kB в костном мозге. Таким образом, механизмы радиационного и естественного старения в клетках костного мозга различаются. Снижение уровня экспрессии Nemo в обеих группах говорит о наличии общих черт и о важности Nemo для регуляции пути NF-kB в костном мозге.
В селезенке облученных мышей одновременное увеличение экспрессии Rela и IkBa говорит об активации классического сигнального пути NF-kB. В отличие от облученных животных, у старых мышей изменена экспрессия всех исследованных генов (табл. 2 и 3). Возможно, это обусловлено тем, что при старении изменяется клеточный состав селезнки. Обнаруженное увеличение экспрессии Ikka одновременно с Il1b связано с альтернативным сигнальным путем NF-kB.
В тимусе через длительное время после облучения не наблюдалось активации сигнального пути NF-kB. У старых животных выявленные изменения указывают на активацию обоих сигнальных путей NF-kB, сопровождающуюся существенным повышением уровня транскрипции Il1b. Известно, что с возрастом происходит инволюция тимуса. В нем практически не остается Т-клеток и уменьшается количество стромальных клеток, поддерживающих лимфопоэз, которые заменяются жировыми клетками [11]. Возможно, наблюдаемые отклонения в сигнальном пути NF-kB связаны с изменением клеточного состава тимуса. Как после облучения, так и у старых мышей в этом органе снижена экспрессия Ikkb. Это может отражать важность Ikkb для регуляции пути NF-kB в данной ткани и указывать на возможные параллели в процессах индуцированного и естественного старения тимуса.
Изменения экспрессии исследованных генов в печени облученных мышей свидетельствуют о запуске альтернативного пути NF-kB. Известно, что этот путь активируется после связывания белков семейства фактора некроза опухолей (ФНО) с соответствующими рецепторами. Таким образом, можно предполагать роль белков ФНО в долгосрочных изменениях в печени после облучения. Однако статистически значимого увеличения экспрессии генов-мишеней NF-kB не было обнаружено, что указывает на пороговый характер реализации данного сигнального пути. Это подтверждается тем, что в печени старых мышей выявлено более выраженное повышение экспрессии Relb, что сопровождалось возрастанием уровня транскрипции Il1b (рис. 2, з), т.е. при старении уровень активации NF-kB превышает пороговый, и это влечет за собой повышение экспрессии генов-мишеней. Белок RELB – репрессор транскрипции генов-мишеней сигнального пути NF-kB в случае, если он функционирует в качестве мономера [2]. При образовании гетеродимеров с другими белками семейства NF-kB продукт Relb активирует гены-мишени. Так как в печени одновременно повышалась экспрессия Relb и Il1b, то можно предполагать, что Relb функционировал в составе гетеродимера – активатора экспрессии генов-мишеней сигнального пути NF-kB, в частности Il1b. Предположение о пороговом характере активации подтверждается также данными, полученными в костном мозге, где одновременно с увеличением экспрессии Nfkb2 у облученных мышей и Rela у старых животных наблюдалось понижение экспрессии генов регуляторного комплекса IKK, и не происходила активация экспрессии генов-мишеней NF-kB.
В печени после облучения и у старых животных задействован альтернативный путь активации. Таким образом, в отличие от всех других исследованных тканей процессы естественного и индуцированного старения в печени схожи.
В мышечной ткани облученных и старых мышей транскрипция большинства исследованных генов была изменена. Известно, что при старении сердечной мышцы, представляющей синцитий, происходит снижение уровня экспрессии всех генов семейства NF-kB [12]. В данном исследовании показано, что у старых мышей в ткани поперечно-полосатой мышцы повышалась экспрессия гена Relb, а транскрипция остальных генов была либо снижена, либо не изменена, что согласуется с результатами упомянутого исследования. Различия между облученными и старыми животными заключались в том, что экспрессия Ikka у первых уменьшалась, а у вторых – увеличивалась, а экспрессия Nfkb1 и Nemo, наоборот, увеличивалась у облученных мышей и понижалась у старых. В мышцах при индуцированном и естественном старении затрагиваются оба пути активации факторов семейства NF-kB.
Из табл. 2 видно, что характер наблюдаемых изменений сильно зависел от ткани. Показано, что схожие изменения наблюдались в костном мозге и тимусе облученных животных, при этом в селезенке изменения практически отсутствовали. Наиболее частые изменения наблюдались в мышцах. У старых животных больше были выражены изменения в селезенке (табл. 3). Во всех исследованых тканях уровень экспрессии Relb был разнонаправленно изменен. Этот ген может быть задействован в процессах, происходящих при старении. Благодаря гибкой регуляции, связанной со способностью образовывать мономеры и гетеродимеры, данный белок при старении различных тканей изменяется по-разному. Необходимо отметить, что данное исследование проведено на уровне определения относительного количества мРНК генов сигнального пути NF-kB, а не на уровне белков и их посттрансляционных изменений. Тем временем для факторов транскрипции NF-kB фосфорилирование белков играет важную роль в их активации. В связи с этим применение методов, позволяющих проанализировать именно белки NF-kB и их фосфорилированные формы, даст более полную информацию об изменениях этого сигнального пути после облучения и при старении.
ЗАКЛЮЧЕНИЕ
В этой работе впервые проведено сравнение уровней транскрипции генов сигнального пути NF-kB у мышей, подвергшихся отдаленному (3 мес.) радиационному воздействию в сублетальных дозах, и у старых интактных животных. Исследованные ткани включали кроветворную и некроветворные, различающиеся по клеточному составу и по скорости самообновления. Во многих из них наблюдались изменения экспрессии NF-kB. Были выявлены общие тенденции: в костном мозге общим для облучения и старения является снижение экспрессии гена Nemo, кодирующего субъединицу регуляторного IKK-комплекса NF-kB, а в тимусе – снижение экспрессии гена Ikkb, кодирующего другую субъединицу того же IKK-комплекса. Вероятно, IKK-комплекс играет важную роль для поддержания нормальной физиологической функции костного мозга и тимуса. Другие изменения в синальном пути NF-kB были разнонаправлены и зависели от типа ткани.
В работе оценивали экспрессию двух генов-мишеней сигнального пути NF-kB – IkBa и Il1b. Не установлено однозначной корреляции между экспрессией этих генов и NF-kB. Через 3 мес. после облучения не наблюдалось изменений экспрессии Il1b в печени, селезенке, тимусе, костном мозге и мышцах. Известно, что в сыворотке крови облученных мышей и старых интактных мышей длительное время поддерживается повышенная концентрация ИЛ-1β [6]. Результаты этой работы позволяют заключить, что исследованные ткани не вносят вклад в наблюдаемый эффект у облученных мышей, и источник длительной секреции ИЛ-1β следует искать в других тканях. У старых мышей экспрессия Il1b была увеличена в тимусе, селезенке и печени. Продукция ИЛ-1β этими тканями может участвовать в повышении его концентрации в периферической крови. Связь экспрессии отдельных генов семейства NF-kB и ИЛ-1β остается неоднозначной и нуждается в дальнейшем исследовании. Показано, что биохимические процессы, протекающие при естественном и ускоренном радиационном старении, затрагивают сигнальный путь NF-kB, но отличаются друг от друга в аспекте его активации. Это подтверждается как различиями в экспрессии генов-мишеней, так и генов, кодирующих сами факторы NF-kB. Следует подчеркнуть, что в связи с ограниченным размером выборки полученные результаты носят предварительный характер и могут быть уточнены в последующих экспериментах.
ПРИЛОЖЕНИЕ
Таблица 4.
Последовательности праймеров и зондов, использованные в работе Table 4. Nucleotide sequences of primers and probes used in the study
| Ген | Нуклеотидные последовательности | |
|---|---|---|
| Il1b | F | ATTCTCTTCAGCCAATCTTCA |
| R | AAGGAGCACTTCATCTGTTTA | |
| зонд | FAM-AGAACAAGTCATCCTCATTGCCAC-RTQ1 | |
| Ikba | F | CAGTGTAGCAGTCTTGACGC |
| R | AGCACCCAAAGTCACCAAGT | |
| зонд | FAM-CACACCCCAGCATCTCCACTCCGT-RTQ1 | |
| Ikka | F | ATCCAGATTATGAAGAAGTTG |
| R | AATTTTCTGGTTTGTTGAGCA | |
| зонд | FAM-CAATGTTGTAAAGGCCTGTGATGTTCC-RTQ1 | |
| Ikkb | F | TGAGGGGATGCAGAACTTG |
| R | ATGAAGGTATCTAAGCGCAG | |
| зонд | FAM-CTTCCCGCAGACCACAGCAGTTCTCAAAC-RTQ1 | |
| Nemo | F | CGCTGCCTGGAGGAGAATC |
| R | GGAACTTGCACATGAGGAAC | |
| зонд | FAM-CCAAGCCAGCCAGAGGGAGGAGAAG-RTQ1 | |
| NFKB1 | F | GCAGAAGATGATCCATATTTG |
| R | ATTTGAAGGTATGGGCCATC | |
| зонд | FAM-TTTCATTTGGATCCTTCTTTGACTCATACA-RTQ1 | |
| NFKB2 | F | TCCCAGCCCATCCATGACAG |
| R | CTCATAGAACCGAACCTCAATG | |
| зонд | FAM-TGAAGATTTCTCGAATGGACAAGACAGC-RTQ1 | |
| Rel | F | GCTCTTCCTCCTGTTGTCTC |
| R | CAAAACGAACTTCTATGTCATC | |
| зонд | FAM-ACCCAATTTATGACAACCGTGCTCCAA-RTQ1 | |
| Rela | F | TCCTTTCTCATCCCATCTTTG |
| R | CTTTCTGCACCTTGTCACAC | |
| зонд | FAM-CAAGATCTGCCGAGTGAACCGAAAC-RTQ1 | |
| Relb | F | AGAGCAGCACCGAGGCCAG |
| R | TCACCTCCACCTCCCGCAG | |
| зонд | FAM-CGGAGCTCGATGGCGGGCAGCGTCT-RTQ1 | |
| Ikba | F | CAGTGTAGCAGTCTTGACGC |
| R | AGCACCCAAAGTCACCAAGT | |
| зонд | FAM-CACACCCCAGCATCTCCACTCCGT-RTQ1 | |
| Ubc | R | TCTGCTGTGTGAGGACTGC |
| F | GATGGTCTTACCAGTTAAGG | |
| зонд | ROX-CACCACCGCTGACGATGCAGATCTTTGTGA-BHQ2 | |
| Rpl13a | R | TCTGGAGGAGGAACGGAAGGAAA |
| F | TTGAGGACCTCTGTGAACTTG | |
| зонд | ROX-AAGATGCACTATCGGAAGAAGAAGCAGATC-BHQ2 | |
| Gapdh | R | CGTCCCGTAGACAAAATGGT |
| F | ATGAGGGGGTCGTTGATGG | |
| зонд | ROX-TCGGTGTGAACGGATTTGGCCGTATTG-BHQ2 | |
| TBP | R | GAGAATAAGAGAGCCACGGAC |
| F | TTTTCTTGCTGCTAGTCTGGAT | |
| зонд | ROX-TTCTTCACTCTTGGCTCCTGTGC-BHQ2 | |
| SDHA | F | GAACACTGGAGGAAGCACAC |
| R | CACAGTCAGCCTCATTCAAG | |
| зонд | ROX-CTTTGGAGTACAGACCTGTTATCGAC-BHQ2 | |
| Hmbs | F | GTGTTGCACGATCCTGAAACT |
| R | GTTGCCCATCTTTCATCACTGTA | |
| зонд | ROX-CTCCTTCCAGGTGCCTCAGAAAAGC-BHQ2 | |
Список литературы
Hayden M.S., Ghosh S. Signaling to NF-kB // Genes Dev. 2004. V. 18. № 18. P. 2195–2224.
Saccani S., Pantano S., and Natoli G. Modulation of NF-kappaB activity by exchange of dimers // Mol. Cell. 2003. V. 11. № 6. P. 1563–1574.
Ten R.M., Paya C.V., Israël N. et al. The characterization of the promoter of the gene encoding the p50 subunit of NF-kappa B indicates that it participates in its own regulation // EMBO J. 1992. V. 11. № 1. P. 195–203.
Lombardi L., Ciana P., Cappellini C. et al. Structural and functional characterization of the promoter regions of the NFKB2 gene // Nucl. Acids Res. 1995. V. 23. № 12. P. 2328–2336.
Rupec R.A., Poujol D., Grosgeorge J. et al. Structural analysis, expression, and chromosomal localization of the mouse ikba gene // Immunogenetics. 1999. V. 49. № 5. P. 395–403.
Bigildeev A.E., Zhironkina O.A., Lubkova O.N. et al. Interleukin-1 beta is an irradiation-induced stromal growth factor // Cytokine. 2013. V. 64. № 1. P. 131–137.
Bigildeev A.E., Zezina E.A., Drize N.J. The effects of interleukin-1 beta and gamma-quantum braking radiation on mesenchymal progenitor cells // Mol. Biol. (Mosk.). 2017. V. 51. № 3. P. 393–403.
Chomczynski P., Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on // Nat. Protoc. 2006. V. 1. № 2. P. 581–585.
Schmittgen T.D., Livak K.J. Analyzing real-time PCR data by the comparative C(T) method // Nat. Protoc. 2008. V. 3. № 6. P. 1101–1108.
Seidman J.G., Seidman C. Transcription factor haploinsufficiency: when half a loaf is not enough // J. Clin. Invest. 2002. V. 109. № 4. P. 451–455.
Rezzani R., Nardo L., Favero G., et al. Thymus and aging: morphological, radiological, and functional overview // Age (Dordr). 2014. V. 36. № 1. P. 313–351.
Khatiwala R.V., Zhang S., Li X., et al. Inhibition of p16INK4A to rejuvenate aging human cardiac progeni-tor cells via the upregulation of anti-oxidant and NFκB signal pathways // Stem Cell Rev. Reports. 2018. V. 14. № 4. P. 612–625.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология



