Радиационная биология. Радиоэкология, 2019, T. 59, № 6, стр. 575-584
АНАЛИЗ ОРИЕНТИРОВОЧНО-ИССЛЕДОВАТЕЛЬСКОЙ АКТИВНОСТИ И УРОВНЯ МИКРОГЛИИ У МЫШЕЙ, ПОДВЕРГШИХСЯ ВОЗДЕЙСТВИЮ γ-ИЗЛУЧЕНИЯ В СУБЛЕТАЛЬНЫХ ДОЗАХ
А. В. Родина 1, Ю. П. Сёмочкина 1, М. Г. Ратушняк 1, В. Г. Шуватова 1, Г. А. Посыпанова 1, Е. Ю. Москалёва 1, *
1 НИЦ Курчатовский институт
Москва, Россия
* E-mail: Moskaleva_EY@nrcki.ru
Поступила в редакцию 07.01.2019
Аннотация
Исследовано влияние γ-излучения в сублетальных дозах (общее облучение) на двигательную и ориентировочно-исследовательскую активность мышей и количество клеток покоящейся и активированной микроглии в мозге. При анализе двигательной активности животных в динамике после радиационного воздействия в дозах 1, 2 и 4 Гр в тесте “Открытое поле” статистически значимых различий с контролем не обнаружено. Количество стоек было снижено через 2 нед и через 1 мес. после облучения, но спустя 2 и 3 мес. после воздействия не отличалось от такового показателя в контроле. Снижение числа лейкоцитов в крови на 50% и ниже на 7–14-е сутки после облучения позволяло прогнозировать возможность нарушения ориентировочно-исследовательской активности животных через месяц после облучения. Обнаружено дозозависимое снижение количества клеток микроглии в первую неделю после облучения и их повышение через месяц после воздействия. Количество клеток активированной микроглии было повышено только в 1-е сутки после облучения. Полученные данные свидетельствуют об отсутствии признаков нейровоспаления в отдаленный период после общего облучения мышей в дозах 1, 2 и 4 Гр. Наблюдаемое снижение ориентировочно-исследовательской активности через 2 нед и через 1 мес. после воздействия может быть связано с ингибированием нейрогенеза в гиппокампе, нарушением процессов нейротрансмиссии и повреждением структуры нейронов.
Влияние разных видов ионизирующих излучений на ЦНС – проблема, которой посвящено большое количество работ в связи с актуальностью изучения отдаленных последствий действия на человека радиационных факторов при техногенных авариях и лучевой терапии, а также моделирования дальних космических полетов [1–5]. Однако клеточные механизмы формирования отдаленных нарушений высшей нервной деятельности при облучении в низких и умеренных дозах изучены недостаточно.
При действии γ-излучения, протонов и ускоренных ионов в диапазоне низких доз обнаружено угнетение нейрогенеза, вызванное гибелью высоко радиочувствительной популяции нейральных стволовых (НСК) и прогениторных клеток в субгранулярной зоне зубчатой извилины, что приводит к снижению образования новых нейронов в мозге, нарушению способности к обучению и снижению памяти у экспериментальных животных [6]. Аналогичные изменения выявлены и у больных, перенесших лучевую терапию злокачественных опухолей головы и шеи [7].
Другой механизм развития когнитивных нарушений в отдаленный период после облучения мозга связывают с повреждением клеток ЦНС в результате развития окислительного стресса и нейровоспаления, в основе которого лежат активация клеток микроглии и секреция ими провоспалительных цитокинов [8–12].
Клетки микроглии образуются в период раннего эмбрионального развития из миелоидных клеток-предшественников костного мозга. Далее во взрослом головном мозге пул микроглии поддерживается в результате сбалансированных процессов пролиферации и гибели клеток путем апоптоза так, что за время жизни микроглия обновляется целиком несколько раз [13]. В процессе развития эмбриона этот специализированный класс глиальных клеток участвует в ремоделировании синапсов и регуляции ангиогенеза. Во взрослом организме клетки микроглии участвуют в устранении ненужных синапсов, в регуляции нейрогенеза, в ремоделировании сосудистой сети ЦНС (например, при инсульте), в развитии реакций клеточного иммунитета и воспаления [14].
Активация микроглии при локальном облучении мозга в дозах порядка 10–60 Гр при лучевой терапии и ее роль в нарушении когнитивных функций в отдаленный период после такого облучения установлены, и в настоящее время продолжается исследование механизмов активации микроглии и ее роли в развитии нейровоспаления [15, 16]. В то же время при общем облучении в умеренных дозах, которые могут вызывать развитие лучевой болезни без летального исхода, эта проблема изучена мало [17, 18].
Целью настоящей работы было исследование влияния γ-излучения (общее воздействие) на двигательную и ориентировочно-исследовательскую активность мышей и количество клеток покоящейся и активированной микроглии в мозге в динамике после воздействия, а также оценка сопряженности этих показателей с нарушениями кроветворения.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. В экспериментах использовали самцов мышей инбредной линии C57BL/6, полученных из питомника “Столбовая”, массой 18–21 г. Животных содержали в стандартных условиях вивария. Корм и воду грызуны получали ad libitum. Все эксперименты с животными проводили в соответствии с требованиями этического комитета НИЦ “Курчатовский институт”.
Облучение мышей. Мышей подвергали воздействию γ-излучения от источника кобальт-60 на установке “ГУТ-200М” при комнатной температуре в дозах 1, 2 и 4 Гр (мощность дозы 0.75 Гр/мин).
Анализ поведения мышей в тесте “Открытое поле”. Для проведения теста “Открытое поле” использовали круглую арену диаметром 1200 мм, окруженную стенками высотой 450 мм. Пол арены и стенки изготовлены из серого поливинилхлорида. Перед помещением в арену каждого следующего животного стенки и пол протирали 70%-ным раствором этанола. Для тестирования каждое животное помещали в центр открытого поля и давали 300 с для свободного обследования арены. Во время тестирования проводили видеорегистрацию поведения животного при помощи цветной аналоговой видеокамеры WV-CP500G (“Panasonic”, Япония), установленной над центром арены на высоте 2.5 м, и системы видеорегистрации поведения EthoVision XT 8.5 (“Noldus Information Technology”, Нидерланды) при частоте сбора данных 25 кадров в секунду и разрешении видео 768 × 576 пикселей. Полученные видеозаписи поведения анализировали с использованием программы EthoVision XT 8.5. Для каждого кадра автоматически находили точку центра масс-проекции тела животного. В арене выделяли следующие зоны: пристеночная зона (кольцо шириной 100 мм от стенки арены), промежуточная зона (кольцо в области от 100 до 300 мм от стенки арены), центральная зона (непосредственный центр арены, диаметр 600 мм). Проводили автоматический анализ следующих параметров поведения животного: общего пройденного пути в открытом поле (см); общей средней скорости (см/с); пройденного пути в пристеночной зоне (см); пройденного пути в промежуточной зоне (см); пройденного пути в центральной зоне (см); времени, проведенного в пристеночной зоне (с); времени, проведенного в промежуточной зоне (с); времени, проведенного в центральной зоне (с); средней скорости в пристеночной зоне (см/с); средней скорости в промежуточной зоне (см/с); средней скорости в центральной зоне (см/с). Кроме того, подсчитывали общее количество стоек (без опоры и с опорой) при анализе видеозаписи поведения мышей.
Выделение клеток из головного мозга мыши. Выделение клеток из головного мозга контрольных и облученных мышей проводили в соответствии с методом [19]. Для каждого срока исследования одновременно анализировали мозг контрольных и облученных животных. Транскардиальную перфузию для удаления клеток крови проводили после анестезии мышей с использованием смеси золетила (0.04 мг на 1 г массы мыши в фосфатно-солевом буфере, ФСБ) и рометара (25 мкл на 100 г массы мышей), которую вводили в/м из расчета 0.1 мл на 10 г веса мыши. Мозг извлекали, удаляли мозжечок и обонятельные доли, помещали в чашку Петри и промывали холодным ФСБ с сахарозой (20 г/л) и глюкозой (0.9 г/л). Добавляли 2 мл аккутазы, тщательно измельчали мозг, переносили в пробирку, добавляли еще 1 мл аккутазы и инкубировали в течение 15 мин при +37°С в водяной бане при помешивании. Затем добавляли в каждую пробирку по 0.5 мл фетальной бычьей сыворотки (ФБС), помещали в ледяную баню, и гомогенат ткани дважды протирали через нейлоновое сито с диаметром пор 100 мкм (“SPL Lifesciences”, Корея). ), затем 1 раз через сито с диаметром пор 70 мкм, переносили в центрифужные пробирки и центрифугировали при 4°С 7 мин при 500 × g. Супернатант удаляли, осадок ресуспендировали в 20%-ном изотоническом растворе (10 мл на 1 мозг) перколла (“GE Healthcare”, США). На перколл наслаивали 5 мл раствора Хэнкса (“Панэко”, Россия) и центрифугировали 10 мин при 550 × g без торможения. Слой миелина, сконцентрированный в интерфазе, и супернатант удаляли, осадок клеток дважды промывали ФСБ. Клетки ресуспендировали в 0.5 мл ФСБ, добавляли трипановый синий и подсчитывали в камере Горяева.
Фенотипирование клеток мозга мыши. Для идентификации клеток микроглии клетки головного мозга (по 200 тыс. клеток) окрашивали антителами к антигену мыши CD11b, конъюгированными с фикоэритрином, и к CD45, конъюгированными с красителем Alexa 488. Клетки микроглии идентифицировали как субпопуляцию СD11b+/СD45low после двойного окрашивания антителами к CD11b и к СD45, а также с помощью антител к антигену ТМЕМ119. Популяции клеток с фенотипом СD11b+/СD45high или СD68+ соответствуют клеткам активированной микроглии и макрофагам. Кроме отдельно указанных антител, использованные антитела были произведены фирмой “Вiolegend” (США). Разведение антител использовали в соответствии с указаниями фирмы-изготовителя. Для идентификации нейронов использовали антитела к β-тубулину III (клон TUJ1), конъюгированные с Alexa Fluor 488, астроцитов – к глиальному фибриллярному кислому белку (GFAP) – конъюгированные с аллофикоцианином (Miltenyi Biotec, Германия), олигодендроцитов – к антигену O4, коньюгированные с аллофикоцианином (“Miltenyi Biotec”, Германия). Окрашивание флуоресцентно-мечеными антителами к указанным белкам проводили в соответствии с указаниями фирмы-изготовителя антител. Для окрашивания антителами к внутриклеточным антигенам клетки предварительно пермеабилизовали 0.3%-ным раствором тритона Х-100 в ФСБ, содержащем 2% обезжиренного БСА (“Sigma Aldrich”, США) в течение 30 мин при комнатной температуре. Затем добавляли антитела и проводили окрашивание. Флуоресценцию клеток анализировали на проточном цитофлуориметре BD FACSCalibur (“BD Biosciences”, США), оснащенным аргоновым лазером с длиной волны 488 нм, и диодным красным лазером (λ = 635 нм) (Ресурсный центр клеточной и молекулярной биологии). В каждом образце анализировали 10 000 клеток.
Статистическая обработка. Статистическую обработку результатов проводили по методу Стьюдента с использованием компьютерной программы “Origin”". Данные представляли в виде средних значений и стандартной ошибки среднего. Статистически значимыми считали результаты при р < 0.05.
РЕЗУЛЬТАТЫ
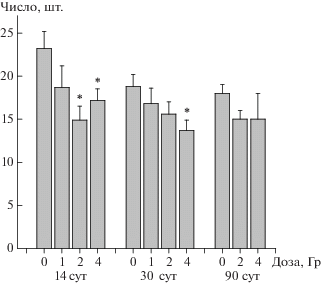
Для анализа поведения облученных в дозах 1, 2 и 4 Гр и контрольных мышей использовали тест “Открытое поле”. По данным автоматического анализа параметров, определяющих поведение животных в динамике после облучения в различных дозах, а именно: время в центре арены, время у стены, время в промежуточной зоне; общая скорость, скорость у стены; общее пройденное расстояние – статистически значимых различий не обнаружено. Различия в поведении мышей выявлены только по количеству стоек, число которых было снижено через 2 нед и через 1 мес. после радиационного воздействия (рис. 1). Снижение количества стоек в тесте “Открытое поле” практически не зависело от дозы облучения мышей: оно наблюдалось через 2 нед после воздействия в дозах 2 и 4 Гр, через месяц – только при дозе 4 Гр. Полученные результаты позволяют заключить, что в отдаленный период после облучения мышей в сублетальных дозах – через 2 нед и 1 мес. – регистрируется снижение ориентировочной реакции, степень которой не зависела от дозы радиационного воздействия (изученный диапазон 1–4 Гр). Через 3 мес. после облучения мышей отличий от контроля по количеству стоек не выявлено.
Рис. 1.
Количество стоек (с опорой и без опоры), выявленное в тесте “Открытое поле” у контрольных и облученных в дозах 1, 2 и 4 Гр мышей в динамике после воздействия. *Отличия от контроля статистически значимы, р < 0.05.
Fig. 1. The number of rearings (with and without support), detected in the test “Open field” in the control and irradiated at doses of 1, 2 and 4 Gy mice in the dynamics after exposure. * Differences from control are significant, p < 0.05.
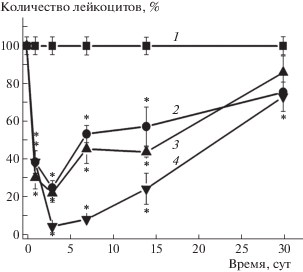
Для контроля степени поражения костного мозга мышей при указанных дозах и скорости восстановления миелопоэза у животных анализировали уровень лейкоцитов периферической крови в динамике после облучения. Как следует из данных, приведенных на рис. 2, степень снижения уровня этих клеток позволяет заключить, что облучение в указанных дозах вызывало у животных острую лучевую болезнь. Количество лейкоцитов после облучения в дозе 1 Гр спустя месяц восстанавливалось до нижней границы нормы, но после воздействия в дозах 2 и 4 Гр оно еще не достигало уровня контроля (рис. 2).
Рис. 2.
Изменение количества лейкоцитов периферической крови у облученных мышей в зависимости от дозы и времени после облучения. Количество лейкоцитов у мышей контрольной группы составляло 13.4 ± 0.6 × 103 клеток/мкл. 1 – контрольные мыши; 2, 3 и 4 – мыши после облучения в дозах 1, 2 и 4 Гр соответственно. *Отличия от контроля статистически значимы, р < 0.05.
Fig. 2. Changes in the number of peripheral blood leukocytes in irradiated mice, depending on the dose and time after irradiation. The number of leukocytes in mice of the control group was 13.4 ± 0.6 × 103 cells/µl. 1 – control mice; 2, 3 and 4 – mice after irradiation at doses of 1, 2 and 4 Gy, respectively. * Differences from control are significant, p < 0.05.
При выделении клеток головного мозга с использованием градиента перколла получали суспензию клеток мозга, не содержавшую агрегатов. Из одного мозга мыши (из его части без мозжечка и обонятельных долей) получали 1.2 ± 0.1 млн клеток, что соответствует данным авторов разработанного метода выделения [19]. Состав полученной фракции клеток мозга мыши характеризовали с использованием иммуноцитохимического метода при окрашивании клеток флуоресцентно мечеными антителами к антигенам CD11b и CD45 или ТМЕМ119 для идентификации клеток микроглии, к β-тубулину III (клон TUJ1) – для идентификации нейронов, к GFAP – для выявления астроцитов, к антигену O4 – для выявления олигодендроцитов при последующей проточной цитометрии. Примеры количественного определения разных типов клеток мозга в составе полученной суспензии показаны на рис. 3, А–Е. Состав полученных клеточных препаратов представлен в табл. 1.
Рис. 3.
Идентификация клеток мозга, выделенных с использованием градиента перколла. А – прямое/боковое светорассеяние клеток мозга мыши; Б – dot-plot гистограмма клеток, окрашенных антителами к CD11b/CD45; область R2 – CD11b/CD45low – соответствует микроглии, R3 – CD11b/CD45high – активированной микроглии; В, Г, Д, Е – определение микроглии по экспрессии ТМЕМ119, нейронов – по экспрессии β-тубулина III; астроцитов – по экспрессии GFAP и олигодендроцитов – по экспрессии О4 соответственно. На рис. В–Д: по оси абсцисс – интенсивность флуоресценции, усл. ед.; по оси ординат – количество клеток, отн. ед.; левый пик – аутофлуоресценция, правый – флуоресценция клеток, окрашенных соответствующими флуоресцентно мечеными антителами.
Fig. 3. Identification of brain cells isolated using a Percoll gradient. A – direct/side light scattering of mouse brain cells; B – dot-plot histogram of cells stained with antibodies to CD11b/CD45; R2 area – CD11b/CD45low cells – corresponds to microglia, R3 – CD11b/CD45high – to activated microglia; C, D, E, F – determination of microglia by expression of TMEM119, neurons – by expression of β-tubulin III; astrocytes – by expression of GFAP and oligodendrocytes – by expression of O4, respectively. In fig. C– E – on the x-axis – fluorescence intensity, arb. unit; on the ordinate axis – the number of cells – relative units; the left peak is auto fluorescence, the right peak is fluorescence of cells stained with the corresponding fluorescently labeled antibodies.
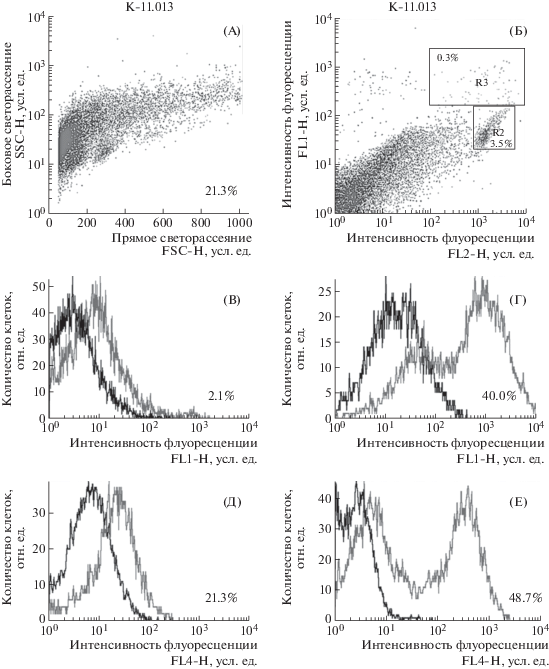
Таблица 1.
Состав препаратов клеток головного мозга контрольных мышей линии C57BL/6, выделенных с использованием одноступенчатого градиента перколла. Выход клеток из одного мозга мыши без мозжечка и обонятельных долей составлял 1.2 ± 0.1 млн Table 1. Composition of the brain cells preparations from C57BL/6 mice isolated using a single-step Percoll gradient. The output of cells from one brain without cerebellum and olfactory lobes was 1.2 ± 0.1 million
| Тип клеток | Маркер | Количество, % Х ± m |
|---|---|---|
| Нейроны | β-тубулин III | 44.3 ± 2.4 |
| Астроциты | GFAP | 16.2 ± 2.2 |
| Олигодендроциты | О4 | 55.7 ± 3.0 |
| Микроглия | CD11b/CD45low | 3.5 ± 0.5 |
| Активированная микроглия | CD11b/CD45high | 0.33 ± 0.01 |
Далее объектом исследования были клетки микроглии и активированной микроглии, выделенные из мозга контрольных и облученных мышей, в динамике после радиационного воздействия в дозах 1, 2 и 4 Гр. Полученные результаты представлены на рис. 4, А. Изменения количества нейронов, астроцитов и олигодендроцитов после облучения в указанных дозах в исследуемой суспензии клеток обнаружены не были.
Рис. 4.
Содержание клеток микроглии с фенотипом CD11b/CD45low (А) и активированной микроглии с фенотипом CD11b/CD45high (Б) в головном мозге мышей в динамике после облучения в дозах 1, 2 и 4 Гр. *Отличия от контроля статистически значимы, р < 0.05.
Fig. 4. The number of microglia cells with the phenotype CD11b/CD45low (A) and activated microglia with the phenotype CD11b/CD45high (B) in the brain of mice in the dynamics after irradiation at doses of 1, 2 and 4 Gy. * Differences from control are significant, p < 0.05.

Как следует из данных, представленных на рис. 4, А, через сутки после облучения в дозах 1, 2 и 4 Гр наблюдается тенденция к снижению количества клеток покоящейся микроглии на 17, 31 и 46% соответственно. Степень снижения была пропорциональна дозе облучения мышей, хотя наблюдаемые изменения не были статистически значимы из-за значительных индивидуальных различий. Существенное снижение количества клеток микроглии было зарегистрировано на 3-и сутки после облучения в дозе 4 Гр. К 7-м суткам количество клеток микроглии начинало восстанавливаться, но у животных, подвергшихся воздействию в дозах 2 и 4 Гр, оно оставалось все еще ниже, чем у контрольных мышей. Через месяц после облучения количество клеток микроглии, выделенных из мозга облученных мышей, превышало уровень контроля. Однако через 2 и даже 3 мес. после воздействия у животных, облученных в дозах 2 и 4 Гр, количество клеток микроглии либо возвращалось к уровню нижней границы нормы, либо статистически значимо снижалось через 3 мес. после облучения в дозе 2 Гр.
Облучение мышей в дозах 1–4 Гр также приводило к изменению количества активированной микроглии в головном мозге (рис. 4, Б). Через сутки после радиационного воздействия обнаружено повышение количества клеток активированной микроглии (значимое при дозах 1 и 2 Гр).
Через 3 сут количество клеток активированной микроглии снижалось (статистически значимо при дозе 4 Гр), а в последующие сроки исследования оно практически не отличалось от контроля.
Для подтверждения данных, полученных в предыдущих экспериментах по количеству клеток микроглии и активированной микроглии через месяц после облучения, была проведена серия дополнительных опытов с использованием антител к высоко специфическому антигену микроглии ТМЕМ119 [20] и к антигену CD68, представленному на клетках преимущественно активированной микроглии и макрофагах (рис. 5). Клетки с фенотипом ТМЕМ119+CD68– соответствуют покоящейся микроглии, с фенотипом ТМЕМ119+CD68+ – преимущественно активированной микроглии, а клетки с фенотипом ТМЕМ119–CD68+ соответствуют макрофагам. Полученные результаты, представленные в табл. 2, подтверждают, что через месяц после общего облучения животных в дозе 2 Гр количество клеток покоящейся микроглии в мозге значимо повышено по сравнению с таковыми показателями у контрольных необлученных мышей.
Рис. 5.
Идентификация клеток микроглии (А) и активированной микроглии (Б) по данным dot-рlot гистограмм клеток, окрашенных антителами к ТМЕМ119 и CD68. По оси абсцисс – интенсивность флуоресценции в канале детекции FL4, усл. ед.; по оси ординат – интенсивность флуоресценции в канале детекции FL1, усл. ед.
Fig. 5. Identification of microglia cells (A) and of activated microglia (B) according to a dot-pot histograms of cells stained with antibodies to TMEM119 and CD68.
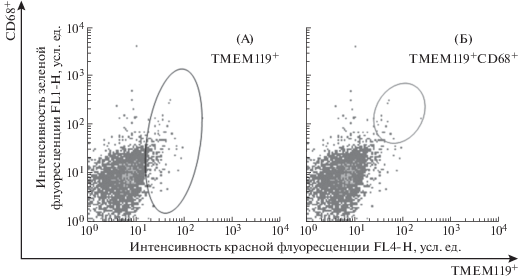
Таблица 2.
Количество клеток микроглии (ТМЕМ119+-клеток), покоящейся (ТМЕМ119+CD68–клеток) и активированной (ТМЕМ119+CD68+-клеток) микроглии, и моноцитов/макрофагов (ТМЕМ119-CD68+-клеток) у контрольных и облученных в дозах 2 и 4 Гр мышей линии C57BL/6 в выделенной фракции клеток через месяц после воздействия Table 2. The number of microglia cells (TMEM119+ cells), resting (TMEM119+ CD68–cells) and activated (TMEM119+ CD68+-cells) microglia and monocytes/macrophages (TMEM119-CD68+-cells) in control and irradiated at doses of 2 and 4 Gy in the cell fraction isolated from C57BL/6 mice brain in a month after exposure
| Тип клеток | Маркер | Количество клеток, % Х ± m |
||
|---|---|---|---|---|
| Контроль | 2 Гр | 4 Гр | ||
| Микроглия вся | ТМЕМ119+ | 2.87 ± 0.29 | 3.64 ± 0.28 | 2.12 ± 0.17 |
| Покоящаяся микроглия | ТМЕМ119+CD68– | 1.67 ± 0.22 | 2.75 ± 0.24* | 1.47 ± 0.11 |
| Активированная микроглия | ТМЕМ119+CD68+ | 1.20 ± 0.20 | 0.89 ± 0.07 | 0.65 ± 0.07* |
| Макрофаги | ТМЕМ119–CD68+ | 0.91 ± 0.09 | 0.65 ± 0.07* | 0.59 ± 0.05* |
Кроме того, обнаружено снижение количества клеток активированной микроглии (на 45.8%, р < 0.05) в мозге мышей, облученных в дозе 4 Гр, в то время как при идентификации активированной микроглии (клеток с фенотипом CD11b/CD45high) это снижение было менее выраженным и составляло только 15% (р > 0.05, рис. 4, Б). Следует также отметить статистически значимое снижение в мозге фракции макрофагов (ТМЕМ119-CD68+-клеток) через месяц после облучения мышей в дозах 2 и 4 Гр (табл. 2).
ОБСУЖДЕНИЕ
При использовании теста “Открытое поле” нами не выявлено изменений в двигательной активности и степени тревожности мышей через 2 нед и 1 мес. после их общего облучения в сублетальных дозах 1, 2 и 4 Гр. В то же время у мышей зарегистрировано снижение ориентировочно-исследовательских реакций через 14 сут после облучения в дозах 2 и 4 Гр и через 30 сут после воздействия в дозе 4 Гр. Спустя 3 мес. поведение контрольных и облученных мышей не различалось (рис. 1). Аналогичные данные об отсутствии нарушений в поведенческих реакциях и памяти мышей через 2 и 5 мес. после общего облучения взрослых мышей в дозе 2 Гр получены в работе [21]. Для контроля когнитивных нарушений авторы использовали как лабиринт Морриса, так и тест распознавания новых объектов. Двигательная активность животных также не была изменена. В то же время снижение активности в поведении мышей, оцениваемой по скорости преодоления барьера, в более отдаленный период – через 12 мес. после воздействия γ-излучения в дозе 2 Гр (и после действия ускоренных ионов 56Fe в эквивалентной дозе 1.6 Гр) – было обнаружено в работе S. Suman и соавт. [22]. При этом необходимо отметить, что различные проявления нарушений функций ЦНС регистрировались в ранний период после воздействия γ-излучения в малых и низких дозах и практически даже в процессе такого облучения [3].
Анализ количества лейкоцитов у животных, подвергшихся воздействию γ-излучения (рис. 2), свидетельствует о том, что после глубокой лейкопении, максимум которой отмечен на 3-и сутки, восстановление количества клеток до 50% от уровня контроля происходит к 7-м суткам при дозе 1 Гр, в период между 7-ми и 14-ми сутками при дозе 2 Гр, и только к 25-м суткам – при дозе 4 Гр.
К 30-м суткам после воздействия в дозах 1 и 2 Гр наблюдали восстановление количества лейкоцитов до нижней границы уровня нормы, в то время как после облучения мышей в дозе 4 Гр оно еще не достигало уровня контроля (рис. 2).
Сравнивая нарушения в поведении мышей через месяц после общего облучения с изменением уровня лейкоцитов периферической крови у животных, можно отметить следующее. Снижение количества лейкоцитов до 50% и ниже по сравнению с контролем в период между 7–14-ми сутками после воздействия позволяет ожидать появление нарушений в поведении животных в отдаленный период – через месяц – после облучения.
При исследовании состояния покоящейся микроглии после общего облучения мышей нами обнаружены снижение количества этих клеток в период 1–7 сут и восстановление данного показателя спустя месяц после облучения во всех исследованных дозах (рис. 4, А). При этом через месяц после облучения наблюдали повышенное содержание клеток покоящейся микроглии после воздействия в дозе 2 Гр (рис. 4, А и табл. 2), что может быть связано с усиленной репопуляцией этого класса глиальных клеток в рассматриваемый период. Таким образом, микроглия восстанавливается при исследованных дозах быстрее, чем костный мозг, как следует из данных о длительной лейкопении (рис. 2). Однако в более отдаленный период – через 2 и 3 мес. после облучения – количество клеток микроглии находится на нижней границе нормы или даже ниже уровня контроля.
При анализе изменения количества клеток активированной микроглии после облучения можно констатировать его повышение только через сутки после воздействия в диапазоне исследованных доз и снижение к 3-м суткам. Начиная с 7-х суток после облучения и до конца исследования – до 3 мес. после облучения – количество клеток активированной микроглии не отличалось от контроля (рис. 4, Б). Активация микроглии через сутки после облучения обусловлена, по-видимому, гибелью радиочувствительных клеток в мозге и происходит под действием продуктов их распада. Действительно, при нейроморфологическом исследовании мозга крыс, подвергшихся воздействию γ-излучения в малых и низких дозах, отмечены тенденция к увеличению деструктивных и некротически измененных нейронов в первые сутки после облучения, которые восстанавливались спустя 6 мес. после воздействия [4], и подавление нейрогенеза [6].
Отсутствие повышения активированной микроглии в отдаленный период после общего облучения в сублетальных дозах может свидетельствовать об отсутствии нейровоспаления в этих условиях. В то же время состояние микроглии может быть различным в разных отделах мозга. Наиболее радиочувствительными клетками мозга являются нейральные стволовые/прогениторные клетки в [6, 23, 24]. Продукты их распада могут локально активировать микроглию в области локализации этих клеток. Однако через месяц после воздействия γ-излучения в дозе 2 Гр не было обнаружено изменения количества клеток микроглии в гиппокампе и уровня экспрессии провоспалительных маркеров в этом отделе и в коре головного мозга [24], что, так же как и полученные нами данные, свидетельствует об отсутствии признаков нейровоспаления после общего облучения мышей в дозе 2 Гр.
Исследования последних лет позволили заключить, что активация микроглии в ЦНС может приводить к образованию клеток с разными свойствами. Микроглия с фенотипом М1 преобладает в зонах повреждения и оказывает цитотоксическое действие, благодаря секреции провоспалительных цитокинов (TNFα, IL-1β) и активных метаболитов кислорода и азота, и обеспечивает первую линию защиты при повреждении. Микроглия с фенотипом М2 оказывает нейропротективное действие, секретирует противовоспалительные цитокины IL-4 и IL-13 [25], хотя различия между этими вариантами могут быть стерты, благодаря существованию переходных популяций микроглии с промежуточными формами активности [26]. Кроме того, активность микроглии находится под контролем микроокружения, в том числе регулируется нейронами. Поэтому для оценки вклада микроглии в повреждение клеток ЦНС в тех или иных условиях целесообразно дополнительно исследовать уровень экспрессии генов провоспалительных цитокинов или их содержание в экстрактах мозга.
Помимо рассмотренных изменений, в настоящее время известно, что облучение мозга может приводить к нарушению процессов нейротрансмиссии, структуры нейронов и процесса ремоделирования синапсов [15], а также к нарушению обмена нейромедиаторов [27]. Эти изменения, наряду с ингибированием нейрогенеза в гиппокампе, при отсутствии активации микроглии и нейровоспаления могут быть основной причиной временных, преходящих изменений в поведении животных при общем облучении в исследованных сублетальных дозах.
ВЫВОДЫ
1. Облучение взрослых мышей самцов в дозах 2 и 4 Гр приводит к временному нарушению ориентировочных реакций, регистрируемых в тесте “Открытое поле”, при полном сохранении двигательной активности через 2 нед и через 1 мес. после облучения, но спустя 2 и 3 мес. поведение облученных животных не отличалось от контроля.
2. Снижение количества лейкоцитов в крови на 50% от уровня нормы и ниже в период между 7–14-ми сутками после радиационного воздействия позволяет ожидать появление нарушений в поведении животных через месяц после облучения.
3. Обнаружено дозозависимое снижение количества клеток микроглии в мозге мышей в первую неделю после облучения и его повышение через месяц после воздействия.
4. Повышение количества клеток активированной микроглии обнаружено только в 1-е сутки после облучения.
5. Полученные данные свидетельствуют об отсутствии признаков нейровоспаления в отдаленный период после общего облучения мышей в дозах 1, 2 и 4 Гр.
Список литературы
Ушаков И.Б., Штемберг А.С. Радиационная физиология высшей нервной деятельности: итоги и перспективы // Рос. физиол. журн. им. И.М. Сеченова. 2010. Т. 96. № 7. С. 657–674. [Ushakov I.B., Shtemberg A.S. Radiation physiology of higher nervous activity: results and perspectives // Neuroscience and Behavioral Physiology. 2012. V. 42. № 1. P. 100–110. (In Russian)] https://doi.org/10.1007/s11055-011-9541-3
Шафиркин А.В., Петров В.М. Структурно-функциональные изменения в центральной нервной системе при воздействии ионизирующих излучений и работоспособность человека // Авиакосм. и экол. медицина. 2012. Т. 46. № 4. С. 3–16. [Shafirkin A.V., Petrov V.M. Structural and functional shifts in the central nervous system due to ionizing radiation; human efficiency // Aerospace and environmental medicine. 2012. V. 46. № 4. P. 3–16. (In Russian)]
Ушаков И.Б., Штемберг А.С. Проблемы исследования воздействия факторов дальних длительных космических полетов на высшую нервную деятельность в модельных экспериментах на животных // Авиакосм. и экол. медицина. 2012. Т. 46. № 1. С. 5–16. [Ushakov I.B., Shtemberg A.S. Problemy issledovaniya vozdeystviya faktorov dal’nikh dlitel’nykh kosmicheskikh poletov na vysshuyu nervnuyu deyatel’nost' v model’nykh eksperimentakh na zhivotnykh // Aerospace and environ. medicine. 2012. V. 46. № 1. P. 5–16. (In Russian)]
Ушаков И.Б., Федоров В.П., Афанасьев Р.В. Нейроморфологические эффекты малых доз ионизирующих излучений // Авиакосм. и экол. медицина. 2012. Т. 46. № 2. С. 16–20. [Ushakov I.B., Fedorov V.P., Afanas’yev R.V. Neyromorfologicheskiye effekty malykh doz ioniziruyushchikh izlucheniy // Aerospace and environ. medicine. 2012. V. 46. № 2. P. 16–20. (In Russian)] https://doi.org/10.7868/S0869587317010030
Григорьев А.И., Красавин Е.А., Островский М.А. К вопросу о радиационном барьере при пилотируемых полетах // Вестн. РАН. 2017. Т. 87. № 1. С. 65–69. [Grigor’yev A.I., Krasavin Ye.A., Ostrovskiy M.A. K voprosu o radiatsionnom bar’yere pri pilotiruyemykh poletakh // Vestnik Rossijskoj Akademii Nauk. 2017. V. 87. № 1. P. 65–69. (In Russian)]
Raber J., Rola R., LeFevour A. et al. Radiation-induced cognitive impairments are associated with changes in indicators of hippocampal neurogenesis // Radiat. Res. 2004. V. 162. № 1. P. 39–47. https://doi.org/10.1667/RR3206
Aarsen F.K., Paquier P.F., Arts W.F. et al. Cognitive deficits and predictors 3 years after diagnosis of a pilocytic astrocytoma in childhood // J. Clin. Oncol. 2009. V. 27. № 2. P. 3526–3532. https://doi.org/10.1200/JCO.2008.19.6303
Chen H., Yoshioka H., Kim G.S. et al. Oxidative stress in ischemic brain damage: mechanisms of cell death and potential molecular targets for neuroprotection // Antioxidants & Redox Signaling. 2011. V. 14. № 8. P. 1505–1517. https://doi.org/10.1089/ars.2010.3576
Tseng B.P., Giedzinski E., Izadi A. et al. Functional consequences of radiation-induced oxidative stress in cultured neural stem cells and the brain exposed to charged particle irradiation // Antioxidants & Redox Signaling. 2013. V. 20. № 9. P. 1410–1422. https://doi.org/10.1089/ars.2012.5134
Son Y., Yang M., Kim J.S. et al. Hippocampal dysfunction during the chronic phase following a single exposure to cranial irradiation // Experim. Neurology. 2014. V. 254. P. 134–144. https://doi.org/10.1016/j.expneurol.2014.01.018
Hwang S.Y., Jung J.S, Kim T.H. et al. Ionizing radiation induces astrocyte gliosis through microglia activation // Neurobiol. Disease. 2006. V. 21. № 3. P. 457–467. https://doi.org/10.1016/j.nbd.2005.08.006
Jenrow K.A., Brown S.L., Lapanowski K. et al. Selective inhibition of microglia-mediated neuroinflammation mitigates radiation-induced cognitive impairment // Radiat. Res. 2013. V. 179. № 5. P. 549–556. https://doi.org/10.1667/RR3026.1
Askew K., Li K., Olmos-Alonso A. Coupled Proliferation and Apoptosis Maintain the Rapid Turnover of Microglia in the Adult Brain // Cell Reports. 2017. V. 18. № 2. P. 391–405. https://doi.org/10.1016/j.celrep.2016.12.041
Eyo U., Dailey M. Microglia: key elements in neural development, plasticity, and pathology // J.l Neuroimmune Pharmacol. 2013. V. 8. P. 494–509. https://doi.org/10.1007/s11481-013-9434-z
Betlazar C., Middleton R.J., Banati R.B., Liu G.J. The impact of high and low dose ionizing radiation on the central nervous system // Redox Biol. 2016. V. 9. P. 144–156. https://doi.org/10.1016/j.redox.2016.08.002
Yang L., Yang J., Li G. et al. Pathophysiological responses in rat and mouse models of radiation-induced brain injury. Molecular Neurobiology. 2017. V. 54. № 2. P. 1022–1032. https://doi.org/10.1111/jnc.13745
Allen A.R., Eilertson K., Chakraborti A. et al. Radiation exposure prior to traumatic brain injury induces responses that differ as a function of animal age // Int. J. Radiat. Biol. 2014. V. 90. № 3. P. 214–23. https://doi.org/10.3109/09553002.2014.859761
Kumar M., Haridas S., Trivedi R. et al. Early cognitive changes due to whole body γ-irradiation: a behavioral and diffusion tensor imaging study in mice // Experim. Neurology. 2013. V. 248. P. 360–368. https://doi.org/10.1016/j.expneurol.2013.06.005
Legroux L., Pittet C.L., Beauseigle D. et al. An optimized method to process mouse CNS to simultaneously analyze neural cells and leukocytes by flow cytometry // J. Neurosci. Methods. 2015. V. 247. P. 23–31. https://doi.org/10.1016/j.jneumeth.2015.03.021
Bennett M.L., Bennett F.C., Liddelow S.A. et al. New tools for studying microglia in the mouse and human CNS // Proc. Nat. Acad. Sci. 2016. V. 113. № 12. P. 1738–1746. https://doi.org/10.1073/pnas.1525528113
Peng S., Yang B., Duan M.Y. et al. The Disparity of impairment of neurogenesis and cognition after acute or fractionated radiation exposure in adolescent BALB/c mice // Dose Response. 2019. V. 17. № 1. P. 1559325818822574. https://doi.org/10.1177/1559325818822574
Suman S., Rodriguez O.C., Winters T.A. et al. Therapeutic and space radiation exposure of mouse brain causes impaired DNA repair response and premature senescence by chronic oxidant production // Aging (Albany NY). 2013. V. 5. № 8. P. 607–622. https://doi.org/10.18632/aging.100587
Mineyeva O.A., Bezriadnov D.V., Kedrov A.V. et al. Radiation Induces Distinct Changes in Defined Subpopulations of Neural Stem and Progenitor Cells in the Adult Hippocampus // Front Neurosci. 2019. V. 12. P. 1013. https://doi.org/10.3389/fnins.2018.01013
Acharya M.M., Patel N.H., Craver B.M. et al. Consequences of low dose ionizing radiation exposure on the hippocampal microenvironment // PLoS One. 2015. V. 10. № 6. P. e0128316. https://doi.org/10.1371/journal.pone.0128316
Tang Y., Le W. Differential Roles of M1 and M2 Microglia in Neurodegenerative Diseases // Molec. Neurobiol. 2016. V. 53. № 2. P. 1181–1194. https://doi.org/10.1007/s12035-014-9070-5
Bachiller S., Jiménez-Ferrer I., Paulus A. et al. Microglia in neurological diseases: a road map to brain-disease dependent-inflammatory response // Front Cell Neurosci. 2018. V. 12. P. 488. https://doi.org/10.3389/fncel.2018.00488
Штемберг А.С., Кохан В.С., Кудрин В.С. и др. Воздействие высокоэнергетических протонов в пике Брэгга на поведение крыс и обмен моноаминов в некоторых структурах мозга // Нейрохимия. 2015. Т. 32 № 1. С. 78–85. [Shtemberg A.S., Kokhan V.S., Kudrin V.S. et al. The effect of high-energy protons in the Bragg Peak on the behavior of rats and the exchange of monoamines in some brain structures // Neurochem. J. 2015. V. 9. № 1. P. 66–72. (In Russian)]. https://doi.org/10.1134/S1819712415010109
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


