Радиационная биология. Радиоэкология, 2020, T. 60, № 1, стр. 5-11
ИССЛЕДОВАНИЕ КОЛИЧЕСТВА КОПИЙ И ГЕТЕРОПЛАЗМИИ МИТОХОНДРИАЛЬНОЙ ДНК В РАЗЛИЧНЫХ ОБЛАСТЯХ ГОЛОВНОГО МОЗГА КРЫС ПОСЛЕ КРАНИАЛЬНОГО ВОЗДЕЙСТВИЯ ПРОТОНОВ
С. А. Абдуллаев 1, *, Э. В. Евдокимовский 1, А. И. Газиев 1
1 Институт теоретической и экспериментальной биофизики РАН
Пущино, Россия
* E-mail: saabdullaev@gmail.com
Поступила в редакцию 27.05.2019
Аннотация
Накопленные за последние годы результаты исследований указывают, что важнейшей мишенью радиационного поражения, наряду с ядром, являются митохондрии. Структурные и функциональные нарушения, индуцируемые радиацией в этих органеллах, оказывают влияние на пострадиационное развитие целого комплекса эффектов на уровне клеток и целого организма животных и человека. Настоящее исследование посвящено оценке изменений количества копий митохондриальной ДНК (мтДНК) относительно ядерной ДНК (яДНК), а также выявлению гетероплазмии мтДНК в трех отделах мозга (в гиппокампе, коре и мозжечке) крыс в разное время после краниального воздействия протонов. В работе использованы методы ПЦР в реальном времени и метод расщепления гетеродуплексов ПЦР-ампликонов мтДНК Surveyor-нуклеазой. Выявлено, что уровень содержания копий мтДНК в трех областях головного мозга крыс резко повышается после воздействия протонов с одновременным увеличением доли ее мутантных копий. Полученные результаты свидетельствуют о том, что синтез мтДНК и уровень ее мутантных копий различаются в гиппокампе, коре и мозжечке головного мозга крыс после воздействия протонов на область черепа. Можно предполагать, что повышенный мутагенез мтДНК может привести к митохондриальной дисфункции с индукцией окислительного стресса, приводящего к нестабильности ядерного генома и развитию отдаленных последствий воздействия ионизирующей радиации.
Результаты эпидемиологических исследований лиц, выживших после атомной бомбардировки, а также пациентов, перенесших радиотерапию опухолей, указывают, что критическими отдаленными последствиями радиационного повреждения мозга являются когнитивные нарушения и индукция онкогенеза [1, 2].
Если радиационная индукция опухолей мозга обусловлена в основном повреждением глиальных клеток, то возникновение когнитивных дисфункций во многом определяется повреждением нервных стволовых клеток и нарушением нейрогенеза в гиппокампе [3]. Хотя результаты многих исследований на разных уровнях выявили различные структурно-функциональные нарушения в разных отделах головного мозга после радиационного воздействия, многое еще остается неопределенным. Особенно это касается выяснения начальных молекулярно-клеточных нарушений, провоцирующих дальнейшее развитие нейродегенеративных и других отдаленных последствий. Результаты ряда проведенных исследований свидетельствуют о том, что нарушения функций митохондрий играют ключевую роль в развитии нейродегенеративных нарушений и инициации онкогенеза [4, 5]. Известно, что активность нейронов головного мозга зависит от чрезвычайно высокого уровня энергетической поддержки в виде молекул АТФ, поставляемых митохондриями. Митохондриальные функции тесно связаны с целостностью мтДНК. Число копий мтДНК на клетку в ткани мозга более чем в 2–3 раза выше, чем в клетках печени и десятки раз выше, чем в других тканях [6, 7]. Повреждение мтДНК полностью отражается на функциях митохондрий [8] с нарушением активности комплексов окислительного фосфорилирования и усилением генерации активных форм кислорода и азота (АФК/А), сопряженной с синтезом АТФ. При этом согласно данным, полученным на различных клетках, повышенная генерация АФК/А сохраняется в течение длительного пострадиационного времени и приводит к резкому усилению оксидативного стресса в облученных клетках [9, 10]. Усиление отсроченного окислительного стресса в клетках, подвергшихся радиационному воздействию, может вызвать повреждения ядерного генома и инициацию его нестабильности [11], которая занимает центральное место в индукции канцерогенеза [12]. Нестабильность генома также является фактором нейродегенеративных заболеваний [13].
Поэтому дальнейшие исследования молекулярных и клеточных механизмов радиационного повреждения структур головного мозга остаются достаточно актуальной проблемой. Особенно это касается выяснения начальных молекулярно-клеточных нарушений, провоцирующих дальнейшее развитие отдаленных последствий.
Развитие этих исследований востребовано в связи с широким использованием ионизирующей радиации (ИИ) в терапии опухолей мозга. Отсутствие достаточных знаний по воздействию космической радиации, в которой протоны занимают более 80% излучения глубокого космоса [14], на здоровье космонавтов, представляется ограничивающим фактором для космических миссий за пределы околоземной орбиты. Кроме того, люди могут подвергаться воздействию ИИ в результате ядерных аварийных инцидентов и при возможном радиологическом терроризме.
Настоящая работа посвящена исследованию количественных изменений мтДНК и ее мутантных копий (гетероплазмии) в гиппокампе, коре и мозжечке головного мозга крыс после краниального воздействия протонов (150 МeV) в дозах 3 и 5 Гр.
МАТЕРИАЛЫ И МЕТОДИКА
В исследовании использовали самцов крыс линии Spraque Dawley в возрасте 2 мес. (масса 221 ± 7.5 г), полученных из питомника филиала Института биоорганической химии РАН (Пущино, Московская обл.). В ходе эксперимента грызуны находились в помещении для животных Лаборатории радиационной биологии в Объединенном институте ядерных исследований (ОИЯИ). Облучение крыс проведено в соответствии со всеми требованиями, установленными Институтской комиссией по контролю использования животных при проведении биомедицинских экспериментов. Животные были акклиматизированы в течение 7 дней до начала экспериментов. Грызуны находились на специальной диете для мышей и крыс, со свободным доступом к чистой питьевой воде и были размещены по три животных в клетке при стандартном 12-часовом цикле свет/темнота при температуре 22 ± 2°С и при влажности 45 ± 5%. Краниальное облучение крыс проводили в дозах 3 и 5 Гр (протоны, E = 150 МэВ) на установке “Фазотрон” Медико-технического комплекса Лаборатории ядерных проблем ОИЯИ (Дубна). Животные получали облучение в однократной дозе при номинальной мощности дозы 0.8 Гр/мин. Крыс анестезировали и декапитировали через 2, 6, 24 ч после радиационного воздействия. Необлученных крыс использовали в качестве контроля. Ткани из трех отделов мозга (гиппокамп, кора, мозжечок) отделяли скальпелем на льду сразу после обезглавливания, замораживали и хранили при –80°С до выделения ДНК. Перед выделением общей геномной ДНК (яДНК и мтДНК) замороженные образцы тканей оттаивали при комнатной температуре, а затем помещали на лед. Затем образцы гомогенизировали и выделяли общую геномную ДНК с использованием специальных наборов QIAGEN Genomic Tip Kit и Genomic DNA Buffer в соответствии с инструкциями производителя (“QIAGEN”, США). Количество ДНК во всех случаях определяли по реакции с реагентом PicoGreen в соответствии с протоколом производителя (“Molecular Probes”, США) с регистрацией флуоресценции на устройстве Infinite 200 NanoQuant (“Tecan Group” Ltd., Австрия). Образцы ДНК, предназначенные для анализа митохондриального генома, инкубировали в течение 20 мин при 25°С в ТЕ-буфере с эндонуклеазой рестрикции XhoI (“New England Biolabs”, США) с целью релаксации сверхскрученных молекул мтДНК крысы [15]. Анализ содержания общего количества мтДНК был проведен количественным методом ПЦР в реальном времени с использованием технологии TaqMan на приборе Prism 7500 (“Applied Biosystems”, США). Изменение относительного количества мтДНК определяли соотношением между числом копий митохондриального гена тРНК и гена GAPDH яДНК в одной и той же пробирке. Для анализа расчетов использовали метод 2–ΔΔCT. ПЦР-тесты проводили в трех повторностях для каждого образца ДНК. Для амплификации гена тРНК (73 п.о.) мтДНК использовали следующие праймеры: forward – 5'-aat ggt tcg ttt gtt caa cga tt-3'; reverse – 5'-aga aac cga cct gga ttg ctc-3'; и зонд – R6G-AAG TCC TAC GTG ATC TGA GTT-RHQ1. Для амплификации гена GAPDH (80 п.н.) яДНК были использованы следующие праймеры: forward‑5'- TGG CCT CCA AGG AGT AAG AAA C-3'; reverse 5'-GGC TCT CTC CTT GCT CTC AGT ATC -3'; и зонд – FAM–CTG GAC CAC CCA GCC CAG CAA-RTQ1. Программа ПЦР была следующей: 5 мин при 95°С, затем 40 циклов (95°С в течение 30 с, отжиг и удлинение при 60°С в течение 1 мин). Результаты представлены в виде процентного отношения (сравнение с необлученными крысами:100%). Для определения количества мутантных копий мтДНК, выделенных из тканей головного мозга, мы использовали Surveyor Mutation Detection Kit (“Transgenomic”, США), как описано [16]. Для амплификации мтДНК использовали участок, охватывающий ген тРНК (507 пар оснований (п.о.)). В качестве праймеров были использованы последовательности: forward – 5'-cac act ctc act cgc atg aa-3' и reverse – 5'-tcc ttc caa tct agt tga gg-3'. Реакционная смесь ПЦР (общий объем 25 мкл) содержала: 75 ммоль/л Трис-НСI, рН 8.8, 20 ммоль/л (NH4)2SO4, 2.5 ммоль/л МgCI2, 200 мкмоль/л каждого dNTP, 250 нмоль/л каждого праймера, 0.01% твин-20. В реакционную смесь вводили 1 нг ДНК и 1 суммарную единицу смеси Taq-и Pfu-полимераз (“Thermo Fisher Scientific”, США), которую вносили методом “горячего старта” после первичной денатурации ДНК-матриц при 94°С в течение 4 мин. ПЦР проводили в режиме 35 циклов: денатурация 30 с при 94°С, отжиг 45 с при 62°С и элонгация 45 с при 72°С, после которых – завершающая инкубация 4 мин при 72°С. ПЦР проводилась на программируемом термоциклере Терцик (“НПФ-ДНК-Технология”, Москва). После завершения реакции все продукты ПЦР образцов ДНК были доведены до одинаковой концентрации путем добавления ТЕ-буфера. Для получения гетеродуплексов смешивали равные объемы (по 7 мкл) ПЦР-ампликонов мтДНК тканей головного мозга облученных и контрольных крыс, а также ПЦР-ампликонов мтДНК тканей головного мозга двух контрольных животных. Смеси нагревали при 99°С в течение 10 мин и медленно охлаждали до 40°С (в течение 70 мин) при скорости снижения температуры 0.3°С/мин. Затем образцы выдерживали 45 мин при комнатной температуре. К смеси гетеродуплексов добавляли 1/10 объема 0.15 моль/л раствора MgCl2, 1 мкл Surveyor Enhancer S и 1 мкл Surveyor Nuclease S. Смесь инкубировали при 42°С в течение 60 мин. Затем реакцию останавливали добавлением 1/10 объема Stop-раствора в соответствии с протоколом производителя (“Transgenomic”, США). Продукты расщепления эндонуклеазой анализировали с помощью электрофореза в 2.0%-ном агарозном геле, окрашенном бромидом этидия. ПЦР-тестирование гетеродуплексов проводили в трех повторностях для каждого образца ДНК. Интенсивность флуоресценции полос ДНК в гелях регистрировали с помощью AlphaImager Mini System (“Alpha Innotech”, США). Отношение флуоресценции продуктов расщепления к общей интенсивности флуоресценции полос ДНК в геле (% ДНК, расщепленной Surveyor Nuclease) рассчитывали с использованием пакета программ ImageJ (“Wayne Rasband”, США). Статистические различия между данными, полученными до и после облучения крыс, были оценены с помощью ANOVA. Результаты были рассчитаны и представлены как среднее значение ± стандартное отклонение (n = 4). Значение р < 0.05 считали статистически значимым.
РЕЗУЛЬТАТЫ
На рис. 1 представлены результаты исследований, полученных методом ПЦР в реальном времени, которые показывают, что количества копий мтДНК увеличиваются относительно яДНК в регионах мозга крыс (гиппокампа, коры и мозжечка) в течение 2–24 ч после краниального облучения в дозах 3 и 5 Гр. При этом максимальные повышения количества копий мтДНК у облученных животных мы регистрируем в гиппокампе. При инициации репликативного синтеза с вовлечением поврежденных мтДНК посредством ДНК-полимеразы γ можно ожидать появление новых копий мтДНК с мутациями и делециями в клетках головного мозга крыс, подвергшихся радиационному воздействию.
Рис. 1.
Активация синтеза мтДНК в тканях разных отделов мозга крыс через 2, 6, 24 ч после воздействия протонов (150 МэВ) на область головы. А – крысы, облученные в дозе 3 Гр; Б – крысы, облученные в дозе 5 Гр. Здесь и на рис. 3 статистическая значимость различий была установлена на уровне р значений р < 0.05 (*), р < 0.01 (**), р < 0.001 (***), р < 0.05.
Fig. 1. Activation of mtDNA synthesis in tissues of different brain regions of rats in 2, 6, 24 hours after exposure to 150 MeV proton beam. (A) – rats, irradiated with a dose of 3 Gy; (B) – rats, irradiated with a dose of 5 Gy. In this Figure and in Figures 3 statistical significance was set at p < 0.05 (*), p < 0.01 (**), *** p < 0.001.

Для оценки мутантных копий мтДНК дополнительно использовались временные точки через 2 нед., 1 и 2 мес. после облучения в дозе 3 Гр. От исследований в эти же сроки после облучения в дозе 5 Гр воздержались, так как возможна гибель крыс при воздействии протонов. На рис. 2 изображены типичные электрофореграммы продуктов Surveyor-эндонуклеазного расщепления гетеродуплексов ПЦР-ампликонов мтДНК. Степень расщепления этим ферментом гетеродуплексов зависит от наличия в них сайтов с неспаренными основаниями, которые могли формироваться благодаря наличию мутаций в определенном количестве копий мтДНК в тканях головного мозга облученных крыс. Растительная Surveyor-эндонуклеаза строго специфически разрезает обе нити ДНК (с 3' стороны) на участках с неспаренными основаниями (включая все замены оснований, вставки и делеции) [16]. На электрофореграммах можно заметить также, что количество продуктов эндонуклеазного расщепления гетеродуплексов различается в зависимости от дозы радиационного воздействия и времени после облучения крыс. Суммарное количество продукта, отщепленного эндонуклеазой от гетеродуплексов, регистрируемое в данных анализах, можно условно считать соответствующим числу мутантных копий в амплифицируемых образцах одинакового количества общей ДНК, выделенных из тканей головного мозга крыс.
Рис. 2.
Электрофорез гетеродуплексов ПЦР-ампликонов мтДНК (507 bp) из тканей разных отделов мозга крыс после воздействия протонов (150 МэВ) на область головы. Анализы проводились после обработки гетеродуплексов ПЦР-ампликонов образцов мтДНК, посредством Surveyor-нуклеазой, специфически узнающей неспаренные основания (мутантные сайты мтДНК). А – крысы, облученные в дозе 3 Гр; Б – крысы, облученные в дозе 5 Гр; а – гиппокамп, б – кора, в – мозжечок. К – гетеродуплексы ампликонов мтДНК необлученных крыс, M – маркер молекулярного веса. Электрофоретически легкие фрагменты – результат расщепления мутантных копий мтДНК.
Fig. 2 Electrophoresis of heteroduplexes of PCR amplicons of mtDNA (507 bp) in tissues of different brain regions of rats after the effect of 150 MeV protons on rat brain. Analyses were carried out after staining of heteroduplexes of PCR amplicons of mtDNA probes with mismatch-specific Surveyor-nuclease (mtDNA mutant sites) in PCR amplification. (A) – rats, irradiated with a dose of 3 Gy; (B) – rats, irradiated with a dose of 5 Gy; a – hippocampus, b – cortex, c – cerebellum. M – a marker of the molecular weight. C – amplified heteroduplexes of mtDNA amplicons in nonirradiated rats. Electrophoretically light fragments result from the disruption of mutant mtDNA copies.

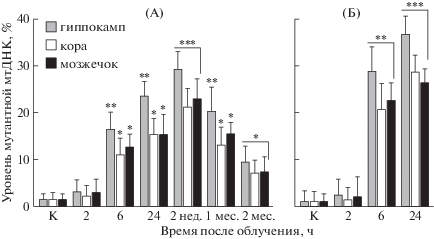
Для сравнительного анализа результатов исследования мы количественно регистрировали процент отщепившихся продуктов (% расщепления гетеродуплексов), в результате действия Surveyor-эндонуклеазы, по отношению к интегральной интенсивности полос ДНК на гелях электрофореграмм, как указано выше. Обобщенные результаты независимых повторных анализов продуктов, отщепляемых гетеродуплексов, представлены на рис. 3. Результаты исследований показывают, что во всех трех структурах головного мозга облученных крыс в дозах 3 и 5 Гр возникает резкое увеличение количества мутантных копий мтДНК (рис. 3). Так, к 24 ч после облучения в дозе 5 Гр количество мутантных копий мтДНК в рассмотренных отделах мозга достигает около 25–35% от общего количества копий мтДНК в этих тканях. При облучении крыс в дозе 3 Гр максимальный уровень мутантных копий мтДНК регистрируется через 2 нед. и составляет около 20–30%, в последующие же сроки после радиационного воздействия количество мутантных копий существенно снижается. В гиппокампе наблюдается самый высокий уровень мтДНК с мутациями. Так, в этом отделе мозга статистически значимое повышение числа мутантных копий мтДНК, по сравнению с таковыми показателями для коры и мозжечка, наблюдается к 6 и 24 ч после облучения крыс в дозе 5 Гр (рис. 3). Через 24 ч и 2 нед. после радиационного воздействия в дозе 3 Гр в гиппокампе животных регистрируется статистически значимое повышение уровня мутантных копий мтДНК, по сравнению с рассматриваемыми показателями для коры и мозжечка. Таким образом, полученные результаты показывают, что увеличение количества копий мтДНК в различных участках головного мозга крыс после облучения сопряжено с индукцией мутаций в мтДНК (появление копий мтДНК с мутациями).
Рис. 3.
Изменение относительных уровней (гетероплазмии) мутантных копий мтДНК (% расщепления Surveyor-нуклеазой гетеродуплексов ПЦР-ампликонов мтДНК) в тканях разных отделов мозга крыс после воздействия протонов (150 МэВ) на область головы. А – крысы, облученные в дозе 5 Гр; Б – крысы, облученные в дозе 3 Гр.
Fig. 3 Alterations in relative levels (heteroplasmy) of mutant mtDNA copies (disruption of heteroduplexes of PCR amplicons of mtDNA using Surveyor-nuclease, %) from tissues of different brain regions of rats after the effect of 150 MeV protons on rat brain. (A) – rats, irradiated with a dose of 5 Gy; (B) – rats, irradiated with a dose of 3 Gy.
ОБСУЖДЕНИЕ
Очевидно, наблюдаемое нами увеличение уровней мтДНК обусловлено активацией биогенеза митохондрий с репликативным синтезом новых копий мтДНК. Ранее была показана активация биогенеза митохондрий и синтеза мтДНК в различных клетках (in vitro) и в тканях грызунов (in vivo) в пострадиационный период [18–20]. Хотя в клетках мозга значительное количество копий мтДНК повреждается и часть подверглась мутагенезу, важнейшей гарантией сохранности генетической информации мтДНК является ее представление в клетках множеством копий [21]. Кроме того, репликация мтДНК не зависит от клеточного деления [22]. Активация биогенеза митохондрий в тканях животных после воздействия ионизирующего излучения представляет собой проявление компенсаторной реакции, связанной с энергетическими потерями в клетках на уровне целого организма. В облученных клетках возникают повышенные расходы АТФ для обеспечения дополнительных энергетических потребностей. Как известно, реакция клеток на повреждения ДНК (DNA Damage Response – DDR) – чрезвычайно энергоемкий процесс, который требует повышенного расхода молекул АТФ. В процесс DDR вовлекаются различные протеинкиназы, которые подвергают в течение нескольких минут фосфорилированию множество белков на сайтах хроматина, содержащих ДНК с повреждениями. При этом, только с участием протеинкиназ АТМ и ATR, выявлено более 900 регулируемых сайтов фосфорилирования хроматина, каждый из которых охватывает более 700 белков [23]. Значительные расходы АТФ связаны с процессом ремоделирования хроматина для обеспечения репарации ДНК. Так, в ответ на возникновение одного двунитевого разрыва ядерной ДНК фосфорилирование гистонов H2AX может охватить участок хроматина размером более одного миллиона пар оснований [24]. Таким образом, при воздействии ИИ на мозг, в первые же минуты, можно ожидать истощение пула молекул АТФ в результате фосфорилирования многих белков и активации биогенеза митохондрий. Митохондрии не только поставляют энергию для клеточных функций, но также принимают участие в передаче сигналов клетки. Восстановление необходимого энергообеспечения может произойти, когда митохондриальные ретроградные сигнализации поступают в ядро [25]. Они способствуют изменению транскрипции ядерных генов, контролирующих активацию митохондриальных процессов для производства АТФ. Ретроградные сигнализации необходимы и для восстановления функции нейронов [25]. Другим путем поддержки производства АТФ можно рассматривать и активацию АМФ-активируемой протеинкиназы, инициирующей биогенез митохондрий, с увеличением соотношения AMP/АТФ [26]. Пострадиационная активация синтеза АТФ сопряжена с усилением генерации АФК/А, которая сохраняется в течение длительного пострадиационного времени. Эта отсроченная активация генерации АФК/А приводит к повышению оксидативного стресса в облученных клетках [9, 10]. Репликация мтДНК с повреждениями будет способствовать увеличению копий мтДНК с мутациями и делециями [17]. Полученные нами данные для всех трех отделов мозга облученных крыс в пострадиационный период также показывают возрастание количества мутантных копий мтДНК. При этом наибольший рост этого показателя выявляется в гиппокампе (рис. 3). Увеличение числа мутантных копий мтДНК также происходит за счет так называемой “клональной экспансии”, возникающей в результате преимущественной репликации мтДНК с определенными типами мутаций и делеций [25]. Частота повреждений и мутаций мтДНК коррелирует с повышением уровня АФК/А в клетках [28, 29]. Поскольку мутации мтДНК приводят к нарушению цепи переноса электронов и усилению генерации АФК/А, которые индуцируют дополнительные повреждения и последующие мутации мтДНК, то мы можем предполагать, что эти события могут приводить к возникновению “порочных кругов” [30], которые будут способствовать длительному сохранению повышенного окислительного стресса в клетках мозга.
Таким образом, полученные результаты свидетельствуют о том, что синтез мтДНК и уровень ее мутантных копий различаются в гиппокампе, коре и мозжечке мозга крыс после краниального воздействия протонов. Эти изменения могут привести к митохондриальной дисфункции с выраженным окислительным стрессом в различных отделах головного мозга и быть сопряженными с развитием отдаленных последствий действия ИИ. Результаты указывают, что выбор митохондриально-направленных (mitochondria targeting) тушителей АФК/А является реальным подходом для смягчения (mitigation) последствий радиационного воздействия на организм.
Список литературы
Hladik D., Tapio S. Effects of ionizing radiation on the mammalian brain // Mutat. Res. 2016. V. 770. P. 219–230.
Casciati A., Dobos K., Antonelli F. et al. Age-related effects of X-ray irradiation on mouse hippocampus // Oncotarget. 2016. V. 7. № 19. P. 28040–58.
Limoli C.L., Rola R., Giedzinski E. et al. Cell-density-dependent regulation of neural precursor cell function // Proc. Natl. Acad. Sci. USA. 2004. V. 101. P. 16052–16057.
Wang Y., Xu E., Musich P.R., Lin F. Mitochondrial dysfunction in neurodegenerative diseases and the potential countermeasure // CNS Neurosci Ther. 2019. [Epub ahead of print].https://doi.org/10.1111/cns.13116
Lee W.T., St. John J.C. Mitochondrial DNA as an initiator of tumorigenesis // Cell Death and Disease. 2016. 7.e2171. https://doi.org/10.1038/cddis.2016.77
Machado T.S., Macabelli C.H., Sangalli J.R. et al. Real-time PCR quantification of heteroplasmy in a mouse model with mitochondrial DNA of C57BL/6 and NZB/BINJ Strains // PLoS ONE. 2015. V. 10. № 8. e0133650.
Xie Y.M., Jin L., Chen X.J. et al. Quantitative changes in mitochondrial DNA copy number in various tissues of pigs during growth // Genet. Molec. Res. 2015. V. 14. № 1. P. 1662–1670.
Van Houten B., Hunter S.E., Meyer J.N. Mitochondrial DNA damage induced autophagy, cell death, and disease // Front. Biosci. (Landmark Ed). 2016. V. 21. P. 42–54.
Azzam E.I., Jay-Gerin J.P., Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury // Cancer Lett. 2012. V. 327. P. 48–60.
Газиев А.И. Пути сохранения целостности митохондриальной ДНК и функций митохондрий в клетках, подвергшихся воздействию ионизирующей радиации // Радиац. биология. Радиоэкология. 2013. Т. 53. № 2. С. 117–136. [Gaziev A.I. Puti sokhraneniya tselostnosti mitokhondrial’noy DNK i funktsiy mitokhondriy v kletkakh, podvergshikhsya vozdeystviyu ioniziruyushchey radiatsii // Radiats. Biologiya. Radioekologiya. 2013. Т. 53. № 2. С. 117–136 (In Russian)].
Kim G.J., Fiskum G.M., Morgan W.F. A role for mitochondrial dysfunction in perpetuating radiation induced genomic instability // Cancer Res. 2006. V. 66. № 21. P. 10377–10383.
Aguilera A., Garcia-Muse T. Causes of genome instability // Annu. Rev. Genet. 2013. V. 47. P. 1–32.
McKinnon P.J. Genome integrity and disease prevention in the nervous system // Genes Dev. 2017. V. 31. № 12. P. 1180–1194.
Townsend L.W. Implications of the space radiation environment for human exploration in deep space // Radiat. Prot. Dosim. 2005. V. 115. P. 44–50.
Gonzalez-Hunt C.P., Rooney J.P., Ryde I.T., Anbalagan C., Joglekar R., Meyer J.N. PCR-based analysis of mitochondrial DNA copy number, mitochondrial DNA damage, and nuclear DNA damage // Curr. Protoc. Toxicol. 2016. V. 67. P. 1–34.
Bannwarth S., Procaccio V., Paquis-Flucklinger V. Rapid identification of unknown heteroplasmic mitochondrial DNA mutations with mismatch-specific surveyor nuclease // Methods Mol. Biol. 2009. V. 554. P. 301–313.
DeBalsi K.L., Hoff K.E., Copeland W.C. Role of the mitochondrial DNA replication machinery in mitochondrial DNA mutagenesis, aging and age-related diseases // Ageing Res. Rev. 2017. V. 33. P. 89–104.
Malakhova L.V., Bezlepkin V.G., Antipova V.N. et al. The increase in copy number of mitochondrial DNA in tissues of γ-irradiated mice // Cell. Molec. Biol. Lett. 2005. V. 10. P. 592–603.
Nugent S.M., Mothersill C.E., Seymour C. et al. Increased mitochondrial mass in cells with functionally compromised mitochondria after exposure to both direct gamma radiation and bystander factors // Radiat. Res. 2007. V. 168. P. 134–42.
Zhang H., Maguire D., Swarts S. et al. Replication of murine mitochondrial DNA following irradiation // Adv. Exp. Med. Biol. 2009. V. 645. P. 43–8.
Gaziev A.I., Abdullaev S., Podlutsky A. Mitochondrial function and mitochondrial DNA maintenance with advancing age // Biogerontol. 2014. V. 15. P. 417–438.
Pinto M., Moraes C.T. Mechanisms linking mtDNA damage and aging // Free Radic. Biol. Med. 2015. V. 85. P. 250–258.
Matsuoka S., Ballif B.A., Smogorzewska A. et al. ATM and ATR substrate analysis reveals extensive protein networks responsive to DNA damage // Science. 2007. V. 316. P. 1160–1166.
Bonner W.M., Redon C.E., Dickey J.S. et al. γH2AX and Cancer // Nat. Rev. Cancer. 2008. V. 8. P. 957–967.
Hunt R.J., Bateman J.M. Mitochondrial retrograde signaling in the nervous system // FEBS Lett. 2018. V. 592. P. 663–678.
Hinchy C., Gruszczyk A.V., Willows R. et al. Mitochondria-derived ROS activate AMP-activated protein kinase (AMPK) indirectly // J. Biol. Chem. 2018. V. 293. № 44. P. 17208–17217.
Bratic A., Larsson N.G. The role of mitochondria in aging // J. Clin. Invest. 2013. V. 123. P. 951–957.
Indo H.P., Davidson M., Yen H.C. et al. Evidence of ROS generation by mitochondria in cells with impaired electron transport chain and mitochondrial DNA damage // Mitochondrion. 2007. V. 7. № 1–2. P. 106–118.
Ishikawa K., Takenaga K., Akimoto M. et al. ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis // Science. 2008. V. 320. № 5876. P. 661–664.
Mandavilli B.S., Santos J.H., Van Houten B. Mitochondrial DNA repair and aging // Mutat. Res. 2002. V. 509. P. 127–151.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


