Радиационная биология. Радиоэкология, 2020, T. 60, № 1, стр. 12-25
КОНЦЕПЦИЯ Т-КЛЕТОЧНОГО РОДА КАК ОСНОВА ДЛЯ АНАЛИЗА РЕЗУЛЬТАТОВ ЦИТОГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ
Е. И. Толстых 1, *, А. В. Возилова 1, М. О. Дёгтева 1, А. В. Аклеев 1
1 Уральский научно-практический центр радиационной медицины
Федерального медико-биологического агентства Российской Федерации
Челябинск, Россия
* E-mail: evgenia@urcrm.ru
Поступила в редакцию 21.03.2019
Аннотация
Оценка частоты хромосомных транслокаций в Т-лимфоцитах периферической крови является общепризнанным биодозиметрическим ретроспективным методом. Аварийное загрязнение р. Теча в 1950-е годы (Челябинская область) остеотропным долгоживущим 90Sr дало возможность оценить влияние локального облучения красного костного мозга (ККМ) на формирование транслокаций в периферических Т-лимфоцитах местных жителей. Для этих лиц в ходе исследований методом флуоресцентной in situ гибридизации (FISH) было отмечено, что дозы облучения ККМ, рассчитанные по данным FISH, были ниже значений, оцененных на основе измерений содержания 90Sr в организме. В настоящем исследовании представлен аналитический обзор опубликованных данных, касающихся наиболее важных процессов развития Т-лимфоцитов и формирования в них хромосомных аберраций: характеристика основных компартментов, где происходит облучение Т-клеток; оценка времени пребывания Т-лимфоцитов и их предшественников в этих компартментах; анализ динамики клеточных популяций (пролиферация и гибель клеток) в периферическом пуле; возрастные аспекты этих процессов. В работе представлена концепция Т-клеточного рода (T-клеточный Genus), который объединяет всех потомков T-прогенитора с наследуемыми специфическими аберрациями, которые могли образоваться в костном мозге.
Анализ хромосомных аберраций в лимфоцитах периферической крови признан в качестве одного из важных методов биодозиметрии [1]. Наиболее полно разработаны методы оценки доз по частоте дицентриков (нестабильных хромосомных аберраций) в лимфоцитах периферической крови [1–4]. Для использования этого метода важно, чтобы цитогенетический анализ был выполнен в течение небольшого промежутка времени после облучения, так как клетки с такими аберрациями гибнут в процессе деления, т.е. происходит быстрое, зависящее от времени, снижение числа клеток с дицентриками. Использование калибровочных кривых позволяет перейти от частоты дицентриков к дозе на лимфоциты. Поскольку эти клетки крови циркулируют в организме, то оцененная доза трактуется как доза на все тело. Если облучение было частичным или неравномерным, то Международное агентство по атомной энергии (МАГАТЭ) [1] рекомендует применять два основных метода Dolphin и Qdr для расчетов доз на все тело. Оба метода используют данные о частоте аберраций и количестве дицентриков на одну клетку, а также калибровочные кривые, полученные in vitro для дицентриков.
В случае, когда прошло несколько и более лет после воздействия (т.е. когда бόльшая часть клеток с дицентриками элиминировалась), то для оценок доз применяются данные по транслокациям (стабильным хромосомным аберрациям) с использованием различных модификаций метода FISH (fluorescence in situ hybridization). Объектом исследования FISH являются главным образом Т-лимфоциты, которые составляют около 75–90% лимфоцитов периферической крови. Стимуляция митогеном T-лимфоцитов на стадии G0 приводит к делению клеток, что позволяет визуализировать повреждения ДНК в метафазных хромосомах. Митоген фитогемагглютинин, используемый в протоколе FISH, стимулирует к делению именно Т-лимфоциты человека in vitro [5]. Различные модификации метода применяются в случаях техногенного (в том числе аварийного) облучения, когда индивидуальная дозиметрия не проводилась, а также для верификации других дозиметрических исследований [3, 6–10]. В частности, полногеномный многоцветный mFISH-анализ и mBAND позволяют определить вид излучения, участвовавшего в поражении клетки (плотно- или редкоионизирующее) [6, 7, 10–12], поскольку характерные сложные хромосомные перестройки, детектируемые при такой окраске, являются результатом воздействия только плотноионизирующей радиацией.
Для случая частичного или неравномерного облучения от β–γ-источников (редкоионизирующее излучение) трактовка результатов FISH-исследований неочевидна. Методы Dolphin и Qdr, использующие данные по числу дицентриков в одной клетке, в этом случае неприменимы. Существует общепринятая точка зрения, высказанная в публикациях МАГАТЭ [1], что “при ретроспективной биологической дозиметрии, спустя десятилетие или более после воздействия, когда транслокации (стабильные хромосомные аберрации) измеряются методом FISH, дозовая оценка представляет собой среднюю дозу на активный (красный) костный мозг – ККМ. Связано это с тем, что первоначально облучению подверглись стволовые клетки – предшественники лимфоцитов, которые собственно и исследуются”.
Ситуация облучения жителей прибрежных сел р. Теча в 1950-е годы дает уникальную возможность проверить применимость этого утверждения для условий частичного (неравномерного) облучения. Основным источником облучения для жителей прибрежных сел после сбросов в р. Теча жидких радиоактивных отходов были β-излучающие изотопы стронция 89,90Sr [13, 14]. Они избирательно накапливаются в костях, в полостях которых находится ККМ. В связи с короткой длиной пробега электронов 89,90Sr-спектров облучению подвергаются только близлежащие ткани (костные поверхности, костный мозг). Таким образом, попадание 89,90Sr в организм жителей прибрежных сел р. Теча привело к локальному облучению ККМ. Когорта жителей прибрежных сел р. Теча хорошо изучена, описаны эффекты радиационного воздействия (повышенный радиогенный риск развития лейкозов и солидных опухолей и др. [15–17]), а также источники облучения и подходы к оценкам доз [14, 18, 19]. Оценки доз от 89,90Sr базируются на измерениях содержания 90Sr в организме [20] и биокинетических моделях для стронция [21]. Относительный вклад облучения от инкорпорированного 89,90Sr в дозу на ККМ варьировал от 60% в верхнем течении р. Теча до >90% в среднем и нижнем [14].
Цитогенетические исследования лимфоцитов лиц – жителей прибрежных сел р. Теча показали [22–24], что дозы, оцененные на основе метода FISH11 со стандартными калибровочными кривыми, были существенно ниже, чем дозы на ККМ, рассчитанные по результатам измерений радионуклидов в организме и γ-полей в местах проживания. Для того чтобы объяснить такое расхождение, мы предположили, что по прошествии десятилетий после локального облучения ККМ исследованные Т-лимфоциты периферической крови представляют собой смешанную популяцию. Часть Т-лимфоцитов, сформированных до начала облучения ККМ, подверглась только внешнему облучению и облучению за счет равномерно-распределенного 137Cs (“небольшая доза”). Другая часть Т-лимфоцитов – это потомки прогениторов, облучившихся за счет 89,90Sr в ККМ (“большая доза”). Таким образом, лимфоциты периферической крови будут облучены в различных дозах, а средняя доза на лимфоциты будет ниже, чем доза облучения ККМ. Это означает, что трактовка данных по частоте транслокаций, рекомендованная МАГАТЭ, не может быть применена для случаев локального облучения ККМ.
Важным для обоснования нашего подхода является объяснение, каким образом в периферической крови в течение десятилетий могут существовать лимфоциты со специфическими аберрациями (или, наоборот, без них), если среднее время жизни отдельных лимфоцитов существенно меньше. В связи с этим необходим анализ динамики Т-клеточных популяций, который выявил ряд фактов. Во-первых, продукция тимусом Т-лимфоцитов резко снижается с возрастом [25, 26], однако количество лимфоцитов в периферическом пуле существенно не меняется. Во-вторых, для поддержания стабильного количества Т-лимфоцитов в периферическом пуле имеет место гомеостатическая пролиферация [27], когда при делении Т-клеток происходит передача стабильных аберраций новым лимфоцитам-потомкам. Таким образом, интерес представляет не продолжительность жизни отдельного лимфоцита, а продолжительность жизни пролиферирующего клона. Более того, количественные оценки показывают, что репертуар Т-клеток периферической крови в основном формируется в детском возрасте и остается довольно стабильным в течение жизни [28–30]. Следует отметить, что прослеживание путей образования, сохранения и передачи транслокаций в Т-клетках крови в течение длительного времени является сложной задачей, поскольку требует проведения продольных исследований в течение десятилетий.
Таким образом, цель настоящего исследования заключалась в следующем: основываясь на опубликованных данных, выделить наиболее существенные процессы формирования периферического пула Т-лимфоцитов с хромосомными аберрациями и разработать новую концепцию Т-клеточного рода для целей биодозиметрии. Это включает: 1) характеристику основных компартментов, связанных с формированием транслокаций; 2) оценку временных характеристик пребывания Т-лимфоцитов и их предшественников в различных компартментах; 3) анализ динамики клеточных популяций (пролиферация и гибель клеток) в периферическом пуле; 4) описание концепции Т-клеточного рода.
ОСНОВНЫЕ КОМПАРТМЕНТЫ ПРЕБЫВАНИЯ Т-ЛИМФОЦИТОВ И ИХ ПРЕДШЕСТВЕННИКОВ
Следующие компартменты были выделены нами как наиболее существенные для формирования предшественников и зрелых Т-лимфоцитов – потенциальных носителей транслокаций: 1) красный костный мозг – место, где находятся стволовые кроветворные клетки, подвергающиеся локальному облучению остеотропными β-излучателями; 2) тимус – орган, где происходит формирование периферических Т-лимфоцитов; а также 3) периферический пул, включающий лимфоидные ткани, селезенку, печень, кровеносные сосуды и т.д. Далее подробно рассматриваются процессы, проходящие в этих компартментах.
Костный мозг
Периферические Т-лимфоциты происходят из гемопоэтических стволовых клеток, расположенных в красном костном мозге. Из этих стволовых клеток происходят различные коммитированные предшественники – прогениторы, которые первыми теряют способность к самовоспроизводству. Изредка некоторое число Т-прогениторов выходит из костного мозга в кровоток, где они получают возможность вхождения в тимус [31–34]. Число предшественников, выходящих в кровоток, уменьшается с возрастом, максимальная скорость “заселения” тимуса наблюдается в первые годы жизни [34, 35].
Следует отметить, что нет прямой зависимости между выходом прогениторов из ККМ в периферическую кровь (число Т-прогениторов в периферической крови) и производством тимусом Т-лимфоцитов. За период от 20–25 до 60 лет доля Т-прогениторов в периферической крови уменьшается примерно в 2 раза, как в расчете на общее число ядросодержащих клеток [36], так и в расчете на общее число плюрипотентных гемопоэтических клеток [37], при этом продукция тимуса снижается почти на порядок [27, 38]. По некоторым экспериментальным оценкам время пребывания Т-прогениторов в циркуляции не превышает 6 мин [34].
Таким образом, производство и миграция Т-прогениторов в периферическую кровь не является лимитирующим фактором для производства тимусом Т-лимфоцитов, хотя имеются данные, что неполное восстановление костномозговых гемопоэтических и лимфопоэтических предшественников после облучения может быть фактором, ограничивающим восстановление числа периферических лимфоцитов [39]. Такими лимитирующими факторами являются условия микроокружения в тимусе, объем эпителия и т. д. Мы можем считать, что после начала локального облучения костного мозга вся продукция тимуса потенциально несет сформированные там аберрации, и она прямо пропорциональна количеству облученных прогениторов, достигших тимуса через периферическую кровь.
Тимус
После попадания из кровеносного русла в тимус клетки-предшественники Т-лимфоцитов продолжают дифференцироваться и активно пролиферировать. В течение своего развития Т-клетки приобретают уникальные гетеродимерные Т-клеточные рецепторы (ТКР), которые могут быть использованы при распознавании патогена. Примерно 95% Т-клеток имеют ТКР с рецепторными цепочками α и β. Они появляются вследствие процесса соматической перегруппировки (рекомбинации), при которой соединяются различные сегменты генов Т-клеточных рецепторов и создается новый ген. Этот процесс присоединения является неточным и идет со вставкой нешаблонных нуклеотидов (N-нуклеотидов) в месте соединения, а также -3'- и 5'-нуклеотидных делеций из зародышевых генов, участвующих в перегруппировке. Этот участок произвольного введения нуклеотида или его стирания называется третьим участком, определяющим комплементарность (CDR3). Полученный в результате этого процесса участок хромосомы имеет уникальную нуклеотидную последовательность, которая специфична для конкретной Т-клетки и всех ее потомков; отсюда проистекает клонотипический характер рецепторов [40]. То есть гены, кодирующие конкретный (уникальный) ТКР, будут переданы всем потомкам Т-лимфоцита, в том числе и после его активации чужеродным антигеном.
T-клеточный рецептор относится к подмножеству рецепторов клеточной поверхности (эпитопов), которые указывают на клеточный тип и стадию дифференциации клетки и которые распознаются антителами. Рецепторы клеточной поверхности или кластеры дифференциации (CD)22 обычно используются в качестве клеточных маркеров для идентификации клеток. Все Т-клетки экспрессируют CD3+ маркер; кроме того, T-клетки имеют другие CD маркеры, отражающие подгруппу клеток и стадию их дифференциации. Около 95–99% T-клеток в периферической крови являются клетками CD4+ или CD8+. Клетки CD4+ являются хелперными клетками, продуцирующими цитокины, которые стимулируют другую Т-клеточную эффекторную функцию и продукцию антител B-клетками, они также мобилизуют мощный механизм воспаления. Клетки CD8+ являются цитотоксичными, они весьма эффективны при прямом лизисе инфицированных (вирусами, например) или злокачественных клеток, несущих антигены [41].
В тимусе Т-клетки развиваются из клеток без специфических Т-маркеров (CD3-CD4-CD8-, т.е. тройные отрицательные клетки) в CD4+CD8+ (двойные положительные клетки). Приблизительно 95–98% двойных положительных клеток гибнет вследствие положительной и отрицательной селекции. Процессы селекции допускают появление Т-клеток только с низкой аффинностью (низким сродством) к ауто-антигенам (антигенам собственных клеток) и собственному основному комплексу гистосовместимости (ауто-МНС). При этом потенциально ауто-реактивные клетки с высокой аффинностью элиминируются, а оставшиеся проходят дальнейшую дифференциацию в одноположительные CD4+ и CD8+ тимоциты. Эти Т-клетки мигрируют из тимуса в периферический пул в качестве наивных Т-клеток – недавних тимусных эмигрантов (RTEs), т.е. клеток, наиболее близких к костномозговым прогениторам. Созревание Т-клеток в тимусе, которое включает пролиферацию Т-предшественников из костного мозга, положительную и отрицательную селекцию с гибелью около 95% клеток, не занимает большое количество времени и составляет по разным оценкам до 1 мес. [42].
Продуктивность тимуса существенно зависит от возраста индивида [43, 44]. К концу первого года жизни тимус достигает максимального размера [26], после этого начинается атрофия коркового и медуллярного слоя тимуса, т.е. эпителиального пространства, где непосредственно происходит созревание Т-лимфоцитов. Объем эпителия снижается на 70% в течение первых 20 лет жизни, и далее это снижение только прогрессирует [26, 45]. Уменьшение эпителиального пространства тимуса приводит к уменьшению производства Т-клеток, которое наблюдается уже в детском возрасте и далее в течение жизни.
Периферический пул
Наивные Т-клетки, т.е. клетки, не встречавшиеся с соответствующим им антигеном, подразделяются на две субпопуляции: недавние тимусные эмигранты (RTEs) и наивные клетки – “ветераны”, которые появляются после ряда делений RTE. Клетки RTEs могут быть идентифицированы в крови при использовании специальных маркеров [38]33. Данные по динамике RTEs используются для количественной оценки работы тимуса [42, 46–50].
Было показано, что во всех возрастных группах число RTEs значительно ниже, чем общее число наивных клеток, которое поддерживается гомеостатической пролиферацией (постоянным делением) наивных клеток [23]. Время между делениями (продолжительность жизни) увеличивается с возрастом; таким образом, постоянный размер пула наивных клеток означает снижение скорости пролиферации в течение жизни.
По оценкам N. Vrisekoop [51] для взрослых, медианные полупериоды жизни для наивных CD4+ и CD8+ были оценены как 1517 и 2374 дней соответственно. Следует отметить, что если время между делениями превышает 1000 дней, то ограничение числа делений соматических клеток (около 35, предел Хэйфлика) не важно, а клон может считаться бессмертным с точки зрения человеческой жизни. Наивные Т-клетки движутся (мигрируют) по кровотоку в поисках чуждых антигенов среди вторичных лимфоидных органов: селезенка, лимфоузлы, костный мозг, организованная лимфоидная ткань, ассоциированная со слизистыми поверхностями и кожей, включая Пэйеровы бляшки, миндалины, легочную, назальную и связанную с кишечником лимфоидную ткань. При рождении человека периферический пул наивных клеток составляет около 90% Т-клеток. В последующем происходит снижение доли наивных клеток, соотношение между наивными клетками и Т-клетками памяти к 20 годам составляет примерно 1 : 1. Далее компартмент наивных Т-клеток остается относительно стабильным до возраста 80–90 лет [52–55], хотя некоторые авторы отмечали возрастное снижение пула наивных клеток и различия между мужчинами и женщинами [28, 56].
Клетки памяти появляются после стимуляции антигеном (в присутствии ко-стимулирующих сигналов и воспалительных цитокинов) и дифференциации наивных клеток. Скорость перехода наивных клеток в пул клеток памяти примерно соответствует скорости появления новых антигенов. Стимулированные наивные клетки (эффекторные клетки) быстро делятся, и около 95% из них гибнут от апоптоза вскоре после ликвидации патогена [57]. Некоторая часть эффекторных клеток дифференцируется в эффекторные клетки памяти, которые порождают клетки центральной памяти44 со свойствами, подобными свойствам стволовых клеток. Было отмечено, что центральные клетки памяти являются самообновляющимися и мультипотентными, и таким образом они обеспечивают потенциальный резервуар для Т-клеток памяти в течение всей жизни [58, 59]. Пул центральных и эффекторных клеток памяти остается относительно стабильным или слегка повышенным для широкого диапазона возрастов (20–90 лет) [53, 55]. Эффекторные клетки памяти сохраняются в периферических лимфоидных органах и в тканях организма. Они делятся быстрее по сравнению с наивными клетками (для взрослых время между делениями занимает 155 и 244 дня для CD4+ and CD8+ соответственно [51]); проходят терминальную дифференциацию после ограниченного числа делений и могут погибнуть вследствие апоптоза. Однако пул эффекторных клеток памяти поддерживается центральными клетками памяти, а гибель эффекторных клеток памяти не означает полную элиминацию специфического клонотипа.
Таким образом, хромосомная аберрация может находиться в клонах Т-лимфоцитов памяти или наивных Т-клеток.
Разнообразие Т-клеточных клонов в различные возрастные периоды (поперечные исследования)
Оценка разнообразия Т-клеточных клонов является сложной задачей, которая решается с помощью глубокого секвенирования регионов, кодирующих ТКР. Обычно глубокому секвенированию подвергают β-регион, обладающий значительно бóльшим разнообразием, чем α-регион.
Данные глубокого секвенирования ТКРβ региона тимоцитов периферической крови от 73 доноров различного возраста были представлены O. Britanova [28], и в настоящий момент это наиболее подробное поперечное исследование разнообразия Т-клеточных клонов. Примененный метод позволил получить 1–2.6 млн различных надежно секвенированных молекул кДНК для ТКРβ на каждый образец крови (3–20 млн ядерных клеток – мононуклеаров) и выявить 0.4–0.6 млн различных уникальных клонотипов ТКРβ на образец. В работе авторы не разделяли Т-клетки на субпопуляции (наивные или клетки памяти, CD4+ или CD8+). Авторы отмечали это как недостаток работы, однако, поскольку исследование судьбы хромосомных аберраций не предполагает разделение Т-лимфоцитов на субпопуляции, этот минус не является для нас существенным. Анализ возрастной зависимости показал, что разнообразие ТКРβ (число уникальных ТКРβ) в расчете на 300 000 Т-лимфоцитов (табл. 1) максимально в пуповинной крови у новорожденных и закономерно снижается с возрастом. В молодом и среднем возрасте разнообразие (как следует из анализа табл. 1) значимо не различается и существенно снижается в пожилом возрасте, однако границу резкого снижения по этим данным можно провести только условно.
Таблица 1.
Разнообразие ТКРβ в зависимости от возраста [28] (поперечные исследования) Table 1. Diversity of TKRβ depending on age [28] (cross-sectional studies)
| Группа доноров | Средний возраст (диапазон) | Число доноров | Разнообразие ТКРβ CDR3 на 300 000 Т-клеток (×105) |
|---|---|---|---|
| Новорожденные (пуповинная кровь) | 0 | 8 | 2.7 ± 0.1 |
| Молодые | 16 (6–25) | 11 | 2.2 ± 0.3 |
| Средний возраст | 40 (30–50) | 13 | 1.6 ± 0.5 |
| Пожилые | 60 (51–75) | 18 | 1.4 ± 0.6 |
| Долгожители | 92 (85–105) | 23 | 0.9 ± 0.4 |
Для примера в табл. 2 приведены результаты изучения разнообразия ТКРβ с учетом субпопуляций Т-лимфоцитов [60], когда исследовали кровь от двух доноров (здоровые мужчины 35 и 37 лет). Разнообразие ТКРβ оценивали с поправкой на “скрытые” клонотипы, представленные одной клеткой; для этого был использован математический подход, разработанный для оценки общего видового разнообразия в большой популяции с использованием измерений видового разнообразия в случайной конечной выборке [61]. Таким образом, табл. 2 представляет абсолютные величины разнообразия ТКРβ (т.е. их общее количество в организме) в различных субпопуляциях Т-лимфоцитов человека, полученные авторами расчетным путем.
Таблица 2.
Расчетные значения количества уникальных ТКРβ в различных субпопуляциях Т-лимфоцитов в организме взрослых мужчин [60] Table 2. The calculated values of the number of unique TKRβ in various subpopulations of T-lymphocytes in the body of adult men [60]
| Субпопуляция | Разнообразие ТКРβ ± ошибка | |
|---|---|---|
| донор 1 | донор 2 | |
| CD8+ памяти | 6.3 × 105 ± 9 × 104 | 4.4 × 105 ± 1.1 × 105 |
| CD8+ наивные | 1.24 × 106 ± 5 × 104 | 9.7 × 105 ± 1.3 × 105 |
| CD4+ памяти | 8.2 × 105 ± 4 × 104 | 8.7 × 105 ± 1.2 × 105 |
| CD4+ наивные | 1.26 × 106 ± 1.3 × 105 | 1.03 × 106 ± 8 × 104 |
Как следует из табл. 2, для взрослых доноров суммарное разнообразие CD4+ несколько выше, чем CD8+. Следует отметить, что для CD8+ разнообразие в пуле наивных клеток примерно в 2 раза выше, чем в пуле клеток памяти, для CD4+ – примерно в 1.2–1.5 раза выше.
Исследование разнообразия клонотипов CD8+ памяти было выполнено группой Y. Naumov [62, 63]. Авторы использовали другой подход, обследовались только взрослые лица с характеристиками комплекса гистосовместимости HLA-A2, и у них изучались клонотипы, участвующие в повторных распознаваниях эпитопа M158–66 гриппа A (эта последовательность присутствует во всех штаммах гриппа). У этих лиц (HLA-A2) формируется устойчивая реакционная способность цитотоксических клеток (CD8+) к эпитопу M158–66, и, как полагают, это происходит вследствие вирусных воздействий, повторяющихся с детства. Данная модель позволяет изучать относительные характеристики разнообразия клонотипов. Исследователи показали, что около 57% Т-клеток памяти у взрослых состоит из большого количества редких или одиночных клонотипов; а ∼43% состоит из нескольких высокочастотных клонотипов [62, 63]. Этот второй компонент, вероятно, представляет Т-клетки, которые чаще всех анализируются при иммунных ответах. Поэтому скорость повторной антигенной стимуляции (частота появления антигена) определяет репертуар Т-клеток периферической крови в специфический период времени. Авторы также указывают на резкое снижение разнообразия клонотипов памяти CD8+ в пожилом возрасте [63]. Так, вариабельность этих клонотипов у лиц среднего возраста (43–49 лет, n = 8) превышала таковую у пожилых людей (68–84 года n = 8) примерно в 2 раза.
Аналогично разнообразию клонотипов памяти CD8+ репертуар CD4 β-цепей у взрослых индивидов меняется мало до 65 лет, после чего также происходит резкая потеря разнообразия [52]. Эта картина наблюдалась как в пуле наивных клеток, так и в пуле клеток памяти [64].
Разделение на субпопуляции Т-лимфоцитов обычно делается в предположении, что после антигенной стимуляции наивные клетки со специфическим ТКР (весь клон) участвуют в иммунном ответе, и часть эффекторных клеток с этим ТКР формирует клон клеток памяти, т.е. пулы клеток памяти и наивных клеток содержат разные клонотипы. V. Venturi и соавт. сопоставили репертуар ТКРβ в пуле цитотоксичных клеток памяти и наивных клеток CD8+ (четыре здоровых донора с характеристиками HLA-A*0201*; три из четырех, однако, были положительны по наличию цитомегаловируса) [65]. Исследователи обнаружили, что имеет место перекрывание репертуара субпопуляций Т-наивных и Т-клеток памяти: до 20% уникальных клонотипов клеток памяти встречаются и в пуле наивных клеток. Общие клонотипы относятся к высококлеточным (высокочастотным), общее число лимфоцитов, принадлежащих общим клонотипам, составляет по меньшей мере половину клеток памяти. Чем больше клеточность общих клонотипов в пуле клеток памяти, тем она больше и в пуле наивных клеток (значимая положительная корреляция).
Численность клонотипов в рамках одной субпопуляции Т-лимфоцитов может различаться в несколько раз. Как уже говорилось выше, около 40% клеток памяти составляют несколько высококлеточных клонотипов, остальные – малоклеточные или клонотипы, представленные одной клеткой [63]. Анализ частот встречаемости клонотипов разной клеточности и представление этих частот в виде ранговой зависимости в log-log масштабе позволили заключить, что их распределение может быть описано степенным законом (показатель степени примерно равен –1.6), что указывает на фрактальный характер организации разнообразия CD8+ клонотипов памяти (по частоте их встречаемости) [66]. Степенная зависимость остается, если анализировать различные субпопуляций CD8+ клонотипов памяти, например, если анализировать разнообразие клонотипов, использующих BJ2,7.
Аналогичные степенные зависимости были получены при изучении разнообразия β-цепей всей популяции Т-лимфоцитов (CD3+) у здоровых доноров, кровь которых использовалась для трансплантации стволовых клеток [67]. Были рассчитаны клональные частоты на уровне сегментов генов: J, VJ и VJ + NI (нуклеотидные вставки). Авторы заключают, что частоты встречаемости различных вариантов генов не являются случайными, а характеризуются степенными зависимостями. То есть существуют определенные доминантные клоны и минорные (малочисленные клоны), которые вместе образуют “себе подобные” распределения внутри любых частей Т-клеточного репертуара клонотипов внутри индивида. Фактически имеет место фрактальная организация частот клонотипов.
Специальный анализ, указывающий на фрактальный характер частного распределения клонотипов Т-лимфоцитов, был также выполнен группой из Нижнего Новгорода под руководством O. Bolkhovskaya [68] с использованием общедоступных баз данных по расшифровке генов ТКР. В частности, этой группой были использованы данные, цитированные выше [60, 67, 69].
Устойчивость репертуара Т-клеточных клонов (продольные исследования)
Возможность прослеживания клонотипного репертуара одного человека в течение десятков лет осложняется тем фактом, что методы глубокого секвенирования были разработаны только в последние годы. Еще одной важной проблемой при изучении динамики Т-клеточных популяций при продольных исследованиях является тот факт, что только 2–3% лимфоцитов находятся в периферической крови в данный момент времени (в момент забора крови) [70, 71]. То есть две пробы крови, отобранные одномоментно или с небольшим интервалом времени, могут существенно различаться по составу Т-клонотипов. Это заставляет исследователей применять специальные приемы при сравнении стабильности клонотипного состава лимфоцитов периферической крови.
Продольные исследования: интервал 3 года (все тимоциты без деления на субпопуляции) [28]
Индивидуальные измерения состава клонотипов в течение 3 лет (продольные исследования) проводили на двух здоровых донорах. Донор № 1 – кровь отбирали в возрасте 27 и 30 дет. Донор № 2 – кровь отбирали в возрасте 47 и 50 лет. В качестве контроля использовали данные для двух индивидов, у которых одномоментно были взяты два образца крови и проведено раздельное секвенирование. Оказалось, что различия в репертуаре ТКРβ между образцами, отобранными с перерывом в 3 года, были минимальны. Они были сопоставимы с различиями между двумя образцами крови, полученными от контрольных доноров. Перекрывание репертуара в первом случае было 48 и 64% (донор № 1 и № 2), а в контроле – 72 и 43%. То есть клонотипный состав, по крайней мере, для первых по частоте 1000 клонов, практически не изменился, однако несколько изменилась клеточность клонов.
Авторы заключают, что постоянные высококлеточные клоны могут занимать более 50% гомеостатического пространства Т-клеток, что подтверждает ранее полученные данные о фрактальной природе разнообразия клонотипов.
Продольные исследования: интервал 7–10 лет (анализ разнообразия клонотипов памяти CD8+) [29]
Как и в вышеописанных работах этой группы, исследователи изучали индивидов с характеристиками HLA-A2.1, генерирующие устойчивую реактивность против M158–66. К сожалению, авторы не делали контрольный анализ двух порций крови, отобранных одномоментно, как это было описано выше в работе [28]. Однако чтобы нивелировать влияние низкочастотных клонов (синглетонов) на картину клонотипного разнообразия, исследователи проанализировали совпадение репертуаров (полученных с интервалом в 10 лет) в зависимости от клеточности клонотипов. Выяснилась следующая зависимость: если сравнивать все разнообразие, учитывая синглетоны, то через 10 лет совпадение будет только 15–30%. Если сравнивать клонотипы, представленные как минимум тремя клетками, то совпадение будет 47–53%, шестью клетками – 61–65%. Как заключают авторы, оценка стабильности репертуара напрямую зависит от возможности максимально полно оценивать репертуар. В целом авторы делают вывод о стабильности репертуара Т-клеток памяти CD8+ в течение как минимум 10 лет.
Продольные исследования: интервал 20 лет (отдельно для субпопуляций CD4+ и CD8+) [30]
В работе [30] указывается, что приблизительно 10–30% и 30–80% последовательностей ТКР в Т-клетках CD4+ и CD8+ соответственно перекрывались в разные возрастные периоды у каждого индивида (диапазон возрастов 23–64 года, одни и те же доноры обследованы с интервалом в 20 лет). Это указывает на долгосрочное стабильное сохранение клональной композиции Т-клеток. Многие из наиболее частых последовательностей (т.е. наиболее распространенные клоны Т-клеток) сохранялись более 20 лет, а некоторые из них были расширены.
В целом, проанализировав последние данные о разнообразии клонотипов Т-клеток, исследователи приходят к выводу, что их репертуар остается весьма постоянным на протяжении всей жизни, за исключением детского возраста и старости [72].
Перемещение периферических Т-лимфоцитов между компартментами тела
Как уже говорилось, только 2–3% лимфоцитов находятся в периферической крови в данный момент времени (в момент забора крови) [70, 71]. Однако практически все лимфоциты пройдут через периферическую кровь в течение дня [73], кроме того, типичные наивные клетки проводят около получаса в сосудистом русле, прежде чем задержаться в очередном лимфатическом узле [74].
Для случая локального облучения костного мозга остеотропными радионуклидами важно оценить, какое время зрелые Т-лимфоциты проводят в костном мозге. Во время пребывания в костном мозге Т-лимфоциты дополнительно подвергаются воздействию 89,90Sr, накопленному в кости. Ряд авторов [75–78] сообщали о рециркуляции Т-лимфоцитов в костном мозге у млекопитающих и людей. В костном мозге представлено около 25 × 109 Т-клеток (3–8% от всех ядросодержащих клеток). Т-лимфоциты поступают из крови, а после пребывания в костном мозге возвращаются в кровь, чтобы мигрировать в другие лимфоидные органы. Согласно [78], у людей процент Т-клеток, присутствующих в крови, лимфатических узлах, селезенке и ККМ, составляет примерно 3, 70, 15 и 12% соответственно. Предполагая постоянную скорость рециркуляции, циркулирующие Т-лимфоциты должны проводить около 12% своей жизни в ККМ, а их кумулятивная (пожизненная) доза формируется на 88% во внескелетных (экстраскелетных) лимфоидных тканях и на 12% в ККМ. Таким образом, в случае хронического воздействия 89,90Sr частота транслокаций отражает промежуточное значение между дозами, накопленными в ЭСТ и ККМ.
КОНЦЕПЦИЯ Т-КЛЕТОЧНОГО РОДА
Как было описано выше, Т-клетки периферической крови – это пролиферирующий пул клеток. Стабильные хромосомные аберрации передаются всем потомкам Т-клеточного прогенитора (Т-прогенитора) и пролиферирующих Т-клеток, образующих клон, если транслокации не летальны. Это означает, что хромосомные аберрации будут регистрироваться до тех пор, пока какие-либо клетки (потомки облученного прогенитора) циркулируют в организме. Эти клетки, объединенные в генус (“Genus” – Т-клеточный род), рассматриваются как потенциальные носители одного специфического маркера (хромосомной транслокации). Поэтому именно Т-клеточный род должен быть объектом рассмотрения при интерпретации цитогенетических исследований при локальном облучении костного мозга. Мы предлагаем следующее определение: T-клеточный Genus (TG) объединяет всех потомков T-прогенитора с наследуемыми специфическими аберрациями, которые могли образоваться в костном мозге.
На рис. 1 представлена упрощенная схема формирования TG, которая обобщает вышеописанные особенности формирования Т-лимфоцитов и их разнообразия в различных компартментах тела человека.
Рис. 1.
Упрощенная схема образования одного Т-клеточного рода (TG), используемая в настоящем исследовании. Т-клеточный предшественник (большой белый кружок) происходит от гемопоэтических стволовых клеток в ККМ и мигрирует к тимусу через кровоток в течение короткого периода времени. После пролиферации и дифференцировки прогенитора большая часть тимоцитов элиминируется в результате позитивной и негативной селекции (маленькие черные кружки). Оставшиеся тимоциты (небольшие белые кружки) входят в кровоток как наивные Т-клетки (CD4+ и CD8+ недавние эмигранты тимуса, RTE), которые дают начало специфическим клонотипам T-клеток (серые фигуры) из-за деления клеток (показаны линиями) в периферическом пуле, для которого также используется название экстраскелетные ткани (ЭСТ). В рамках специфического клонотипа происходит переход от пула T-naive к пулу T-памяти после стимуляции антигеном; этот процесс не показан, поскольку он не сопровождается потерей хромосомных аберраций и изменениями в Т-клеточных рецепторах. Показана судьба пяти отдельных клонотипов (различающихся по генам Т-клеточного рецептора и идентичных по остальным генам) в периферическом пуле: во время взятия крови клонотипы № 1 и № 2 содержат несколько клеток; клонотипы № 3 и № 4 были безвозвратно потеряны; клонотип № 5 – многоклеточный из-за продолжающейся стимуляции антигеном. Во время взятия крови все клетки специфического TG (относящиеся к трем выжившим клонотипам) содержат транслокации, унаследованные от общего предшественника, подвергнутого воздействию в ККМ.
Fig. 1. Simplified scheme for the formation of a single T-cell Genus (TG) used in this study. The T-cell progenitor (large white circle) is originated from hematopoietic stem cells in RBM (red none marrow) and migrates to the thymus through the bloodstream for a short time period. After proliferator and differentiation, the majority of thymocytes are eliminated as a result of positive and negative selection (small black circles). The remaining thymocytes (small white circles) enter the bloodstream as naive T-cells (CD4+ and CD + recent thymus emigrants, RTEs), which give rise to specific T-cell clonotypes (gray shapes) due to cell division (shown by lines) in the peripheral pool, for which the name extra skeletal tissue (ECT) is also used. In the framework of a specific clonotype, there is a transition from the T-naive pool to the T-memory pool after antigen stimulation; the process is not shown, since it is not accompanied by a loss of chromosomal aberrations and changes in T-cell receptors. The fate of five separate clonotypes (differing in the genes of the T-cell receptor and identical in other genes) in the peripheral pool is shown: at the time of blood sampling, clonotypes № 1 and № 2 contain several cells; clonotypes № 3 and № 4 were irretrievably lost; clonotype № 5 is multicellular due to ongoing antigen stimulation. At the time of blood sampling, all specific TG cells (belonging to the three surviving clonotypes) contain translocations inherited from the common progenitor exposed in RBM.
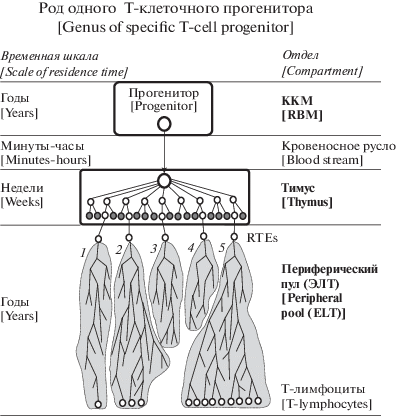
Динамика TG никогда специально не изучалась, поскольку для иммунологов значительно больший интерес представляет динамика клонотипов, содержащих уникальные Т-клеточные рецепторы (ТКР). Как говорилось выше, методы глубокого секвенирования репертуара ТКР с нормализацией, основанной на уникальных молекулярных идентификаторах, позволяют изучать долгосрочную динамику клонотипов Т-клеток [28, 79]. Анализ продольных исследований показывает, что вследствие гомеостатической регуляции некоторая (возможно значительная) часть уникальных клонотипов, генерируемых тимусом, сохраняется в течение жизни человека (хотя бы на уровне синглетонов, представленных в пробах одной клеткой). Это также относится к TG, т.е. мы должны предположить, что репертуар TG остается довольно постоянным на протяжении жизни. По аналогии с клонотипами Т-клеток периферической крови следует ожидать фрактальную организацию клонотипов в пределах конкретного TG, что предполагает существование нескольких многоклеточных клонов и большое количество малоклеточных клонов. Потеря всего набора клонотипов, принадлежащих TG, представляется маловероятной.
Чтобы оценить вклад облученных TG в суммарную продукцию тимуса в течение жизни, необходимо оценить зависящую от возраста динамику TG – скорость производства и скорость потери. Поскольку нет прямых оценок, мы можем предположить, что количество произведенных RTE прямо пропорционально числу TG (это означает, что один предшественник производит примерно одинаковое число RTE). Такое предположение позволяет экстраполировать данные по динамике RTE на динамику TG. Что касается скорости безвозвратной потери TG в зависимости от возраста, этот показатель также нельзя оценить напрямую. Тем не менее скорость потери клонотипа в значительной степени зависит от истории “иммунной экосистемы” отдельного индивида, наличия у него хронических инфекций, частоты контактов с чужеродным микроокружением и т.д. Что касается TG, то потеря всех клонотипов одного TG маловероятна, а скорость безвозвратной потери TG должна быть малой по сравнению с темпом их производства. В этой связи следует рассмотреть следующие варианты: 1) скорость потери TG пропорциональна скорости производства TG (RTE), т.е. скорость максимальна в детском возрасте и минимальна у пожилых людей; 2) потеря TG происходит с постоянной скоростью на протяжении всей жизни; и 3) скорость потери TG обратно пропорциональна возрасту, т.е. минимальна в детстве и максимальна у пожилых людей. Эти варианты можно проверить, используя модельные подходы с привлечением данных цитогенетических исследований жителей прибрежных сел р. Теча. Разработка и валидация модели облучения Т-лимфоцитов происходит в настоящее время.
ПРИМЕНЕНИЕ КОНЦЕПЦИИ Т-КЛЕТОЧНОГО РОДА В БИОДОЗИМЕТРИИ
Разработанная концепция TG прежде всего касается моделирования эффектов воздействия на лимфоциты α- и β-излучений остеотропных радионуклидов (89,90Sr, 226Ra и др.), т.е. случаев локального облучения костного мозга [80]. Помимо этого есть и другие радионуклиды, которые неравномерно распределяются в организме.
Наиболее практически значимыми для оценок эффектов профессионального облучения являются изотопы плутония. Плутоний аккумулируется не только на поверхности кости, облучая прилегающий слой костного мозга, но также и в печени [81], в легких и легочных лимфоузлах [82, 83], где Т-лимфоциты могут оставаться довольно долго. Следует отметить, что нормальная печень содержит большое количество лимфоцитов, которые составляют около 25% от общего количества клеток печени [84]. Среди лимфоцитов CD4+ и CD8+ Т-клетки составляют около 63%. Некоторые из этих клеток являются дифференцированными эффекторами, которым суждено умереть в результате апоптоза, но многие из них являются иммунокомпетентными клетками, проходящими через печень для обеспечения постоянного иммунного надзора, а также эффекторными T-клетками, ассоциированными с эпителием [85]. Это означает, что даже недолгое периодическое пребывание Т-лимфоцитов в печени может привести к значительному облучению, принимая во внимание, что дозовый коэффициент, позволяющий перейти от количества поступившего радионуклида к поглощенной дозе, для печени выше в 4 раза по сравнению с дозовым коэффициентом для ККМ [81]. Аналогичная ситуация наблюдается для легочных лимфатических узлов, которые накапливают значительное количество плутония [82, 83].
Необходимо также принять во внимание, что для рабочих ядерных предприятий начало облучения приходится на возраст старше 20 лет. Это означает, что периферический пул лимфоцитов уже в основном сформирован. Таким образом, доза облучения лимфоцитов в большей мере должна быть связана не с дозой от Pu на костномозговые предшественники лимфоцитов, а с дозой, полученной при миграции зрелых лимфоцитов через печень, лимфоузлы и ККМ. Количественная оценка вкладов облучения в различных компартментов требует разработки соответствующей модели. Концепция TG позволяет разработать такую модель и оценить относительный вклад различных компартментов (органов депонирования Pu) в дозу облучения лимфоцитов.
ВЫВОДЫ
Неравномерное облучение тела человека возникает, в частности, при внутреннем воздействии β-излучения радионуклидов, характеризующегося короткой длиной пробега электронов, когда эти изотопы избирательно накапливаются в каком-либо компартменте. К таким радионуклидам относится 90Sr, накапливающийся в костной ткани (орган-источник) и облучающий, в основном, красный костный мозг (орган-мишень). Для правильной интерпретации цитогенетических исследований с целью биодозиметрии необходимо учитывать облучение Т-лимфоцитов и их предшественников в различных компартментах – ККМ, периферический пул.
В разных компартментах и в разные периоды времени носители одной и той же разновидности хромосомных аберраций могут быть представлены разными клетками – прогениторы и зрелые лимфоциты, принадлежащие различным субпопуляциям Т-лимфоцитов. Нами была предложена новая концепция Т-клеточного рода, Т-клеточный род (genus) объединяет всех потомков T-прогенитора с наследуемыми специфическими аберрациями, которые могли образоваться в костном мозге. Т-клеточный род является наиболее подходящим объектом моделирования для оценок средневзвешенных доз облучения Т-лимфоцитов, облучившихся в различных компартментах.
Список литературы
IAEA. Cytogenetic dosimetry: applications in preparedness for and response to radiation emergences. International Atomic Energy Agency, 2011. 247 p.
Нугис В.Ю., Севанькаев А.В., Хвостунов И.К. и др. Результаты 25-летнего цитогенетического обследования лиц, подвергшихся облучению в различных дозах при аварии на Чернобыльской АЭС // Радиац. биология. Радиоэкология. 2011. Т. 51. № 1. С. 81–90. [Nugis V.Yu., Sevan’kaev A.V., Khvos-tunov I.K. et al. The results of 25 year-cytogenetic investigation of survivors exposed to different doses of irradiation in the Chernobyl accident // Radiats. Biologiya. Radioecologiya. 2011. V. 51. № 1. S. 81–90. (In Russian)]
Khvostunov I.K., Snigiryova G.P., Moiseenko V.V., Lloyd D.C. A follow-up cytogenetic study of workers highly exposed inside the Chernobyl sarcophagus // Radiat. Prot. Dosim. 2015. V. 167. № 4. P. 405–418. https://doi.org/10.1093/rpd/ncu351. http://www.memoid.ru/node/Perspektivy_atomnoj_ehnergetiki_sovremennoj_Rossii-cite_ref.D0.B0.D1.82.D0.BE. D0.BC_12-7
Биологическая индикация радиационного воздействия на организм человека с использованием цитогенетических методов: мед. технология № ФС‑2007/015-У. Российский научный центр рентгенорадиологии, Институт общей генетики им. Н.И. Вавилова. М., 2007. 29 с. [Biologicheskaya indikatsiya radiatsionnogo vozdeistviya na organizm cheloveka s ispol’zovaniem tsitogeneticheskikh me-todov: med. tekhnologiya № FS-2007/015-U. Rossiiskii nauchnyi tsentr rentgenoradiologii, Institut obshchei genetiki im. N.I. Vavilova. Moskva, 2007. 29 p. (In Russian)]
Nowell P.C. Phytohemagglutinin – An initiator of mitosis in cultures of normal human leukocytes // Cancer Res. 1960. V. 20. № 4. P. 462–466.
Sotnik N.V., Osovets S.V., Scherthan H., Azizova T.V. mFISH analysis of chromosome aberrations in workers occupationally exposed to mixed radiation // Radiat. Environ. Biophys. 2014. V. 53. № 2. P. 347–354. https://doi.org/10.1007/s00411-014-0536-7
Tawn E.J., Whitehouse C.A., Holdsworth D. et al. mBAND analysis of chromosome aberrations in lymphocytes exposed in vitro to α-particles and γ-rays // Int. J. Radiat. Biol. 2008. V. 84. № 1. P. 1–7. https://doi.org/10.1080/09553000802078412
Tawn E.J., Curwen G.B., Jonas P. et al. Chromosome Aberrations Determined by FISH in Radiation Workers from the Sellafield Nuclear Facility // Radiat. Res. 2015. V. 184. № 3. P. 296–303. https://doi.org/10.1667/RR14125.1
Пилинская М.А., Дыбский С.С., Скалецкий Ю.Н. и др. Опыт использования метода FISH для реконструкции индивидуальных доз облучения у ликвидаторов Чернобыльской аварии в рамках Украинско-Американского проекта “Лейкемия” // Цитология и генетика. 2006. Т. 40. № 3. С. 34–39. [Pilinskaia M.A., Dybskiǐ S.S., Skaletskiǐ Yu.N. et al. The experience of FISH technique application for reconstruction of individual radiation doses in Chernobyl liquidators in the framework of Ukrainian-American project “Leukemia” // Tsitologiya i Genetika. 2006. V. 40. № 3. S. 34–39. (In Russian)]
Hande M.P., Azizova T.V., Burak L.E. et al. Complex chromosome aberrations persist in individuals many years after occupational exposure to densely ionizing radiation: an mFISH study // Genes, Chromosomes, Cancer. 2005. V. 44. № 1. P. 1–9. https://doi.org/10.1002/gcc.20217
Curwen G.B., Sotnik N.V., Cadwell K.K. et al. Chromosome aberrations in workers with exposure to α-particle radiation from internal deposits of plutonium: expectations from in vitro studies and comparisons with workers with predominantly external γ-radiation exposure. 2015. V. 54. № 2. P. 195–206. https://doi.org/10.1007/s00411-015-0585-6
Сотник Н.В., Азизова Т.В. Использование методов mFISH и mBAND в биоиндикации воздействия внутреннего α-излучения // Радиац. биология. Радиоэкология. 2016. Т. 56. № 2. С. 156–162. [Sotnik N.V., Azizova T.V. Using mFISH and mBAND for Bioindication of Internal α-Radiation // Radiats. Biologiya. Radioecologiya. 2016. V. 56. № 2. S. 156–162. (In Russian)]
Дегтева М.О., Шагина Н.Б., Воробьева М.И. и др. Современное представление о радиоактивном загрязнении реки Теча в 1949–1956 // Радиац. биология. Радиоэкология. 2016. Т. 56. № 5. С. 523–534. [Degteva M.O., Shagina N.B., Vorobiova M.I. et al. Contemporary Understanding of Radioactive Contamination of the Techa River in 1949–1956 // Radiats. Biologiya. Radioecologiya. 2016. V. 56. № 5. S. 523–534. (In Russian)] https://doi.org/10.7868/S0869803116050039
Degteva M.O., Napier B.A., Tolstykh E.I. et al. Enhancements in the Techa River Dosimetry System: TRDS-2016D Code for reconstruction of Deterministic Estimates of Dose from Environmental Exposures // Health Phys. 2019. V. 117. № 4. P. 378–387. https://doi.org/10.1097/HP.0000000000001067
Davis F.G., Krestinina L.Yu., Preston D. et al. Solid Cancer Incidence in the Techa River Incidence Cohort: 1956–2007 // Radiat Res. 2015. V. 184. P. 56–65. https://doi.org/10.1667/RR14023.1
Krestinina L.Yu., Davis F.G., Schonfeld S. et al. Leukaemia incidence in the Techa River Cohort: 1953–2007 // Br. J. Cancer. 2013. V. 109. P. 2886–2893. https://doi.org/10.1038/bjc.2013.614
Schonfeld S.J., Krestinina L.Yu., Epifanova S.B. et al. Solid cancer mortality in the Techa River Cohort (1950–2007) // Radiat. Res. 2013. V. 179. №.2. P. 183–189. https://doi.org/10.1667/RR2932.1
Napier B.A., Degteva M.O., Shagina N.B., Anspaugh L.R. Uncertainty analysis for the Techa River Dosimetry System // Med. Radiol. Radiat. Saf. 2013. V. 58. № 1. P. 5–28.
Napier B.A., Eslinger P.W., Tolstykh E.I. et al. Calculations of individual doses for Techa River Cohort members exposed to atmospheric radioiodine from Mayak releases // J. Environ. Radioact. 2017. V. 178–179. P. 156–167. https://doi.org/10.1016/j.jenvrad.2017.08.013
Дёгтева М.О., Толстых Е.И., Суслова Г.К. и др. Анализ результатов мониторинга содержания долгоживущих радионуклидов в организме жителей Уральского региона // Радиац. гигиена. 2018. Т. 11. № 3. С. 30–39. [Degteva M.O., Tolstykh E.I., Suslova K.G. et al. Analysis of the results of long-lived radionuclide body burden monitoring in residents of the Urals region // Radiation Hygiene. 2018. V. 11. № S. 30–39. (In Russian)].https://doi.org/10.21514/1998-426X-2018-11-3-30-39
Shagina N.B., Tolstykh E.I., Degteva M.O. et al. Age and gender specific biokinetic model for strontium in humans // J. Radiol. Prot. 2015. V. 35. № 1. P. 87–127. https://doi.org/10.1088/0952-4746/35/1/87
Vozilova A.V., Shagina N.B., Degteva M.O., et al. Preliminary FISH-based assessment of external dose for residents exposed on the Techa River // Radiat. Res. 2012. V. 177. № 1. P. 84–91.
Vozilova A.V., Shagina N.B., Degteva M.O. et al. FISH analysis of translocations induced by chronic exposure to Sr radioisotopes: second set of analysis of the Techa River Cohort // Radiat. Prot. Dosim. 2014. V. 159. № 1–4. P. 34–37. https://doi.org/10.1093/rpd/ncu131
Дегтева М.О., Шишкина Е. А., Толстых Е.И. и др. Использование методов ЭПР и FISH для реконструкции доз у людей, облучившихся на реке Теча // Радиац. биология. Радиоэкология. 2017. Т. 57. № 1. С. 34–45. [Degteva M.O., Shishkina E.A., Tolstykh E.I. et al. Application of EPR and FISH methods to dose reconstruction for people exposed in the Techa River area // Radiats. Biologiya. Radioecologiya. 2017. V. 57. № 1. S. 30–41 (In Russian)] https://doi.org/10.7868/S0869803117010052
Bains I., Thiébaut R., Yates A.J., Callard R. Quantifying thymic export: combining models of naive T cell proli-feration and TCR excision circle dynamics gives an explicit measure of thymic output // J. Immunol. 2009. V. 183. № 7. P. 4329–4336. https://doi.org/10.4049/jimmunol.0900743
Steinmann G.G., Klaus B., Muller-Hermelink H.K. The involution of the ageing human thymic epithelium is independent of puberty. A morphometric study // Scand. J. Immunol. 1985. V. 22. P. 563–575. https://doi.org/10.1111/j.1365-3083.1985.tb01916.x
den Braber I., Mugwagwa T., Vrisekoop N., et al. Maintenance of peripheral naive T cells is sustained by thymus output in mice but not humans // Immunity. 2012. V. 36. № 2. P. 288–297. https://doi.org/10.1016/j.immuni.2012.02.006
Britanova O.V., Shugay M., Merzlyak E.M. et al. Dynamics of Individual T Cell Repertoires: From Cord Blood to Centenarians // J. Immunol. 2016. V. 196. № 12. P. 5005–5013. https://doi.org/10.4049/jimmunol.1600005
Naumova E.N., Gorski J., Naumov Y.N. Two Compensatory Pathways Maintain Long-Term Stability and Diversity in CD8 T Cell Memory Repertoires // J. Immunol. 2009. V. 183. № 4. P. 2851–2858. https://doi.org/10.4049/jimmunol.0900162
Yoshida K., Cologne J.B., Cordova K. et al. Aging-related changes in human T-cell repertoire over 20 years delineated by deep sequencing of peripheral T-cell receptors // Exp. Gerontol. 2017. V. 1. № 96. P. 29–37. https://doi.org/0.1016/j.exger.2017.05.015
Linton P.J., Dorshkind K. Age-related changes in lymphocyte development and function // Nat. Immunol. 2004. V. 5. № 2. P. 133–139. https://doi.org/10.1038/ni1033
Sambandam A., Bell J.J., Schwarz B.A. et al. Progenitor migration to the thymus and T cell lineage commitment // Immunol. Res. 2008. V. 42. № 1–3. P. 65–74. https://doi.org/10.1007/s12026-008-8035-z
Müller L., Pawelec G. Introduction to ageing of the adaptive immune system / Eds J. A. Bosch, A. C. Phillips, & J. M. Lord. Immunosenescence: Psychological and behavioural determinants. New York: Springer, 2013. P. 17–33.
Krueger A., Ziętara N., Łyszkiewicz M. T-Cell Development by the Numbers // Trends Immunol. 2017. V. 38. № 2. P. 128–139. https://doi.org/10.1016/j.it.2016.10.007
Zlotoff D.A., Bhandoola A. Hematopoietic progenitor migration to the adult thymus // Ann. N.Y. Acad. Sci. 2011. V. 1217 P. 122–138. https://doi.org/10.1111/j.1749-6632.2010.05881.x
Wagner U., Schatz A., Baerwald C., Rossol M. Brief report: deficient thymic output in rheumatoid arthritis despite abundance of prethymic progenitors // Arthritis Rheum. 2013. V. 65. № 10. P. 2567–2572. https://doi.org/10.1002/art.38058
Kyoizumi S., Kubo Y., Kajimura J. et al. Age-associated changes in the differentiation potentials of human circulating hematopoietic progenitors to T- or NK-lineage cells // J. Immunol. 2013. V. 190. № 12. P. 6164–6172. https://doi.org/10.4049/jimmunol.1203189
Bains I. Mathematical Modelling of T Cell Homeostasis: A thesis submitted for the degree of Doctor of Philosophy of the University College London. 2010. Avai-lable at: http://discovery.ucl.ac.uk/20159/1/20159.pdf. Accessed August 29, 2019.
Stewart F.A., Akleyev AV., Hauer-Jensen M. et al. Early and late effects of radiation in normal tissues and organs – threshold doses for tissue reactions in a radiation protection context. Annals of the ICRP. Elsevier, 2012. 322 p.
Yassai M.B., Naumov Y.N., Naumova E.N., Gorski J. A clonotype nomenclature for T cell receptors // Immunogenetics. 2009. V. 61. № 7. P. 493–502. https://doi.org/10.1007/s00251-009-0383-x
Broere F., Apasov S.G., Sitkovsky M.V., van Eden W. T cell subsets and T cell-mediated immunity. In Principles of Immunopharmacology (Eds.) Nijkamp FP, Parnham M. Springer. Birkhauser Basel, 2011. P. 15–27.
De Boer R.J., Perelson A.S. Quantification T lymphocyte turnover // J. Theor. Biol. 2013. V. 327. P. 45–87. https://doi.org/10.1016/j.jtbi.2012.12.025
Douek D.C., Betts M.R., Hill B.J. Evidence for increased T cell turnover and decreased thymic output in HIV infection // J. Immunol. 2001. V. 167. № 11. P. 6663–6668. https://doi.org/10.4049/jimmunol.167.11.6663
Bloemers B.L., Bont L., de Weger R.A. et al. Decreased thymic output accounts for decreased naive T cell numbers in children with Down syndrome // J. Immunol. 2011. V. 186. № 7. P. 4500–4507. https://doi.org/10.4049/jimmunol.1001700
Flores K., Li J., Sempowski G.D. et al. Analysis of the human thymic perivascular space during aging // J. Clinic. Investigate. 1999. V. 104. № 8. P. 1031–1039. https://doi.org/10.1172/jci7558
Ye P., Kirschner D.E. Measuring emigration of human thymocytes by T-cell receptor excision circles // Crit. Rev. Immunol. 2002. V. 22. № 5–6. P. 483–497.
Ye P., Kirschner D.E. Reevaluation of T cell receptor excision circles as a measure of human recent thymic emi-grants // J. Immunol. 2002. V. 168. № 10. P. 4968–4979. https://doi.org/10.4049/jimmunol.168.10.4968
Haines C.J., Giffon T.D., Lu L.S. et al. Human CD4+ T cell recent thymic emigrants are identified by protein tyrosine kinase 7 and have reduced immune function // J. Exp. Med. 2009. V. 206. № 2. P. 275–285. https://doi.org/10.1084/jem.20080996
Aguilera-Sandoval C.R., Yang O.O., Jojic N. et al. Supranormal thymic output up to 2 decades after HIV-1 infection // AIDS. 2016. V. 30. № 5. P. 701–711. https://doi.org/10.1097/QAD.0000000000001010.
Fink P.J. The Biology of Recent Thymic Emigrants // Annu Rev. Immunol. 2013. V. 31. P. 31–50. https://doi.org/10.1146/annurev-immunol-032712-100010
Vrisekoop N., den Braber I., de Boer A.B. et al. Sparse production but preferential incorporation of recently produced naive T cells in the human peripheral pool // Proc. Natl. Acad. Sci. USA. 2008. V. 105. № 16. P. 6115–6120. https://doi.org/10.1073/pnas.0709713105
Naylor K., Li G., Vallejo A.N. et al. The influence of age on T cell generation and TCR diversity // J. Immunol. 2005. V. 174. № 11. P. 7446–7452. https://doi.org/10.4049/jimmunol.174.11.7446
Abdulahad W.H., van der Geld Y.M., Stegeman C.A. et al. Persistent expansion of CD4+ effector memory T cells in Wegener’s granulomatosis // Kidney Int. 2006. V. 70. № 5. P. 938–947. https://doi.org/10.1038/sj.ki.5001670
Huenecke S., Behl M., Fadler C. et al. Age-matched lymphocyte subpopulation reference values in childhood and adolescence: application of exponential regression analysis // Eur. J. Haematol. 2008. V. 80. № 6. P. 532–539. https://doi.org/10.1111/j.1600-0609.2008.01052.x
Yan J., Greer J.M., Hull R. et al. The effect of ageing on human lymphocyte subsets: comparison of males and females // Immun. Ageing. 2010. V. 7. P. 4. https://doi.org/10.1186/1742-4933-7-4
Pido-Lopez J., Imami N., Aspinall R. Both age and gender affect thymic output: more recent thymic migrants in females than males as they age // Clin. Exp. Immunol. 2001. V. 125. № 3. P. 409–413. https://doi.org/10.1046/j.1365-2249.2001.01640.x
Ahmed R., Bevan M.J., Reiner S.L., Fearon D.T. The precursors of memory: models and controversies // Nat. Rev. Immunol. 2009. V. 9. P. 662–668. https://doi.org/10.1038/nri2619
Lugli E., Dominguez M.H., Gattinoni L. et al. Superior T memory stem cell persistence supports long-lived T cell memory // J. Clin. Invest. 2013. V. 123. № 2. P. 594–599. https://doi.org/10.1172/JCI66327
Costa Del Amo P., Lahoz-Beneytez J., Boelen L. et al. Human TSCM cell dynamics in vivo are compatible with long-lived immunological memory and stemness // PLoS Biol. 2018. V. 16. № 6. e2005523. https://doi.org/10.1371/journal.pbio.2005523
Robins H.S., Campregher P.V., Srivastava S.K. et al. Comprehensive assessment of T-cell receptor beta-chain diversity in alphabeta T cells // Blood. 2009. V. 114. № 19. P. 4099–4107. https://doi.org/10.1182/blood-2009-04-217604
Fisher R.A., Corbet A.S., Williams C.B. The relation between the number of species and the number of indivi-duals in a random sample of an animal population // J. Anim. Ecol. 1943. V. 12. P. 42–58. https://doi.org/10.2307/1411
Naumov Y.N., Naumova E.N., Clute S.C. et al. Complex T cell memory repertoires participate in recall respon-ses at extremes of antigenic load // Immunol. 2006. V. 177. № 3. P. 2006–2014. https://doi.org/10.4049/jimmunol.177.3.2006
Naumov Y.N., Naumova E.N., Yassai M.B., Gorski J. Selective T cell expansion during aging of CD8 memory repertoires to influenza revealed by modeling // J. Immunol. 2011. V. 186. № 11. P. 6617–6624. https://doi.org/10.4049/jimmunol.1100091
Johnson P.L., Yates A.J, Goronzy J.J., Antia R. Periphe-ral selection rather than thymic involution explains sudden contraction in naive CD4 T-cell diversity with age // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 52. P. 21432–21437. https://doi.org/10.1073/pnas.1209283110
Venturi V., Quigley M.F., Greenaway H.Y. et al. A mecha-nism for TCR sharing between T cell subsets and individuals revealed by pyrosequencing // J. Immunol. 2011. V. 186. № 7. P. 4285–4294. https://doi.org/10.4049/jimmunol.1003898
Naumov Y.N., Naumova E.N., Hogan K.T. et al. A fractal clonotype distribution in the CD8+ memory T cell repertoire could optimize potential for immune responses // J. Immunol. 2003. V. 170. № 8. P. 3994–4001. https://doi.org/10.4049/jimmunol.170.8.3994
Meier J., Roberts C., Avent K. et al. Fractal organization of the human T cell repertoire in health and after stem cell transplantation // Biol. Blood. Marrow Transplant. 2013. V. 19. № 3. P. 366–377. https://doi.org/10.1016/j.bbmt.2012.12.004
Bolkhovskaya O.V., Zorin D.Yu., Ivanchenko M.V. Assessing T cell clonal size distribution: a non-parametric approach. arXiv:1404.6790 [q-bio.QM] 21 Aug. 2014. Available at: https://arxiv.org/pdf/1404.6790.pdf Accessed August 29, 2019.
Robins H.S., Srivastava S.K., Campregher P.V. et al. Overlap and effective size of the human CD8+ T cell receptor repertoire // Sci. Transl. Med. 2010. V. 2. № 47. P. 47–64. https://doi.org/10.1126/scitranslmed.3001442
Trepel F. Number and distribution of lymphocytes in man // A critical analysis. Klin Wochenschr. 52: 511–515 (quoted by [38])
Di Rosa F., Gebhardt T. Bone Marrow T Cells and the Integrated Functions of Recirculating and Tissue-Re-sident Memory T Cells // Front Immunol. 2016. V. 7. № 51. https://doi.org/10.3389/fimmu.2016.00051
Attaf M., Huseby E., Sewell A.K. αβ T cell receptors as predictors of health and disease // Cell Mol. Immunol. 2015. V. 12. № 4. P. 391–399. https://doi.org/10.1038/cmi.2014.134
Schick P.F., Trepel F., Lehmann-Brockhaus E. et al. Autotransfusion of 3H-cytidine-labelled blood lymphocytes in patient with Hodgkin’s and non-Hodgkin patient. I. Limitation of the method // Acta haematol. 1975. V. 53. № 4. P. 193–205. https://doi.org/10.1159/000208184
Pabst R. The spleen in lymphocyte migration // Immunol. Today. 1988. V. 9. № 2. P. 43–45. https://doi.org/10.1016/0167-5699(88)91258-3
Zhao E., Xu H., Wang L. et al. Bone marrow and the control of immunity // Cell Mol. Immunol. 2012. V. 9. № 1. P. 11–19. https://doi.org/10.1038/cmi.2011.47
Parretta E., Cassese G., Santoni A. et al. Kinetics of in vivo proliferation and death of memory and naive CD8 T cells: parameter estimation based on 5-bromo-2'-deoxyuridine incorporation in spleen, lymph nodes, and bone marrow. //J. Immunol. 2008. V. 180. № 11. P. 7230–7239. https://www.ncbi.nlm.nih.gov/pubmed/18490722https://doi.org/10.1038/icb.2016.47
Di Rosa F. T-lymphocyte interaction with stromal, bone and hematopoietic cells in the bone marrow // Immunol. Cell Biol. 2009. V. 87. № 1. P. 20–29. https://doi.org/10.1038/icb.2008.84
Di Rosa F., Pabst R. The bone marrow: a nest for migratory memory T cells // Trends Immunol. 2005. V. 26. № 7. P. 360–366. https://doi.org/10.1016/j.it.2005.04.011
Britanova O.V., Putintseva E.V., Shugay M. et al. Age-related decrease in TCR repertoire diversity measured with deep and normalized sequence profiling // J. Immunol. 2014. V. 192. № 6. P. 2689–2698. https://doi.org/10.4049/jimmunol.1302064
Толстых Е.И., Дегтева М.О., Возилова А.В., Аклеев А.В. Интерпретация результатов метода FISH при неравномерном внутреннем облучении человека с использование модельного подхода // Генетика. 2019. Т. 55. № 10. С. 1172–1179. [Tolstykh E.I., Degteva M.O., Vozilova A.V., Akleyev A.V. Interpretation of FISH Results in the Case of Nonuniform Internal Radiation Exposure of Human Body with the Use of Model Approach // Human Genetics. 2019. V. 55. № 10. S. 1227–1233. doi: 10.1134/S1022795419100132.]https://doi.org/10.1134/S0016675819100138
ICRP-67 (1993) Age-dependent dose to members of the public from intake of radionuclides: Part 2: Ingestion dose coefficients ICRP Publication 67; Ann. ICRP 23 (3/4): 1–167.
Suslova K.G., Khokhryakov V.F., Sokolova A.B., Miller S.C. 238Pu: a review of the biokinetics, dosimetry, and implications for human exposures // Health Phys. 2012. V. 102. № 3. P. 251–262. https://doi.org/10.1097/hp.0b013e318234899a
Suslova K.G., Sokolova A.B., Krahenbuhl M.P., Miller S.C. The effects of smoking and lung health on the organ retention of different plutonium compounds in the Ma-yak PA workers // Radiat Res. 2009. V. 171. № 3. P. 302–309. https://doi.org/10.1667/0033-7587-171.3.302
Racanelli V., Rehermann B. The liver as an immunolo-gical organ // Hepatology. 2006. V. 43. S. 54–62. https://doi.org/10.1002/hep.21060
Lalor P.F., Shields P., Grant A.J, Adams D.H. Recruitment of lymphocytes to the human liver // Immunol. Cell Biol. 2002. V. 80. P. 52–64. http://www.nature.com/icb/jounal/v80/n1/full/icb20027a.html-aff1https://doi.org/10.1046/j.1440-1711.2002.01062.x
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


