Радиационная биология. Радиоэкология, 2020, T. 60, № 2, стр. 189-202
ИЗМЕНЧИВОСТЬ В ПОПУЛЯЦИЯХ РАСТИТЕЛЬНЫХ ТЕСТ-ОРГАНИЗМОВ ПРИ БИОИНДИКАЦИИ ВОДОЕМОВ С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ТЯЖЕЛЫХ ЕСТЕСТВЕННЫХ РАДИОНУКЛИДОВ, ХИМИЧЕСКИМ ЗАГРЯЗНЕНИЕМ И НЕДОСТАТКОМ БИОГЕНОВ
И. С. Боднарь 1, *, Е. В. Чебан 1, Н. Г. Рачкова 1
1 Институт биологии Коми научного центра Уральского отделения РАН
Сыктывкар, Россия
* E-mail: bodnar-irina@mail.ru
Поступила в редакцию 30.01.2019
Аннотация
Проведена оценка токсичности природных вод подвергнутого в 2015 г. консервации хранилища отходов, а также других радиоактивно загрязненных территорий района расположения бывшего радиевого промысла (пос. Водный, Республика Коми) с использованием в качестве тест-объекта ряски малой (Lemna minor L.). В воде с импактных участков обнаружены повышенные концентрации 226Ra, 238U, ионов Ba2+, Ca2+, Sr2+, Cl–. При биотестировании воды в первый год после консервации хранилища эффективность его реабилитации подтвердилась. В дальнейшем, в период с 2016 по 2018 гг., при культивировании на водах из р. Ухта в зоне влияния объекта консервации и из его дренажных колодцев морфометрические и биохимические параметры ряски ухудшились: снизилась удельная скорость роста, уровень содержания хлорофилла, увеличилась доля растений с хлорозами и некрозами. У растений, выращенных на речных импактных водах отбора 2017–2018 гг., содержание малонового диальдегида (МДА) было достоверно выше (p ≤ 0.05) по сравнению с фоновым. Морфометрические параметры лабораторной культуры зависели от концентрации в воде ионов Ca2+, Mg2+, K+, Ba2+, Na+, Sr2+, уровень МДА – от Ba2+, Sr2+, содержание хлорофилла а – от Са2+, Na+, Sr2+, хлорофилла b и каротиноидов – от Sr2+ (p ≤ 0.05).
Природные воды являются наиболее уязвимым к антропогенному воздействию звеном природной среды [1]. Поступление в водотоки таких компонентов как тяжелые естественные радионуклиды представляет серьезную опасность для экосистем и населения. Несмотря на значительное количество мероприятий, направленных на улучшение экологической обстановки в загрязненных районах, проблема минимизации миграции радионуклидов природного происхождения при утилизации производственных отходов и дезактивации территорий до сих пор актуальна для России. Так, в окрестностях пос. Водный Республики Коми (Северо-Западный ФО) с 1931 по 1957 гг. располагалось производство по добыче радия из пластовых вод и отходов урановой промышленности. Производственные объекты промысла были рассредоточены на территории около 3000 км2 [2]. Отходы предприятия складировались в приповерхностном хранилище в десятке метров от р. Ухта и на долгие годы стали источником радиоактивного и химического загрязнения окружающей среды. Основным загрязняющим радионуклидом был 226Ra, в меньших количествах в отходах присутствовал 238U. Главной магистралью для переноса на большие расстояния водорастворенных и взвешенных форм нахождения радионуклидов и содержащихся в радиоактивных отходах тяжелых металлов стала р. Ухта, являющаяся левым притоком р. Ижмы Печорского бассейна. Ниже от объектов радиевого промысла по ее течению располагаются промышленные города Ухта и Сосногорск с совокупным населением около 130 тыс. чел.
В начале шестидесятых годов (1962 г.) на территориях нескольких радиевых заводов и хранилища радиоактивных отходов (РАО) была проведена дезактивация насыпным методом, но ее положительный эффект, проявившийся в ослаблении радиационного фона, снижении миграционной способности радионуклидов, ограничении их негативного воздействия на живые организмы, продлился лишь несколько лет. Со временем значительно интенсифицировался процесс поступления радионуклидов в наземную растительность и их вынос в дезактивирующий слой [3, 4]. В 2015 г. применительно к хранилищу РАО была использована технология консервации с сооружением геохимических и физических барьеров, препятствующих проникновению радионуклидов и тяжелых металлов за пределы очага загрязнения. С территории вывезены старые металлические конструкции и радиоактивно загрязненные древесные отходы, выполнены работы по сооружению противофильтрационной завесы из бентонита “стена в грунте”, системы лучевого дренажа, гидронаблюдательных скважин и верхнего защитного экрана [5]. Однако, несмотря на усилия по реабилитации территорий бывшего радиевого промысла, в районе его расположения до настоящего времени остаются опасные для биоты и населения локальные участки с повышенным радиационным фоном, где рекультивация никогда не проводилась.
В биоиндикации природных вод широко используется ряска малая (Lemna minor L.), водное покрытосеменное растение семейства рясковые (Lemnaceae). К преимуществам ряски малой в качестве тест-объекта относят быстрые темпы роста, небольшие размеры, легкость культивирования, высокую степень однородности клонов, чувствительность к широкому спектру загрязняющих веществ [6].
Цель данной работы – с использованием в качестве тест-объекта ряски малой (Lemna minor L.) оценить токсичность природных вод с территории зоны влияния радиевого промысла с последующим анализом эффективности консервации хранилища РАО.
МАТЕРИАЛЫ И МЕТОДИКА
Район исследования
Отбор проб воды проводили в сентябре 2016 г., в июне и сентябре 2017 г., марте, июне, июле 2018 г. на прибрежной территории и в акватории р. Ухта вблизи от двух производственных объектов бывшего радиевого промысла – объекта консервации хранилища РАО и нерекультивированного участка радиохимического завода № 3 (63°31′ с. ш., 53°26′ в. д.).
Предварительно с помощью дозиметра “Арбитр” измеряли мощность экспозиционной дозы на обследуемой территории, затем ранжировали ее и примыкающую к ней акваторию по критериям, отраженным в работе В.В. Бадяева и соавт. [7]. Таким образом, выбор пунктов отбора проб соответствовал трем зонам: фоновой, буферной и импактной. Фоновые участки: 1) р. Ухта на участке русла выше по течению от хранилища РАО на 26 км (Ф1); 2) скважина, вскрывающая грунт на глубину 12 м вблизи от хранилища РАО, расположена выше от него в ландшафте, выбрана в качестве фоновой для грунтовых вод (Ф2). Буферный участок: р. Ухта, участок в 100 м выше по течению от хранилища РАО (БЗ). Импактные участки: 1) р. Ухта на участке русла, примыкающем к хранилищу РАО (ХР1); 2) сток из дренажных колодцев объекта консервации хранилища РАО (ДК); 3) р. Ухта, 100 м ниже хранилища РАО (ХР2); 4) р. Ухта на участке русла ниже по течению от хранилища РАО, вблизи загрязненной радием нерекультивированной территории радиохимического завода № 3 (РЗ); 5) скважина за пределами объекта консервации хранилища РАО, ниже его по уровню в ландшафте, вскрывает грунт до уровня речного дна (СКВ).
Химический анализ природных вод
Содержание 238U, 226Ra и природных изотопов тория в тестируемых водных образцах определяли в лаборатории миграции радионуклидов и радиохимии, катионно-анионный состав вод – в лаборатории “Экоаналит” Института биологии Коми НЦ УрО РАН.
Растительный материал
В данной работе использовали лабораторную культуру ряски малой Института биологии Коми НЦ УрО РАН. Рясковые обладают высокой скоростью роста, хорошо культивируются, размножаются преимущественно вегетативно, что позволяет получить генетически однородную популяцию [8]. Ряска малая (Lemna minor L.) широко используется в качестве тест-объекта в оценке токсичности вод при химическом загрязнении, в том числе и радионуклидами. Культивирование проводили на питательной среде Штейнберга [9]. Растения выращивали в климатической камере KBWF 240 (“Binder”, Германия) при стандартных условиях: 70%-ная влажность, температура 24 ± ± 0.1°С, фотопериодичность “свет/темнота” 16 ч: 8 ч. Освещение осуществляли холодно-белым светом люминесцентных ламп с интенсивностью 8000 люкс.
Морфометрические параметры
При подготовке эксперимента из материнской культуры отбирали колонии, состоящие из 2–4 фрондов, и переносили их в тестовые емкости с 100%-ной природной водой. Воду предварительно отфильтровали. Каждая экспериментальная емкость содержала 9–12 пластинок. В качестве отрицательного контроля использовали растения, выращенные на питательной среде Штейнберга. Время экспозиции составляло 7 сут, по истечении которых анализировали следующие морфометрические характеристики растений: удельная скорость роста, площадь листоподобной поверхности, уровень и характер повреждения фрондов, изменение их окраски [10].
Среднюю удельную скорость роста принимали как логарифметическое увеличение темпа роста – количества фрондов:
где μi – j – средняя удельная скорость роста от времени i до времени j; Nj – переменная теста в опыте во время j; Ni – переменная теста в контроле во время i; t – период времени от i до j.Для определения времени удвоения (Td) числа фрондов с целью проверки данных на соответствие критерию достоверности (удвоение в контроле менее чем за 60 ч) использовали следующую формулу: Td = ln2/μ. Расчет площади фронда проводили по фотографиям. Изображения были проанализированы с помощью программного обеспечения Image J (NIH, США).
Определение уровня малонового диальдегида
Уровень перекисного окисления липидов (ПОЛ) мембран при окислительном стрессе оценивали по содержанию малонового диальдегида (МДА). Предварительно ряску культивировали в экспериментальном растворе 4 дня [11]. Для определения МДА 50 мг растительного материала гомогенизировали в 1.5 мл 20%-ного водного раствора трихлоруксусной кислоты (ТХУ) с кварцевым песком, затем центрифугировали при 10 000 об/мин в течение 15 мин. К аликвоте супернатанта объемом 0.3 мл добавили 1.2 мл 0.5%-ного раствора тиобарбитуровой кислоты (ТБК) в 20%-ном водном растворе ТХУ. Реакционную смесь инкубировали 30 мин при 95°С, быстро охладили для остановки реакции, после центрифугировали 15 мин при 10 000 об./мин. Оптическую плотность супернатанта определяли при 532 и 600 нм. В качестве контроля использовали 0.5%-ный раствор ТБК в 20%-ном водном растворе ТХУ. Содержание МДА определяли по формуле:
где Сx – содержание МДА, нмоль/л сырой массы; E – оптическая плотность раствора; Ve – объем экстракта, взятый для анализа, мл; k – коэффициент молярной экстинкции МДА, равный 156 ммоль/л см–1; ms – масса образца для экстракции [12].Определение уровня фотосинтетических пигментов
Концентрацию фотоассимилирующих пигментов у ряски определяли в июне, июле 2018 г., на 4-е сутки после начала воздействия. Для определения содержания пигментов фотосинтетического аппарата навеску свежего растительного материала (50 мг) растирали с добавлением небольшого количества кварцевого песка (для лучшего измельчения растений), карбоната кальция (для нейтрализации эндогенных кислот) и 0.7 мг 96%-ного водного раствора этанола, выдерживали 30 мин при температуре 4°С. Полученный гомогенат центрифугировали 10 мин при 13 000 об./мин. Экстракт сливали в чистую пробирку. К осадку добавляли раствор этанола и снова центрифугировали. Добавление новой порции растворителя и центрифугирование повторяли до серой окраски осадка. Оптическую плотность проб определяли на спектрофотометре “КФK-2” при требуемых длинах волн. Концентрацию пигментов рассчитывали по формуле, приведенной в работе [13].
Статистическая обработка данных осуществлялась с использованием программного пакета STATISTICA 6.0. Достоверность различий между параметрами в опыте и контроле определяли с помощью критерия Стьюдента, Манна–Уитни, одностороннего дисперсионного анализа.
РЕЗУЛЬТАТЫ
Радиационный фон территории и удельная активность радионуклидов в природных водах
Согласно полученным нами данным, в 2016 г. после консервации хранилища РАО удельная активность 226Ra в воде из импактной зоны речной акватории варьировала в диапазоне 0.01–0.04 Бк/л. В годовой динамике содержание радия в воде р. Ухта вблизи от объекта могло повышаться до 0.12 Бк/л [14]. Удельная активность радия в стоке из колодца лучевого дренажа в сентябре 2016 г. составила 0.086 Бк/л, что в 2 раза больше, чем в реке [15]. Приведенные данные заметно контрастируют с результатами наших исследований, характеризующими радиоэкологическую ситуацию в районе в период, предшествующий консервации. В частности, это касается содержания радионуклидов в воде мелких непересыхающих водоемов с прямым стоком в реку, имевшихся на территории хранилища РАО до реабилитации. Удельная активность радионуклидов в их водах превышала фоновую для региона, но соответствовала нормам радиационной безопасности (НРБ-99/2009): 228Th – до 0.4 мБк/л, 230Th – до 5 мБк/л, 232Th – до 0.2 мБк/л, 226Ra – до 0.15 Бк/л [16]. В годовой многолетней динамике для радия она могла достигать 0.49 Бк/л, что в сравнении с показателями от 1963 г. указывало на активизацию гидрогенной миграции радионуклида [3, 14]. Верхний предел градиента удельной активности урана, напротив, снизился от 2.5 до 0.25 Бк/л.
Мощность экспозиционной дозы на территории хранилища РАО в преддверии консервации варьировала от 40 до 3500 мкР/ч. После реабилитации в 2016 г. она снизилась до 60 мкР/ч. На нерекультивированной территории радиохимического завода № 3, загрязненной радием, фиксировали уровень γ-излучения до 1000 мкР/ч.
Катионно-анионный состав воды
Состав природных вод для неукорененных плейстофитов, к которым относится ряска малая, имеет исключительное значение. Ведь все необходимые для жизнедеятельности минеральные соли растения получают только из водной среды. Это особенно важно отметить, поскольку характерной особенностью поверхностных вод в таежных северных экосистемах России является слабая минерализованность. Так, по полученным нами ранее данным [16], особенностью анионно-катионного состава исследуемых природных вод являлось низкое содержание нитратов (до 0.044 мг/л), калия (5–15 мг/л), фосфатов (до 1 мг/л) при несколько большем по сравнению с фоновым значением содержании гидрокарбонатов (400–420 мг/л). Для мелких водоемов хранилища РАО отмечали повышенное содержание катионов бария (0.3 мг/л, 3 ПДК), а также избыток ионов хлора (160 мг/л). Это объяснялось использованием хлоридов бария и кальция в технологическом процессе осаждения радия [2]. Высокая минерализованность поверхностных и почвенно-грунтовых вод территории хранилища ионами щелочных и щелочноземельных элементов статистически значимо (n = = 21, r = 0.47–0.61, р ≤ 0.05) стимулировала растворение сосредоточенных в РАО соединений радионуклидов [17].
В природных водах, тестируемых в настоящей работе, содержание макроэлементов имело сезонную динамику (табл. 1), что также находит подтверждение в ранее полученных данных [17]. Наиболее низкие концентрации биогенов наблюдались в случае речных вод, отобранных вблизи загрязненной радием нерекультивированной территории радиохимического завода № 3 (РЗ), а самые высокие – в воде из дренажного колодца (ДК) объекта консервации хранилища РАО. Содержание калия в речной воде исследуемого района характеризовалось значениями до 0.8 мг/л. Концентрация бария в речной воде рядом с хранилищем РАО не превосходила соответствующие фоновые показатели (до 24 мкг/л). В то же время в воде из дренажной системы объекта консервации определялось существенное содержание этого компонента, превышающее предельно допустимые концентрации. Его уровень в случае дренажных стоков варьировал от 46 до 190 мкг/л.
Таблица 1.
Информация о содержании в природной воде некоторых значимых ионов Table 1. Information on the content of some significant ions in natural water
| Место отбора проб | Дата отбора проб | Содержание, мг/дм3 | ||||
|---|---|---|---|---|---|---|
| Ca2+ | Mg2+ | K+ | Ba2+ | Na+ | ||
| Ф1 | Июнь 2016 | 80 ± 13 | 12.3 ± 1.8 | 0.59 ± 0.14 | 24 ± 6 | 3.5 ± 0.5 |
| Сентябрь 2016 | 51 ± 8 | 11.7 ± 1.8 | 0.67 ± 0.16 | 11 ± 2.1 | 3.7 ± 0.6 | |
| Июнь 2017 | 50 ± 8 | 7.4 ± 1.1 | 0.41 ± 0.11 | 12 ± 3 | 2.0 ± 0.3 | |
| Окт 2017 | 38 ± 6 | 6.5 ± 1 | 0.51 ± 0.12 | 9.1 ± 2.4 | 1.82 ± 0.27 | |
| Июль 2018 | 84 ± 13 | 14.4 ± 2.2 | 0.72 ± 0.17 | 20 ± 5 | 4.4 ± 0.7 | |
| БЗ | Июнь 2016 | 77 ± 12 | 11.8 ± 1.8 | 0.69 ± 0.11 | 14 ± 4 | 4.1 ± 0.6 |
| Сентябрь 2016 | 62 ± 10 | 11.5 ± 1.7 | 0.78 ± 0.19 | 13 ± 3 | 3.9 ± 0.6 | |
| Июнь 2017 | 48 ± 8 | 7.1 ± 1.1 | 0.47 ± 0.11 | 14 ± 4 | 2.6 ± 0.4 | |
| Окт 2017 | 34 ± 6 | 5.8 ± 0.9 | 0.49 ± 0.12 | 9.9 ± 2.6 | 2.4 ± 0.4 | |
| Июль 2018 | 84 ± 13 | 14.4 ± 2.2 | 0.94 ± 0.23 | 21 ± 5 | 5.7 ± 0.9 | |
| ХР1 | Июнь 2016 | 78 ± 13 | 12.0 ± 1.8 | 0.78 ± 0.12 | 15 ± 4 | 4.6 ± 0.7 |
| Сентябрь 2016 | 43 ± 7 | 10.6 ± 1.6 | 0.67 ± 0.16 | 11 ± 3 | 3.4 ± 0.5 | |
| Июнь 2017 | 48 ± 8 | 7.2 ± 1.1 | 0.46 ± 0.11 | 21 ± 5 | 2.4 ± 0.4 | |
| Окт 2017 | 35 ± 6 | 5.9 ± 0.9 | 0.74 ± 0.11 | 10 ± 2.6 | 2.2 ± 0.3 | |
| Июль 2018 | 30 ± 5 | 14.6 ± 2.2 | 1.16 ± 0.19 | 30 ± 8 | 6.7 ± 1.0 | |
| ДК | Июнь2016 | – | – | – | – | – |
| Сентябрь2016 | 53 ± 9 | 20 ± 3 | 10.9 ± 1.7 | 46 ± 12 | 58 ± 9 | |
| Июнь2017 | 169 ± 27 | 23 ± 3 | 10 ± 1.6 | 190 ± 40 | 82 ± 12 | |
| Окт 2017 | 129 ± 21 | 26 ± 4 | 10.8 ± 1.7 | 138 ± 28 | 76 ± 11 | |
| Июль 2018 | 146 ± 23 | 23 ± 3 | 8.2 ± 1.3 | 250 ± 50 | 79 ± 12 | |
| ХР2 | Июнь 2016 | 77 ± 12 | 11.8 ± 1.8 | 0.69 ± 0.11 | 14 ± 4 | 4.5 ± 0.7 |
| Сентябрь 2016 | 50 ± 8 | 11.5 ± 1.7 | 0.7 ± 0.17 | 11.2 ± 2.9 | 3.8 ± 0.6 | |
| Июнь 2017 | 48 ± 8 | 7.2 ± 1.1 | 0.45 ± 0.11 | 12 ± 3 | 2.4 ± 0.4 | |
| Окт 2017 | 35 ± 6 | 6.1 ± 0.9 | 0.52 ± 0.13 | 10.1 ± 2.6 | 2.6 ± 0.4 | |
| Июль 2018 | 84 ± 3 | 14.7 ± 2.2 | 0.85 ± 0.2 | 22 ± 6 | 5.9 ± 0.9 | |
| РЗ | Июнь2016 | 41 ± 7 | 5.3 ± 0.8 | 0.56 ± 0.13 | 8 ± 2 | 5.1 ± 0.8 |
| Сентябрь2016 | 65 ± 10 | 11.8 ± 1.8 | 0.69 ± 0.16 | 14 ± 4 | 3.8 ± 0.6 | |
| Июнь2017 | 16.2 ± 2.6 | 2.0 ± 0.3 | 0.29 ± 0.07 | 7.3 ± 1.9 | 1.63 ± 0.24 | |
| Окт 2017 | 14.4 ± 2.3 | 1.62 ± 0.24 | 0.35 ± 0.08 | 8.3 ± 2.2 | 1.51 ± 0.23 | |
| Июль 2018 | 44 ± 7 | 5.2 ± 0.8 | 0.68 ± 0.16 | 17 ± 4 | 5.8 ± 0.9 | |
| Ф2 | Июль 2018 | 24 ± 4 | 6.5 ± 1 | 1.9 ± 0.3 | 24 ± 6 | 3.2 ± 0.5 |
| СКВ | Июль 2018 | 41 ± 7 | 105 ± 16 | 8.7 ± 1.4 | 60 ± 12 | 138 ± 21 |
Удельная скорость роста
Поскольку анионно-катионный состав природных вод в районе исследования характеризовался сезонной динамикой, то скорость роста ряски малой при ее культивировании на воде фоновых участков также варьировала в разные периоды отбора (рис. 1). Наиболее низкие темпы роста на речной воде с участка Ф1 были выявлены для образцов, отобранных в октябре 2017 г., высокие – в марте и июле 2018 г.
Рис. 1.
Изменение удельной скорости роста ряски малой. Даты отборов проб: 1 – 09.2016, 2 – 06.2017, 3 – 09.2017, 4 – 03.2018, 5 – 06.2018, 6 – 07.2018. Здесь и далее участки отбора проб: Ф1 и Ф2 – фоновые участки для речной и грунтовой воды. БЗ – буферный участок р. Ухта. Импактные участки: ХР1 – р. Ухта на участке русла, примыкающем к хранилищу РАО, ДК – сток из дренажных колодцев объекта консервации хранилища РАО, ХР2 – р. Ухта, 100 м ниже хранилища РАО, РЗ – р. Ухта на участке русла ниже по течению от хранилища РАО, вблизи загрязненной радием нерекультивированной территории радиохимического завода № 3, СКВ – скважина за пределами объекта консервации хранилища РАО, ниже его по уровню в ландшафте, вскрывает грунт до уровня речного дна. * Отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Стьюдента.
Fig. 1. Relative growth rate of plant Lemna minor. Dates of sampling: 1 – 09.2016, 2 – 06.2017, 3 – 09.2017, 4 – 03.2018, 5 – 06.2018, 6 – 07.2018. Hereinafter sampling plots: Ф1 and Ф2 are the background plots for river and groundwater. BЗ – buffer section of the river Ukhta. Impact sites: XP1 – p. Ukhta in the section of the channel adjacent to the RW storage facility, DC – runoff from the drainage wells of the RW storage facility conservation facility, XP2 – p. Ukhta, 100 m below the radioactive waste storage facility; Ukhta in the channel section downstream of the radioactive waste storage facility, near the non-regulated territory of radiochemical plant № 3 contaminated with radiation, СКВ is a well outside the conservation object of the radioactive waste storage facility, below it in the landscape, it opens the soil to the level of the river bottom. * Differences are significant in comparison with background indicators (p ≤ 0.05), Student’s test.
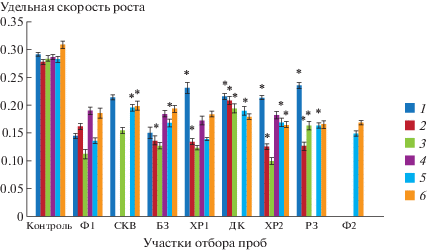
Для речных вод импактного участка русла динамика роста ряски отличалась от сезонной. В первый год после консервации в 2016 г. удельная скорость роста ряски на речных водах, отобранных вблизи хранилища, была больше, чем на буферном и фоновом участках (р ≤ 0.05). При этом на воде ХР1 она снижалась на 20% по сравнению с контролем (среда Штейнберга). В 2016 г. наиболее высокие темпы роста у ряски наблюдались на воде с участка речного русла, примыкающего к нерекультивированной территории радиохимического завода № 3 (РЗ), наименьшие – на водных образцах из буферной зоны. Удельная скорость роста ряски, культивируемой на импактных водах (ХР1, ХР2, РЗ), снижалась от отбора к отбору. Так, через год после окончания инженерных работ по изоляции РАО летом и осенью 2017 г., а также в отборах 2018 г. скорость роста ряски на импактных водах не отличалась или была ниже (в случае образца ХР2), чем на фоновых.
Воды системы лучевого дренажа объекта консервации представляли собой грунтовую воду, непосредственно контактировавшую с захороненными радиоактивными отходами, поэтому по химическому составу она значительно отличалась от речных водных образцов. Темпы роста культивируемой на дренажной воде ряски в период наблюдения с 2016 по 2018 гг. постепенно снижались. В сентябре 2017 г. скорость роста культуры на этих образцах была выше, чем на воде Ф2 из скважины за пределами хранилища РАО. В июне 2018 г. показатель, измеренный для воды с дренажных колодцев, уже не отличался от соответствующего фоновым пробам Ф1 и Ф2. Наконец, в июле 2018 г. была установлена наиболее низкая за весь период наблюдения скорость роста ряски на этой воде. Показатель оказался на 18% меньше, чем в октябре 2016 г.
Изоляция РАО нашла отражение в изменении скорости роста ряски на воде РЗ, отобранной ниже по течению р. Ухта от объекта консервации. Для этой группы образцов в период исследований наблюдалась динамика, аналогичная для проб ХР1 и ХР2 с участков вблизи территории хранилища: в первый год после консервации темпы роста ряски были высокие, затем они постепенно снижались до уровня, соответствующего воде из буферной зоны. В сентябре 2017 г. удельная скорость роста ряски, выращенной на воде ХР1 и ХР2, уменьшилась на 47%, ниже по течению – на 53%, на участке в районе радиохимического завода № 3 – на 31% по сравнению с аналогичным периодом 2016 г. С октября 2017 г. по июль 2018 г. удельная скорость роста на участке РЗ оставалась постоянной.
В марте 2018 г. во всех тестируемых природных водах, приуроченных к разным участкам отбора, скорость роста ряски была одинакова (вода с дренажных колодцев и из реки вблизи участка радиохимического завода № 3 не анализировалась в этот период), по-видимому, из-за отсутствия интенсивного поверхностного стока с загрязненной территории. Летом 2018 г. удельная скорость роста у ряски, выращенной на воде с импактных речных участков ХР1, ХР2, РЗ, была наименьшей, наибольшая наблюдалась для образца грунтовых вод СКВ.
Результаты статистической обработки данных, приуроченных к разным пробоотборам, свидетельствовали, что на темпы роста тестовых растений, культивированных на природной воде, значительное влияние оказывал недостаток биогенов: магния, калия, нитратов, а также избыток бария и стронция. Так, удельная скорость роста ряски в 2016 г. зависела от концентрации ионов кальция (F = 43, р ≤ 0.05) и бария (F = 5.58, р ≤ ≤ 0.05). В 2017 г. на темпы роста растений наибольшее влияние оказывало содержание ионов кальция (Fиюнь = 3.57, Fсент = 11, р ≤ 0.05), магния (Fиюнь = 27.2, Fсент = 33, 3, р ≤ 0.05), калия (Fиюнь = = 50, Fсент = 14.8, р ≤ 0.05), бария (Fиюнь = 12.8, Fсент = 15, р ≤ 0.05), натрия (Fиюнь = 27, Fсент = 29, р ≤ 0.05). В июле 2018 г. величина рассматриваемого параметра была тесно связана с концентрацией ионов кальция (F = 2.73, р ≤ 0.05), магния (F = 3.5, р ≤ 0.05), бария (F = 4.3, р ≤ 0.05) и стронция (F = 4.5, р ≤ 0.05).
Площадь фрондов
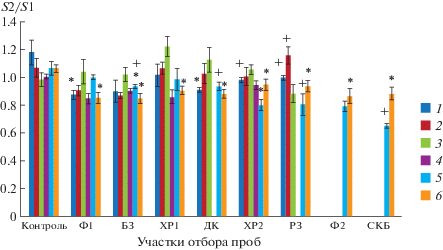
Анализ полученных данных показал, что в 2016 г. площадь листоподобной поверхности (фрондов) ряски, культивированной на импактных образцах ХР2 и РЗ, а в июне 2017 г. – на воде РЗ, была выше, чем на Ф1. В сентябре 2017 г. при культивировании на воде из дренажных колодцев площадь фрондов растения оказалась больше, чем на воде из Ф2 (рис. 2). В июне 2018 г. в случае образцов из импактных участков ХР2, РЗ, СКВ показатель стал ниже фонового. Площадь фрондов в июне 2017 г. зависела от концентрации ионов бария (F = 4.1, p ≤ 0.05) и натрия (F = 4, р ≤ 0.05), в октябре 2017 г. – содержания ионов магния (F = 3.3, р ≤ ≤ 0.05) и калия (F = 4.3, р ≤ 0.05) в тестируемых водах.
Рис. 2.
Изменение площади листоподобной поверхности ряски (S2/S1, где S1 – первоначальная площадь, S2 – площадь по окончании семидневного эксперимента). Даты отборов проб: 1 – 09.2016, 2 – 06.2017, 3 – 09.2017, 4 – 03.2018, 5 – 06.2018, 6 – 07.2018. * Отличия достоверны по сравнению с положительным контролем (среда Штейнберга), + отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Стьюдента).
Fig. 2. Change in the area of the fronds of duckweed (S2/S1, where S1 is the initial area, S2 is the area at the end of the seven-day experiment). Dates of sampling: 1 – 09.2016, 2 – 06.2017, 3 – 09.2017, 4 – 03.2018, 5 – 06.2018, 6 – 07.2018. * Differences are significant in comparison with the positive control (Steinberg medium), +differences are significant in comparison with the background indicators (p ≤ 0.05), Student’s test.
Повреждения фрондов
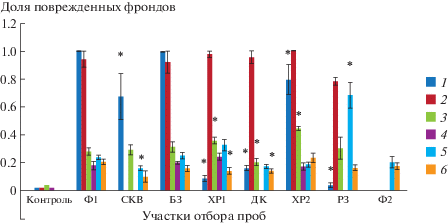
При действии неблагоприятных факторов появляются повреждения в виде некрозов и хлорозов. В 2016 г. наиболее низкий уровень повреждений, до 20% от общего числа растений в колонии, наблюдали на воде с участков импактной зоны (ХР1, ХР2 и ДК) (рис. 3). В случае культивирования на образце РЗ число поврежденных фрондов ряски достигало 5% от общего их количества, т.е. было не выше, чем в контроле на среде Штейнберга. Позже в июле 2017 г. доля выращенных на различных водах растений, имеющих некрозы и хлорозы, значительно возросла, затем в сентябре 2017 г. она вновь снизилась и сохранила невысокий уровень (18–24%) в марте 2018 г. Летом 2018 г. доля поврежденных растений, культивированных на образцах РЗ (июнь) и ДК (июль), была выше по сравнению с фоновыми пробами Ф1 и Ф2 (р ≤ ≤ 0.05). Таким образом, изначально после консервации объекта уровень повреждений фрондов оставался низким, в отборы 2017 г. и в марте 2018 г. он уже совпадал с фоновым показателем, а в июле 2018 г. в случае импактных вод – достоверно его превысил (р ≤ 0.05). Согласно результатам дисперсионного анализа, уровень повреждений во фрондах ряски зависел от концентрации кальция, магния, калия, бария, натрия, стронция (р ≤ 0.05). С учетом этого высокий уровень поврежденных растений при их культивировании на водах фонового участка (до 100%) можно объяснить недостатком макроэлементов.
Рис. 3.
Изменение доли поврежденных фрондов. Даты отборов проб: 1 – 09.2016, 2 – 06.2017, 3 – 09.2017, 4 – 03.2018, 5 – 06.2018, 6 – 07.2018. * Отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Манна–Уитни.
Fig. 3. Change in the proportion of damaged fronts. Dates of sampling: 1 – 09.2016, 2 – 06.2017, 3 – 09.2017, 4 – 03.2018, 5 – 06.2018, 6 – 07.2018. * Differences are significant in comparison with background indicators (p ≤ 0.05), Mann–Whitney’s test.
Уровень фотоассимилирующих пигментов
Цвет растений зависел от типа повреждений фрондов. Желтая окраска свидетельствовала о развитии хлорозов, бурая – некрозов, белая – о наличии отмерших старых растений. До появления видимых повреждений фрондов у растений снизился уровень хлорофиллов и каротиноидов.
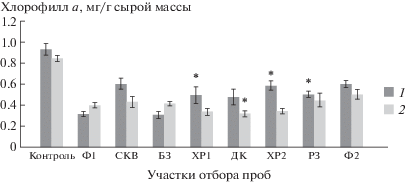
Так, культивирование ряски на тестируемых водах отбора 2018 г. показало снижение содержания хлорофилла а в растениях (рис. 4). У растений на образцах с фоновой и буферной зоны содержание хлорофилла а составляло 30–50% от контроля. Содержание хлорофилла а в культурах на воде фоновой и буферной территорий в июле повысилось по сравнению с июнем с 31 до 47% и с 32.3 до 48.8% от контроля соответственно. На образцах с импактных территорий, наоборот, оно понизилось: ХР1 – с 54 до 41%, ДК – с 52 до 38%, ХР2 – с 62 до 41.3%, СКВ с 75.5 до 58.4% от контроля. В культурах, выращенных на импактных водах июньского отбора ХР1, ХР2, РЗ, содержание хлорофилла а выше, чем на фоновом участке. Оно зависело от концентрации кальция (F = 3.1, р ≤ ≤ 0.05), натрия (F = 3.3, р ≤ 0.05) и стронция (F = = 3.3, р ≤ 0.05) в воде. В июле ухудшилось качество воды ДК из дренажных колодцев, что регистрировалось при культивировании на ней растений по уменьшению до уровней ниже фоновых содержаний хлорофилла а (р ≤ 0.05).
Рис. 4.
Изменение уровня хлорофилла a у ряски малой. Даты отборов проб: 1 – 06.2018, 2 – 07.2018. * Отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Стьюдента.
Fig. 4. Changes in the level of chlorophyll a. Dates of sampling: 1 – 06.2018, 2 – 07.2018. * Differences are significant compared with background values (p ≤ 0.05), Student’s test.
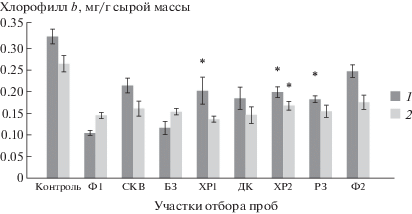
Концентрация хлорофилла в у ряски в июне на водах из импактных территорий стала выше, чем на фоновых, а в июле эти показатели сохранились только на участках ХР2, СКВ (рис. 5). На фоновой воде Ф1 содержание хлорофилла в у растений в июле повысилось по сравнению с предыдущим месяцем с 31 до 55%, на воде БЗ из буферной зоны – с 35 до 58% от контроля и, по данным дисперсионного анализа, зависело от концентрации стронция (F = 3, р ≤ 0.05).
Рис. 5.
Изменение уровня хлорофилла b у ряски малой. Даты отборов проб: 1 – 06.2018, 2 – 07.2018. * Отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Стьюдента.
Fig. 5. Changes in the level of chlorophyll b. Dates of sampling: 1 – 06.2018, 2 – 07.2018. * Differences are significant compared to background values (p ≤ 0.05), Student’s test.
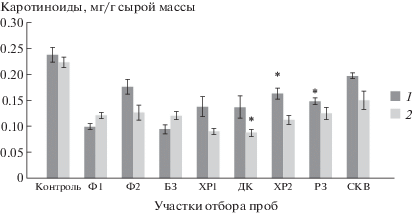
Наиболее высокое содержание каротиноидов было установлено у ряски, культивированной на грунтовой воде СКВ из скважины на прибрежной территории вблизи от объекта консервации (рис. 6). На воде с фонового и буферного участков уровень каротиноидов у ряски в июле возрос с 40 до 55% от контроля. В то же время при выращивании на импактных водах он снизился в случае ХР, ДК – с 58 до 40%, ХР2 – с 68 до 51%, РЗ – с 62.5 до 56%, СКВ – с 75.5 до 58.4%. Величина показателя была тесно связана с концентрацией ионов стронция (F = 3.3, р ≤ 0.05) в воде.
Рис. 6.
Изменение уровня каротиноидов у ряски малой. Даты отборов проб: 1 – 06.2018, 2 – 07.2018. * Отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Стьюдента.
Fig. 6. Change in the level of carotenoids. Dates of sampling: 1 – 06.2018, 2 – 07.2018. * Differences are significant compared to baseline values (p ≤ 0.05), Student’s test.
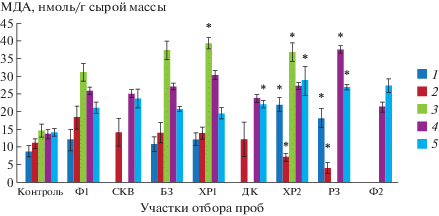
Содержание малонового диальдегида (МДА) в растениях
Измерение содержания малонового диальдегида (МДА) в растительном материале позволяет оценить уровень окислительного стресса в конкретных условиях его выращивания. Уровень МДА у растений, культивированных на природной воде исследуемого района, был выше по сравнению с контролем (рис. 7). Показано, что летом 2017 и 2018 гг. его содержание у растений, выращенных на воде с импактных участков ХР2, РЗ, превосходило соответствующий показатель у ряски, культивировавшейся на воде с фоновой территории (р ≤ 0.05). Судя по величине исследуемого параметра, в марте 2018 г. наиболее сильный окислительный стресс испытывали растения, выращенные на воде ХР1. Проведенный дисперсионный анализ подтвердил тесную связь в июне 2017 г. содержаний малонового диальдегида и магния (F = 15.5, р ≤ 0.05), в октябре – кальция (F = 5.4, р ≤ 0.05) и бария (F = 5.3, р ≤ 0.05). Для выборки данных, приуроченной к отборам 2018 г., подобная зависимость была обнаружена между концентрацией МДА и содержанием в воде ионов бария (F = 3.3, р ≤ 0.05) и стронция (F = = 3.8, р ≤ 0.05).
Рис. 7.
Изменение содержания малонового диальдегида. Даты отбора проб: 1 – 07.2017, 2 – 09.2017, 3 – 03.2018, 4 – 06.2018, 5 – 07.2018. * Отличия достоверны по сравнению с фоновыми показателями (р ≤ 0.05), критерий Манна–Уитни.
Fig. 7. Change in the content of malondialdehyde. Dates of sampling: 1 – 07.2017, 2 – 09.2017, 3 – 03.2018, 4 – 06.2018, 5 – 07.2018. * Differences are significant compared to the background values (p ≤ 0.05), Mann–Whitney’s test.
ОБСУЖДЕНИЕ
Полученные в настоящей работе данные свидетельствуют, что при оценке степени воздействия на окружающую среду локального радиоактивного загрязнения обязательно изучение реакции растений. Растения, будучи основными продуцентами органических соединений из солнечной энергии и начальным звеном трофических цепей, являются важным структурно-образующим компонентом биоценоза [18]. В качестве такого объекта для изучения реакции растений на загрязнение водных объектов нами была выбрана ряска малая (Lemna minor L.). Она чутко реагирует на присутствие в воде ионов разных химических элементов, изменения в ее росте и морфометрических параметрах происходят при низких концентрациях большинства распространенных токсикантов. Ранее рясковые успешно использовались нами при оценке токсичности природных вод, загрязненных радионуклидами [16].
При функционировании производств, подобных промышленной добыче радия из нескольких сырьевых источников, чаще всего происходит комплексное нарушение окружающей среды, в том числе поликомпонентное загрязнение природных вод. Их токсичность для водных организмов в последующем зависит от целого ряда факторов, в первую очередь, от концентрации радионуклидов и химических поллютантов. Основными загрязнителями вод импактной зоны вышеуказанного радиевого промысла до консервации его хранилища РАО являлись водорастворенные и взвешенные формы нахождения радия и урана. Помимо этого, в воде в избыточном количестве присутствовали ионы бария, соли которого использовались в производственном технологическом процессе выделения радия. После консервации хранилища радиоактивных отходов в декабре 2015 г. активность воды отвечала нормам радиационной безопасности, уровень γ-излучения снизился до 60 мкР/ч.
Сочетание факторов радиационной и нерадиационной природы, в том числе и климато-географических оказывает разнонаправленное действие на физиологические и биохимические процессы, поэтому реакция растений на него неоднозначна [19]. Оценку эффективности консервации хранилища радиоактивных отходов следует проводить на основе результатов, полученных в динамике за несколько лет. В этом нас убеждают не только представленные в настоящей работе собственные наблюдения, но и данные литературы. Так, в последнее время стало известно, что в рамках федеральной программы законсервировано несколько крупных радиоактивно загрязненных объектов. Одним из них является оз. Карачай. Несмотря на обнадеживающие прогнозы, среди исследователей нет однозначного мнения относительно последствий консервации этого объекта, так же как и далекого будущего экологического состояния территории всего Теченского каскада водоемов. По некоторым расчетам [20], уже примерно с середины 2030 г. поступление стронция-90 из водоносного горизонта в р. Теча может составить от 20 до 200 Ки/год. Вынос урана к 2080 г. способен возрасти до 10 тыс. Ки/год.
Результаты проведенного нами биотестирования импактных природных вод из района проведения консервации радиоактивных отходов радиевого промысла в Республике Коми наглядно демонстрируют, что для объективной оценки эффективности мероприятий реабилитации необходима такая организация исследований, которая отражала бы протекание процессов восстановления и самоочищения территории загрязнения в годовой и многолетней динамике. На текущий период времени радиохимический анализ воды на импактных участках вблизи пос. Водный Республики Коми выявил в природных водах повышенные по сравнению с фоновым уровнем концентрации 226Ra, 238U, а также Ba2+, Ca2+, Sr2+, хлоридов. Хлорид бария хорошо растворим и обладает высокой токсичностью для растений, его негативные эффекты усиливаются при недостатке калия [16]. Как показал проведенный дисперсионный анализ, содержание ионов бария влияло не только на темпы роста ряски, но и на уровень поврежденности фрондов растения и степень испытываемого им окислительного стресса. В таком случае опасным для биоты фактором могут оказаться не только повышенное содержание радионуклидов, но и высокие концентрации нерадиоактивных компонентов загрязнения.
Кроме того, полученные нами данные выявляют большое значение геохимических особенностей природных вод для развития водных растений. Как показал катионно-анионный анализ, речная вода на изучаемой таежной территории слабо минерализована, для нее характерен недостаток калия, магния, нитратов. Однако отличия в содержании макроэлементов между разными водными образцами все же регистрируются. Тестируемая вода в районе хранилища РАО и на фоновом участке имела низкие концентрации калия, слабощелочную реакцию. Речная вода, отобранная в непосредственной близости от нерекультивированной территории радиохимического завода № 3, была наименее минерализована, с недостатком калия, магния, кальция. Вода из дренажных колодцев – сильно минерализованная, с повышенным содержанием кальция, натрия, в ней в избытке содержался барий. В наших экспериментах слабая минерализованность вод провоцировала недостаток биогенных элементов у живущих в водной среде растений и сказывалась на морфометрических параметрах ряски, в результате чего удельная скорость роста, уровень поврежденных растений, площадь листоподобной поверхности зависели от концентрации в воде магния, кальция, калия, натрия, стронция. Тот факт, что дисбаланс элементов может повысить чувствительность организмов к воздействию токсикантов и привести к снижению устойчивости экосистем, хорошо известен. Особое значение имели сезонные колебания химического состава воды фоновой и буферной зон влияния, что было отчетливо заметно по динамике показателей удельной скорости роста, доли поврежденных растений, культивированных на этих образцах.
Как показал анализ данных, в первый год после консервации скорость роста, площадь поверхности фрондов у ряски, культивированной на воде с импактной зоны, были выше фоновых (р ≤ 0.05), а уровень повреждений листоподобной пластины в виде хлорозов и некрозов был ниже. Судя по вышеприведенному факту, эффективность консервации в первый год после завершения работ не вызывает сомнений. В 2017 г. ростовые показатели в случае выращивания на водах импактных участков ХР1, ХР2 и РЗ снизились до уровня фоновых. Высокие показатели роста остались только у растений, культивированных на воде из стока дренажных колодцев хранилища. По сравнению с фоновым образцом вода из зоны влияния хранилища была более токсична летом. Одной из причин этого может быть воздействие радионуклидов, миграция которых усиливается при повышении концентрации щелочноземельных металлов в воде. Токсичность повышается в летнее время, когда увеличивается удельная электропроводность, концентрация щелочных и щелочноземельных элементов, а значит, и поступление 226Ra в импактные речные воды [3]. Концентрация 226Ra контролируется ключевыми факторами водной геохимии, зависит от содержания отдельных щелочноземельных элементов (Mg, Ca, Sr, Ba), Mn [21]. Летом 2018 г. качество воды из колодцев лучевого дренажа для ряски ухудшилось, удельная скорость роста и концентрация хлорофилла были меньше по сравнению с фоновыми показателями, повысился уровень повреждений фрондов. Площадь листоподобной поверхности в июне-июле 2018 г. в случае выращивания ряски на водах импактных участков ХР2, РЗ, СКВ уменьшилась до значений ниже фоновых (p ≤ 0.05).
Содержание хлорофилла при культивировании на природной воде было также снижено и составляло 31–75% от контроля. Концентрация пигментов у водных растений напрямую зависела от минерализованности среды. Доказано, что исключение макроэлементов (азота, фосфора, калия) приводит к существенному снижению содержания хлорофилла а, снижение хлорофилла в наблюдается при исключении азота [22]. Низкое содержание хлорофилла было выявлено нами при культивировании растений на воде из фоновой и буферной зоны, что также могло быть вызвано недостатком минерального питания. Ранее в наших экспериментах было показано, что при недостатке калия снижается площадь фрондов ряски, усиливается ее чувствительность к ионам бария [16]. Собственно, это и приводит к сокращению удельной скорости роста и увеличению доли поврежденных растений. В настоящей работе наиболее высокий уровень хлорофилла а наблюдали при культивировании ряски на грунтовых водах из СКВ и Ф2, а низкий – на речной воде, отобранной вблизи бывшего хранилища РАО. В естественных условиях обитания содержание фотосинтетических пигментов у рясковых тоже изменяется в течение вегетационного периода, их высокие концентрации обычно обнаруживаются в июле и августе [1]. При культивировании ряски на воде с буферных и фоновых участков концентрация хлорофиллов a и b, также как и каротиноидов, в июле повысилась по сравнению с июнем, на импактных водах – снизилась. По имеющимся данным, снижение концентрации хлорофиллов и каротиноидов в растениях объясняется подавлением синтеза хлорофиллов, усилением процесса их деградации, нарушением ультраструктуры хлоропластов [23–25]. Поскольку у ряски функцию фотоассимиляции выполняют в том числе и корни, то при нарушении минерального питания, воздействии тяжелых металлов и радиации корни белеют, а общее содержание хлорофилла уменьшается.
Полученные в настоящей работе данные подтверждают, что комплексное загрязнение окружающей среды вызывает стресс у растений, изменяя баланс между прооксидантами и антиоксидантами [26]. Известно, что избыток металлов и малые дозы радиации приводят к увеличению перекисного окисления липидов мембран [27, 28]. При совместном действии этих факторов возможно появление синергических и антагонистических эффектов [19]. В настоящей работе показано, что окислительный стресс, регистрируемый по уровню МДА, в 2017–2018 гг. был выше у растений, культивированных на речной воде с импактных участков. Его усиление согласуется с подавлением роста растений. Согласно результатам статистического анализа, уровень МДА зависит от концентрации ионов кальция, бария, калия, натрия и стронция.
Подытоживая полученные данные, отметим, что химическое и радиоактивное загрязнение поверхностных вод приводит к трансформации биоценозов. В модельных условиях эксперимента нами было показано, что эффекты могут быть связаны не только с токсическим воздействием в виде снижения удельной скорости роста, повышения уровня поврежденности и сокращения площади листовой поверхности, с биохимическими изменениями (повышение содержания малонового диальдегида, снижение концентрации фотоассимилирующих пигментов), но и с увеличением ростовых параметров при низкоинтенсивных воздействиях. Оба эти исхода в природных условиях сказываются на состоянии окружающей природной среды, приводя к изменению видового разнообразия исходных экосистем, снижению продуктивности биоценоза, чрезмерному разрастанию водных растений и эвтрофикации водоемов, накоплению токсических продуктов и исчезновению фито- и зоопланктона, ценных видов рыб.
Список литературы
Лукина Л.Ф., Смирнова Н.Н. Физиология высших водных растений. Киев: Наук. думка, 1988. 188 с. [Lukina LF., Smirnova NN. Fiziologiya vysshih vodnyh rastenij. Kiev: Nauk. Dumka, 1988. 188 p. (In Russian)]
Таскаев А.И., Кичигин А.И. “Водный промысел”: производство радия в Республике Коми. Сыктывкар, 2002. 30 с. [Taskaev A.I., Kichigin A.I. “Vodnyj promysel”: proizvodstvo radiya v Respublike Komi. Syktyvkar, 2002. 30 p. (In Russian)]
Рачкова Н.Г., Шапошникова Л.М. Аккумуляция урана и радия-226 водными и наземными мхами в зоне влияния бывших объектов по добыче радия // Современные проблемы науки и образования. 2017. № 3. С. 146. [Rachkova N.G., Shaposhnikova L.M. Uranium and radium-226 accumulation by aquatic and terrestrial mosses in impact zone of the former radium production objects // Modern problems of science and education. 2017. № 3. P. 146. (In Russian)]
Шапошникова Л.М., Шуктомова И.И. Последствия применения насыпного метода дезактивации на примере радиевого промысла [Consequences of the bulk method of decontamination on the example of radium craft] // Экология. 2015. № 3. С. 237–240. [Shaposhnikova L.M., Shuktomova I.I. Consequences of radioactive decontamination by earthfill method in a former radium production site // Russian Journal of Ecology. 2015. V. 46. № 3. P. 299–302. (In Russian)] https://doi.org/10.7868/S0367059715030105
Собко А.А. Проект по реабилитации территории: заводы № 1, № 7 и хранилище отходов (Республика Коми, пгт. Водный) // Мат. конф. по ВЭ ЯРОО и реабилитации объектов ядерного “наследия” “Вывод 2012”. Доступно по: http://www.atomeco.org › mediafiles › files › Present12 › Sobko. Ссылка активна на 19.12.2019.
Basiglini E., Pintore M., Forni C. Effects of treated wastewaters and temperatures on growth and enzymatic activities of duckweed (Lemna minor L.) // Ecotoxico. Environ. Safety. 2018. V. 153. P. 54–59. https://doi.org/10.1016/j.ecoenv.2018.01.053
Бадяев В.В., Егоров Ю.А., Казаков С.В. Охрана окружающей среды при эксплуатации АЭС. М.: Энергоатомиздат, 1990. 222 с. [Badyaev V.V., Ego-rov Yu.A., Kazakov S.V. Ohrana okruzhayushchej sredy pri ekspluatacii AES. M.: Energoatomizdat, 1990. 222 p. (In Russian)]
Тахтаджян А.Л. Жизнь растений. Т. 6. М.: Просвещение, 1982. С. 493–500. [Tahtadzhyan A.L. Zhizn’ rastenij. Т. 6. M.: Prosveshchenie, 1982. P. 493–500. (In Russian)]
Steinberg R. Mineral requirement of Lemna minor L. // Plant Physiol. 1946. V. 21. P. 42–48. https://doi.org/10.1104/pp.21.1.42
OECD Guidelines for the testing chemicals. Lemna sp. Growth Inhibition Test. Paris: Organisation for Economic Co-operation and Development, 2006.
Uruç Parlac K., Demirezen Yilmaz D. Response of antioxidant defences to Zn stress in three duckweed species // Ecotoxicol. Environ. Safety. 2012. № 85. P. 52–58. https://doi.org/10.1016/j.ecoenv.2012.08.023
Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. М.: БИНОМ, 2011. С. 348–349. [Molekulyarno-geneticheskie i biohimicheskie metody v sovremennoj biologii rastenij / Pod red. Vl.V. Kuznecova, V.V. Kuznecova, G.A. Romanova. M.: BINOM; 2011. P. 348–349. (In Russian)]
Lichtenthaler H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Meth. Enzymol. 1987. № 148. P. 350–382. https://doi.org/10.1016/0076-6879(87)48036-1
Шапошникова Л.М., Рачкова Н.Г. Анализ эффективности реабилитации территории хранилища отходов радиевого производства в Республике Коми // Геоэкология. Инженерная экология. Гидрогеология. Геокриология. 2018. № 2. С. 75–84. [Shaposhnikova L.M., Rachkova N.G. Analysis of effectivency of rehabilitation of the radium production waste storage territory in the Komi Republic // Environ. Geosci. 2018. № 2. P. 75–84. (In Russian)] https://doi.org/10.7868/S0869780318020072
Рачкова Н.Г., Шапошникова Л.М., Шуктомова И.И. Экологические аспекты фитопоглощения поллюантов в водных и наземных экосистемах территорий техногенного радиоактичного загрязнения // XV Всерос. науч.-практ. конф. с междунар. участием “Биодиагностика состояния природных и природно-техногенных систем”. Киров: ФГБОУ ВО “Вятский государственный университет”. 2017. С. 75–79. [Rachkova N.G., Shaposhnikova L.M., Shuktomova I.I. Ekologicheskie aspekty fitopogloshcheniya pollyuantov v vodnyh i nazemnyh ekosistemah territorij tekhnogennogo radioaktichnogo zagryazneniya // XV Vserossijskaya nauchno-prakticheskaya konferen-ciya s mezhdunarodnym uchastiem “Biodiagnostika sostoyaniya prirodnyh i prirodno-tekhnogennyh system”. Kirov: FGBOU VO “Vyatskij gosudarstvennyj universitet”. 2017. P. 75–79. (In Russian)]
Боднарь И.С., Чебан Е.В., Зайнуллин В.Г. Экотоксикологическая оценка поверхностных вод с территории хранилища радиоактивных отходов (пос. Водный, Республика Коми) с использованием ряски малой (Lemna minor L.) // Изв. Коми научного центра Уральского отделения РАН. 2017. № 3. С. 34–39. [Bodnar I.S., Cheban E.V., Zainullin V.G. Ecotoxicological assessment of surface waters from the territory of radioactive waste storage (Vodny, Komi Republic) using duckweed (Lemna minor L.) // Bulletin of the Komi Science Center of the Ural Branch of the Russian Academy of Sciences. 2017. V. 31. № 3. P. 34–39. (In Russian)]
Рачкова Н.Г., Шуктомова И.И., Карманов А.П. Фазовое распределение радия-226 в поверхностных водах района расположения бывшего радийдобывающего предприятия [Phase distribution of radium-226 in the surface waters of the area of the former radium mining enterprise] // Бутлеровские сообщения. 2016. Т. 45. № 3. С. 60–67. [Rachkova N.G., Shuktomova I.I., Karmanov A.P. Phase distribution of radium in surface waters in the area of former radium production // Butlerov communications. 2016. V. 45. № 3. P. 60–67. (In Russian)]
Позолотина В.Н., Молчанова И.В., Карпаева Е.В. и др. Современное состояние наземных экосистем Восточно-Уральского радиоактивного следа: уровни загрязнения, биологические эффекты. Екатеринбург: Изд-во “Гощицкий”, 2008. 204 с. [Pozolotina V.N., Molchanova I.V., Karpaeva E.V. i dr. Sovremennoe sostoyanie nazemnyh ekosistem Vostochno-Ural’skogo radioaktivnogo sleda: urovni zagryazneniya, biologicheskie effekty. Ekaterinburg: Izd-vo “Go-shchickij”, 2008. 204 p. (In Russian)]
Евсеева Т.И., Гераськин С.А. Сочетанное действие факторов радиационной и нерадиационной природы на традесканцию. Екатеринбург: УрО РАН, 2001. 155 с. [Evseeva T.I., Geras’kin S.A. Sochetannoe dejstvie faktorov radiacionnoj i neradiacionnoj prirody na tradeskanciyu. Ekaterinburg: UrO RAN, 2001. 155 p. (In Russian)]
Серебряков Б.Е. Об опасности озера Карачай для будущих поколений [The dangers of Karachay Lake for future generations]. Интернет-издание Проатом. 27.06.2018. Доступно по: http://www.proatom.ru/modules.php?name=News&file=article&sid=8103. Ссылка активна на 19.12.2019.
Lagace F., Foucher D., Surette C., Clarisse Ol. Radium geochemical monitoring in well waters at regional and local scales: an environmental impact indicator-based approach. Chemospere. doi:2018;205:627–634.https://doi.org/10.1016/j.chemosphere.2018.04.098
Мережко А.И. Роль высших водных растений в самоочищении водоемов // Гидробиол. журн. 1973. № 4. С. 118–125. [Merezhko A.I. Rol’ vysshih vodnyh rastenij v samoochishchenii vodoemov // Gidrobiolo-gicheskij zhurnal. 1973. № 4. P. 118–125. (In Russian)]
Титов А.Ф., Казнина Н.М., Таланова В.В. Тяжелые металлы и растения. Петрозаводск: Карельский НЦ РАН, 2014. 194 с. [Titov A.F., Kaznina N.M., Talanova V.V. Heavy metals and plants. Petrozavodsk: Ka-rel’skij nauchnyj centr RAN, 2014. 194 p. (In Russian)]
Molas J. Changes in morphological and anatomical structure of cabbage (Brassica oleracea L.) outer leaves and in ultrastructure of their chloroplasts caused by an in vitro excess of nickel. // Photosynthetica. 1997. V. 34. № 4. P. 513–522. https://doi.org/10.1023/A:1006805327340
Sheoran I.S., Singal H.R., Singh R. Effect of cadmium and nickel on photosynthesis and enzymes of the photosynthetic carbon reduction cycle in pigeon pea (Cajanus cajan L.) // Photosynthesis Res. 1990. № 23. P. 345–351.
Mittler R. Oxidative stress, antioxidants and stress tole-rance // Trends Plant Science. 2002. № 7. P. 405–410. https://doi.org/10.1016/s1360-1385(02)02312-9
Поливода Б.И., Конев В.В., Попов Г.А. Биофизические аспекты радиационного поражения биомембран. М.: Энергоатомиздат, 1990. 160 с. [Polivoda B.I., Konev V.V., Popov G.A. Biofizicheskie aspekty radiacionnogo porazheniya biomembran. M.: Energoatom-izdat, 1990. 160 p. (In Russian)]
Лебедева А.Ф., Саванина Я.В., Барский Е.Л., Гусев М.В. Устойчивость цианобактерий и микроводорослей к действию тяжелых металлов: роль металлсвязывающих белков // Вестн. МГУ. Сер. 16. Биология. 1998. № 2. С. 42–49. [Lebedeva A.F., Savanina Ya.V., Barskij E.L., Gusev M.V. Ustojchivost’ cianobakterij i mikrovodoroslej k dejstviyu tyazhelyh metallov: rol' metallsvyazyvayushchih belkov. Vestnik MGU. Ser. 16. Biologiya. 1998; 2. P. 42–49. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


