Радиационная биология. Радиоэкология, 2020, T. 60, № 2, стр. 153-162
ИССЛЕДОВАНИЕ ВЛИЯНИЯ ПРОТОННОГО ИЗЛУЧЕНИЯ НА ПРОТЕОМ КЛЕТОК ГОЛОВНОГО МОЗГА МЫШИ
А. В. Литвинчук 1, 3, Е. С. Зорина 2, А. Т. Копылов 2, В. О. Попова 1, О. К. Легина 1, Н. Л. Ронжина 1, Н. А. Верлов 1, Д. Л. Карлин 1, В. В. Лысенко 1, В. Ф. Ежов 1, 4, С. Н. Нарыжный 1, 2, *
1 Петербургский институт ядерной физики им. Б.П. Константинова НИЦ “Курчатовский институт”
Ленинградская обл., Гатчина, Россия
2 Институт биомедицинской химии им. В.Н. Ореховича
Москва, Россия
3 MUNI, Masaryk University, Department of Experimental Biology, Faculty of Science
Brno, Czech Republic
4 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: snaryzhny@mail.ru
Поступила в редакцию 26.06.2019
Аннотация
Представлены результаты протеомного анализа клеток нервной ткани головного мозга мыши после однократного локального воздействия пучка протонов с энергией 1 ГэВ при поглощенной дозе 3 Гр. В работе использовали электрофоретические методы разделения белков, а также масс-спектрометрические и иммунные методы детектирования. Обнаружено, что на 31-е сутки после облучения количество детектируемых протеоформ и экспрессированных генов увеличилось почти в 2 раза: 7754 протеоформы и 1591 ген после облучения против 3652 протеоформ и 996 генов до облучения. Полученные данные указывают на пластичность ответа нервной ткани на воздействие протонного излучения. Особенно следует отметить изменения таких белков, как 14-3-3, кофилин-1, нейромодулин и гамма-енолаза, участвующих в перестройке цитоскелета и восстановительных процессах.
Интерес к изучению воздействия протонов высоких энергий на центральную нервную систему связан с протонной терапией и с исследованиями космоса, так как космическое излучение на 80 процентов состоит из протонов высоких энергий [1]. Исследование воздействия этих частиц очень сильно зависит от материальной базы и не имеет такой большой истории, как исследование радиационных эффектов гамма-излучения. Имеющиеся литературные данные о сравнительном исследовании влияния на нервные клетки облучения протонами или гамма-излучением указывают на более высокое поражающее действие протонов и на то, что для лечения глиобластом применение протонной радиации предпочтительнее, чем облучение гамма-лучами [2]. Для решения проблемы радиационного риска необходимо комплексное изучение поражающего действия заряженных частиц на всех уровнях биологической организации. Наиболее важными здесь будут являться исследования нарушений высших интегративных функций мозга [3–6].
Работы по исследованию возможностей метода облучения протонами высоких энергий (1 ГэВ) напролет были начаты в Ленинградском институте ядерной физики имени Б.П. Константинова (ныне НИЦ Курчатовский институт – ПИЯФ) совместно с Центральным научно-исследовательским рентгенорадиологическим институтом Минздрава СССР (ныне РНЦРХТ Минздрава РФ) в 1971 г. на одном из физических каналов ускорителя. В 1973 г. они были продолжены на специально созданном медицинском протонном комплексе, который включает в себя медицинский протонный тракт и лабораторную пристройку с залом облучения. [7] Синхроциклотрон (ПИЯФ) имеет фиксированную энергию выведенного протонного пучка – 1 ГэВ. Протоны столь высокой энергии легко проходят сквозь облучаемый объект, производя равномерную ионизацию вдоль своего пути. При этом пропадает эффект увеличения ионизации в зоне облучения за счет пика Брэгга. Однако этот недостаток компенсируется малым рассеянием протонов в веществе. Поэтому, если сформировать узкий, с резкими границами пучок протонов на входе облучаемого объекта, то он остается практически таким же узким и в зоне облучения внутри объекта. В результате применения облучения напролет в сочетании с ротационной конвергентной техникой облучения можно обеспечить очень высокое отношение дозы в зоне облучения к дозе на поверхности объекта. Были выполнены исследования относительной биологической эффективности пучка. Для этого проведен ряд экспериментов: тест на выживаемость культуры гаплоидного штамма дрожжей Saccharomyces cerevisiae и раковых клеток линии HeLa, тест по частоте возникновения доминантных летальных мутаций на модельном объекте генетики Drosophila melanogaster, проведены тесты по перевиваемости асцитной карциномы Эрлиха и асцитной гепатомы Зайделя. Распространенность биологического действия излучения в стороны от пучка протонов (область высоких и низких изодоз) исследовалась на собаках с облучением головного мозга (тест по гистологическим изменениям), а также на тесте с микрообъемами культуры дрожжевых клеток. Результаты позволили обосновать возможность эффективного клинического применения протонов с энергией 1 ГэВ [8].
С 1975 г. протонный пучок синхроциклотрона ПИЯФ систематически используется для облучения различных участков головного мозга при лечении ряда заболеваний центральной нервной системы и гипофиза (протонная гипофизэктомия). Курс протонной терапии прошли 1394 больных. Было достигнуто соотношение дозы в зоне облучения к дозе на поверхности (200:1), доза в хиазме составляла 1.91 Гр, осложнений не было [8–10]. Учитывая особенности создания высоких доз в зоне облучения, представляет интерес изучение возможных дозовых нагрузок на здоровую ткань с целью оптимизации метода и установления параметров безопасности.
Радиационная терапия является неотъемлемой частью лечения опухолей головного мозга и у пациентов детского возраста, что повышает ее социальную значимость. Недавние публикации посвящены исследованию нейропсихологических эффектов протонной терапии в сравнении с лучевой терапией на основе фотонов. Показано, что лучевая терапия с использованием фотонов приводит к интеллектуальному спаду, дефициту исполнительного функционирования, академическим неполным достижениям / неудачам и снижению качества жизни, связанного со здоровьем. Применение протонного облучения обеспечивает более целенаправленную терапию, сводя к минимуму повреждение развивающегося мозга. Дети, которые прошли протонную терапию, продемонстрировали относительно нетронутые интеллект, академичность и внимание [11–13].
В последнее десятилетие число проводимых исследований в этой области увеличилось в связи с развитием протонной терапии в США и странах Европы, а также появлением новых направлений в изучении космоса. При больших дозах облучения обнаружены повреждения нейрональных клеток в гиппокампе и префронтальной коре и показаны нарушения функций головного мозга, включая изменения памяти и способности к обучению [14]. Вызывают озабоченность негативные когнитивные изменения после воздействия протонов и тяжелых ионов при лечении рака пучками частиц, а также при воздействии космического излучения на космонавтов. До конца не поняты механизмы, происходящие в клетках головного мозга при воздействии протонов, в частности, не определена биологическая эффективность протонного пучка при пограничных и более высоких поглощенных дозах входящих протонов с высокими энергиями. Необходимы дополнительные исследования, чтобы получить информацию о допустимых дозовых нагрузках на центральную нервную систему и понять суть требуемой корректировки при радиационных поражениях.
В наших исследованиях были проведены эксперименты для изучения клеточного ответа нервной системы на отдаленных сроках при однократном локальном облучении головного мозга (большие полушария) мыши пучком с дозой 3 Гр, которая выше применяемой в Гатчинском методе. В отдаленные сроки возможны как необратимый патогенез, так и адаптивные изменения. Для прояснения механизмов ответа организма на это воздействие был выполнен сравнительный протеомный анализ нервной ткани в контроле и после облучения. Для этого были использованы электрофоретические методы разделения белков, а также масс-спектрометрические и иммунные методы их детектирования [15–17].
Представленные нами исследования протеома клеток нервной системы после облучения ускоренными протонами позволят установить закономерности регуляции функциональной активности белков, процессы, происходящие в клетках в пострадиационный период, и открыть возможные пути для необходимой коррекции. Это может дать основу не только для понимания происходящих процессов в клетке, но и для предсказания последующих. Последнее обстоятельство особенно привлекательно для радиационной медицины при терапии мозга человека.
МАТЕРИАЛЫ И МЕТОДИКА
Лабораторных мышей (коричневые агути, линия 129/Sv, самцы в возрасте 3 мес) подвергали локальному облучению на установке протонный ускоритель СЦ-1000, ПИЯФ. Энергия протонов – 1 ГэВ. Облучение навылет головы мыши в области больших полушарий выполнено пучком, диаметр которого был равен 6 мм, мощность дозы составила 0.5 Гр/мин, поглощенная доза – 3 Гр. Мыши во время облучения были зафиксированы в специальных резервуарах на экспериментальном держателе. Забор материала (головной мозг) производили на 3-и, 10-е и 31-е сутки после облучения. Мышей забивали мгновенной декапитацией. Выборка составляла пять опытных мышей и три контрольные мыши на каждую экспериментальную точку. Эксперимент выполнен согласно правилам работы с лабораторными животными (грызунами).
Приготовление экстракта ткани головного мозга и разделение белков методом изоэлектрофокусирования (ИЭФ) с последующей их идентификацией с использованием масс-спектрометра Orbitrap Q-Exactive (Thermo Scientific, США) были выполнены, как описано ранее [8, 10]. Ткань измельчали и экстрагировали лизирующим буфером (7 моль/л мочевина, 2 моль/л тиомочевина, 40 г/л CHAPS (3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate), 10 г/л дитиотреитол, 20 г/л IPG (Immobilized pH gradient) буфер (pH 3–10), коктейль протеазных ингибиторов). На полоски для ИЭФ ImmobilineDryStrip (длина 7 см, pH 5–8, GE Healthcare, США), наносили 300 мкг белка. ИЭФ проводили на приборе 3100 OFFGEL Fractionator (Agilent technologies, США), следуя протоколу производителя. Суммарный вольтаж был 20 кВ⋅ч, который набирался в течение 14 ч. Полоски (31-й день после облучения и контроль) по окончании ИЭФ были разрезаны на 28 секций (ширина 2.5 мм каждой) и подвергнуты стандартной обработке для масс-спектрометрии. Тандемный МС-анализ с применением количественного параметра emPAI (еxponentially modified Protein Abundance Index), который определяет относительное количество белка в пробе на основе покрытия аминокислотной последовательности обнаруженными пептидами и их совпадения с теоретически предсказанными пептидами из базы данных [15, 18]. Данные анализировали программой SearchGui (v.3.3.3) и PeptideShaker (v. 1.16.27) [19, 20]. Белок считался достоверно идентифицированным в случае детектирования как минимум двух протеотипических пептидов, принадлежащих этому белку. Представленные данные получены в результате трех независимых экспериментов.
Для иммуноблотинга использовали контрольные (необлученные) экстракты головного мозга и полученные через 3, 10 и 31 дни после облучения. Двумерный электрофорез (2DE) белков был выполнен как описано ранее [17]. Полоски ImmobilineDryStrip после ИЭФ (первое направление) помещали сверху на полиакриламидный гель и вели денатурирующий электрофорез во втором направлении. Затем проводили перенос белков из геля на мембрану PVDF (Amersham Hybond-P, GE Healthcare) с последующим иммунодетектированием, следуя протоколу Blue Dry Western [21]. Детектирование белка кофилина-1 проводили, используя кроличьи поликлональные анти-кофилин антитела (ab42824, Abcam) в разведении 1/2000, ослиные антитела против иммуноглобулинов кролика, меченных пероксидазой хрена (NA934-100UL, GE Healthcare) в разведении 1/10 000. Реакцию с антителами визуализировали с помощью ECL (Western Lightning Ultra, PerkinElmer, США) и рентгеновской пленки (Amersham Hyperfilm ECL) при экспозиции 3 мин.
РЕЗУЛЬТАТЫ
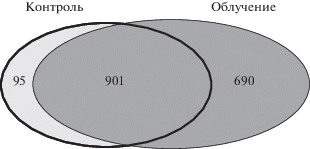
Используя масс-спектрометрию в сочетании с двумерным электрофорезом и иммунодетекцией, мы получили протеомный профиль клеток ткани головного мозга мыши в норме и после облучения головы животного протонами (доза 3 Гр). Обнаружено, что на 31-е сутки после облучения количество детектируемых протеоформ и экспрессированных генов увеличивается почти в два раза (7754 протеоформы и 1591 ген в норме против 3652 протеоформ и 996 генов в контроле). Причем 901 ген экспрессируется как в контроле, так и после облучения; продуктов 690 генов не было обнаружено до облучения и 95 – после облучения (рис. 1).
Рис. 1.
Распределение генов, белки которых были детектированы в образцах (большие полушария головного мозга), взятых из контрольных и облученных мышей (31-е сутки после облучения).
Fig. 1. Distribution of genes, which proteins were detected in the samples (cerebral hemispheres), taken from the control and irradiated mice (31 days after irradiation).
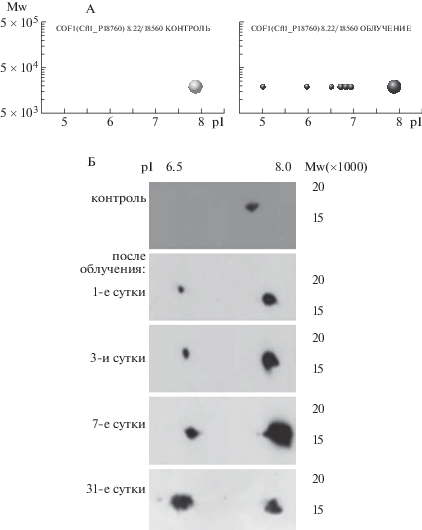
Большие отличия в наборах протеоформ, детектированных в контроле и после облучения, были выявлены для белков семейства 14-3-3, кофилина-1 и некоторых других. На рис. 2 представлены белки семейства 14-3-3 в норме и на 31-е сутки после облучения. Наши эксперименты с использованием Вестерн-блоттинга показали, что уже в ранние сроки (спустя сутки) обнаруживаются и далее (на 3-и, 10-е и 31-е сутки) накапливаются новые протеоформы кофилина-1, у которых изоэлектрическая точка сдвинута в кислую область (рис. 3, Б). Данные, полученные на основе масс-спектрометрии, указывают, что эти протеоформы фосфорилированы и ацетилированы (рис. 3, А). Образование кислых протеоформ связано с фосфорилированием остатков серина 23, 24, 119 и 120 и ацетилированием остатка лизина 13.
Рис. 2.
Профили протеоформ регуляторных белков семейства 14-3-3. Слева – контроль, справа – на 31-е сутки после облучения. Размер каждого шарика пропорционален количеству соответствующей протеоформы, выраженной в единицах emPAI. По оси абсцисс – значения изоточек (рI) протеоформ, по оси ординат – их молекулярный вес (Mw).
Fig. 2. Proteoform profiles of regulatory proteins of the 14-3-3 family. Left – control, right – 31 days after irradiation.

Рис. 3.
Профили протеоформ кофилина-1, выявленные масс-спектрометрически (А) или иммуноблоттингом после разделения белков 2DE (Б). По оси абсцисс –значения изоточек (рI) протеоформ, по оси ординат – их молекулярный вес (Mw).
Fig. 3. Profiles of cofilin-1 proteoforms detected by mass spectrometry (A) or immunoblotting after separation of proteins by 2DE (B).
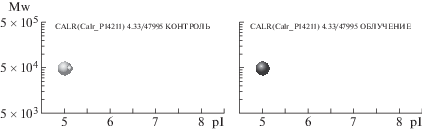
Также проведенный нами протеомный анализ позволяет проследить за судьбой и многих других белков. В частности, увеличиваются количество протеоформ и общее содержание нейромодулина на 31-е сутки после облучения (рис. 4). Енолаза γ – это белок, присутствующий в нейронах, но не в клетках глии, он обладает нейропротекторными свойствами. После облучения у этого белка появляются дополнительные протеоформы, причем представленные на высоком уровне (рис. 5). Белок кальретикулин (CALR) является маркером повреждения нейронов, экспрессия которого в наших экспериментах не изменилась после облучения (рис. 6).
Рис. 4.
Профили протеоформ белка нейромодулина. Слева – контроль, справа – на 31-е сутки после облучения. Размер каждого шарика пропорционален количеству соответствующей протеоформы, выраженной в единицах emPAI. По оси абсцисс – значения изоточек (рI) протеоформ, по оси ординат – их молекулярный вес (Mw).
Fig. 4. Proteoform profiles of the protein neuromodulin. Left – control, right – 31 days after irradiation.
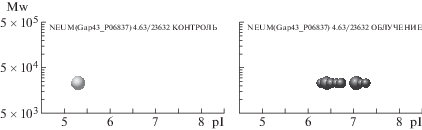
Рис. 5.
Профили протеоформ гамма-енолазы. Слева – контроль, справа – на 31-е сутки после облучения. По оси абсцисс отложены значения изоточек (рI) протеоформ, по оси ординат – их молекулярный вес (Mw). Размер каждого шарика пропорционален количеству соответствующей протеоформы, выраженной в единицах emPAI.
Fig. 5. Proteoform profiles of gamma enolase. Left – control, right – 31 days after irradiation.
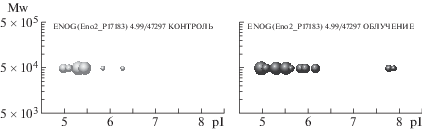
Рис. 6.
Профили протеоформ кальретикулина. Слева – контроль, справа – на 31-е сутки после облучения. По оси абсцисс – значения изоточек (рI) протеоформ, по оси ординат – их молекулярный вес (Mw). Размер каждого шарика пропорционален количеству соответствующей протеоформы, выраженной в единицах emPAI.
Fig. 6. Proteoform profiles of calreticulin. On the left – control, on the right – 31 days after irradiation.
ОБСУЖДЕНИЕ
Белки семейства 14-3-3 были впервые открыты в нервной ткани в 1967 г. Их масса составляет около 1% от общего количества белка в клетке, и поначалу считалось, что их основная функция заключается в регуляции синтеза нейтротрансмиттеров, а именно серотонина. Однако последующие работы по изучению белков 14-3-3 показали, что они имеют большое количество партнеров, выполняющих самые разные функции [22–24]. Посттрансляционные модификации, а именно фосфорилирование и дефосфорилирование, определяют степень взаимодействия белков 14-3-3 и их мишеней. За счет этих модификаций белки 14-3-3 способны контролировать важные клеточные процессы: апоптоз, пролиферацию, транскрипцию, репликацию, функционирование ионных каналов и организацию цитоскелета клетки. Кроме того, в последнее время белки 14-3-3 рассматриваются еще и как маркеры ряда нейродегенеративных и онкологических заболеваний. Они были обнаружены в ликворе и в спинномозговой жидкости у пациентов с деменциями, энцефалопатиями, злокачественными образованиями центральной нервной системы [25, 26]. Данный факт позволяет предположить, что специфичные протеоформы белков семейства 14-3-3 могут быть биомаркерами пострадиационных процессов и при воздействии ускоренных протонов на нервную ткань. Более того, возможно, что не изменение количества белков семейства 14-3-3, а их посттрансляционные модификации (появление протеоформ) в большей степени влияют на подконтрольные им клеточные процессы. Белки 14-3-3B, 14-3-3E, 14-3-3F, 14-3-3G, 14-3-3T имеют в норме кислые изоэлектрические точки (pI), в диапазоне 4.5–5.0 После облучения обнаружены также дополнительные протеоформы с pI 5.5–8 (рис. 2). Для 14-3-3Z обнаружены многочисленные протеоформы как в норме, так и в облученном организме. Кроме того, увеличилась их представленность (количество) в тканях после облучения.
Изменение изоэлектрической точки со сдвигом в щелочную область происходит при амидировании С-конца и карбоксильных групп аминокислот, а также в результате реакции этерификации. Такие процессы возможны при появлении радиационных радикалов, которые рассматриваются как генераторы радикальных процессов в клетке на пострадиационном этапе [27, 28]. Действительно, в нашем случае появление протеоформ с изоточкой, сдвинутой в щелочную область, обнаруживается не только для белков семейства 14-3-3, но и для некоторых других (AMPH, ANXA6, AP1B1, ARF4, BASP1 и др.).
Согласно литературным данным, активность протеинкиназы Raf1 в мозге мышей важна в сигнальном каскаде дифференцировки нейронов, показана ее важная роль для нормального функционирования ЦНС. Предполагают, что при повреждениях двигательных нейронов белок 14-3-3Z активирует Raf1, который в свою очередь активирует различные подклассы протеинкиназ [29]. В наших экспериментах все протеоформы 14-3-3Z присутствуют как в контроле, так и после облучения, но после облучения их уровень увеличен. Можно предположить, что они опосредуют процессы регенерации нейронов, синаптической трансмиссии и пластичности.
Кофилин-1 – это белок, который совместно с белком декстрином отвечает за деполимеризацию актина [30]. По литературным данным, представленным на PhosphoSitePlus®, кофилин-1 мыши может быть также фосфорилирован по остаткам серина (3, 8, 41, 156 и 160), треонина (25, 69, 88, 129, 148), тирозина (68, 82, 85, 89, 117, 140) [31]. Обнаруженное в наших экспериментах фосфорилирование серина 23 и ацетилирование лизина 13, ранее не детектированные у мышей, хорошо согласуются с литературными данными, полученными на других объектах. Для клеток базофильной лейкемии крысы (2Н3) по данным масс-спектрометрического анализа фосфорилирование кофилина-1 проходило по остаткам серина-23 и/или серина-24 [32]. В результате такого типа фосфорилирования кофилин-1 становился неактивным, не связывался с филаментами актина и не взаимодействовал с белком 14-3-3Z. Актин оставался в полимерном состоянии и тем самым обеспечивал процесс дегрануляции. Для мыши показано только влияние фосфорилирования остатка серина 3 на реорганизацию цитоскелета и пластичность нейронов [31]. Это фосфорилирование ингибируется фосфатидилинозитол-4,5-дифосфатом и кортактином [30, 33–35]. Гораздо больше данных о влиянии фосфорилирования кофилина-1 на клеточные процессы получено на клетках человека: 1) фосфорилирование остатка серина 3 влияет не только на реорганизацию цитоскелета, но изменяет клеточную адгезию, клеточное движение, ингибирует апоптоз и рост клеток; 2) фосфорилирование остатков серина 23 и 24 и тирозина 68 влияет на реорганизацию цито-скелета [31]. Принимая во внимание то, что фосфорилированный кофилин-1 не способен связываться с полимерным актином, можно предположить, что актин после облучения находится в полимерном состоянии, что обеспечивает сохранность цитоскелета. Белок 14-3-3Z связывает фосфорилированный кофилин и препятствует его дефосфорилированию под действием протеинфосфатаз [22].
Таким образом, фосфорилированный кофилин не связывается с фибриллярным актином и не способен вызывать фрагментацию F-актина после облучения протонами в клетках нервной ткани. Возможно, белок 14-3-3, как главный регулятор, связывает фосфорилированный кофилин-1 и тем самым усиливает стабилизацию актиновых филаментов. Такой комплекс существенно влияет на перестройку актинового цитоскелета в нервных клетках и играет особую роль в зависимой от цитоскелета кластеризации рецепторов ацетилхолина при формировании синапсов [36].
Морфологический анализ синапсов трансгенных мышей, нокаутированных по генам актин-деполимеризующего фактора (АДФ) и кофилина-1, показал повышенный уровень синаптосомального F-актина и увеличение плотности посадки везикул на пресинаптической мембране. При этом у животных не было обнаружено отклонений в поведении и показано, что способность к обучению сохраняется [37]. Данный факт указывает на компенсаторную функцию нервной системы в случае удаления белков, деполимеризующих актин.
По литературным данным, после облучения рентгеновскими лучами зрелых нейронов наблюдается значительное уменьшение количества актина в шипиках нейронов, боковых выростах дендритов. При этом изменялась форма шипиков, они становились тонкими и удлиненными [38]. В литературе имеются также данные о повреждении нейронов и протонами. Так, морфологический анализ нейронов гиппокампа указал на повреждения нейрональных сетей (дендритных деревьев), причем на 10-е сутки после облучения протонами повреждения еще мало заметны, но становятся значительными только на 30-е сутки [39].
Нейроны имеют длинный отросток, аксон (нейрит), как правило не ветвящийся по его протяжению, но образующий концевые разветвления, которые содержат синаптические пузырьки для проведения импульсов от перикариона. Объем аксона может достигать до 99% суммарного объема нейрона. Экспрессия белка нейромодулина, специфичного для аксона фосфобелка, является признаком начала дифференцировки отростка в аксон или его восстановления после повреждения. Нами обнаружено увеличение количества протеоформ и общего содержания нейромодулина на 31-е сутки после облучения, как показано на (рис. 4), и этот факт косвенно указывает на возможность восстановления аксонов у поврежденных нейронов после облучения. Сначала образуются короткие отростки на нейроне, которые потенциально могут стать либо аксоном, либо дендритами. Отросток, накапливающий нейромодулин, в дальнейшем становится аксоном.
На основе полученной информации о модификациях таких белков, как енолаза γ и кальретикулин, можно полагать, что в нейронах происходят компенсаторные процессы после облучения и они не сдвигают метаболизм клеток в патологическое состояние.
Наши выводы о пластичности нервной системы хорошо согласуются с результатами исследований когнитивных функций организма при воздействии протонов. Опубликованы результаты исследований нейробиологических эффектов воздействия компонента галактического космического излучения — протонов высокой энергии в модельных экспериментах на обезьянах (макаках-резус). Показано, что облучение головы обезьян протонами в дозе 3 Гр не вызывает существенных изменений их когнитивных функций и концентрации моноаминов и их метаболитов в периферической крови. Изучение эффектов воздействия космической радиации на функции центральной нервной системы (ЦНС) приобретает особенную актуальность в связи с планированием и подготовкой дальних длительных космических экспедиций (в частности, Марсианской миссии) [3] и при проведении терапии протонами высоких энергий.
ЗАКЛЮЧЕНИЕ
В наших исследованиях были проведены эксперименты для изучения клеточного ответа нервной системы при однократном облучении больших полушарий головного мозга мыши высокоэнергетичными протонами при поглощенной дозе 3 Гр. В отдаленные сроки возможны как необратимый патогенез, так и адаптивные изменения. Специфичность и пластичность – два основных свойства нервной системы, на которую воздействует протонное излучение, и происходящие изменения требуют объяснения на молекулярном уровне. В основе функциональности нейронов и нейронной сети, как и других клеток, лежит генетическая программа, по которой синтезируются белки. Ранее полагали, что генетическая программа должна быть достаточно гибкой, и в целях необходимой адаптации достаточно пластичной. Наши исследования подтверждают, что в адаптации нервной системы и пластичности нейронов важная роль принадлежит регуляции активности генов, а также указывают на важность различных модификаций белков. Как мы установили, эти модификации сохраняются и в отдаленные сроки после облучения. Повышается уровень и увеличивается количество протеоформ маркерного белка нейронов гамма-енолазы, регуляторных белков семейства 14-3-3, регуляторного белка цитоскелета – кофилина-1. В то же время изменений в экспрессии кальретикулина, маркера повреждения нейронов, обнаружено не было. Полученные нами данные о пострадиационных процессах в ткани головного мозга, а также исследования других авторов когнитивных функций организма после облучения протонами дают основания полагать о достаточно высокой безопасности применения протонов 1 ГэВ при лечении патологий мозга по Гатчинскому методу.
Список литературы
Abrosimov N.K., Gavrikov Yu.A., Ivanov E.M. et al. 1000 MeV proton beam therapy facility at Petersburg Nuclear Physics Institute synchrocyclotron // J. Phys.: Conf. Ser. 2006. V. 41. № 1. P. 424–432.
Mitteer R.A.J.r, Wang Y., Shah J. et al. Proton beam radiation induces DNA damage and cell apoptosis in glioma stem cells through reactive oxygen species // Sci. Rep. 2015. V. 5. P. 13961.
Belyaeva A.G., Shtemberg A.S., Nosovskii AM. et al. The effects of high-energy protons and carbon ions (12C) on the cognitive function and the content of monoamines and their metabolites in peripheral blood in monkeys // Neurochem. J. 2017. V. 11. № 2. P. 168–175.
Kokhan V.S., Matveeva M.I., Mukhametov A. et al. Risk of defeats in the central nervous system during deep space missions // Neurosci. Biobehav. Rev. 2016. V. 71. P. 621–632.
Belov O.V., Belokopytova K.V., Kudrin V.S. et al. Neurochemical insights into the radiation protection of astronauts: Distinction between low- and moderate-LET radiation components // Phys. Med. 2019. V. 7. P. 7–16.
Shtemberg A.S., Bazian A.S., Lebedeva-Georgievskaya K.B. et al. [Effects of exposure to high-energy protons on rat’s behavior and underlying neurochemical mechanisms // Aviakosm. Ekol. Med. 2013. V. 47. № 6. P. 54–60. (In Russian)]
Карлин Д.Л., Коннов Б.А., Виноградов Б.В. и др. Медицинский протонный тракт синхроциклотрона Ленинградского института ядерной физики // Мед. радиология. 1975. Т. 20. № 7. С. 13–19. [Karlin D.L., Konnov B.A., Vinogradov BV. et al. Medizinskiy protonnyi truct sinkhroziklotrona leningradskogo instituta yadernoi physiki // Med. Radiol. 1975. V. 20. № 7. P. 13–19. (In Russian)]
Коннов Б.А. Исследование пучка протонов с энергией 1000 МэВ для лучевой терапии: Дис. ... д-ра мед. наук. Ленинград: ЦНИРРИ Минздрава СССР, 1982. [Konnov B.A. Issledovanie puchka protonov s energiei 1000 MeV dlya luchevoi terapii: Diss. ... d-ra med. nauk. Leningrad: CNIRRI Minzdrava SSSR, 1982. (In Russian)]
Гранов А.М., Тютин Л.А., Шалек Р.А., и др. Сорокалетний опыт клинического применения пучка протонов с энергией 1000 МЭВ на базе синхроциклотрона Петербургского института ядерной физики им. Б.П. Константинова // Мед. физика. 2016. Т. 70. № 2. С. 10–17. [Granov A.M., Tyutin L.A., Shalek R.A. et al. Sorokaletniy opyt klinicheskogo primeneniya puchka protonov s energiei 1000 MeV na base sinkhroziklotrona leningradskogo instituta yadernoi physiki im. B.P.Konstantinova // Med. phisika. 2016. V. 70. № 2. P. 10–17. (In Russian)]
Коннов Б.А., Гранов А.М., Тютин Л.А. и др. Способ облучения ионизирующим излучением объемных образований головного мозга и устройство для его осуществления: Патент РФ № 2104595, февраль, 1998. [Konnov B.A., Granov A.M., Tyutin L.A. et al. Sposob oblucheniya ioniziruyuschim izlucheniem ob’emnukh obrazovanii golovnogo mozga I ustroistvo dlya ego osushestvleniya: Patent RF № 2104595, fevral, 1998. (In Russian)]
Pulsifer M.B., Duncanson H., Grieco J. et al. Cognitive and adaptive outcomes after proton radiation for pediatric patients with brain tumors // Int. J. Radiat. Oncol. Biol. Phys. 2018. V. 102. № 2. P. 391–398.
Ventura L.M., Grieco J.A., Evans C.L. et al. Executive functioning, academic skills, and quality of life in pediatric patients with brain tumors post-proton radiation therapy // J. Neuro-Oncol. 2018. V. 137. № 1. P. 119–126.
Gross J.P., Powell S., Zelko F. et al. Improved neuropsychological outcomes following proton therapy relative to X-ray therapy for pediatric brain tumor patients // J. Neuro-Oncol. 2019. V. 21. № 7. P. 934–943.
Greene-Schloesser D., Robbins M.E., Peiffer A.M. et al. Radiation-induced brain injury: A review // Front. Oncol. 2012. V. 2. P. 73.
Naryzhny S., Zgoda V., Kopylov A. et al. A semi-virtual two-dimensional gel electrophoresis: IF–ESI LC-MS/MS // Methods X. 2017. V. 4. P. 260–264.
Naryzhny S.N., Zgoda V.G., Maynskova M. et al. Combination of virtual and experimental 2DE together with ESI LC-MS/MS gives a clearer view about proteomes of human cells and plasma // Electrophoresis. 2016. V. 37. № 2. P. 302–309.
Нарыжный С.Н., Ронжина Н.Л., Майнскова М.А. и др. Разработка штрих-кода и получение белкового профиля глиобластомы // Биомед. химия. 2014. Т. 60. № 3. С. 308–321. [Naryzhny S.N., Ronzhina N.L., Maynskova M.A. et al. Razrabotka shtrikh koda I poluchenie belkovogo profilya glioblastoma // Biomed. khimiya. 2014. V. 60. № 3. P. 308–321. (In Russian)]
Ishihama Y., Oda Y., Tabata T., et al. Exponentially Modified Protein Abundance Index (emPAI) for Estimation of Absolute Protein Amount in Proteomics by the Number of Sequenced Peptides per Protein // Mol. Cell. Proteomics. 2005. V. 4. № 9. P. 1265–1272.
Vaudel M., Barsnes H., Berven F.S. et al. SearchGUI: An open-source graphical user interface for simultaneous OMSSA and X!Tandem searches // Proteomics. 2011. V. 11. № 5. P. 996–999.
Vaudel M., Burkhart J.M., Zahedi R.P. et al. PeptideShaker enables reanalysis of MS-derived proteomics data sets: To the editor // Nature Biotechnol. 2015. V. 33. P. 22–24.
Naryzhny S. Blue Dry Western: Simple, economic, informative and fast way of immunodetection // Anal. Biochem. 2009. V. 392. № 1. P. 90–95.
Gohla A., Bokoch G.M. 14-3-3 regulates actin dynamics by stabilizing phosphorylated cofilin // Curr. Biol. 2002. V. 12. № 19. P. 1704–1710.
Moore B.W., Perez V.J., Gehring M. Assay and regional distribution of a soluble protein characteristic of the nervous system // J. Neurochem. 1968. V. 15. № 4. P. 265–272.
Zhao J., Meyerkord C.L., Du Y. et al. 14-3-3 proteins as potential therapeutic targets // Seminars Cell Development. Biol. 2011. V. 22. P. 705–712.
Chohan G., Pennington C., Mackenzie J.M. et al. The role of cerebrospinal fluid 14-3-3 and other proteins in the diagnosis of sporadic Creutzfeldt–Jakob disease in the UK: a 10-year review // J. Neurol., Neurosurg., Psychiatry. 2010. V. 81. № 11. P. 1243–1248.
Xiao T., Ying W., Li L. et al. An approach to studying lung cancer-related proteins in human blood // Mol. Cell Proteomics. 2005. V. 4. № 10. P. 1480–1486.
Stratton K. Temperature effects on the formation and reactions of free radicals in gamma-irradiated dry enzymes // Radiat. Res. 1968. V. 35. № 1. P. 182–201.
Иванов В.Е., Карп О.Э., Попова Н.Р. и др. Образование долгоживущих форм белков сыворотки крови под действием тепла // Альманах клин. мед. 2014. Т. 1. № 31. С. 17–20. [Ivanov V.E., Karp O.E., Popova N.R. et al. Obrazovanie dolgozhivuschikh form belkov syvorotki krovi pod deistviem tepla // Almanakh klin. med. 2014. V. 1. № 31. P. 17–20.
Chen D.H., Brkanac Z., Verlinde C.L. et al. Missense mutations in the regulatory domain of PKCγ: a new mechanism for dominant nonepisodic cerebellar ataxia // Am. J. Hum. Genet. 2003. V. 72. № 4. P. 839–949.
Racz B., Weinberg R.J. Spatial organization of cofilin in dendritic spines // Neuroscie. 2006. V. 138. № 2. P. 447–456.
Hornbeck P.V., Zhang B., Murray B. et al. PhosphoSitePlus, 2014: mutations, PTMs and recalibrations // Nucl. Acids Res. 2015. V. 43. Database issue. P. D512–D520.
Huang T.Y., DerMardirossian C., Bokoch G.M. Cofilin phosphatases and regulation of actin dynamics // Curr. Opin. Cell Biol. 2006. V. 18. № 1. P. 26–31.
Bernstein B.W., Bamburg J.R. ADF/cofilin: a functional node in cell biology // Trends Cell Biol. 2010. V. 20. № 4. P. 187–195.
Niwa R., Nagata-Ohashi K., Takeichi M. et al. Control of actin reorganization by Slingshot, a family of phosphatases that dephosphorylate ADF/cofilin // Cell. 2002. V. 108. № 2. P. 233–246.
Gorlich A., Wolf M., Zimmermann A.M. et al. N-cofilin can compensate for the loss of adf in excitatory synapses // PLoS One. 2011. V. 6. № 10. e26789.
Lee C.W., Han J., Bamburg J.R. et al. Regulation of acetylcholine receptor clustering by ADF/cofilin-directed vesicular trafficking // Nature Neurosci. 2009. V. 12. № 7. P. 848–856.
Wolf M., Zimmermann A.M., Gorlich A. et al. ADF/cofilin controls synaptic actin dynamics and regulates synaptic vesicle mobilization and exocytosis // Cereb. Cortex. 2015. V. 25. № 9. P. 2863–2875.
Shirai K., Mizui T., Suzuki Y. et al. X irradiation changes dendritic spine morphology and density through reduction of cytoskeletal proteins in mature neurons // Radiat. Res. 2013. V. 179. № 6. P. 630–636.
Parihar V.K., Pasha J., Tran K.K. et al. Persistent changes in neuronal structure and synaptic plasticity caused by proton irradiation // Brain Struct. Funct. 2015. V. 220. № 2. P. 1161–1171.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


