Радиационная биология. Радиоэкология, 2020, T. 60, № 3, стр. 291-297
ИССЛЕДОВАНИЕ РАДИОЗАЩИТНОЙ ЭФФЕКТИВНОСТИ ПРОДУКТОВ КОНДЕНСАЦИИ ТИОЛСОДЕРЖАЩИХ ГИДРАЗИДОВ С МОНО- И ДИСАХАРИДАМИ
И. В. Лагода 1, *, Е. А. Якунчикова 1, И. С. Драчев 1, А. Н. Гребенюк 2, А. А. Мартыненков 3, Л. Ю. Кулешова 4, М. А. Копаница 4, А. Ю. Ершов 3
1 Государственный научно-исследовательский испытательный институт военной медицины
Министерства обороны РФ
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
Санкт-Петербург, Россия
3 Институт высокомолекулярных соединений РАН
Санкт-Петербург, Россия
4 Рязанский государственный медицинский университет им. акад. И.П. Павлова
Рязань, Россия
* E-mail: lagoda@mail.ru
Поступила в редакцию 01.07.2019
После доработки 01.07.2019
Принята к публикации 18.09.2019
Аннотация
В экспериментах на мышах проведено изучение радиозащитной эффективности сахаросодержащих соединений на основе продуктов конденсации гидразидов тиогликолевой (TGH) и тиосалициловой (TSH) кислот с серией природных альдоз: моносахаридов – D-глюкозой (Glс) и D-галактозой (Gal), и дисахаридов – D-лактозой (Lac) и D-мальтозой (Mal). Показано, что применение препаратов Glс-TGH и Mal-TSH увеличивает выживаемость смертельно облученных животных на 25% при введении за 1 ч и на 40% при введении за 24 ч до облучения. Предполагается, что ведущую роль в радиопротекторной активности препаратов играет защита стволовых кроветворных клеток испытуемых животных.
Тиолированные сахара – ключевые интермедиаты в синтезе гликонаночастиц благородных металлов (чаще всего золота и серебра), в последнее время нашедшие широкое применение в биологических и биомедицинских целях [1–5]. В частности, благодаря разветвленной сети углеводных фрагментов, имитирующих естественную клеточную поверхность, повышенному сродству к природным гликопротеиновым молекулам (лектинам), а также необычным оптическим свойствам, обусловленных эффектом плазмонного резонанса, гликонаночастицы благородных металлов находят применение в медицине для диагностики и лечения ряда онкологических заболеваний [4, 5].
В отличие от целевых биомедицинских применений золотых и серебряных гликонаночастиц, биологические свойства входящих в их состав тиолсодержащих сахаров в качестве лигандов практически не изучены. В связи с этим представляется актуальным изучение собственной радиопротекторной активности исходных тиолированных моно- и дисахаридов. Накопленные к настоящему моменту данные свидетельствуют, что соединения, в структуре которых содержатся аминные и тиольные группы, разделенные между собой 2–3 атомами углерода, обладают высокой профилактической радиозащитной активностью [6]. Такие вещества могут применяться при лучевой терапии онкологических больных, а также для защиты клеток, не вовлеченных в опухолевый рост. Однако широкое практическое применение аминотиолов ограничено их плохой переносимостью. Одним из способов снижения токсичности и, тем самым, улучшения переносимости серосодержащих радиопротекторов может являться включение в их состав фрагментов природных моно- и дисахаридов.
Ранее нами был предложен одностадийный метод синтеза тиолсодержащих углеводов 1, основанный на взаимодействии природных моно- и дисахаридов c гидразидами тиогликолевой (TGH) и тиосалициловой (TSH) кислот (рис. 1), а также были получены гликонаночастицы серебра и золота на их основе [7–12].
Рис. 1.
Схема получения меркаптоацилгидразонов моно- и дисахаридов, R = СН2, С6Н4; Х = Н, С6Н11О5.
Fig. 1. Scheme of mercaptoacylhydrazones preparation R = СН2, С6Н4; Х = Н, С6Н11О5.
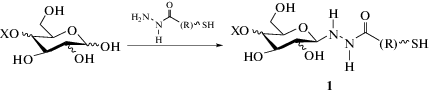
Настоящая работа посвящена изучению радиопротекторной активности продуктов конденсации гидразидов тиогликолевой (TGH) и тиосалициловой (TSH) кислот с серией природных моно- и дисахаридов: D-глюкозой (Glc), D-галактозой (Gal), D-лактозой (Lac) и D-мальтозой (Mal).
МАТЕРИАЛЫ И МЕТОДИКА
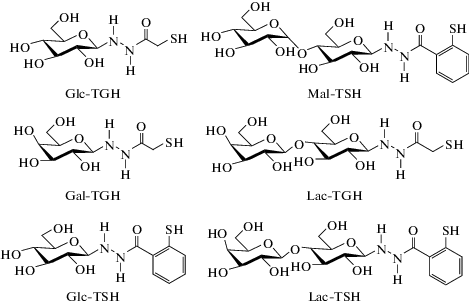
Синтез тиолсодержащих сахаров Glс-TGH, Gal-TGH, Glс-TSH, Lac-TSH, Mal-TSH и Lac-TGH осуществляли в Институте высокомолекулярных соединений РАН по ранее разработанной методике [7, 12] взаимодействием исходных моно- или дисахаридов с гидразидами тиогликолевой или тиосалициловой кислот. Физико-химические и спектральные характеристики полученных препаратов соответствовали литературным данным [7] (рис. 2).
Рис. 2.
Структурные формулы исследуемых сахаросодержащих соединений.
Fig. 2. Chemical structures of tested sugar-containing compounds.
В ходе экспериментов, выполненных на 300 белых беспородных мышах-самцах, применяли токсикологические, радиобиологические и гематологические методы исследования. На первом этапе была оценена переносимость препаратов при однократном внутрибрюшинном введении. Далее изучали радиопротекторную эффективность соединений после внутрибрюшинного введения за 1 ч и 24 ч до облучения, а также влияние наиболее эффективных соединений на костномозговое и экстрамедуллярное кроветворение у облученных животных.
При проведении исследования выполняли требования нормативно-правовых актов о порядке экспериментальной работы с использованием животных, в том числе по гуманному отношению к ним: “Этический кодекс” (1985), включающий раздел “Международные рекомендации по проведению медико-биологических исследований с использованием животных”, Хельсинкская декларация Всемирной медицинской ассоциации (2000) и др.
При исследовании острой токсичности продуктов конденсации тиолсодержащих гидразидов с моно- и дисахаридами общая продолжительность наблюдения за животными составляла 14 сут. В первые сутки после введения животные находились под непрерывным наблюдением, в остальные дни их состояние контролировали в 9.00, 11.00, 13.00, 15.00 и 17.00 ч. При этом в период наблюдения фиксировали общее состояние животных, особенности их поведения, интенсивность и характер двигательной активности, наличие и характер судорог, координацию движений, тонус скелетных мышц, реакцию на тактильные, болевые, звуковые и световые раздражители, частоту и глубину дыхательных движений, ритм сердечных сокращений, состояние шерстистого и кожного покровов, окраску слизистых оболочек, зрачка, положение хвоста, количество и консистенцию фекальных масс. Для изучения острой токсичности тиолсодержащие сахара вводили внутрибрюшинно в возрастающих дозах: 300, 500, 800 мг/кг. Максимальная вводимая доза составляла 1000 мг/кг.
Для моделирования острого радиационного поражения мышей подвергали воздействию γ-облучения на установке ИГУР-1 с мощностью дозы 1.01 Гр/мин. Для проведения облучения мышей помещали в пластиковые пеналы (по 12 животных контрольных и опытных групп) и подвергали воздействию ионизирующего излучения одновременно, в первой половине дня.
Оценку противолучевых свойств исследуемых веществ проводили при облучении в дозе 6.5 Гр (ЛД90-100/30). В соответствии с требованиями “Методических указаний по доклиническому изучению радиопротекторных свойств фармакологических веществ” для первоначального отбора эффективных радиозащитных препаратов использовали определение 30-суточной выживаемости и величину средней продолжительности жизни (СПЖ) облученных животных [13].
Влияние испытуемых веществ на гемопоэз исследовали при облучении животных в дозах 6.0 (ЛД50/30) и 6.5 Гр (ЛД90-100/30). Оценку костномозгового кроветворения проводили на основании подсчета миелокариоцитов костного мозга на 9-е сутки после облучения. Экстрамедуллярный гемопоэз оценивали по влиянию препаратов на массу селезенки и количество эндогенных колониеобразующих единиц (КОЕс) на 9-е сутки после облучения [14].
Растворы исследуемых тиолсодержащих сахаров для внутрибрюшинного введения готовили ex-tempore, с использованием воды дистиллированной в качестве растворителя из расчета 750 мг/кг. Животным контрольной группы внутрибрюшинно вводили дистиллированную воду в том же объеме и в те же сроки, что и мышам опытных групп.
Статистическую значимость различий значений показателя выживаемости между экспериментальными группами определяли с помощью непараметрического критерия Гехана–Вилкоксона, представляющего собой модификацию непараметрического рангового критерия Вилкоксона для оценки значимости различия показателя в двух независимых выборках. В остальных случаях применяли U-тест по методу Манна и Уитни. Различия считали статистически значимыми при р ≤ 0.05.
РЕЗУЛЬТАТЫ
Синтезированные тиолсодержащие сахара Glс-TGH, Gal-TGH, Glс-TSH, Lac-TSH, Mal-TSH и Lac-TGH относятся по классификации К.К. Сидорова к “практически нетоксичным” веществам [15]. Опыты показали, что их однократное внутрибрюшинное введение мышам в дозах 300, 500, 800 и 1000 мг/кг не приводило к гибели животных. Введение тиолсодержащих сахаров в возрастающих дозах не приводило к существенным изменениям общего состояния животных. Каких-либо изменений в их поведении, интенсивности и характере двигательной активности или нарушений в координации движений не наблюдали. Реакция на тактильные, звуковые и световые раздражители у опытных мышей не отличалась от реакции интактных животных и была в пределах физиологической нормы. Введение препаратов не приводило к развитию судорог, изменению состояния шерстистого покрова и видимых слизистых оболочек, частоты и характера дефекации.
Изучение противолучевого действия исследуемого класса веществ показало, что некоторые его представители улучшают течение и исходы ОРП. Как видно из данных, приведенных в табл. 1, введение препарата Glс-TGH за 1 ч до облучения увеличивало выживаемость смертельно облученных животных на 17%, а за 24 ч – на 40%. При этом величины СПЖ увеличивались на 2 и 8 сут соответственно. Похожей противолучевой эффективностью обладал препарат Mal-TSH. При его введении за 1 ч выживаемость смертельно облученных животных увеличивалась на 25%, а за 24 ч – на 42%. Величина СПЖ при профилактическом введении Mal-TSH за 1 ч до облучения увеличивалась на 5 сут, а за 24 ч – на 6 сут. Остальные исследованные соединения не проявляли выраженной радиопротекторной активности.
Таблица 1.
Влияние сахаросодержащих соединений при профилактическом внутрибрюшинном введении (750 мг/кг) на течение и исходы острого радиационного поражения у мышей, облученных в дозе 6.5 Гр Table 1. Impact of sugar-containing compounds via prophylactic i.p. administration (750 mg/kg) on course and outcome of acute radiation damage in mice, exposed at a dose of 6.5 Gy
| Экспериментальная группа | Срок профилактического введения, ч | Выживаемость (Р ± mp),% | СПЖ (Р ± mp), сут |
|---|---|---|---|
| Облучение (контроль) | – | 6 ± 5 | 12 ± 1 |
| Glс-TGH | 1 | 17 ± 11* | 14 ± 2 |
| 24 | 40 ± 15* | 20 ± 3 | |
| Gal-TGH | 1 | 4 ± 4 | 10 ± 0 |
| 24 | 4 ± 4 | 9 ± 1 | |
| Glс-TSH | 1 | 4 ± 4 | 9 ± 1 |
| 24 | 4 ± 4 | 12 ± 1 | |
| Lac-TSH | 1 | 4 ± 4 | 9 ± 0 |
| 24 | 4 ± 4 | 11 ± 0 | |
| Mal-TSH | 1 | 25 ± 13* | 17 ± 2 |
| 24 | 42 ± 14* | 18 ± 3 | |
| Lac-TGH | 1 | 8 ± 8 | 14 ± 2 |
| 24 | 4 ± 4 | 11 ± 0 |
Дальнейшие эксперименты показали, что введение препаратов Glc-TGH и Mal-TSH за 24 ч до облучения способствует сохранению у мышей костномозгового и экстрамедуллярного кроветворения. Как видно из данных, приведенных в табл. 2, на 9-е сутки после облучения животных в дозе 6.0 Гр (ЛД50/30) количество ядросодержащих клеток костного мозга составляло 1960.5 × 109/бедро. Увеличение дозы γ-излучения до 6.5 Гр (ЛД50/30) приводило к снижению этого показателя до 1293.3 × 109/бедро. При профилактическом введении Glc-TGH у мышей, облученных в дозе 6.0 Гр, количество ядросодержащих клеток костного мозга было на 22% больше, чем у животных контрольной группы, и составляло в среднем 2399.5 × 109/бедро. В случае введения этого вещества до облучения в дозе 6.5 Гр исследуемый показатель был на 13% выше, чем в контроле, и составлял 1466.2 × 109/бедро. Использование Mal-TSH также способствовало увеличению количества ядросодержащих клеток костного мозга: в случае облучения мышей в дозе 6,0 Гр исследуемый показатель был на 21% выше, чем у животных контрольной группы, и составлял 2379.8 × × 109/бедро, а при дозе 6.5 Гр – на 53% выше, и составлял 1973.3 × 109/бедро.
Таблица 2.
Влияние сахаросодержащих соединений при профилактическом (за 24 ч) внутрибрюшинном введении (750 мг/кг) на костномозговое кроветворение у облученных мышей Table 2. Impact of sugar-containing compounds via prophylactic i.p. administration (24 h before irradiation) (750 mg/kg) on the irradiated mice’ bone-marrow hemapoiesis
| Экспериментальная группа | Количество ядросодержащих клеток, ×109 /бедро, при облучении в дозе, Гр | |
|---|---|---|
| 6.0 | 6.5 | |
| Облучение (контроль) | 1960.5 ± 56.3 | 1293.3 ± 4.6 |
| Glс-TGH | 2399.5 ± 577.9* | 1466.2 ± 68.7* |
| Mal-TSH | 2379.8 ± 260.1* | 1973.3 ± 442.5* |
Данные, приведенные в табл. 3, свидетельствуют, что введение препаратов Glс-TGH и Mal-TSH за 24 ч до облучения оказывает положительное влияние на экстрамедуллярное кроветворение у мышей. Так, масса селезенки мышей на 9-е сутки после облучения в дозе 6.0 Гр в случае введения Glc-TGH была на 17% больше, чем у животных контрольной группы, а при облучении в дозе 6.5 Гр превосходила значения показателя в контрольной группе на 10%. При введении Mal-TSH масса селезенки была на 10% выше, чем в контрольной группе, при дозе облучения 6.0 Гр и на 18% выше при облучении в дозе 6.5 Гр.
Таблица 3.
Влияние сахаросодержащих соединений при профилактическом (за 24 ч) внутрибрюшинном введении (750 мг/кг) на экстрамедуллярное кроветворение у облученных мышей Table 3. Impact of sugar-containing compounds via prophylactic i.p. administration (24 h before irradiation) (750 mg/kg) on the irradiated mice’ extramedullar hemapoiesis
| Экспериментальная группа | Масса селезенки, мг, при облучении в дозе, Гр | Количество КОЕс, абс. ед., при облучении в дозе, Гр | ||
|---|---|---|---|---|
| 6.0 | 6.5 | 6.0 | 6.5 | |
| Облучение (контроль) | 67.5 ± 3.7 | 50.7 ± 1.8 | 8.7 ± 1.7 | 2.2 ± 1.2 |
| Glс-TGH | 79.1 ± 12.7 | 56.0 ± 6.1 | 11.5 ± 6.1 | 2.8 ± 1.2 |
| Mal-TSH | 74.3 ± 2.3 | 59.8 ± 3.6 | 9.8 ± 1.2 | 3.5 ± 0.6 |
Существенное влияние введение исследуемых веществ оказывало на количество КОЕс. У мышей контрольной группы, облученных в дозе 6.0 Гр, этот показатель составлял 8.7 ± 1.7, а в дозе 6.5 Гр – 2.2 ± 1.2 эндогенных колоний. При профилактическом введении Glc-TGH количество КОЕс было выше на 32% при облучении в дозе 6.0 Гр и на 27% выше в случае облучения в дозе 6.5 Гр. Препарат Mal-TSH увеличивал количество КОЕс на 13 и 59% при облучении в дозах 6.0 и 6.5 Гр соответственно.
ОБСУЖДЕНИЕ
Одним из основных факторов, ограничивающих практическое использование высокоэффективных сероазотсодержащих радиопротекторов является наличие нежелательных побочных эффектов (гиподинамия, нарушение гемодинамики, диспепсические расстройства и др.) [16, 17]. Включение в состав молекулы аминотиолов природных моно- и дисахаридов позволяет существенно улучшить переносимость препаратов при сохранении их радиозащитного действия. Полученные данные свидетельствуют о хорошей переносимости синтезированных тиолсодержащих ацилгидразонов моно- и дисахаридов. Так, их внутрибрюшинное введение мышам в диапазоне доз от 300 до 1000 мг/кг не сопровождалось гибелью экспериментальных животных, а также негативным влиянием на общее состояние и поведение последних. По классификации К.К. Сидорова, синтезированные препараты относятся к классу “практически нетоксичных” веществ. При этом следует отметить, что сами ацилгидразоны являются достаточно токсичными соединениями, обладающими в том числе и цитостатической активностью [18]. Введение в состав тиолсодержащих ацилгидразонов остатков моно- и дисахаридов позволяет не только снизить токсичность, но и существенно улучшить растворимость соединений, что немаловажно при разработке инъекционных лекарственных форм препарата.
Некоторые из синтезированных нами соединений обладают достаточно выраженным радиопротекторным действием, приводящим к увеличению выживаемости смертельно облученных мышей до 40% (Glc-TGH и Mal-TSH). Можно предположить, что радиопротекторная эффективность меркаптоацилгидразонов может быть обусловлена также и их антиоксидантными свойствами. Известно, что ацилгидразоны после поступления внутрь клетки могут активно связывать ионы железа (III), влияя на его внутриклеточный уровень [19, 20]. Снижая внутриклеточную концентрацию ионов железа (III), ацилгидразоны способствуют уменьшению процессов перекисного окисления липидов в облученном организме [18, 20, 21].
Другим возможным механизмом действия изученных меркаптоацилгидразонов может являться их способность обратимо ингибировать синтез ДНК. В пользу этого механизма говорит тот факт, что наибольшее радиопротекторное действие исследуемых соединений наблюдали при их введении за 24 ч до облучения. Схожие данные по радиопротекторной эффективности ацилгидразонов отмечали и другие исследователи. Так, В.Г. Владимировым и соавт. было показано, что ацилгидразоны проявляют высокую радиопротекторную активность, при этом оптимальное время их профилактического введения составляет 24 ч до облучения [22].
Таким образом, тиолсодержащие сахара – меркаптоацилгидразоны моно- и дисахаридов являются перспективным классом противолучевых средств. Они отличаются хорошей переносимостью и достаточно высокими противолучевыми свойствами. Поскольку тиолсодержащие сахара в основном находят применение в синтезе золотых и серебрянных гликонаночастиц, входя в их состав в качестве лигандов [1–5, 7–12], представляется перспективным изучение возможности биомедицинского применения комбинации “гликонаночастица–гликолиганд” в онкологии, в частности, при лучевой терапии. Эффективность такой системы может быть обусловлена их комбинированными свойствами, где гликонаночастицы избирательно воздействуют на раковые клетки, а тиолированные гликолиганды позволят защитить клетки, не вовлеченные в опухолевый рост, от негативного лучевого воздействия.
ВЫВОДЫ
1. Тиолсодержащие ацилгидразоны моно- и дисахаридов обладают радиозащитной активностью, увеличивая выживаемость смертельно облученных мышей на 20–40%.
2. Изученные соединения обладают хорошей переносимостью и относятся к практически нетоксичным соединениям.
3. Радиозащитная эффективность тиолсодержащих ацилгидразонов моно- и дисахаридов незначительна при введении за 1 ч до облучения, но возрастает при увеличении срока профилактического введения до 24 ч.
Список литературы
García I., Gallo J., Marradi M. et al. Glyconanoparticles: new nanomaterials for biological application. Chapt. 6 // Engineered carbohydrate-based materials for biomedical applications: polymers, surfaces, dendrimers, nanoparticles, and hydrogels / Ed. R. Narain. New Jersey: Wiley, 2011. P. 213–250.
Федотчева Т.А., Оленин А.Ю., Старостин К.М. и др. Перспективы применения наночастиц золота, серебра и оксида железа для повышения эффективности химиотерапии опухолевых новообразований // Хим.-фарм. журн. 2015. Т. 49. № 4. С. 11–22. [Fedotcheva T.A., Starostin K.M., Shimanovskii N.L. Prospects for Using Gold, Silver, and Iron Oxide Nanoparticles for Increasing the Efficacy of Chemotherapy // Pharmaceutical Chemistry Journal. 2015. V. 49. № 4. S. 220–230. (In Russian]https://doi.org/10.1007/s11094-015-1260-6
Bhattarai J.K., Neupane D., Mikhaylov V. et al. Self-assembled monolayers of carbohydrate derivatives on gold surfaces. Chapt. 4 // Carbohydrate / Ed. M. Cali-skan, I.H. Kavakli, G.C. Oz. InTech Publisher. 2017. P. 63–97. https://doi.org/10.5772/66194
Haume K., Rosa S., Grellet S. et al. Gold nanoparticles for cancer radiotherapy: a review // Cancer Nano. 2016. V. 7/8. P. e1–20. https://doi.org/10.1186/ s12645-016-0021-x
Yang C., Bromma K., Di Ciano-Oliveira C. et al. Gold nanoparticle mediated combined cancer therapy // Cancer Nano. 2018. V. 9/4. P. e1–14. https://doi.org/10.1186/s12645-018-0039-3
Johnke R.M., Sattler J.A., Allison R.R. Radioprotective agents for radiation therapy: future trends // Future Oncol. 2014. V. 10. № 15. P. 2345–2357. https://doi.org/10.2217/fon.14.175
Ершов А.Ю., Васильева М.Ю., Лагода И.В. и др. Продукты конденсации D-рибозы с тиолсодержащими гидразидами и гликонаночастицы золота на их основе // Журн. общей химии. 2018. Т. 88. №1. С. 108–114. [Ershov A.Y., Vasil’eva M.Y., Lagoda I.V. i dr. Condensation Products of D-Ribose with Thiol-Containing Hydrazides and Gold Glyconanoparticles Thereof // Russ. J. Gen. Chem. 2018. V. 88. №1. P. 103–108. (In Russian)] https://doi.org/10.1134/S1070363218010164
Васильева М.Ю., Ершов А.Ю., Байгильдин В.А. и др. Синтез гликонаночастиц серебра на основе 3-меркаптопропионилгидразонов моно- и дисахаридов // Журн. общей химии. 2018. Т. 88. №1. С. 115–119. [Vasil’eva M.Y., Ershov A.Y., Baigil’din V.A. i dr. Synthesis of Silver Glyconanoparticles Based on 3-Thiopropionylhydrazones of Mono- and Disaccharides // Russ. J. Gen. Chem. 2018. V. 88. № 1. P. 109–113. (In Russian)] https://doi.org/10.1134/S1070363218010176
Ершов А.Ю., Васильева М.Ю., Лагода И.В. и др. Строение продуктов конденсации D-лактозы и D-мальтозы с тиолсодержащими гидразидами // Журн. общей химии. 2018. Т. 88. № 6. С. 1020–1026. [Ershov A.Y., Vasil’eva M.Y., Lagoda I.V. i dr. Structure of the Condensation Products of D-Lactose and D-Maltose with SH-Contaning Carboxylic Acid Hydrazides // Russ. J. Gen. Chem. 2018. V. 88. № 6. P. 1199–1204. (In Russian)] https://doi.org/10.1134/S1070363218060245
Васильева М.Ю., Ершов А.Ю., Байгильдин В.А. и др. Получение гликонаночастиц золота на основе продуктов конденсации D-лактозы и D-мальтозы с тиолсодержащими гидразидами // Журн. общей химии. 2018. Т. 88. № 6. С. 1027–1032. [Vasil’eva M.Y., Ershov A.Y., Baigil’din V.A. i dr. Synthesis of Gold Glyconanoparticles Based on the Condensation Products of D-Lactose and D-Maltose with SH-Containing Hydrazides // Russ. J. Gen. Chem. 2018. V. 88. № 6. P. 1205–1209. (In Russian)] https://doi.org/10.1134/S1070363218060257
Ершов А.Ю., Мартыненков А.А., Лагода И.В. и др. Синтез 4-[ω-(меркаптоалкил)окси]бензоилгидразонов моно- и дисахаридов как потенциальных гликолигандов наночастиц благородных металлов // Журн. общей химии. 2019. Т. 89. № 2. С. 301–308. [Ershov A.Y., Martynenkov A.A., Lagoda I.V. i dr. Synthesis of 4-[ω-(Mercaptoalkyl)oxy]benzoylhydrazones of Mono- and Disacсharides as Potential Glycoligands of Noble Metal Nanoparticles // Russ. J. Gen. Chem. 2019. V. 89. № 2. P. 292–299. (In Russian)] https://doi.org/10.1134/S1070363219020208
Ершов А.Ю., Васильева М.Ю., Левит М.Л. и др. Синтез гликонаночастиц золота на основе тиолсодержащих ацилгидразонов D-гексоз и их модификация тиолированной поли(2-дезокси-2-метакрилоиламино-D-глюкозой) // Журн. общей химии. 2019. Т. 89. № 2. С. 309–318. [Ershov A.Y., Vasil’eva M.Y., Levit i dr. Synthesis of Gold Glyconanoparticles Based on Thiol-Containing D-Hexose Acylhydrazones and Their Modification by Thiolated Poly(2-deoxy-2-methacryloylamino-D-glucose) // Russ. J. Gen. Chem. 2019. V. 89. № 2. P. 300–308. (In Russian)] https://doi.org/10.1134/S107036321902021X
Михайлов П.П., Коровкина Э.П. Методические указания по доклиническому изучению радиопротекторных свойств фармакологических веществ // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Р.У. Хабриева. 2-е изд. М.: Медицина, 2005. С. 724–429. [Mikhailov P.P., Korov-kina E.P. Metodicheskie ukazaniya po doklinicheskomu izucheniyu radioprotektornykh svoistv farmakologicheskikh veshchestv // Rukovodstvo po eksperimental’nomu (doklinicheskomu) izucheniyu novykh farmakologicheskikh veshchestv / Pod red. R.U. Khabrieva. 2-e izd. M.: Meditsina; 2005. P. 724–429. (In Russian)]
Методические рекомендации по вопросам определения численности кроветворных колониеобразующих единиц (КОЕ) с помощью тестов экзогенных и эндогенных селезеночных колоний, Обнинск: МРНЦ РАМН, 1975. 11 с. [Metodicheskie rekomendatsii po voprosam opredeleniya chislennosti krovetvornykh kolonieobrazuyushchikh edinits (KOE) s pomoshch’yu testov ekzogennykh i endogennykh selezenochnykh kolonii. Obninsk: MRNC RAMN, 1975. 11 s. (In Russ.)]
Березовская И.В. Классификация химических веществ по параметрам острой токсичности при парентеральных способах введения // Хим.-фарм. журн. 2003. Т. 37. № 3. С. 32–34. [Berezovskaya I.V. Klassifikatsiya khimicheskikh veshchestv po parametram ostroy toksichnosti pri parenteralnykh sposobakh vvedeniya // Khim.-farm. zhurn. 2003. Т. 37. № 3. S. 32–34. (In Russian)]
Филимонова М.В., Филимонов А.С. Современные проблемы и перспективы разработки и внедрения отечественных противолучевых лекарственных средств // Радиац. биология. Радиоэкология. 2019. Т. 59. № 2. С. 127–131. [Filimonova M.V., Filimonov A.S. Sovremennyye problemy i perspektivy razrabotki i vnedreniya otechestvennykh protivoluchevykh lekarstvennykh sredstv // Radiats. biologiya. Radioekologiya. 2019. Т. 59. № 2. S. 127–131 (In Russian)]
Singh V.K., Newman V.L., Romaine P.L. et al. Radiation countermeasure agents: an update (2011–2014) // Expert. Opin. Ther. Pat. 2014. V. 24. № 11. P. 1229–1255.
Potučková E., Hrušková K., Bureš J. et al. Structure-activity relationships of novel salicylaldehyde isonicotinoyl hydrazone (SIH) analogs: iron chelation, anti-oxi-dant and cytotoxic properties // PLoS One. 2014. V. 9. Iss 11. P. e112059. https://doi.org/10.1371/journal.pone.0112059
Ponka P., Borova J., Neuwirt J. et al. Mobilization of iron from reticulocytes. Identification of pyridoxal isonicotinoyl hydrazone as a new iron chelating agent // FEBS Lett. 1997. V. 97. № 2. P. 317–321. https://doi.org/10.1016/0014-5793(79)80111-8
Caro A.A., Commissariat A., Dunn C. et al. Prooxidant and antioxidant properties of salicylaldehyde isonicotinoyl hydrazone iron chelators in HepG2 cells // Biochim. Biophys. Acta. 2015. V. 1850. № 11. P. 2256–2264. https://doi.org/10.1016/j.bbagen.2015.08.005
Charkoudian L.K., Pham D.M., Franz K.J. A pro-chelator triggered by hydrogen peroxide inhibits iron-promoted hydroxyl radical formation // J. Am. Chem. Soc. 2006. V. 128. № 38. P. 12424–12425. https://doi.org/10.1021/ja064806w
Владимиров В.Г., Красильников И.И., Арапов О.В. Радиопротекторы: структура и функция. Киев: Наукова думка, 1989. 264 с. [Vladimirov V.G., Krasil’nikov I.I., Arapov O.V. Radioprotektory: struktura i funktsiya. Kiev: Naukova dumka, 1989. 264 s. (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


