Радиационная биология. Радиоэкология, 2020, T. 60, № 3, стр. 270-278
РАННИЕ ОТСРОЧЕННЫЕ ЭФФЕКТЫ ВОЗДЕЙСТВИЯ УСКОРЕННЫХ ИОНОВ УГЛЕРОДА И ПРОТОНОВ НА КОГНИТИВНЫЕ ФУНКЦИИ МЫШЕЙ
С. С. Сорокина 1, *, С. И. Заичкина 1, О. М. Розанова 1, А. Е. Шемяков 1, Е. Н. Смирнова 1, А. Р. Дюкина 1, А. Е. Мальков 1, В. Е. Балакин 2, В. А. Пикалов 3
1 Инcтитут теоpетичеcкой и экcпеpиментальной биофизики PАН
Пущино, Россия
2 Физико-теxничеcкий центр Физического института им. П.Н. Лебедева PАН
Протвино, Россия
3 Институт физики высоких энергий НИЦ “Курчатовский институт”
Протвино, Россия
* E-mail: sv0723@yandex.ru
Поступила в редакцию 03.07.2019
После доработки 03.07.2019
Принята к публикации 18.09.2019
Аннотация
Исследованы ранние отсроченные эффекты воздействия ускоренных ионов углерода и протонов на когнитивные функции мышей по тестам на общую исследовательскую активность, пространственное обучение, кратковременную и долговременную гиппокампзависимую память. Полученные результаты показали, что у животных, облученных как протонами, так и ионами углерода, не изменяются параметры поведения: уровень тревожности не увеличен, ярко выражена исследовательская модель поведения, не наблюдается дефицит гиппокампзависимой памяти. Однако в тесте долговременной памяти группа животных, облученная протонами, совершает меньшее число ошибок в нахождении скрытой норки-мишени, что может свидетельствовать о лучшем сохранении следов памяти.
Лучевая терапия вот уже более века является одним из наиболее эффективных методов лечения онкологических заболеваний. Каждый год более 200 тыс. пациентов подвергаются облучению головного мозга, во время которого окружающие опухоль здоровые ткани также подвергаются воздействию с возможностью развития у пациентов различных неврологических нарушений. Речь идет как об острой и хронической радиационно-индуцированной травме мозга, так и о радиационной энцефалопатии. Подобные нарушения клинически проявляются как фокальные неврологические дефициты, вторичная эпилепсия, психическое и поведенческое расстройства, повышенное внутричерепное давление и прогрессирующие нарушения гиппокампопосредованного обучения и памяти, что значительно ухудшает качество продленной жизни пациентов [1]. В зависимости от срока проявлений клинических симптомов после курса лучевой терапии последствия классифицируются как острые, ранние отсроченные и поздние отсроченные повреждения [2]. Острое повреждение мозга проявляется во время и/или в течение нескольких дней после облучения. Раннее отсроченное повреждение происходит через 1.5–3 мес. после облучения, однако некоторые исследователи считают, что это время следует увеличить до 6 мес. [3]. Хотя оба типа этих повреждений могут приводить к серьезным последствиям для здоровья пациента, чаще всего они проходят после кратковременного направленного лечения. В отличие от них позднее отсроченное повреждение мозга обычно развивается спустя 6 мес. после облучения и считается необратимым, с прогрессирующим патогенезом [4].
В последнее десятилетие протонная и ионная терапия опухолей активно развивается и становится приоритетной среди лучевых способов борьбы с раком. За счет уникальных свойств тяжелых ионов, позволяющих с высокой точностью выгружать дозу в заданном объеме, можно эффективно подавлять рост опухолей, находящихся глубоко или в непосредственной близости от анатомических структур, чувствительных к облучению, при минимизации нагрузки на окружающие здоровые ткани [5]. Несмотря на то что большинство пациентов, в частности, с опухолями в области головы и шеи, подвергаются лучевой терапии с использованием рентгеновских или γ-лучей, к настоящему времени накопилось большое количество сведений о преимуществах адронной терапии. В связи с этим все больше радиологических центров стараются перейти на использование интенсивно-модулированной лучевой терапии (IMRT) на базе линейных ускорителей с выводом пучков протонов или ионов углерода, чтобы более безопасно и эффективно доставлять точные дозы облучения к опухоли при минимизации нагрузки на окружающие здоровые ткани [6]. На базе ФТЦ ФИАН (Протвино) в настоящее время работает комплекс протонной терапии “Прометеус”, специализирующийся на лечении опухолей в области головы и шеи человека и в то же время позволяющий проводить эксперименты на животных. В Центре коллективного пользования “Радиобиологический стенд на углеродном пучке У-70” на базе НИЦ “Курчатовский институт” – ИФВЭ (Протвино) интенсивно исследуется пучок ускоренных ионов углерода с энергией 450 МэВ/нуклон.
Следует отметить недостаточность систематических экспериментальных данных по биоэффектам протонов и ускоренных ионов углерода с разными характеристиками. Как следствие, отсутствуют фундаментальные основы специфики действия ускоренных частиц на критические структуры и процессы в различных органах и тканях при тотальном или локальном облучении в дозах, характерных для космического пространства, а также при стандартной лучевой терапии. Одной из проблем обобщения данных, полученных на разных ускорителях, являются резко отличающиеся технические возможности оборудования, которое формирует пучки частиц с разными физическими характеристиками, а также разные способы доставки дозы. Это требует экспериментальных исследований на конкретной установке при разных режимах облучения в условиях in vivo, что позволило бы в будущем быстрее адаптировать терапевтические установки для практических целей и варьировать подходы при лечении опухолей разных типов и локализаций. Литературные данные о влиянии разных видов плотноионизирующих излучений на когнитивные функции и нейрогенез лабораторных животных, облученных по схеме радиотерапии или при моделировании условий длительных космических полетов, достаточно немногочисленны, противоречивы и зависят от вида объекта, дозы, режима облучения, применяемых методик и сроков тестирования [7]. В ходе комплексного радиобиологического исследования ионов углерода ускорительного комплекса У-70 и тонкого сканирующего пучка протонов на установке “Прометеус” возникла возможность оценки влияния на поведение мышей этих видов облучения в поглощенных дозах, используемых в радиотерапии и моделирующих радиационное воздействие на центральную нервную систему при длительных космических полетах.
Целью работы является оценка ранних отсроченных эффектов ускоренных ионов углерода и протонов на когнитивные функции мышей по тестам на общую исследовательскую активность, пространственное обучение, кратковременную и долговременную гиппокампзависимую память.
МАТЕРИАЛЫ И МЕТОДИКА
Эксперименты проводили на двухмесячных самцах белых беспородных мышей колонии SHK (28–34 г). Животные содержались в клетках по 10 особей в стандартных условиях вивария ИТЭБ РАН и были разделены на три группы: необлученный контроль, облученные протонами и ускоренными ионами углерода. Исследование было одобрено Комиссией по биологической безопасности и биоэтике ИТЭБ РАН (протокол № 23). Эксперименты проводили в соответствии с требованиями Федерации европейских научных ассоциаций по содержанию и использованию лабораторных животных в научных исследованиях (FELASA).
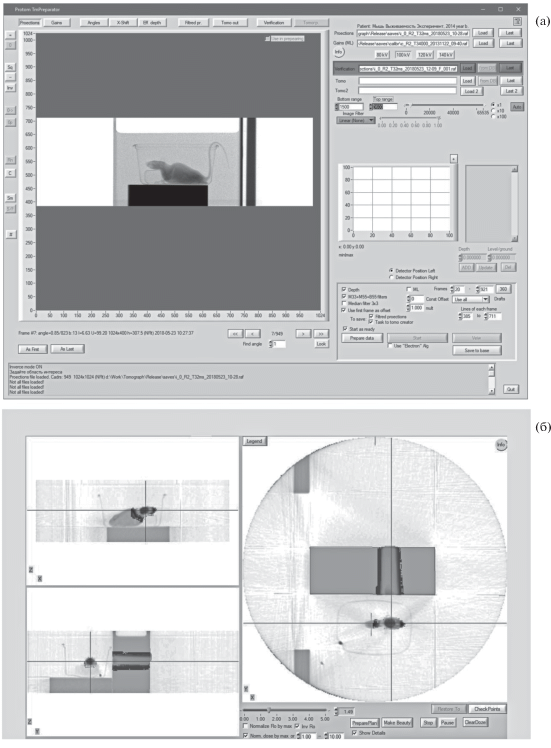
Животных наркотизировали ксилазин-золетиловой смесью и помещали в специальные кюветы. Для расчета плана облучения при помощи конусно лучевого компьютерного томографа получали трехмерные изображения кюветы с животным (рис. 1, а, б). Голову мышей облучали в дозе 1.8 Гр на протонном синхротроне (Комплекс протонной терапии “Прометеус”, ФТЦ ФИАН, Протвино) тонким пучком протонов с одного направления методом сканирования по заданному объему мишени в модифицированном пике Брэгга с энергией протонов на выходе ускорителя 85–100 МэВ и сигмой пучка 2.8–3.6 мм. Режим облучения – импульсный с длительностью 200 мс и циклом 2 с. При таком циклическом режиме работы установки каждый цикл протоны инжектируются в канал, ускоряются до заданной энергии и после этого выпускаются в заданную мишень. Мощность дозы составила 1.5 Гр/мин. Контроль дозы осуществляли клиническим дозиметром на основе алмазного детектора (ИФТП, Россия) и дозиметрической пленкой (Gafchromic radiothe-rapy film EBT2, США).
Рис. 1.
Подготовка сеанса облучения животных на установке “Прометеус”: а – скриншот программы планирования при подготовке плана облучения животного; б – проекция животного, полученная при помощи встроенного конусно-лучевого компьютерного томографа.
Fig. 1. Preparation of an animal irradiation session at the “Prometeus” complex of proton therapy: а – screenshot of the planning program under a preparation of an animal exposure plan; b – projection of the animal obtained using the Cone Beam Computed Tomography.
Другую группу животных подвергали тотальному воздействию ускоренных ионов углерода в модифицированном пике Брэгга в дозе 1.5 Гр в помещении временного радиобиологического стенда ускорительного комплекса У-70 (ИФВЭ НИЦ “Курчатовский институт”, Протвино). Энергия пучка на выходе ускорителя составила 450 МэВ/нуклон. На экспериментальную установку выводили до 1.0 × 109 ядер углерода в режиме медленного вывода с циклом 8 с, длительность вывода – 0.6 с. Мощность дозы составила 1.6 Гр/мин. Облучение проводили в однородном пучке, сформированным “воблер” магнитом. Сеанс облучения сопровождался дозиметрической пленкой “EBT3” (Gafchromic®film), закрепленной на торце контейнера с мышами со стороны падающего пучка, и контролировался при помощи нейтронного монитора – сферы из полиэтилена с детектором тепловых нейтронов внутри. Контрольных мышей также наркотизировали и подвергали “ложному” облучению с содержанием в тех же условиях, что и экспериментальные группы.
Через 3 мес. после облучения, что соответствует срокам ранних отсроченных повреждений, для оценки общей активности, пространственного обучения, кратковременной и долговременной гиппокампзависимой памяти использовали следующий набор методик: тест открытого поля, тест на распознавание нового объекта и лабиринт Барнс. Установка “открытое поле” используется для определения уровня двигательной, ориентировочно-исследовательской активности, соотношения активных и пассивно-оборонительных реакций в умеренно стрессирующей обстановке [8]. Данные тест, предложенный C.S. Hall в 1936 г., позволяет оценить выраженность элементарных поведенческих актов у грызунов в стрессогенных условиях, возникающих в ответ на помещение лабораторного животного в установку, имеющую большую площадь и интенсивность освещения, чем клетка для его повседневного содержания. Большое число “побежек” в центр открытого поля свидетельствует о преобладании ориентировочно-исследовательского поведения над низким уровнем стресса у животных. Эмоциональный статус оценивается по таким критериям, как частота и продолжительность груминга, а также количество уринаций и дефекаций. Время наблюдения занимало 4 мин. Лабиринт Барнс используется для оценки пространственного обучения и памяти. Этот тест состоит из двух фаз – обучения в течение 3 дней и тестирования на 3-й и 9-й дни после обучения. Время наблюдения занимало 3 мин. Регистрируются пройденное расстояние, скорость и время, проведенное как в правильном секторе, так и в целом в течение сессии, а также время задержки до нахождения убежища. Умеренные отрицательные подкрепления (яркий свет, вентилятор) обеспечивают мотивацию для животного по поиску убежища. Будучи менее стрессогенным, он служит хорошей альтернативой тесту Морриса. Для исследования нарушений функций непространственной гиппокампопосредованной кратковременной памяти был применен тест распознавания нового объекта, который основан на запоминании знакомых объектов и естественном для грызунов предпочтении новизны, что позволяет выявить избирательное действие на внимание и эпизодическую память. В ходе эксперимента на этапах обучения и тестирования регистрируется совокупное время исследования знакомого и нового объектов и высчитывается коэффициент дискриминации (КД). Тестирование проводилось в установке “открытое поле”, с которой животные уже были знакомы. Время наблюдения занимало 5 мин с интервалом между этапами в 15–20 мин. Все поведенческие тесты сопровождались автоматическим видеотрекингом мышей с использованием специального программного обеспечения.
Анализ достоверности отличий между группами проводили с помощью U-критерия Манна–Уитни (уровень значимости p < 0.05). Статистическое сравнение кривых обучения проводили с использованием дисперсионного анализа ANOVA в программном пакете для статистического анализа IgorPro 8.
РЕЗУЛЬТАТЫ
Как видно из гистограмм на рис. 2, а и б, животные, облученные как протонами, так и ионами углерода, были более активны (скорость перемещения и суммарное пройденное расстояние выше), они чаще выходили в центр открытого поля и проводили там больше времени по сравнению с необлученными контрольными животными (рис. 2, в, г). В дополнение для оценки исследовательской активности анализировали вертикальную активность по числу стоек, а для оценки эмоционального состояния животных анализировали количество актов груминга, дефекации и уринации. Животные после облучения ускоренными ионами углерода продемонстрировали более высокий уровень вертикальной активности (p < 0.05), в то время как по уровню беспокойства облученные животные обеих групп не отличались от контроля (данные не проиллюстрированы). Суммарно полученные наблюдения могут свидетельствовать не только об увеличении локомоторной активности у облученных животных, но и о преобладании исследовательского поведения над оборонительной реакцией у группы мышей, облученных ускоренными ионами углерода.
Рис. 2.
Изменение ориентировочно-исследовательского и эмоционального поведения в тесте “открытое поле” у мышей, подвергнутых воздействию ускоренных ионов углерода и протонов: а – скорость, см/с; б – пройденное расстояние, см; в – частота выхода в центр поля; г – суммарная длительность нахождения в центре поля.
Fig. 2. Changes in exploratory and emotional behavior in the open field test in mice exposed to accelerated carbon ions and protons: a – velocity, сm/s; b – distance moved, cm; c – frequency of access to the center of the open field; d – total (cumulative) duration of the stay in the center of the open field.

На рис. 3, а представлены кривые обучения, демонстрирующие уменьшение времени поиска убежища и снижение числа ошибок (количество исследованных норок) при увеличении числа испытаний (девять сеансов). Все группы животных продемонстрировали хорошее обучение в течение 3 дней в лабиринте Барнс. Дисперсионный анализ кривых обучения по критерию времени поиска убежища выявил достоверные отличия в прохождении теста у облученных ионами углерода мышей. Мыши из этой группы быстрее других справлялись с нахождением убежища в первые дни тестирования, однако динамика приобретения навыка по поиску убежища была медленнее по сравнению с контрольной и облученной протонами группами, с более длительным поиском в начале обучения. Следует заметить, что при анализе числа ошибок – неверно исследованных норок (без убежища) – не было обнаружено отличий между экспериментальными группами (рис. 3, б). Все мыши совершали одинаковое число ошибок на каждом этапе обучения. Более быстрое прохождение лабиринта группой мышей после облучения ускоренными ионами углерода, вероятно, связано не с улучшением обучаемости и долговременной памяти, а скорее с более выраженной исследовательской активностью и высокой скоростью перемещения по лабиринту. Задержка до нахождения норки-мишени в конце обучения во всех группах была одинакова, что свидетельствует об одинаковом уровне приобретенного навыка перед финальным тестированием.
Рис. 3.
Изменение показателей обучения мышей, подвергнутых воздействию ускоренных ионов углерода и протонов, в лабиринте Барнс: а – время поиска убежища, с; б – число ошибок.
Fig. 3. Change in learning outcomes of mice exposed to accelerated carbon and proton ions in the Barnes maze: a – latency to goal box, s; b – number of incorrect hole pokes.

Как следует из рис. 4, при проведении теста на долговременную память животные, облученные протонами, показали меньшее число ошибок в нахождении норки-мишени по сравнению с контрольной группой и животными, облученными ускоренными ионами углерода.
Рис. 4.
Влияние ускоренных ионов углерода и протонов на пространственную память мышей в лабиринте Барнс. Проба 1 – тестирование животных в лабиринте на 3-й день после обучения; проба 2 – тестирование животных в лабиринте на 9-й день после обучения.
Fig. 4. The effect of accelerated carbon ions and protons on the spatial memory of mice in the Barnes maze. Probe 1 – testing animals in the maze on the 3rd day after learning; probe 2 –testing animals in the maze on day 9 after learning.

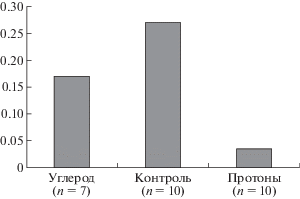
При проведении теста на распознавание нового объекта было выявлено, что при замене старого объекта на новый частота подходов и время нахождения у нового объекта наиболее выражены у необлученной группы мышей. Анализ предпочтения новизны при тестировании показал, что коэффициент дискриминации (КД) для контрольных мышей, а также групп, облученных ускоренными ионами углерода и протонами, через 3 мес. после облучения составил 0.270, 0.167 и 0.032 соответственно. Следовательно, через 3 мес. после облучения во всех исследованных группах не было выявлено нарушений непространственной гиппокампопосредованной кратковременной памяти: животные проводили гораздо больше времени, исследуя новый объект, чем знакомый на этапе тестирования, при этом в группе, облученной протонами, предпочтение новизны у мышей было наименее выражено (рис. 5).
Рис. 5.
Влияние ускоренных ионов углерода и протонов на непространственную кратковременную память мышей: средние значения коэффициента дискриминации по тесту распознавания новых объектов. КД = t(А2) – t(A1)/t(A2) + t(A1), где t(А2) – суммарное время, проведенное у нового объекта, а t(A1) – суммарное время, проведенное у старого объекта. Значения КД > 0.1 означают, что животное различает новый и старый объекты.
Fig. 5. The effect of accelerated carbon ions and protons on the non-spatial short-term memory in mice: average values of the discrimination coefficient using the novel objects recognition test. CD = t(А2) – t(A1)/t(A2) + t(A1), где t(А2) where t(A2) is the total exploration time for new object, and t(A1) is the total exploration time for old object. Values of CD > 0.1 mean that the animal distinguishes the new and old objects.
ОБСУЖДЕНИЕ
Лучевая терапия широко используется для лечения рассеянного первичного и метастатического рака мозга, при этом у многих пациентов, проживших более 6 мес. после лечения, развиваются впоследствии хронические радиационно-индуцированные нарушения ЦНС. Особенно это актуально при лучевой терапии опухолей головного мозга у детей, после которой на фоне увеличения длительности жизни часто существенно ухудшается ее качество из-за когнитивных нарушений. Хотя патогенез этих нарушений остается до конца неизвестным, одним из основных механизмов может быть снижение нейрогенеза в гиппокампе. Крайне мало клинических и экспериментальных данных о влиянии облучения протонами и ионами углерода в терапевтических дозах на различные когнитивные функции и их связь с нейрохимическими процессами в разных отделах мозга, особенно в ранние отдаленные сроки после воздействия, по сравнению с большим количеством работ по влиянию рентгеновского излучения. Так, в работе [9] головной мозг самцов мышей линии C57BL/J6 в возрасте 21 дня облучили в диапазоне доз 2–10 Гр рентгеновского излучения, через 48 ч после чего был проведен иммуногистохимический анализ. Было показано, что количество пролиферирующих клеток зубчатой субгранулярной зоны гиппокампа и их потомства, незрелых нейронов, уменьшалось дозозависимым образом. После облучения мышей в дозе 5 Гр и окрашивания пролиферирующих клеток BrdU через 1 и 3 мес. было обнаружено, что облучение значительно уменьшило производство новых нейронов, но не изменяло глиальные компоненты головного мозга. Было отмечено, что сниженный нейрогенез связан с хронической воспалительной реакцией, что через 3 мес. после облучения стало клинически сопровождаться дефицитом пространственной памяти. Эти данные подтвердили, что облучение молодых животных вызывает долгосрочное ухудшение нейрогенеза, которое обусловливает в дальнейшем гиппокамзависимый дефицит памяти.
В нашей работе облучение самцов мышей в возрасте 2 мес. проводили ускоренными ионами углерода тотально и тонким сканирующим пучком протонов – краниально. Было выявлено, что через 3 мес. после воздействия модель поведения животных не изменяется: уровень тревожности не увеличен, животные проявляют высокую локомоторную активность с вероятным усилением исследовательского поведения, не наблюдается дефицит кратковременной и долговременной гиппокампзависимой памяти. Интересно, что в тесте Барнс при оценке долговременной памяти группа животных, облученная локально протонами, совершает достоверно меньшее число ошибок в нахождении скрытой норки-мишени, по сравнению с контрольными животными и группой мышей, облученной тотально ускоренными ионами углерода. Это может свидетельствовать как о лучшем сохранении следов памяти, так и о снижении афферентной генерализации, когда животные более целенаправленно реагируют на условные раздражители, при этом более оперативно решая поставленную задачу [10]. Кроме того, в работах Rabin с коллегами было показано, что облучение всего организма вызывает более существенные нарушения в работе ЦНС по сравнению с локальным облучением головы в эквивалентных значениях доз [11]. Аналогичные результаты были получены при облучении крыс протонами с энергией 165 МэВ в дозе 1.5 Гр, что вызывало улучшение рабочей памяти животных, однако этот эффект инвертировался при увеличении дозы до 3 Гр [12]. Кроме того, в модельных экспериментах на обезьянах, облученных высокоэнергетическими протонами и ионами углерода, было продемонстрировано, что облучение головы протонами в дозе 3 Гр не вызывало каких-либо существенных изменений как в когнитивных функциях животного, так и концентрациях моноаминов и их метаболитов в периферической крови. При этом воздействие ионов углерода в дозе 1 Гр привело к значительному ухудшению когнитивных функций и значительному снижению концентрации метаболитов серотонина в крови обезьян [13]. В работе [14] было изучено влияние облучения протонами в дозах 1 и 2 Гр в пике Брэгга с энергией 170 МэВ на процессы обучения, воспроизведения навыков и концентрацию моноаминов и их метаболитов в гиппокампе и других структурах головного мозга крыс Вистар. При облучении в дозе 2 Гр наблюдалась тенденция к прогрессированию нарушений функционирования долговременной рабочей памяти, уже сформированной к моменту облучения. В то же время облучение в дозе 1 Гр приводило к менее значительному ухудшению – снижение коэффициента обучения не достигало значимого уровня. Облучение протонами в обеих дозах не влияло на выработку и воспроизведение рефлекса пассивного избегания. Авторы отмечают уменьшение концентрации катехоламинов в префронтальной коре и концентрации 3-МТ – метаболита дофамина в стриатуме, при этом во всех остальных структурах, в том числе гипоталамусе, значимых изменений не обнаружено. При исследовании тотального действия ускоренных ионов углерода с энергией 500 МэВ в дозе 1 Гр было показано, что через 30 и 90 сут после облучения в головном мозге крыс происходят изменения в работе норадреналин-, дофамин- и серотонинэргических систем. Наибольшие различия наблюдались в префронтальной коре и гипоталамусе, что указывает на важную роль этих отделов мозга в реализации поздних эффектов воздействия радиации на функции ЦНС. Авторы полагают, что спустя некоторое время после воздействия активно реализуются компенсаторно-восстановительные механизмы, которые при относительно низких значения ЛПЭ могут в конечном итоге приводить к восстановлению некоторых когнитивных функций [15].
Использование в нашей работе однократной дозы, эквивалентной по величине одной фракции курса радиотерапии, было обусловлено тем, что наиболее перспективным направлением в протонной и ионной терапии в настоящее время является гипофракционирование, т.е. увеличение однократной дозы и уменьшение количества фракций в курсе. В связи с этим мы планируем тестировать более высокие, чем принято в конвенциальной радиотерапии, дозы. Ранее нами при исследовании гипофракционированного режима облучения солидной формы асцитной карциномы Эрлиха была показана не только возможность полного подавления роста опухоли, но и снижение отдаленных лучевых реакций кожи, рецидивирования, влияние на среднюю продолжительность жизни животных [16]. Трудно предположить, как ионы углерода с более высоким значением ОБЭ по сравнению с протонами, что было установлено на других объектах и тест-системах, будут влиять на когнитивные функции при высокоточном облучении опухолей головы. Так, например, было показано, что фракционированное облучение головы 6–9-летних приматов в дозе 40 Гр Х-лучей (5 Гр дважды в неделю в течение 4 нед) приводит спустя 6 мес. после облучения к значительному нарушению выполнения теста распознавания нового объекта, который тесно связан с работой периархинальной коры головного мозга [17].
Характер эффектов, полученных на мышах в ранние отдаленные сроки при облучении тонким сканирующим пучком протонов и ускоренными ионами углерода, позволяет сделать вывод об отсутствии негативного влияния на когнитивные навыки лабораторных животных. Это открывает перспективы для следующего шага в развитии адронной терапии – возможности увеличения однократной дозы облучения и отработки схем гипофракционирования.
Список литературы
Bramlett H.M., Dietrich W.D. Long-term consequences of traumatic brain injury: current status of potential mechanisms of injury and neurological outcomes // J. Neurotrauma. 2015. V. 32. P. 1834–1848.
Sheline G.E. Radiation therapy of brain tumors // Cancer. 1977. V. 39. Suppl 2. P. 873–881.
Yan L., Xi Z., Drettner B. Epidemiological studies of nasopharyngeal cancer in the Guangzhou area, China. Preliminary report // Acta Otolaryngol. 1989. V. 107. № 5–6. P. 424–427.
Brown W.R., Blair R.M., Moody D.M. et al. Capillary loss precedes the cognitive impairment induced by fractionated whole-brain irradiation: a potential rat model of vascular dementia // J. Neurol. Sci. 2007. V. 257. № 1–2. P. 67–71.
Xмелевcкий Е.В. Лучевая терапия рака простаты: фотоны, протоны или тяжелые ионы // Pадиац. онкология и ядеpная медицина. 2013. № 1. С. 28–33. [Khmelevsky E.V. Luchevaya terapiya raka prostaty: fotony, protony ili tyazhelye iony // Radiat. oncology and nuclear medicine. 2013. № 1. P. 28–33. [(In Russian)]
Cheung K.Y. Intensity modulated radiotherapy: advantages, limitations and future developments // Biomed. Imaging Interv. J. 2006. V. 2. № 1. P. e19.
Kiffer F., Boerma M., Allen A. Behavioral effects of space radiation: A comprehensive review of animal studies // Life Sci. Space Res. 2019. V. 21. P. 1–21.
Whimbey A.E., Denenberg V.H. Two independent behavioral dimensions in open-field performance // J. Comparat. Physiol. Psychol. 1967. V. 63. № 3. P. 500–504.
Rola R., Raber J., Rizk A. et al. Radiation-induced impairment of hippocampal neurogenesis is associated with cognitive deficits in young mice // Experim. Neurol. 2004. V. 188. P. 316–330.
Ушаков И.Б., Штемберг А.С., Шафиркин А.В. // Реактивность и резистентность организма млекопитающих. Принципы формирования, регуляции и прогнозирования. М.: Наука, 2007. С. 493. [Ushakov I.B., Shtemberg A.S., Shafirkin A.V. The reactivity and resistance of the mammalian organism. The principles of formation, regulation and forecasting. M.: Science, 2007. P. 493. (In Russian)]
Rabin B.M., Shukitt-Hale B., Carrihill-Knoll K.L., Gomes S.M. Comparison of the effects of partial- or whole-body exposures to 16O particles on cognitive performance in rats // Radiat. Res. 2014. V. 3. № 181. P. 251–257.
Штемберг А.С., Базян А.С., Лебедева-Георгиевская К.Б. и др. Влияние облучения протонами высокой энергии на поведение крыс и его нейрохимические механизмы // Авиакосм. и экол. медицина. 2013. Т. 47. № 6. С. 54–60. [Shtemberg A.S., Bazyan A.S., Lebedeva-Georgievskaya K.D. i dr. Vliyanie oblucheniya protonami vysokoj energii na povedenie krys i ego nejrohimicheskie mekhanizmy // J. Aerospace and Environ. Med. 2013. V. 47. № 6. P. 54–60. (In Russian)]
Беляева А.Г., Штемберг А.С., Носовский А.М. и др. Воздействие высокоэнергетических протонов и ионов углерода 12С на когнитивные функции обезьян и содержание моноаминов и их метаболитов в периферической крови // Нейрохимия. 2017. Т. 34. № 1. С. 1–9. [Belyaeva A.G., Shtemberg A.S., Nosovskii A.M. i dr. Vozdeistvie visokoenergeticheskih protonov i ionov ugleroda 12C na kognitivnie funkcii obezyan i soderjanie monoaminov i ih metabolitov v perifericheskoi krovi // Neurochem. J. 2017. Т. 34. № 1. S. 1–9. (In Russian)]
Штемберг А.С., Кохан В.С., Кудрин В.С. и др. Воздействие высокоэнергетических протонов в пике Брэгга на поведение крыс и обмен моноаминов в некоторых структурах мозга // Нейрохимия. 2015. Т. 32. № 1. С. 78–85. [Shtemberg A.S., Kokhan V.S., Kudrin V.S. i dr. Vozdejstvie vysokoenergeticheskih protonov v pike Bregga na povedenie krys i obmen monoaminov v nekotoryh strukturah mozga // Neurochem. J. 2015. Т. 32. № 1. S. 78–85. (In Russian)]
Белокопытова К.В., Белов О.В., Кудрин В.С. и др. Динамика обмена моноаминов в структурах головного мозга крыс в поздние сроки после облучения ускоренными ионами углерода // Нейрохимия. 2016. Т. 33. № 2. С. 147–155. [Belokopytova K.V., Belov O.V., Kudrin V.S i dr. Dinamika obmena monoaminov v strukturah golovnogo mozga krys v pozdnie sroki posle oblucheniya uskorennymi ionami ugleroda // Neurochem. J. 2016. V. 33. № 2. P. 147–155. (In Russian)]
Балакин В.Е., Шемяков А.Е., Заичкина C.И. и др. Отдаленные лучевые последствия после гипофракционированного облучения протонами солидной карциномы Эрлиха у мышей // Биофизика. 2017. Т. 62. № 1. С. 161–167. [Balakin V.E., She-myakov A.E., Zaichkina S.I. i dr. Otdalennye luchevye posledstviya posle gipofrakcionirovannogo oblucheniya protonami solidnoj karcinomy Erliha u myshej // Biophysics. 2017. V. 62. № 1. P. 138–142. (In Russian)]
Robbins M.E., Payne V., Tommasi E. et al. The AT1 receptor antagonist, L-158,809, prevents or ameliorates fractionated whole-brain irradiation-induced cognitive impairment // Int. J. Radiat. Oncol. Biol. Phys. 2009. V. 73. P. 499–505.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


